церебральный кортекс что это
Префронтальный кортекс и его функции
Префронтальный кортекс (PFC) осознанно направляет мысли, эмоции и действия, организуя ответы мозга через обширные корковые и подкорковые проекции. Сети нейронов PFC способны представлять цели в отсутствие стимуляции со стороны окружающей среды, обеспечивая большие возможности для абстракции и ингибирования ( торможения, подавления ). Эти способности PFC наиболее ослаблены в психических заболеваниях.
PFC способен направлять мысли, поведение и эмоции, представляя цели и стимулы, которые не присутствуют в окружающей среде. Эти репрезентативные знания создаются сетями нейронов PFC, участвующих в рекуррентном возбуждении, настроенном интернейронами ГАМК ( GABA) Последние исследования показали, что постоянная активность и настройка сетей PFC также глубоко могут изменяться катехоламинами: норэпинефрином (NE) и дофамином (DA). Это тонкий и высокочувствительный процесс, при котором слишком мало или слишком много NE или DA сильно ухудшают функцию PFC.
Высокие уровни высвобождения NE и DA в PFC во время стресса разрушают физиологию и функцию сети PFC. Высокие уровни выброса NE во время стресса затрагивают адренорецепторы с низким сродством к NE, то есть альфа-1 и бета-рецепторы. Стимуляция рецепторов альфа-1 или бета-1 нарушает функции PFC, а также подобный эффект имеют очень высокие уровни стимуляции DA D1-рецептора. Эти отрицательные эффекты происходят посредством избыточной сигнализации канала cAMP-HCN ), а также путем активации фосфотидил-инозитол-протеинкиназы С. Высокие уровни генерации цАМФ во время стрессового воздействия открывают большое количество HCN-каналов, ослабляя как предпочтительные, так и неподтвержденные входы в клетку, что приводит к обрушению сети. Разнообразные методы лечения повышают скорость отключения сети cAMP, и сетевая активность восстанавливается, если каналы HCN блокируются. Высокие уровни цАМФ могут также способствовать передаче фосфотидил-инозита, например, путем фосфорилирования рецепторов IP3. Таким образом, эти внутриклеточные пути действуют совместно, вызывая быструю и заметную потерю функциональной активности PFC.
Протеинкиназа С активируется серией химических реакций. Нейротрансмиттерные рецепторы на клеточных мембранах (например, норадренергический альфа-1-рецептор, серотонинергический 5HT 2Aрецептор или метаботропные глутаматные рецепторы), соединяются с белками Gq, которые, в свою очередь, активируют фосфолипазу C. Фосфолипаза C, в свою очередь, расщепляет PIP2 с образованием IP3 и DAG. IP3 взаимодействует с рецепторами эндоплазматического ретикулума для высвобождения кальция из внутриклеточных накоплений. Выделенный кальций затем облегчает транслокацию протеинкиназы C в клеточную мембрану, где она активируется DAG. Важно отметить, что фермент, называемый киназой DAG, ингибирует активность этого пути, фосфорилируя DAG в качестве начального этапа рециркуляции DAG обратно в PIP2. Таким образом, киназа DAG снижает активность протеинкиназы С. Другим важным молекулярным тормозом на этом пути является регулятор сигнала G белка 4 (RGS4), который ингибирует Gq и сигнализирует об этом через этот путь ( как киназы RGS4, так и DAG изменяются при психических заболеваниях).
Хроническое воздействие стресса приводит к ретракции префронтальных кортикальных дендритов и потере дендритных шипов. Эта потеря серого вещества, по-видимому, связана с повышением уровня сигнальной передачи белка киназы С. Протеинкиназа С также взаимодействует с другими внутриклеточными путями, такими как гликогенсинтаза 3 и ERK MAP киназные пути, которые регулируют выживаемость клеток. Эти данные очень важны для психических заболеваний, так как происходит потеря серого вещества PFC как при шизофрении, так и при биполярном расстройстве.
Многие распространенные симптомы психических заболеваний, например, отвлекаемость, плохая концентрация, потеря проницательности, плохой мониторинг ошибок и тестирование на действительность, слабое эмоциональное регулирование, забывчивость, дезорганизация, являются признаками дисфункции PFC.
Медиальный префронтальный кортекс
Споры о функциональном значении медиальной префронтальной коры общеизвестны. Медиальная префронтальная кора (mPFC) обеспечивает принятие решений, избирательно принимает участие в извлечении событий из долговременной памяти, поддерживает память и консолидацию по шкале времени от секунд до нескольких дней. Существует также предположение, что функция mPFC заключается в исследовании ассоциаций между контекстом, местоположением, событиями и соответствующими адаптивными ответами, особенно эмоциональными. Участие mPFC, как в процессах памяти, так и в процессах принятия решений может быть связано с тем, что почти все такие задачи влекут за собой возможность вспомнить лучшее действие или эмоциональный отклик на конкретные события в определенном месте и времени. Взаимодействие между несколькими системами памяти может объяснить изменение значения mPFC для разных типов воспоминаний с течением времени. В частности, mPFC, вероятно, полагается на гиппокамп для обеспечения и поддержки быстрого обучения и консолидации памяти.
Теории медиальной префронтальной функции подчеркнули ее роль в принятии адаптивных решений. Отметим, что вся префронтальная кора получает широкий спектр сенсорных и лимбических входов, которые могут активировать контекстно-зависимые представления целей или правил задачи. Активное поддержание этих целей обеспечивает сигнал смещения «сверху вниз», который может влиять на сопоставления стимул-ответ в других областях мозга. Они также предполагают, что обратная связь результатов приводит к синаптической пластичности в префронтальной коре, гарантируя, что соответствующее целевое состояние разрешено в соответствующем контексте ( Miller and Cohen, 2001).
Учитывая важную роль гиппокампа в памяти, неудивительно, что гиппокамп и mPFC связаны анатомически. По сравнению с другими кортикальными областями, прогнозы от вентральной половины гиппокампа к mPFC особенно сильны.
Кортексин : инструкция по применению
Состав
Каждый флакон содержит:
Фармакотерапевтическая группа
Прочие психостимулирующие и ноотропные средства. Код ATX: N06BX.
Описание
Лиофилизированный порошок или пористая масса белого или белого с желтоватым оттенком цвета.
Согласно экспериментальным данным комплекс низкомолекулярных водорастворимых полипептцдных фракций КОРТЕКСИН® оказывает ноотропное, нейротрофическое, нейропротекторное и антиоксидантное действие на ткани головного мозга при травматических, ишемических или токсических поражениях центральной нервной системы (ЦНС). В доклинических исследованиях на моделях черепно-мозговых травм (ЧМТ), токсической невропатии и тотальной ишемии головного мозга на фоне применения препарата КОРТЕКСИН® показано снижение гибели нейронов мозга, уменьшение показателей окислительного стресса, более быстрое восстановление рефлексов, координации и когнитивных функций.
Механизм действия препарата КОРТЕКСИН® на молекулярном уровне детально не изучен, однако в исследованиях in vitro показано снижение гибели нейронов, как при перекисном окислительном стрессе, так и при глутаматном отравлении на фоне применения данного препарата. На модели ЧМТ применение препарата предупреждало нарушения микроциркуляции и уменьшало отечность мозга и подкорковых структур. Показано положительное влияние на тонус магистральных и периферических мозговых артерий в постокклюзивный период на модели нарушения мозгового кровообращения. На фоне лечения препаратом КОРТЕКСИН® ЧМТ и токсической нейропатии показано снижение патологического уровня молочной кислоты и увеличение концентрации глюкозы и АТФ в тканях мозга, что говорит об активации данным препаратом внутриклеточного метаболизма нейронов и активации репаративных процессов. Также на фоне применения препарата КОРТЕКСИН® отмечается повышение интенсивности тканевого дыхания (потребления кислорода) и активация аэробного пути образования энергии, что также подтверждает активирующий метаболический эффект препарата. Таким образом комплекс пептидов препарата КОРТЕКСИН® активирует внутриклеточные процессы регуляции и антиоксидантной защиты.
Препарат КОРТЕКСИН® представляет собой смесь полипептидов сходных или идентичных эндогенным полипептидам человека, в связи с чем непосредственное измерение фармакокинетических параметров не может быть выполнено. КОРТЕКСИН® вводят внутримышечно, что обеспечивает максимальную биодоступность и быстрое поступление компонентов препарата в кровь. Изменение биохимических показателей, электрической (ЭЭГ) и метаболической активности головного мозга на фоне применения препарата косвенно свидетельствуют о тканеспецифичной тропности препарата и проникновении через гематоэнцефалический барьер.
Метаболизм обусловлен составом препарата, идентичен метаболизму эндогенных пептидов и соответствует общим принципам метаболизма пептидов и аминокислот: деградация происходит под действием протеаз и пептидаз крови, с образованием активных и неактивных коротких пептидов и продолжается внутриклеточными протеазами в лизосомах. Конечным продуктом деградации являются аминокислоты, которые вновь используются в качестве субстратов в анаболических и катаболических процессах. Дальнейшая элиминация происходит общим для продуктов азотистого обмена «гаем.
Показания к применению
в комплексной терапии нарушений мозгового кровообращения,
в комплексной терапии черепно-мозговой травмы и ее последствий.
энцефалопатии различного генеза.
Способ применения и дозировка
Препарат вводят внутримышечно.
Содержимое флакона перед инъекцией растворяют в 1-2 мл воды для инъекций или 0,9 % раствора натрия хлорида, направляя иглу к стенке флакона во избежание пенообразования, и вводят однократно ежедневно: взрослым в дозе 10 мг в течение 10 дней.
При полушарном ишемическом инсульте в остром и раннем восстановительном периодах взрослым в дозе 10 мг 2 раза в сутки (утром и днем) в течение 10 дней, с повторным курсом через 10 дней.
Длительность курса лечения определяется врачом.
В очень редких случаях (менее 0,01 % или 1:10 000) возможно возникновение реакций гиперчувствительности, которые могут иметь следующие клинические проявления: реакции анафилаксии (анафилактический шок, ангионевротический отек гортани), кожная сыпь, кожный зуд, гиперемия кожи, гиперемия в месте введения.
В очень редких случаях (менее 0,01 % или 1:10 000) отмечено возбуждающее действие препарата на нервную систему, что может проявляться следующими симптомами: психомоторным возбуждением, нарушением координации движений, бессонницей, ощущением тревоги, тахикардией (увеличением частоты сердечных сокращений).
В случае возникновения побочных реакций, в том числе не указанных в данной инструкции, следует прекратить применение препарата и обратиться к врачу.
Противопоказания
— индивидуальная непереносимость препарата
Меры предосторожности
Используйте КОРТЕКСИН® только по назначению врача!
Применение местного анестетика Лидокаина в качестве растворителя для приготовления раствора лекарственного препарата КОРТЕКСИН® не рекомендуется.
Флакон с растворенным лекарственным препаратом нельзя хранить и использовать после хранения. Раствор КОРТЕКСИНА® не рекомендуется смешивать с другими растворами.
В случае пропуска инъекции не рекомендуется вводить двойную дозу, а провести следующую инъекцию как обычно в намеченный день.
Специальные меры предосторожности при уничтожении неиспользованных лекарственных препаратов не требуются.
Информация об особенностях применения препарата КОРТЕКСИН® у лиц с нарушенной функции печени и почек отсутствует, в связи с чем рекомендуется проводить оценку соотношения ожидаемой пользы и потенциального риска перед применением препарата.
Применение у детей
Применение при беременности и в период грудного вскармливания
Препарат противопоказан при беременности (из-за отсутствия данных клинических исследований). При необходимости назначения препарата в период лактации следует прекратить грудное вскармливание (из-за отсутствия данных клинических исследований).
Влияние лекарственного препарата на способность управлять транспортными средствами, механизмами
В случае возникновения симптомов возбуждающего действия (см. раздел «Побочное действие») препарат может оказывать влияние на выполнение потенциально опасных видов деятельности, требующих особого внимания и быстрых реакций (управление автотранспортом, работа с движущимися механизмами).
Передозировка
В настоящее время о случаях передозировки препарата не сообщалось.
Мозг, общение нейронов и энергетическая эффективность
По всей видимости, в эволюции сформировались энергетически эффективные механизмы кодирования и передачи информации в мозге. Подпись: «Усердно пытаюсь минимизировать энергозатраты».
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
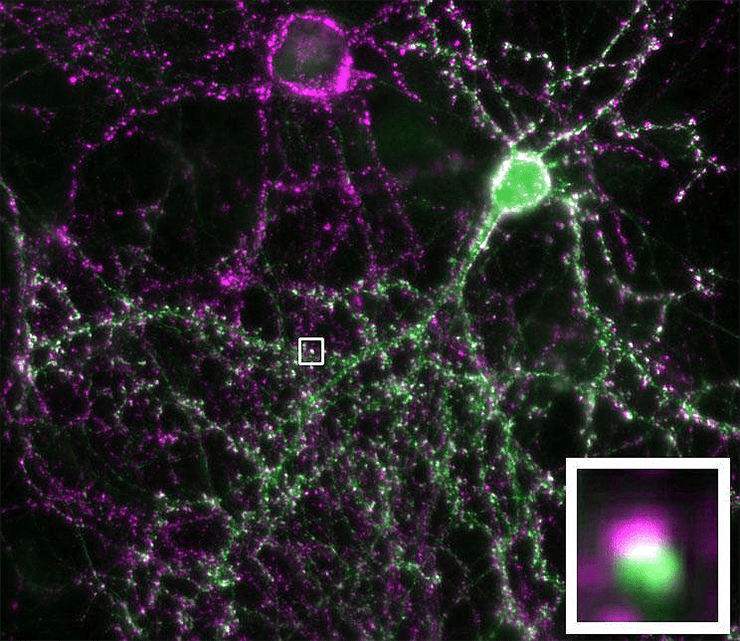
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Что такое интернейроны?
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
Интернейроны отличаются способностью генерировать значительно более высокочастотные сигналы, чем другие нейроны. Они также содержат больше митохондрий, главных органелл энергетического метаболизма, «фабрик» по производству АТФ. Последние к тому же содержат большое количество белков цитохром-с оксидазы и цитохрома-с, являющихся ключевыми для метаболизма. Так, интернейроны являются крайне важными и, в то же время, энергозатратными клетками [8], [9], [11], [16].
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Поиск оптимума
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
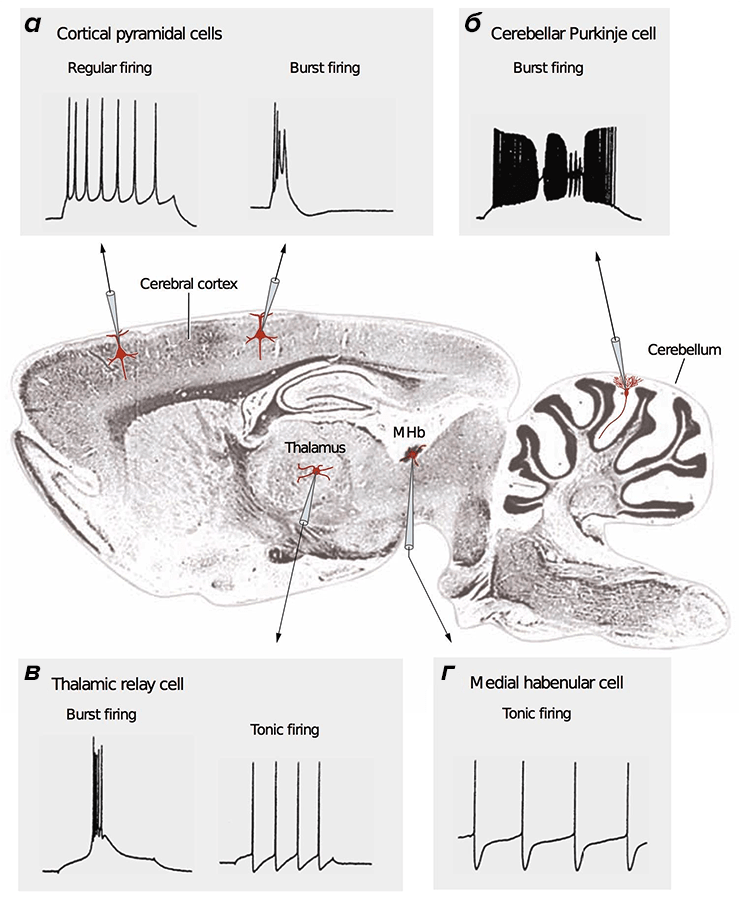
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Что такое потенциал действия?
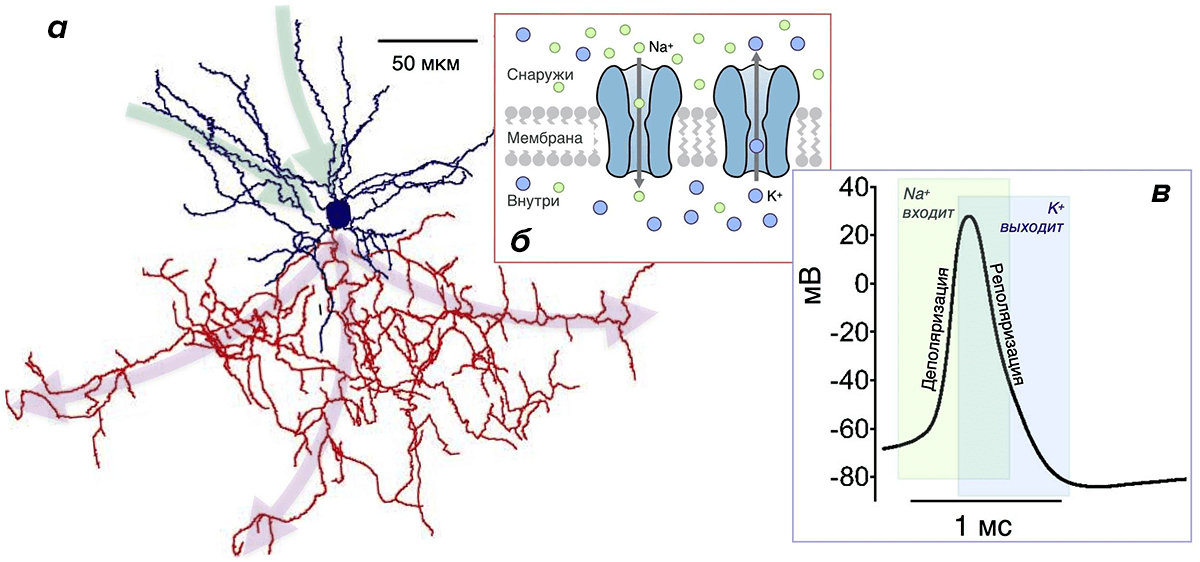
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
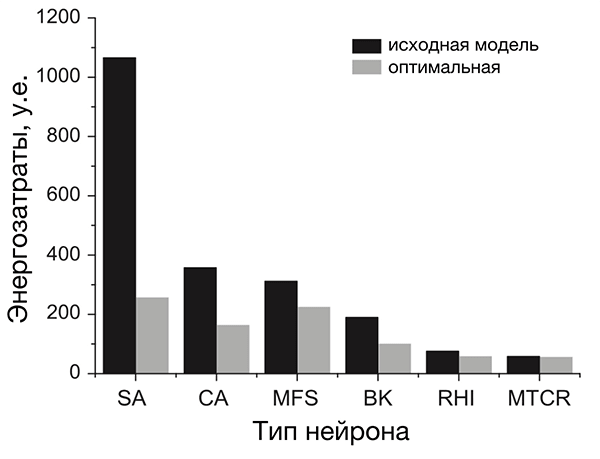
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает. «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.