Нейроны во время сна
О сне и нейронных связях.
Среди нейробиологов популярно мнение о том, что мозговые клетки, работающие сообща, всегда связаны между собой. Проще это означает, что чем больше нейросетей образуется в человеческом мозгу, тем он умнее. Вот почему является справедливой еще одна старая истина, гласящая, что практика приводит к совершенству.
Чем чаще вы упражняетесь в игре на музыкальных инструментах, в общении на других языках или в жонглировании, тем искуснее вы становитесь.
Науке известно об этом уже довольно давно. И сегодня исследователи изучают уже другую сторону данного вопроса: чтобы пополнить свой запас знаний, умение забывать или просто разрывать устаревшие нейронные сети являются намного важнее постоянной практики. Это умение получило название «синаптического прунинга».
Механизм прунинга
Давайте представим ваш мозг в виде сада. Только в нем вы выращиваете вовсе не фрукты, овощи или цветы, а налаживаете синаптические связи между мозговыми клетками. Это своего рода мосты, по которым перемещаются дофамин, серотонин и прочие нейротрансмиттеры.
«Глиальные клетки» работают в этом саду мозговыми садовниками. Они способствуют более быстрому прохождению импульсов между конкретными нейронами. Кроме того, есть еще один вид глиальных клеток, чья задача заключается в утилизации отходов, борьбе с сорняками, избавлении от вредителей и уборке опавших листьев.
Садовники, занимающиеся «подрезанием веток» в голове, получили в научных кругах название «микроглии». Они перерезают существующие синаптические связи. Вопрос только в том, как они понимают, какие именно синапсы необходимо ликвидировать?
Ученые только начали приближаться к разгадке этой тайны, но им уже известно, что синапсы, утратившие свою пользу для человека, помечаются специальным протеином C1q. И когда микроглии видят такую пометку, они связываются с этим белком и разрывают существующий «мост».
В итоге мозг расчищает почву для появления свежих и более устойчивых связей, повышая вашу обучаемость.
Важность сна
Ваш мозг самоочищается во сне!
Приходилось ли вам чувствовать, будто ваш мозг битком набит информацией? Так бывает во время изучения какого-то нового предмета или в попытках освоиться на новой работе. А порой это происходит без какой-либо видимой причины.
Под воздействием потока незнакомой информации мозг выстраивает новые связи, однако их пока нельзя назвать надежными. Для начала ему необходимо избавиться от всего лишнего, чтобы расчистить место для построения наиболее эффективных и упорядоченных нейронных связей. А происходит это во время сна.
Когда человек спит, его мозговые клетки сокращаются почти на 60%, чтобы дать возможность глиальным садовникам убрать ненужный «мусор» — старые синапсы.
Приходилось ли вам просыпаться после продолжительного ночного отдыха и замечать, насколько ваш разум чист, и как быстро одна мысль сменяет другую? Эффект от здорового сна можно сравнить с дефрагментацией жесткого диска компьютера.
По этой же причине дневной сон способствует улучшению когнитивных функций. 10 или 20 минут такого сна позволяют микроглиям быстро ликвидировать устаревшие синапсы, чтобы на их месте могли образоваться новые.
Если же вы постоянно недосыпаете, то любые попытки над чем-то поразмыслить становятся похожими на прогулку в непроходимых джунглях с мачете в руке.
Вы почти не продвигаетесь, и это приводит к истощению. И наоборот, мысли выспавшегося человека напоминают веселую прогулку по убранным тропинкам красивого парка, где ничто не заграждает обзор. И это очень бодрит.
Вы сами решаете, какая информация будет удалена
Уничтожению подлежат все синаптические связи с соответствующей меткой. Сохраняются лишь те, что пользуются спросом, поэтому будьте внимательны в своих мыслях. Так, если одержимо изучать всевозможные предположения о том, чем же закончится «Игра престолов», забыв о своей работе, то не нужно быть гением, чтобы понять, от каких синапсов ваш мозг избавится в первую очередь.
Если вы конфликтуете со своим коллегой по работе и думаете лишь о том, чтобы с ним поквитаться, а не о текущем проекте, то в конечном итоге вы станете изощренным мстителем, лишенным каких-либо новаторских идей.
Важно лишь то, на чем вы акцентируете свое внимание. Выбирая объект внимания, вы тем самым в буквальном смысле обретаете способность управлять собственным разумом.
Конечно, никому из нас не под силу контролировать абсолютно все, что с нами происходит на протяжении дня. Но никто не мешает нам сознательно выбирать, как все эти события на нас повлияют, и в соответствии с этим построить в своем мозгу нужные нейронные связи.
Не стоит зацикливаться на том, что мешает вам двигаться вперед. Лучше подумайте обо всех тех вещах, которые делают вас лучше. Не просчитывайте возможные варианты исхода событий, замените это медитацией.
Очистите разум, направьте всю его энергию на то, что принесет вам пользу.
Здесь все зависит от стратегии. Вам следует использовать свой мозг с умом, будьте мудрыми. Мудрость приходит к человеку, когда он может противостоять соблазнам.
Таким образом, чтобы избавиться от ненужных знаний, просто перестаньте думать об этих вещах. Если же вы все равно о них вспомнили, просто переключите внимание на что-то другое.
Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни
Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни
Эпифиз вырабатывает «гормон сна» мелатонин ночью, а солнечный свет тормозит его образование. Мелатонин — главный регулятор циркадных ритмов, управляющих распорядком дня человека.
Автор
Редакторы
Новая неделя, новый день, новый год. Время жизни разбито на отрывки разной длительности, и все эти отрывки повторяются. Каждые несколько часов нам хочется есть. Каждый вечер мы ложимся спать. Каждые четыре недели организм женщины вырабатывает яйцеклетку. Большинство процессов, происходящих с нашим телом, циклично, и одни циклы завязаны на другие. И хотя старение организма периодическим процессом не назовёшь (ведь никто не молодеет!), его ход напрямую зависит от биоритмов человека, в частности, от цикла сна и бодрствования. Доказательства этому находятся и на уровне поведения, и на уровне отдельных органов, клеток и генов.
Старение и долголетие
Цикл статей, задуманных в рамках спецпроекта «биомолекулы» для фонда «Наука за продление жизни».
В этом цикле рассмотрим общие проблемы старения клеток и организмов, научные подходы к долголетию и продлению здоровой жизни, связь сна и старения, питания и продолжительности жизни (обратимся к нутригеномике), расскажем про организмы с пренебрежимым старением, осветим темы (эпи)генетики старения и анабиоза.
Конечно, феномен старения настолько сложен, что пока рано говорить о радикальных успехах в борьбе с ним и даже о четком понимании его причин и механизмов. Но мы постараемся подобрать наиболее интересную и серьёзную информацию о нащупанных связях, модельных объектах, разрабатываемых и уже доступных технологиях коррекции возрастзависимых нарушений.
Краткое содержание спецпроекта освещено в видеоролике «Стареть или не стареть? // Всё как у зверей». Подробности же узнаете из наших статей.
Следите за обновлениями!
Часы в мозге
Как показывает практика, механизмы смены сна и бодрствования можно объяснить даже детям — «„Проснись!“ — „Усни. “ — „Проснись!“ — „Усни. “ — „Проснись!“» [1]. — Ред.
У дрозофил нашли подобие «гена сна», что описано в статье «Бессонные ночи дрозофилы» [2]. Чисто теоретически это может привести к тому, что потребностью во сне можно будет управлять, но вряд ли мы это когда-то увидим. — Ред.
Есть предположение, что изначально (много миллионов лет назад) циркадные ритмы помогали организмам не умирать от кислорода, которого в тот момент в атмосфере стало аномально много для тогдашних обитателей планеты — «Прообраз биологических часов» [3]. — Ред.
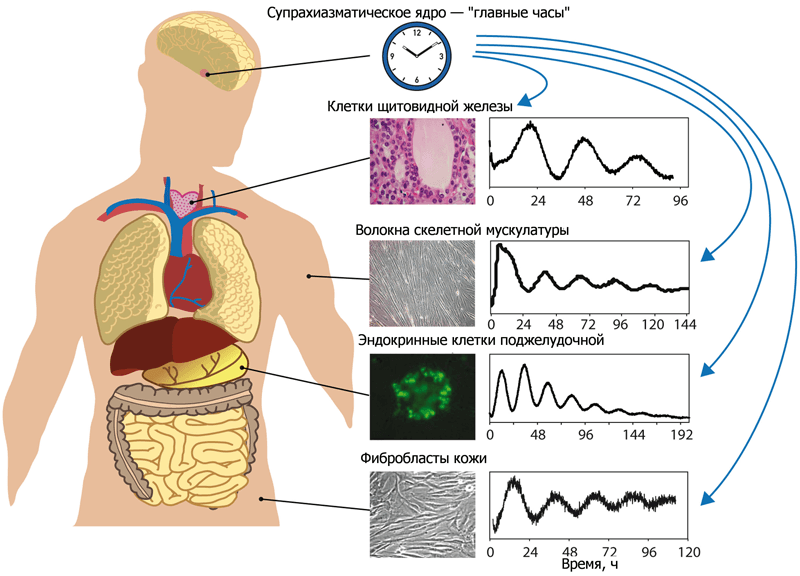
Рисунок 1. Влияние супрахиазматического ядра гипоталамуса на работу различных клеток организма. Функционирование клеток всех типов тканей подчиняется центральному ритму, который задаёт супрахиазматическое ядро гипоталамуса. Оно «следит» за тем, чтобы сигналы от нервной и эндокринной систем приходили к клеткам в одно и то же время — фактически, синхронизирует их. Кстати, то же можно сделать и вне организма: выращивая в культурах несколько образцов различных тканей человека, можно эти культуры синхронизировать, если имитировать сигналы SCN. Такая синхронизация активности культур различных типов клеток одного и того же человека представлена на графиках.
В ходе исследований посмертных срезов мозга здоровых пожилых людей выяснилось, что с возрастом нейроны SCN дегенерируют. Изменяется и структура LC. Кроме того, активность лобных долей коры значительно падает с возрастом (и степень снижения этой активности напрямую отражается на интеллекте), что показано в исследованиях фМРТ [4]. Всё это приводит к тому, что со временем у людей исчезают острые пики активности при бодрствовании. То есть пожилые, конечно, бодрствуют, но внимательность и скорость мышления у них не так хороши, как раньше. Вероятно, причина этого — постепенное ухудшение работы мозговых регуляторов сна и бодрствования.
У пожилых по сравнению с молодыми эффективность сна снижена. С этим может быть связана старческая сонливость, возникающая даже тогда, когда человек определённо выспался. Судя по всему, возрастное падение качества сна не вызвано какими-то конкретными патологиями, это просто часть обычного процесса старения. Впрочем, так ли неизбежно само старение, вопрос.
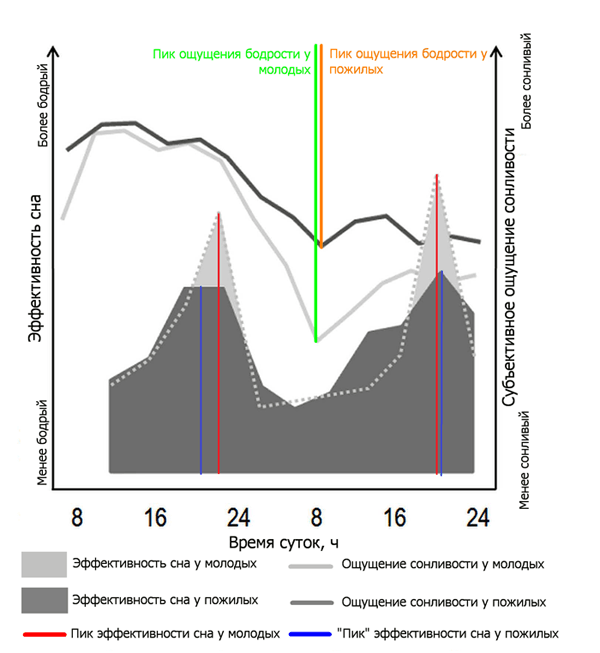
Кроме того, старые хуже переносят вынужденный пропуск сна. Это показали эксперименты, в ходе которых 12 мужчин возрастом 21–31 год и 11 мужчин возрастом 61–70 лет не спали 40 часов (рис. 2). У пожилых субъективное ощущение сонливости было сильнее, чем у молодых, да и внимание из-за недосыпа падало заметнее [5].
Другой эксперимент с такой же длительностью провели в 2005 году [6]. Его результаты тоже представлены на рисунке 2 (закрашенные серым области). В нём двум группам участников-мужчин (опять пожилым и молодым) нужно было в течение 40 часов то спать по 75 минут, то бодрствовать по 150 минут, притом делать это по расписанию. Такой искусственный режим должен был выявить, насколько сон у людей одной возрастной группы более эффективен, чем у испытуемых из другой группы. Нетрудно догадаться, что молодые во время эксперимента и после него чувствовали себя лучше, чем пожилые, потому что лучше высыпались.
Рисунок 2. Субъективное восприятие качества сна и бодрствования у молодых и пожилых мужчин во время 40-часового эксперимента по лишению сна [5], а также эффективность сна во время эксперимента с множеством эпизодов сна [6]. Пожилые раньше начинают чувствовать сонливость, и субъективно она проявляется сильнее (тёмно-серая линия). Молодые более устойчивы к депривации сна (светло-серая линия). Кроме того, субъективно сон молодых (светло-серые закрашенные области) более эффективен, чем сон пожилых (тёмно-серые закрашенные области).
«Гены циркадных ритмов» и старение
Работа любого органа — это, в конечном счёте, работа его генов. Наши «внутренние часы» — не исключение. В супрахиазматическом ядре экспрессируется ряд генов, малоактивных в других частях мозга и тела вообще. Среди таких генов BMAL1 (он же MOP3 и ARNT3), CLOCK и NPAS2 [7], [8]. Эти гены были выявлены в исследованиях с помощью нокаутных мышей — таких, которым методами генной инженерии нарушили работу одного или нескольких генов.
Как правило, продолжительность жизни у грызунов с одним или несколькими выключенными «генами периодичности» снижена. В частности, мыши с неработающим BMAL1 живут меньше своих собратьев. Под конец жизни у них проявляются все характерные признаки старения: их органы уменьшаются в размерах, теряется мышечная масса и подкожный жир, развивается старческая катаракта, повышается содержание активных форм кислорода в тканях [9]. При постоянной нехватке белков BMAL1 и CLOCK ухудшается память, снижается интеллект: животные хуже обучаются и быстрее забывают новую информацию [10].
BMAL1 и CLOCK действуют по-разному: если «выключить» работу гена CLOCK, не затрагивая BMAL1, жизнь мышей претерпевает менее глобальные изменения. Средний срок жизни грызунов без CLOCK на 15% короче, чем у животных дикого типа, а преждевременное старение проявляется у них только в изменении структуры кожи и развитии катаракты [11].
Вот один из примеров связи циркадных ритмов с обменом веществ в целом: «Найдена связь между обменом веществ и циркадным ритмом» [12].
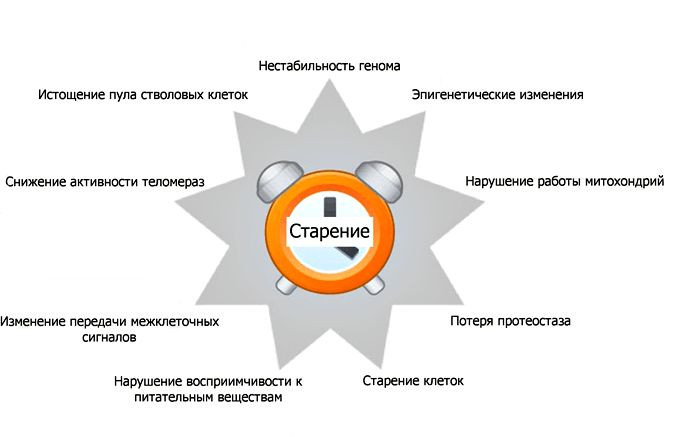
Рисунок 3. Примеры проявлений старения на клеточном уровне. Подробное объяснение этих проявлений дано ниже в тексте в виде нумерованного списка.
Исследования обычно проводятся на больших группах животных, и данные по этим животным усредняются. Но мы-то помним, что каждый организм имеет свой уникальный геном, и от того, как гены в его составе взаимодействуют между собой, зависит очень многое. У двух мышей может быть нарушена работа одного и того же CLOCK, но на уровне отдельных органов и организма в целом это нарушение проявится у них совершенно по-разному. Да даже если с вариантами генов всё в порядке, два организма не будут стариться одинаково. Дело в том, что роль в силе и характере изменений сна с возрастом играет и генотип конкретного организма. Это было подтверждено исследованиями на мышах [23], [24], в которых качество сна грызунов оценивали по элетроэнцефалограммам, а также смотрели, как с возрастом у этих грызунов ухудшается зрение.
У грызунов линии C57BL/6 чаще других с возрастом развивается катаракта, а значит, почти пропадает зрение. Видимо, поэтому под старость (в возрасте примерно год) эти сумеречные животные всё более активны в светлое время суток и всё менее активны в темноте. Кроме того, пожилые C57BL/6 бодрствуют дольше остальных, а AKR/J дольше всех спят. Больше всего времени в стадии REM-сна проводят мыши линии DBA/2J, а меньше всего — AKR/J. Если годовалым мышам этих трёх линий некоторое время мешать спать, а потом дать им возможность выспаться, то быстрее всех к своему обычному режиму возвращаются грызуны C57BL/6.
Сон и метаболизм
Мы выяснили, как нарушение работы «генов циркадных ритмов» влияет на состояние отдельных клеток. А как на них действует нарушения сна, столь частые в преклонном возрасте?
Хотя сон считается временем покоя, во время сна очищение нейронов от «отработанных» продуктов обмена веществ происходит быстрее, чем при бодрствовании [26]. Кстати, ночью очищается не только нервная система. Во время сна также усиливается или ослабевает экспрессия ряда генов. В тканях лёгких экспрессия 3% генов различается во сне и при бодрствовании. В тканях сердца таких «сон-зависимых» генов 6%. Во время сна содержание маркеров клеточного стресса в тканях лёгких, сердца и мозга снижено [27].
Возможно, одна из функций сна — избавление организма от отработанных метаболитов и общее восстановление клеток после стресса. Если это предположение окажется верным, оно сможет объяснить некоторые факты. Например, известно, что независимо от национальности у женщин 46–57 лет, имеющих частые жалобы на качество сна, особенно высок риск метаболического синдрома [28]. Впрочем, последнее может быть связано с тем, что в дополнительные часы бодрствования эти женщины едят [29]. А значит, они потребляют больше калорий в сутки, чем женщины без проблем со сном. В пользу этой гипотезы свидетельствует то, что экспериментальное нарушение сна не вызывало у крыс метаболического синдрома [30].
По данным эпидемиологических исследований, депривация (ограничение времени) сна повышает вероятность дислипидемии, диабета 2 типа и нетолерантности к глюкозе (таб. 1).
| Первый автор статьи, ссылка | Год | Число участников | Продолжительность исследования | Результаты |
|---|---|---|---|---|
| Chaput et al. [32] | 2007 | 740 | 3 года | Регулярный сон длительностью менее 6 часов вызывает нарушение толерантности к глюкозе. |
| Mallon et al. [33] | 2005 | 2663 | 12 лет | У мужчин частые пробуждения и короткий сон связаны с повышенной вероятностью диабета. |
| Nilsson et al. [34] | 2004 | 6599 | 14,8 ± 2,4 года | Нарушения сна повышают риск развития диабета. |
| Tuomilehto et al. [35] | 2008 | 2800 | 2 года | Слишком короткий (≤6 ч) или слишком длинный (≥8ч) сон повышают вероятность развития диабета 2 типа у женщин среднего возраста. У мужчин аналогичного эффекта не нашли. |
| Meisinger et al. [36] | 2005 | 8300 | 11 лет | У людей обоих полов сложности с поддержанием сна (частые просыпания и т.п.) повышают риск развития диабета 2 типа. |
| Hayashino et al. [37] | 2007 | 6509 | 6 лет | У взрослых без серьёзных проблем со здоровьем нарушения засыпания связаны с повышенным риском диабета. |
| Kawakami et al. [38] | 2004 | 2649 | 8 лет | Нарушения сна связаны с повышением риска диабета в 2-3 раза. |
| Choi et al. [39] | 2008 | 4222 | 1 год | И слишком короткий, и слишком длинный сон ассоциируются с повышенным риском метаболического синдрома. |
| Gangwisch et al. [40] | 2007 | 8992 | 10 лет | Кратковременный сон может быть важным фактором риска диабета. |
| Xu et al. [41] | 2010 | 10143 | 10 лет | Короткий ночной сон и частый дневной сон связаны с проявлением диабета. |
| Rafalson et al. [42] | 2010 | 1455 | 6 лет | Короткий ночной сон связан с нарушением содержания глюкозы в крови натощак, вызванным резистентностью к инсулину. |
| Yaggi et al. [43] | 2006 | 1709 | 18 лет | И слишком короткий, и слишком длинный сон повышают риск развития диабета. |
| Hall et al. [44] | 2008 | 1214 | Одномоментное исследование | Продолжительность сна связана со степенью риска метаболического синдрома. |
| Facco et al. [45] | 2010 | 189 | В течение беременности | Малая продолжительность сна связана с нарушением толерантности к глюкозе во время беременности. |
| Qui et al. [46] | 2010 | 1290 | В течение беременности | Гестационный диабет (диабет беременных) и нарушение толерантности к глюкозе чаще развиваются у тех, кто мало спит. |
Помимо нарушений метаболизма, ошибок репликации и повышенным по сравнению с нормой процентом гибнущих клеток [30], депривация сна может повлечь за собой негативные последствия для иммунной системы. У пациентов с постоянным недосыпом днём в крови повышается содержание маркеров воспаления — фактора некроза опухолей (TNF), интерлейкинов 1 и 6, а также кортизола [31], [47]. А ведь воспаление идёт рука об руку с повышенным риском множества заболеваний, начиная от инсульта и заканчивая болезнью Альцгеймера. Например, при последней клетки микроглии (это макрофаги в мозге) выделяют заметные количества интерлейкинов 12 и 23 — одних из важнейших сигналов воспаления. В норме этого, разумеется, не происходит, ведь ни болезни Альцгеймера, ни воспаления нет. Судя по всему, команду микроглии вырабатывать факторы воспаления даёт сам бета-амилоид. Далее, при болезни Альцгеймера астроциты (разновидность глиальных клеток, питают и поддерживают нейроны, направляют их рост у зародышей) становятся восприимчивыми к IL-12 и IL-23 (опять же, в норме такого не наблюдается.) Отложения бета-амилоида увеличиваются в размерах, клеток астроглии становится всё больше, а нейронов рядом с ними — всё меньше [48]. Если снизить выработку IL-12 и IL-23 в клетках глии, патология замедлит своё развитие.
Во взаимосвязях воспаления, выделения интерлейкинов и работы астроцитов при болезни Альцгеймера ещё предстоит разобраться, но уже сейчас ясно, что такие взаимосвязи существуют. На самом деле, подобных корреляций выявили уже немало. А о связи нарушений сна и различных заболеваний (нервных, и не только) будет отдельная статья.
Сон спасает нейроны от перегрузки
Во время сна мозг ослабляет межнейронные контакты, чтобы нейроны сохранили способность к восприятию новой информации.
Нервные клетки общаются друг с другом с помощью синапсов – особых межклеточных контактов, которые пропускают электрохимический импульс от нейрона-передатчика к нейрону-приемнику.
Импульс между клетками перескакивает не сам по себе (хотя бывают и такие межнейронные соединения), а посредством специальных веществ нейромедиаторов, к которым относятся дофамин, серотонин, гамма-аминомасляная кислота и многие другие: нейрон-передатчик выбрасывает нейромедиатор в синаптическую щель, а нейрон-приемник ловит нейромедиаторные молекулы своими рецепторами и генерирует на своей мембране такой же импульс, который бежит дальше.
Впрочем, каким именно окажется сгенерированный сигнал, таким же или не таким же, зависит во многом от молекулярной химии синапса, от соотношения между нейромедиатором и рецепторами к нему. Если рецепторов много, нейроны будут хорошо «слышать» друг друга, если мало, путешествующий по нейронной цепи сигнал начнёт затухать.
Вся нервная деятельность завязана на синапсы и нервные цепи, и память – не исключение: чтобы хорошо что-то запомнить, нужно, чтобы сформировались прочные межнейронные контакты. Однако если нейроны будут без конца усиливать свои синапсы, то это в конце концов приведёт к информационному беспорядку и истощению самих клеток, так что никакого обучения и запоминания не получится. Можно предположить, что нервные клетки должны специально ослаблять силу межнейронных контактов, чтобы поддерживать равновесие между необходимостью помнить старое и усваивать новое. Известно, что во время бодрствования синапсы всё время усиливаются, так что сам собой напрашивается вывод, что их ослабление, спасающее нервную систему от перегрузки, происходит во сне.
Исследователи из Института Джонса Хопкинса показали, как именно это происходит. Ричард Хагенир (Richard Huganir) и его коллеги проанализировали состояние нейронов в центрах памяти у мышей во время сна и во время бодрствования, причём особое внимание обращали на синаптические рецепторы нейронов-приемников. Оказалось, что у спящих мышей число рецепторов к нейромедиаторам уменьшалось на 20%.
Удалось найти и того, кто управляет «сонным» ослаблением синапсов – им оказался белок под названием Homer1a (стоит уточнить, что сам по себе Homer1a открыли ещё в 1997 году, но, как часто бывает с регуляторными белками, его функции до сих пор продолжают активно изучать). В межнейронных контактах у спящих мышей уровень Homer1a резко возрастал, а если его синтез у животных искусственно подавляли, то и никакого ослабления синапсов не происходило.
То есть Homer1a в нужный момент запускает ослабление синапсов, уменьшая количество рецепторов к нейромедиаторам – в результате у проснувшегося мозга будут ресурсы для восприятия нового. Но как сам белок угадывает, что индивидуум уснул и можно браться за работу?
В статье в Science говорится, что Homer1a реагирует на уровень норадреналина и аденозина. Норадреналин поддерживает организм в бодрствующем состоянии, и, когда его много, белок Homer1a уходит из зоны синапса, когда же уровень норадреналина падает, Homer1a в синапс возвращается. Причем Homer1a реагирует на возрастающую потребность во сне: когда мышей принудительно лишали сна на несколько дней, количество этого белка в синапсах увеличивалось, хотя мыши не спали. Причина здесь в аденозине, который постепенно накапливается во время бодрствования и вызывает сонливость – если у животных блокировали действие аденозина, уровень Homer1a в синапсах так и не повышался.
Наконец, исследователи проверили, действительно ли ослабление синапсов необходимо для эффективной работы мозга. Мышей сажали в клетку, где по полу время от времени пробегал слабый электрический разряд, так что вскоре животные понимали, что в этой клетке ничего хорошего ждать не стоит, и, оказавшись в ней снова, замирали на месте – обычная реакция грызунов на стресс. Затем мыши отправлялись спать, а после сна их снова сажали либо в электрическую клетку, либо в какую-то другую.
Поспавшие мыши, попав в то место, где их били током, 25% времени проводили в ступоре – они хорошо помнили и клетку, и связанные с ней неприятные ощущения. В другой клетке мыши тоже время от времени пугались, но неизмеримо реже, так что на стрессовую реакцию приходилось всего 9% времени пребывания.
Картина менялась, если у животных подавляли ослабление синапсов. Ожидалось, что в таком случае память вообще станет хуже, но вышло несколько иначе: мыши впадали в стресс намного чаще и в электрической клетке, и в безопасной. Сами авторы работы объясняют это так: из-за того, что все межнейронные контакты сохранили свою первоначальную силу, животным стало трудно отличить одну клетку от другой, как если бы слишком сильные воспоминания искажали восприятие. Иными словами, ослабление синапсов необходимо, чтобы не путаться в груде равнозначной информации.
Но насколько такое ослабление затрагивает мозг в целом? Отчасти на этот вопрос отвечает другая статья, также опубликованная в Science – в ней нейробиологи из Висконсинского университета в Мадисоне пишут, что они проанализировали около семи тысяч синапсов в моторной и сенсорной коре мозга мыши и в результате пришли к выводу, что синапсы во время сна уменьшаются примерно на 18%.
Что в данном случае значит «уменьшаются»? У всякого синапса есть определённая площадь, и чем она больше, тем сильнее канал передачи информации между нейронами (очевидно, что с большой поверхности можно высвободить больше нейромедиаторов и что на большую площадь можно посадить больше тех самых рецепторов к нейромедиаторам). Уменьшение синапса означает, что сокращается его площадь.
Исследователи подчёркивают, что сокращение не затрагивало самые большие синапсы – вероятно, они формировали нервные цепочки, отвечающие за самую важную информацию, которую ни в коем случае нельзя потерять. Конечно, несколько тысяч синапсов из моторной и сенсорной коры – это ещё не весь мозг, однако есть все основания полагать, что сонное регулирование синапсов в той или иной степени происходит и в других его областях.