какую роль в клетке выполняет ррнк
Биоинформатика в мире РНК-структур
Понимание, как формируется пространственная конфигурация РНК, необходимо для разработки методов предсказания вторичных структур молекул и определения выполняемых ими функций в клетке живых организмов
рисунок А.В. Головина
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Амбициозный проект «Геном человека», завершившийся в 2003 году, был призван расшифровать всю ДНК, содержащуюся в человеческом геноме. Считалось, что проект поможет понять, как функционируют гены, каким образом они определяют состояние клетки и организма человека в целом, а также даст толчок развитию медицины и биологических наук. Однако исследования показали, что вся сложность клетки как целостной системы не сводится к одному лишь геному. Функционирование и роль молекулы РНК в регуляции клеточных процессов во многом зависят от ее пространственной организации, изучение которой — сложная задача, справиться с которой под силу только биоинформатике.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Биоинформатика и молекулярная эволюция».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Вторичная структура РНК
У прокариот процесс транскрипции и трансляции обычно сопряжен в пространстве и во времени. — Ред.
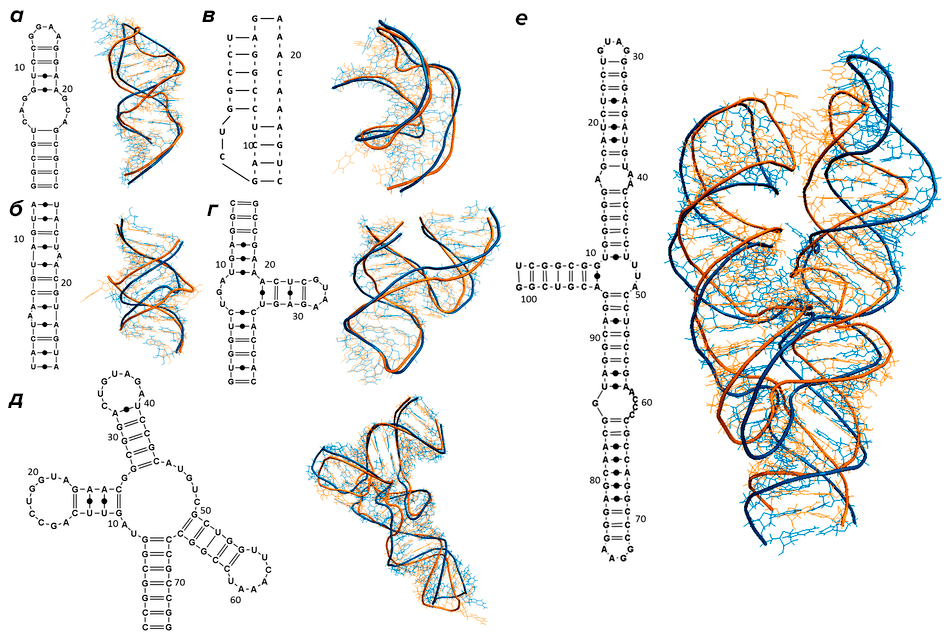
Дело в том, что РНК, подобно белковым молекулам [4], не существуют в виде простой цепочки. Нуклеотиды РНК взаимодействуют друг с другом, объединяясь в пары по принципу комплементарности, в результате чего молекула нуклеиновой кислоты приобретает причудливую конфигурацию: возникают петли, шпильки, псевдоузлы и другие формы (рис. 1). Если первичная структура — это просто последовательность нуклеотидов, то подобные образования относятся к вторичной структуре. И этот уровень организации молекулы также несет информацию, которая используется в регуляции таких процессов, как транскрипция ДНК, сплайсинг РНК, изменение активности генов с помощью микроРНК, а также транспорт транскриптов в определенные области клетки [5].
Рисунок 1. Разнообразие вторичных структур РНК: а — шпилька с внутренней петлей; б — дуплекс с двумя выступами; в — псевдоузел; г — молотовидный рибозим (hammerhead ribozyme) PDB: 1NYI; д — тРНК PDB: 1J1U; е — РНК из белок-РНКовго комплекса, узнающего и осуществляющего доставку на мембрану синтезируемых на рибосоме мембранных белков (SRP RNA) PDB: 1Z43. Справа от каждой структуры показана ее 3D-модель: предсказанные с помощью вычислительных методов (синий цвет) и полученные экспериментально (желтый цвет).
Вторичная структура также влияет на взаимодействие РНК с молекулами, например, со специфическими белками RBP (RNA binding proteins). Они связываются с РНК с образованием рибонуклеопротеиновых комплексов и регулируют сплайсинг, трансляцию и другие процессы. Если участок связывания «закрыт» петлей, белок не сможет провзаимодействовать с молекулой [6]. Роль вторичной структуры можно также проиллюстрировать воздействием мутаций. В работе Мэтью Халворсена (Matthew Halvorsen), опубликованной в журнале PLoS Genetics в 2010 году, изучались мутации, связанные с заболеваниями человека и находящиеся в регуляторных участках РНК, называемых 5′- и 3′-нетранслируемыми областями. Эти области отвечают за регуляцию процесса трансляции, деградацию РНК, участвуют в РНК-интерференции и при этом сильно структурированы. Мутации могут вызвать серьезные структурные перестройки, что становится причиной таких заболеваний, как наследственный синдром гиперферритинемии-катаракты, ретинобластома или гипертензия [7].
Рисунок 2. Вторичная структура РНК большой рибосомной субъединицы Escherichia coli
При наличии определенных факторов конфигурация РНК может изменяться, что, в свою очередь, влияет на регуляцию генов. Один из лучших примеров специфичности и динамичности вторичной структуры — РНК-переключатели (riboswitch), имеющиеся в клетках бактерий, дрожжей, водорослей и высших растений. Это участки мРНК, которые способны получать информацию о внутриклеточных условиях, связываясь с лигандами. Обычно РНК-переключатели состоят из двух доменов — аптамера, который взаимодействует с лигандами, и домена экспрессии. Как только лиганд (аминокислота, нуклеотиды, ионы металлов) связывается с аптамером, происходят изменения во вторичной структуре примыкающего к аптамеру домена экспрессии, что имеет значение для дальнейшей судьбы мРНК. Например, возникновение шпилек может воспрепятствовать транскрипции или синтезу белка в рибосомах [5]. Структура аптамера, подобно устройству дверного замка, подходит только определенному лиганду, который играет роль ключа
РНК-структуромика
Весь клеточный набор вторичных РНК-структур называется «РНК-струтурóмом» (по аналогии с генóмом или транскриптóмом) [2]. Исследование структурома позволяет ученым понять, как определенные разновидности (мотивы) укладки молекул РНК связаны с участием в различных клеточных процессах, таких как транскрипция, сплайсинг, локализация в клетке, трансляция и регуляция транскриптов. Здесь ученые сталкиваются с определенными проблемами. Недостаточно высокая эффективность методов изучения структуры РНК и сложность получения длинных фрагментов РНК — существенные препятствия на пути к полному описанию структурома. Однако буквально за последние годы технологии секвенирования совершили огромный скачок в развитии. Появились инструменты секвенирования нового поколения, которые позволяют с высокой точностью и относительно быстро определить последовательности ДНК и РНК. Очень важно также использование вычислительных методов, которые сильно продвинулись в своей способности точно предсказывать структуру РНК. При этом все же золотым стандартом определения структуры РНК был и остается эксперимент [5].
Исследования с использованием компьютерных методов привели ко многим открытиям. Например, транспортные РНК обладают структурными особенностями, которые соответствуют их функциям. Для поиска тРНК существуют различные инструменты, например, программа tRNAscan-SE, написанная на популярном среди биоинформатиков языке Perl. Она занимается поиском «подозрительных» участков в геноме, которые могут кодировать тРНК. После тщательного «просеивания» этих участков, остаются гены, которые являются истинными тРНК с вероятностью в 99–100%. Программа ориентируется не только на последовательность нуклеотидов, которая может различаться у разных тРНК, но также на вторичную структуру, являющейся общей для всех тРНК и напоминающей лист клевера. Кроме этого, tRNAscan-SE сравнивает гены-кандидатов с последовательностью, структура которой известна. Если гены-кандидаты формируют такую же структуру, значит они с высокой вероятностью являются тРНК [8].
Естественный отбор имеет значение
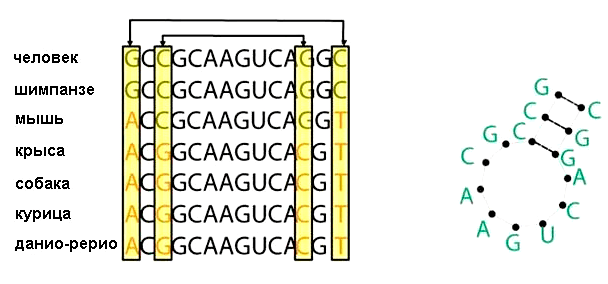
Как узнать, что на данной последовательности образуется структура? Для этого нужно, чтобы замена нуклеотида на одном участке последовательности обязательно сопровождалась компенсаторной заменой нуклеотида на другом участке последовательности [9]. Это значит, что оба нуклеотида участвуют в формировании структуры, к примеру, образуя пару G—C или A—U. Структура сохранится, если пара G—C заменится на пару A—U или наоборот. Когда в распоряжении есть достаточное количество гомологов, то, исходя из расположения многих консервативных пар, можно вывести вторичную структуру РНК (рис. 3).
Рисунок 3. Консервативность пар оснований в гомологичных последовательностях является основой для предсказания вторичной структуры. Стрелочками указаны взаимодействующие друг с другом нуклеотиды, которые могут быть различными в ряду последовательностей, однако сохраняющие конфигурацию молекулы (справа).
Вездесущая термодинамика
Когда в распоряжении исследователя имеется не ряд гомологов, а только одна последовательность, имеет смысл воспользоваться термодинамическим моделированием. Предполагается, что молекула РНК правильной структуры находится в состоянии термодинамического равновесия [10]. На основе энергетических параметров данной молекулы, полученных экспериментально, строятся всевозможные конфигурации вторичной структуры. Среди них ищут наиболее устойчивую, которая и будет правильным решением. Для коротких цепочек, длиной менее 700 пар оснований, данный метод корректно определяет структуру для 70% пар. Однако если цепочка длиннее, точность падает вплоть до 20%. Альтернативный подход — использование алгоритмов, основанных на вероятностном моделировании, — к сожалению, сильно уступает термодинамическим методам. Другая возможная стратегия — объединение термодинамического моделирования и машинного обучения [11]. Также с помощью PARS-метода можно выяснить, какие нуклеотиды являются непарными, чтобы исключить их из алгоритма и улучшить точность предсказания.
В методах предсказания вторичной структуры существуют существенные ограничения. Конформационные изменения РНК-переключателей в результате взаимодействия с лигандом настолько сложно смоделировать, что существующие алгоритмы оказываются бесполезными. Также большие трудности вызывает предсказание псевдоузлов, состоящих из двух совмещенных особым образом шпилек (рис. 1). Псевдоузлы встречаются в рРНК, тРНК, а также в геномах вирусных РНК, где они участвуют в процессах трансляции [12]. Для их поиска разрабатывают специальные методы, которые ориентированы на отдельные типы псевдоузлов. Однако с увеличением длины последовательности экспоненциально растет время, затрачиваемое алгоритмом на решение данной задачи. В этих условиях эксперимент становится необходим, позволяя ученым улучшить существующие алгоритмы и разработать новые стратегии поиска.
В игру вступает параллельное секвенирование
В параллельном анализе структуры РНК (или PARS-методе) применяются инструменты секвенирования нового поколения, которые позволяют получить миллионы расшифрованных последовательностей за один единственный эксперимент. Сначала образцам РНК позволяют свернуться с образованием вторичной структуры, затем их подвергают воздействию рибонуклеаз — ферментов, катализирующих расщепление связи между нуклеотидами. В PARS-методе используют два типа рибонуклеаз — V1 и S1. Первая расщепляет спаренные участки, вторая — простую цепь. Полученные фрагменты конвертируют в ДНК и секвенируют. Те фрагменты, которые были обработаны V1, в большинстве случаев обрываются на том нуклеотиде, который участвовал в образовании вторичной структуры. Сравнение большого числа копий одной РНК, позволяет судить об интенсивности расщепления на определенных участках молекулы и определить, формируется ли на этом участке вторичная структура [5].
С помощью PARS в 2010 году Кертес и его коллеги изучили вторичную структуру транскриптома дрожжей, проанализировав приблизительно 4,2 миллиона нуклеотидов в 3 тысячах транскриптов. Ими были обнаружены регуляторные мотивы, например, участок внутренней посадки рибосомы URE2, который позволяет начать синтез белка не с одного из концов мРНК, а с середины молекулы. Это исследование, опубликованное в журнале Nature [13], показало, что PARS-метод способен пролить свет на глобальную структурную организацию мРНК. Было открыто преимущественное расположение вторичных структур в кодирующих участках по сравнению с нетранслируемыми областями, а также их роль в регуляции процесса трансляции, который протекает тем активнее, чем менее структурирован сайт инициации трансляции. Объединение параллельного анализа с программными средствами предсказания конфигурации, а также термодинамическим моделированием, дает в руки ученых мощный инструмент для более глубокого постижения мира РНК-структур, что способствует появлению новых гипотез и открытий, касающихся регуляции клеточных процессов.
Стóит отметить, что данный метод дает весьма приблизительную и косвенную информацию о вторичной структуре РНК. На данный момент разработаны более «продвинутые» экспериментальные методики, основанные на химической модификации неспаренных нуклеотидов и позволяющие получать данные более высокого разрешения (напр. SHAPE). — Ред.
Самая большая РНК-лаборатория в мире
Моделирование вторичной структуры РНК, несмотря на большое количество методов, до сих пор остается сложной задачей. Не все принципы известны, а экспериментальные данные настолько обширны, что на анализ, который проводят небольшие группы ученых, уходит много труда и времени. Чтобы решить эту проблему, в университете Карнеги-Меллон и Стэнфордском университете разработали краудсорсинговый проект EteRNA.
В последние годы все больше серьезных научных проектов идут «в народ» в форме онлайн-игр. Такое явление получило название «гражданской науки». Примером аналогичной инициативы служит аркадная игра FoldIt, нацеленная на предсказание строения белковых молекул: «Тетрис XXI века» [14]. — Ред.
Концепция «мусорной ДНК» неоднократно сильно менялась: лет 10 назад бытовало мнение, что ДНК «активна лишь на 10%», а всё остальное является бесполезным кладбищем генов. В последнее время эти воззрения сильно модифицировались, в который раз подтверждая, что не все так просто: «Сколько сора в нашей ДНК» [16]. — Ред.
Биологическая роль ДНК и РНК
ДНК – самая важная молекула для всех живых существ, даже растений. Она определяет наследование, кодирования белков и содержит инструкции для развития и размножения всего организма и каждой его клетки в отдельности. Достижения генетики позволили раскрыть информацию, содержащуюся в ДНК, и использовать ее с пользой для людей. Теперь каждый может сделать конфиденциальный ДНК-тест, чтобы получить ответы на самые сложные вопросы. Давайте узнаем больше, как работает и какова биологическая роль ДНК.
Какие функции выполняет ДНК в организме
ДНК несет ответственность за рост и поддержание жизни, что выражается в выполнении этой молекулой трех функций.
Таким образом, на что влияет ДНК в организме? Размеры ее влияния огромны – эта молекула содержит инструкции, необходимые организму для развития, жизни и размножения. Эти инструкции находятся внутри каждой клетки и передаются от обоих родителей их детям.
ДНК помогает синтезу РНК
Матричная РНК, или мРНК, – это одноцепочечная промежуточная молекула, которая переносит генетическую информацию от ДНК в ядре к цитоплазме, где она служит шаблоном в образовании полипептидов. мРНК синтезируется в ядре с использованием нуклеотидной последовательности ДНК в качестве матрицы.
Процесс создания мРНК из ДНК называется транскрипцией и происходит в ядре. мРНК направляет синтез белков, который происходит в цитоплазме. мРНК, образованная в ядре, транспортируется из ядра в цитоплазму, где она присоединяется к рибосомам. Белки собираются на рибосомах с использованием нуклеотидной последовательности мРНК в качестве инструкции. Таким образом, мРНК несет «сообщение» от ядра к цитоплазме. Сообщение закодировано в нуклеотидной последовательности мРНК, которая комплементарна нуклеотидной последовательности ДНК, служившей матрицей для синтеза мРНК. Создание белков из мРНК называется трансляцией. В этом заключается биологическая роль РНК.
Молекулярные болезни и связь молекул ДНК
Молекулярное, или генетическое, заболевание – это любое заболевание, вызванное сбоем на молекулярном уровне, то есть в молекуле ДНК. Генетическая аномалия может варьироваться от незначительной до крупной – от одной мутации в единственном основании в ДНК до грубой хромосомной аномалии, включающей изменение количества или набора хромосом. Мутации могут происходить либо случайно, либо из-за воздействия окружающей среды.
Существует ряд различных типов генетических нарушений обмена, в том числе:
Однако далеко не все мутации в генах – это приговор. Гены могут включаться и выключаться при определенных условиях среды. Поэтому даже имея предрасположенность к тому или иному заболеванию, для предупреждения их развития человек может соблюдать назначенный врачом план питания и тренировок, отказываясь от вредных привычек.
Строение и действие гена РНК
ДНК – дезоксирибонуклеиновая кислота, а РНК – рибонуклеиновая кислота. Хотя и ДНК, и РНК несут генетическую информацию и имеют связь между собой, между ними довольно много различий. Что общего между ДНК и РНК и в чем отличия?
Функции ДНК и РНК в организме разные. ДНК отвечает за хранение и передачу генетической информации, в то время как РНК непосредственно кодирует аминокислоты и выступает в качестве посредника между ДНК и рибосомами для производства белков.
Преимущества проведения анализов в лаборатории Медикал Геномикс Украина
Лаборатория Медикал Геномикс Украина – крупнейшая в стране английская лаборатория генетических исследований. Здесь вы можете пройти любой генетический тест, в том числе для установления родственных отношений, а также медицинские, генеалогические исследования.
Мы работаем быстро и качественно, гарантируя конфиденциальность и высокую точность результата, поскольку используем передовое оборудование, а каждый тест проверяется двумя независимыми группами ученых.
Позвоните нам, если у вас есть вопросы – наши консультанты ответят на них и помогут оформить заказ. Сдать биоматериалы можно в одном из наших 78 пунктов приема образцов по всей Украине или заказав набор для домашнего забора материала.
Кодирующие некодирующие РНК
Несмотря на многолетние усилия, мир некодирующих РНК еще таит в себе немало загадок
Автор
Редактор
Среди всех областей и без того бурно развивающейся молекулярной биологии одной из наиболее процветающих является биология некодирующих РНК — РНК, которые никогда не «переводятся» в белки. Каждый год становятся известны всё новые и новые виды некодирующих РНК, участвующих в самых замысловатых молекулярных процессах. Кроме того, накапливается всё больше свидетельств того, что некоторые некодирующие РНК все-таки транслируются, правда, не в большие белки, а в короткие пептиды. Как же так получается? Каковы функции кодируемых этими РНК пептидов? Пока на эти вопросы нет исчерпывающего ответа. Тем не менее, что-то все-таки начинает проясняться, и об этом мы сегодня и поговорим.
«Биомолекула» не раз писала о разных аспектах биологии некодирующих РНК: об РНК-интерференции — важнейшем механизме регуляции экспрессии генов, ключевую роль в котором играют некодирующие РНК [2]; об РНК-регуляторах [3]; о двухцепочечных РНК [4] и о применении антисмысловых РНК в медицине [5].
Хотя ученые постоянно открывают всё новые и новые типы некодирующих РНК, наши старые знакомые, давно известные нкРНК, совсем недавно начали открываться с новой стороны. Оказывается, некоторые из них не такие уж и некодирующие, а могут подвергаться трансляции с образованием вполне функциональных пептидов. Пока возможность трансляции удалось доказать только для длинных некодирующих РНК, предшественников микроРНК и кольцевых РНК. Наш обзор посвящен именно этой таинственной и малоизученной стороне биологии (не)кодирующих РНК.
Длинные некодирующие РНК
К числу длинных некодирующих РНК относят нкРНК, длина которых превышает 200 нуклеотидов. В клетках днкРНК вовсе не являются диковинкой: по оценкам, в человеческом геноме имеется около 16 тысяч генов, которые в общей сложности кодируют 28 тысяч длинных некодирующих РНК. Таких РНК больше, чем генов, которые их кодируют, потому что транскрипт, считанный с одного гена, разрезается на несколько самостоятельных молекул, каждая из которых функционирует как днкРНК. Группа длинных некодирующих РНК очень разнородна: некоторые ее представители являются антисмысловыми РНК (то есть транскриптами, считанными с белок-кодирующих генов, но в обратном направлении); другие соответствуют вырезанным из мРНК интронам; наконец, третьи считываются с длинных межгенных промежутков.
Функции, которые могут выполнять длинные некодирующие РНК, также в высшей степени разнообразны. Они могут регулировать транскрипцию белок-кодирующих генов, связываться с различными белками, влияя на их функционирование, а также контролировать процессы созревания других РНК, их экспорт из ядра и синтез белка. Кажется логичным, что в некоторых длинных некодирующих РНК могут найтись хотя бы совсем короткие открытые рамки считывания: длинная последовательность будет содержать рамку считывания с бóльшей вероятностью, чем короткая. Кроме того, длинные некодирующие РНК локализуются преимущественно в цитоплазме, где и происходит трансляция, и созревают так же, как мРНК: они транскрибируются РНК-полимеразой II, подвергаются сплайсингу, имеют кэп и поли(А)-хвост. Действительно, недавно подсчитали, что более 40% днкРНК потенциально могут транслироваться в пептиды, состоящие более чем из десяти аминокислотных остатков. Каким же образом удалось это установить? Как правило, применяли метод, известный как рибосомное профилирование (хотя, заметим, часто используют не совсем правильный перевод термина — «рибосомальный профилинг» — прим. ред.) [1].
Рибосомное профилирование
О том, что такое полимеразная цепная реакция и секвенирование, можно прочитать в статьях нашего спецпроекта «12 методов в картинках»: «Полимеразная цепная реакция» [6] и «Секвенирование нуклеиновых кислот» [7].
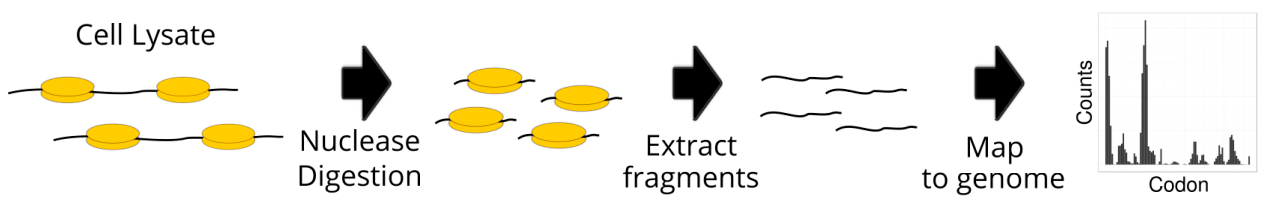
Рисунок 1. Основные этапы рибосомного профилирования
Функциональные пептиды пока известны только для четырех длинных некодирующих РНК. У дрозофилы есть днкРНК pncr003:2L, которая содержит две открытые рамки считывания, соответствующие пептидам длиной менее 30 аминокислотных остатков. Оба этих пептида обнаруживаются в диадах — местах соединения Т-трубочек и цистерн саркоплазматического ретикулума в мышечных клетках. При нокауте или нокдауне соответствующего гена у мух наблюдается повышенная аритмия сердечных сокращений. Вероятнее всего, оба пептида участвуют в обмене кальция в мышечных клетках и взаимодействуют с кальциевой АТФазой саркоплазматического ретикулума, которая откачивает ионы кальция из цитозоля в саркоплазматический ретикулум в ходе расслабления мышцы [1].
О нокауте и нокдауне читайте в статье нашего спецпроекта «12 методов в картинках» «Генная инженерия. Часть II: инструменты и техники» [8].
У мышей есть пептид миорегулин (MLN), состоящий из 46 аминокислотных остатков и считывающийся с длинной некодирующей РНК. Он синтезируется в скелетных мышцах, но не в сердечной и гладких мышцах. Миорегулин связывается с изоформой кальциевой АТФазы саркоплазматического ретикулума, специфичной для скелетных мышц, и подавляет её работу, препятствуя откачке кальция из цитоплазмы в саркоплазматический ретикулум. Мыши, нокаутные по миорегулину, оказываются выносливее мышей дикого типа и имеют бóльшее содержание кальция в саркоплазматическом ретикулуме [1].
Мышиная длинная некодирующая РНК, известная как DWORF, тоже специфична для мышечной ткани и содержит открытую рамку считывания из 34 кодонов. Соответствующий пептид также взаимодействует с кальциевой АТФазой саркоплазматического ретикулума, препятствуя ее связыванию с миорегулином и другими пептидами, подавляющими ее активность, и таким образом способствует ее активной работе [1].
Человеческая длинная некодирующая РНК LINC00961 кодирует пептид из 90 аминокислотных остатков, получивший название SPAR. У мышей тоже есть этот пептид, однако он состоит из 75 аминокислот. SPAR локализуется в поздних эндосомах и лизосомах и взаимодействует с лизосомной АТФазой. У мышей, нокаутных по SPAR’у, наблюдается повышенная способность к регенерации мышц за счет усиленной работы сигнального пути mTORC1, который у мышей дикого типа подавляется SPAR’ом [1].
Предшественники микроРНК
МикроРНК представляют собой короткие одноцепочечные РНК длиной от 18 до 22 нуклеотидов. Процессинг микроРНК включает два основных этапа. На первом этапе длинный транскрипт, считанный с гена микроРНК и обозначаемый «при-микроРНК», разрезается на более короткие предшественники — пре-микроРНК. Далее пре-микроРНК выходят из ядра в цитоплазму и разрезаются на собственно микроРНК. Понятно, что микроРНК слишком коротки, чтобы что-то кодировать. А вот предшественники, например, при-микроРНК, вполне могут содержать открытые рамки считывания. Кроме того, при-микроРНК имеют кэп на 5′-конце и поли(А)-хвост на 3′-конце, как мРНК.
Пока что только у растений удалось выявить белковые продукты при-микроРНК. Первичный транскрипт miR171b люцерны усеченной содержит две рамки считывания, соответствующие пептидам длиной 20 и 5 аминокислотных остатков. Наиболее длинный пептид (miPEP171b) удалось выявить в зачатках боковых корней растения. Выяснилось, что miPEP171b способствует накоплению микроРНК, соответствующей тому же гену. Хотя бы одна открытая рамка считывания имеется у примерно 50 при-микроРНК резуховидки Таля — популярного модельного объекта. Удалось показать, что один из кодируемых ими пептидов, miPEP165a, консервативен среди всех капустноцветных и тоже повышает накопление микроРНК, считываемой с того же гена. Обработка проростков искусственным miPEP165a приводила к увеличению длины корней. Аналогичный эффект на соответствующие микроРНК показан для ряда других пептидов, считываемых с при-микроРНК, однако конкретный механизм, лежащий в основе этого эффекта, остается загадкой [1].
Кольцевые РНК
Благодаря отсутствию концов трансляция кольцевых РНК, число нуклеотидов в которых кратно трем, может приводить к образованию длинных полипептидов (теоретически бесконечной длины), состоящих из повторяющихся блоков одних и тех же аминокислот. В этом случае ограничение длины пептида будет связано лишь с процессивностью (то есть способностью функционировать, не отсоединяясь от матрицы) рибосомы. Если же число нуклеотидов в кольцевой РНК не кратно трем, то каждый оборот трансляции будет сопровождаться сдвигом рамки считывания, и продуктом будет цепочка из повторов трех различных полипептидов. Нечто похожее происходит у некоторых вироидов — субвирусных агентов, геном которых представлен кольцевой молекулой РНК. У них три разных полипептида образуются с одной и той же кольцевой РНК за счет сдвигов рамки считывания. Однако свидетельств в пользу существования такой «бесконечной» трансляции в клетках пока нет [10].
Пока совсем немного экспериментальных свидетельств и в целом трансляции клеточных кольцевых РНК. У дрозофилы удалось «поймать» рибосому с помощью профилирования на 37 кольцевых РНК, однако для большинства РНК соответствующие им пептиды не идентифицированы. Удалось, однако, выделить пептид, считываемый с кольцевой РНК circMbl. Другая кольцевая РНК, circ-ZNF609, содержит открытую рамку считывания длиной 753 нуклеотида, и многие молекулы этой РНК выделены в составе полисомных комплексов (то есть связанными с несколькими рибосомами). Кроме того, в ней содержится последовательность, соответствующая IRES. С помощью искусственных конструктов удалось показать возможность трансляции открытой рамки считывания из circ-ZNF609, однако сам пептид не выделили. У человека обнаружили 250 кольцевых РНК, связанных с полисомами, и идентифицировали 33 пептида, закодированных кольцевыми РНК [1].
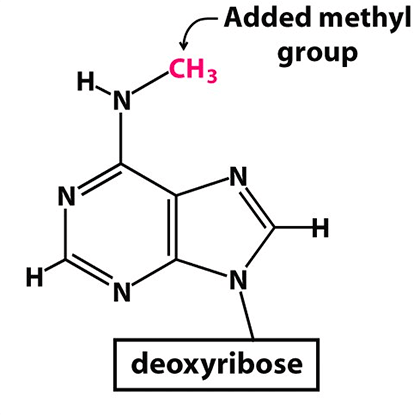
Рисунок 2. Метилированный аденозин (m 6 A)
Многие мРНК (как клеточные, так и вирусные) подвергаются особой модификации — метилированию аденозина (сокращенное обозначение m 6 A). Метилирование аденозина заключается в присоединении метильной группы к атому азота у шестого атома углерода аденина (рис. 2).
Зеленый флуоресцентный белок стал верным помощником ученых в изучении самых разнообразных клеточных процессов. Об открытии и применении GFP можно прочитать в нашей статье «Флуоресцирующая Нобелевская премия по химии» [11]
На что может влиять трансляция некодирующих РНК
Различным аспектам аутоиммунитета посвящен спецпроект «Биомолекулы» «Аутоиммунные заболевания».
Подводя итог, можно сказать, что мы только-только начали приоткрывать завесу тайны над трансляцией некодирующих РНК и знаем совсем немного, поэтому будем с нетерпением ждать новых открытий в этой интереснейшей области молекулярной биологии.