Гепаторенальный синдром при циррозе что это
Гепаторенальный синдром:состояние проблемы и перспективы лечения
Гепаторенальный синдром (ГРС) является одной из значимых проблем современной гепатологии. В основе ГРС лежит нарушение гемодинамики, которое приводит к активизации симпатической нервной системы и продукции вазоактивных медиаторов, что приводит к развитию ГРС. Прогноз течения ГРС крайне неблагоприятный. На сегодняшний день оптимальный выбор у больных с ГРС – трансплантация печени. Терапевтические методы лечения, применяемые в течение последних лет, а также трансъюгулярное внутрипеченочное портосистемное шунтирование используются с целью улучшения функции почек. Применение альбуминового диализа при ГРС является новым методом, позволяющим корригировать почечную функцию и подготовить больного к операции.
В настоящее время число больных с заболеваниями печени остается стабильно высоким. Основной причиной смерти пациентов с этой патологией является печеночная недостаточность (ПечН) [1,2]. Патогенез ПечН при различных заболеваниях печени схож. В его основе лежит массивное повреждение гепатоцитов, в результате чего происходит угнетение функции печени, сопровождающееся возникновением энцефалопатии. В дальнейшем возможно развитие сердечно-сосудистой, дыхательной и почечной недостаточности [3]. На более поздних стадиях присоединяются инфекционные осложнения [4]. Пристального внимания у больных ПечН заслуживает возникновение почечной дисфункции, что значительно ухудшает прогноз заболевания [3,5,6]. Для обозначения этого состояния в литературе используется термин гепаторенальный синдром (ГРС).
Гепаторенальный синдром – тяжелое осложнение, возникающее у пациентов с ПечН и характеризующееся клиническими проявлениями почечной недостаточности (ПН). Чаще ГРС развивается при хронической ПечН (ХПечН), хотя возможно его возникновение и при фульминантной ПечН [4].
Важно подчеркнуть, что диагноз ГРС правомочен только у больных с тяжелыми заболеваниями печени при отсутствии других причин для почечной патологии. В настоящее время ГРС рассматривают как функциональное расстройство, поскольку для него нет специфического морфологического субстрата. При трансплантации почек больным хронической ПН от доноров с ГРС функция пересаженных почек восстанавливалась [7]. Эта потенциальная обратимость в сочетании с пониманием патофизиологии ГРС лежит в основе медикаментозных методов терапии, направленных на устранение висцеральной вазодилятации и восстановление эффективного циркулирующего объема, а также использования экстракорпоральных методов лечения [6].
Впервые ГРС был описан в 1863 году, когда Flint A. отметил, что развитие цирроза печени (ЦП) часто сочетается с явлениями ПН. Однако, термин «гепаторенальный синдром» был предложен хирургами для описания ПН, возникшей после операций на желчных путях или по поводу травмы печени. Окончательное формирование концепции ГРС произошло в 60-70-е годы ХХ века, когда была доказана ведущая роль нарушений гемодинамики и резистентности сосудов почек [5,6].
По данным литературы ГРС развивается примерно у 18% пациентов с ЦП в течение первого года и достигает 39% к пятому году течения заболевания [5]. Сообщается, что у 17% пациентов, госпитализированных по поводу асцита, был диагностирован ГРС, причем внутрибольничная смертность в этой группе превышала 50%. Развитие ГРС описано и у больных с компенсированной формой ПечН при наличии предрасполагающих факторов, таких как: бактериальная инфекция или сепсис, высокообъемный парацентез, желудочно-кишечное кровотечение, назначение нефротоксичных препаратов или интенсивное использование диуретиков [6].
Частой причиной формирования ПН у больных с заболеваниями печени является спонтанный бактериальный перитонит [5]. Приводятся данные, что у 15% пациентов возникновение ГРС связано с проведением высокообъемного парацентеза, когда за одну процедуру удаляется более 5 л асцитической жидкости без предварительного введения раствора альбумина. Другим хорошо известным предрасполагающим фактором формирования ГРС у пациентов с ЦП является желудочно-кишечное кровотечение. Частота развития ГРС у больных c ПечН на фоне или после эпизода желудочно-кишечного кровотечения приближается к 10%. Также установлено, что уменьшение объема циркулирующей крови вследствие интенсивного применения диуретических препаратов является одним из пусковых механизмов развития ГРС [4]. Сообщается о развитии ПН у больных ЦП после назначения аминогликозидов [8]. Другой важной причиной ГРС является использование нестероидных противовоспалительных препаратов, которые ингибируют образование простагландинов и ухудшают экскрецию ионов натрия [9,10].
В основе ГРС лежат гемодинамические нарушения, которые проявляются гипердинамическим синдромом на фоне вазодилятации [10,11,12]. Одновременно наблюдается уменьшение индекса общего сосудистого сопротивления и компенсаторное повышение сердечного выброса [12].
Объяснение гемодинамических расстройств при ПечН базируется на теории периферической вазодилятации. По современным представлениям ведущая роль в формировании системной вазодилятации у больных с ПечН отводится NO. Установлено, что под влиянием бактериальных эндотоксинов, уровень которых в крови повышается при декомпенсации ПечН, происходит усиленный синтез NO. В дальнейшем NO по портокавальным шунтам поступает в системный кровоток и оказывает мощное сосудорасширяющее действие. [9,13]. Именно NO вызывает стойкую периферическую вазодилятацию, приводящую к системной артериальной гипотензии и стойкой почечной гипоперфузии, вследствие которой наблюдается внутрипочечная активация систем вазоконстрикции (ренин-ангиотензин-альдостероновой, а также эндотелина-1), проявляющейся стойким спазмом сосудистого русла почек, который ведет к резкому снижению скорости клубочковой фильтрации (СКФ) [13,14,15].
Таким образом, в основе патогенеза ГРС лежит несоответствие между системным сосудистым тонусом и состоянием внутрипочечной гемодинамики, приводящее к нарастающему ухудшению фильтрационной функции почек. Это несоответствие усугубляется по мере увеличения выраженности дисбаланса между гуморальными системами, регулирующими процессы вазоконстрикции и вазодилатации, нарушений сократимости миокарда левого желудочка, а также расстройств водно-электролитного гомеостаза [15,16].
Клиническими симптомами ГРС являются нарастание азотемии, отечного синдрома, асцита, повышение осмолярности мочи и гипонатриемия [1,4].
Осмысление накопленных клинических данных привело к выработке в 2005 году на конференции в Сан-Франциско новых диагностических критериев ГРС, которые были предложены специальной группой, входящей в состав Международного клуба асцита [17]:
1. ЦП с асцитом.
2. Концентрация креатинина в сыворотке более 133 ммоль/л (1,5 мг/дл).
3. Отсутствие положительной динамики в уровне креатинина (
Эта статья.
. про отделения
Читайте также
Ограничения в связи с профилактикой распространения коронавирусной инфекции COVID-19
Госпитализация (круглосуточно)
8 (499) 394-67-57
Скорая помощь (круглосуточно)
8 (495) 620-84-04
8 (499) 390-80-84
Гепаторенальный синдром при циррозе что это
Одним из жизнеугрожающих осложнений портальной гипертензии (ПГ) является гепаторенальный синдром (ГРС), проявляющийся функциональной почечной недостаточностью, которая нередко развивается у пациентов с прогрессирующим циррозом печени (ЦП), осложненным асцитом и нарушениями в системе кровообращения. Диагноз ГРС устанавливается при отсутствии иных причин органических или функциональных поражений почек [1; 2].
Первые упоминания о ГРС появились более 100 лет назад. В 1863 г. A. Flint отметил у тяжело больных ЦП пациентов с асцитом расстройства функции почек. В последующем было установлено совместное поражение печени и почек. В 1893 г. M. Pavlow в экспериментах на животных установил наличие альбуминурии после формирования портокавального анастомоза. В 1911 г. P. Clairmont и соавт., F. Steinthal опубликовали наблюдение поражения почек с летальным исходом, последовавшее после операции на желчных протоках по поводу механической желтухи [3; 4].
Термин «гепаторенальный синдром» был предложен в 1916 г. P. Merklen. В 1932 г. эта патология была названа F.C. Helwig и соавт. «синдром печень-почки». И только в 1956 г. Hecker и Sherlock более подробно описали его у 9 пациентов с ЦП и острым гепатитом, отметив развитие острой почечной недостаточности без протеинурии и с низкой концентрацией натрия в моче [5]. Авторы установили, что ГРС наблюдается у 7–15% пациентов с ЦП, которые были госпитализированы по поводу асцита. Количество таких больных существенно возрастает в терминальной стадии заболевания печени. Прогноз выживания пессимистичен, так как восстановление нормальной функции почек при развитии ГРС проблематично. Так, в течение первых двух месяцев умирают около 90% пациентов с прогрессирующим ГРС.
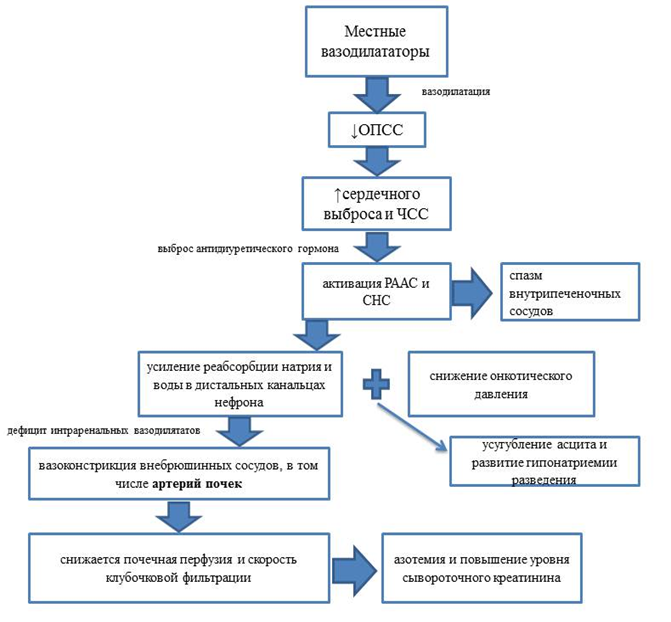
В настоящее время основной теорией патогенеза ГРС считается классическая гипотеза «периферической вазодилатации». Патогенетический механизм, характерный для функциональных изменений при ГРС, представлен в виде схемы.
Схема классической гипотезы «периферической вазодилатации»
Примечание: ОПСС – общее периферическое сопротивление сосудов; РААС – ренин-ангиотензин-альдостероновая система; СНС – симпатическая нервная система; ЧСС – частота сердечных сокращений.
В настоящее время доказано, что ГРС возникает при дисбалансе прессорно-депрессорной системы, который усиливается по мере нарастания нарушений функций печени, прогрессирования ПГ или поступлением некоторых лекарственных средств (например, нестероидных противовоспалительных препаратов), еще сильнее подавляющих образование вазодилататоров. В результате снижается почечная перфузия и скорость клубочковой фильтрации и, как следствие, развивается азотемия и повышение уровня сывороточного креатинина, которые считают основными признаками при ГРС.
В последнее десятилетие выявлено, что снижение системной гемодинамики негативно влияет на внутрипеченочный кровоток, в результате чего усугубляется печеночная недостаточность, проявляющаяся возрастанием уровня трансаминаз.
В свою очередь, под влиянием вазоконстрикторов (ангиотензина II, норадреналина и вазопрессина) и вследствие снижения синтеза оксида азота цирротической печенью происходит спазм внутрипеченочных сосудов. Проведенные исследования показывают, что изменения внутрипеченочного кровотока коррелируют с уровнем ренина в плазме крови.
Представленная «классическая гипотеза периферической вазодилатации» не описывает другие возможные механизмы патогенеза почечной недостаточности при ГРС 8. Так, очень большое значение в формировании гипоперфузии почек имеет нарушение баланса в почечной продукции эндогенных вазоконстрикторов и вазодилататоров [9].
Результаты исследований L. Ruiz-del-Arbol и соавт. подтвердили предположение о том, что у пациентов с ГРС достоверно снижен сердечный выброс по сравнению с больными без ГРС. Полагают, что циркуляторная дисфункция при ГРС обусловлена не только вазодилатацией, но и сердечной недостаточностью. Эти изменения объясняются развитием при ЦП специфической кардиомиопатии, характеризующейся дилатацией сердца, гипертрофией и электрической нестабильностью миокардиоцитов, а также его систолической и диастолической дисфункцией.
Большое значение в патогенезе ГРС имеет надпочечниковая недостаточность. Это положение подтверждается выраженным снижением функции надпочечников у пациентов с ЦП и тяжелой бактериальной инфекцией, наиболее часто приводящей к формированию ГРС. Исследования показывают, что у 80% пациентов с ГРС выявляется надпочечниковая недостаточность. При добавлении к терапии кортизола гемодинамика быстро восстанавливалась. Надпочечниковая недостаточность при ГРС вызвана региональной вазоконстрикцией. Возможно, в развитии надпочечниковой недостаточности принимают участие цитокины, прямо угнетающие синтез кортизола корой надпочечников. Это доказывает исследование, которое выявило более высокий уровень цитокинов, повышенную активность ренина и симпатической нервной системы, а также снижение сердечного выброса и скорости клубочковой фильтрации у пациентов с ГРС 1 типа в отличие от пациентов, не имеющих ренальной патологии.
Таким образом, при ГРС развивается полиорганная патология, характеризующаяся острым нарушением функций сердечно-сосудистой системы, почек, печени, надпочечников и т.д. Поэтому лишь дальнейшее изучение патогенетических механизмов развития и прогрессирования ГРС позволит усовершенствовать имеющиеся и создать принципиально новые способы диагностики, лечения и профилактики гепаторенального синдрома [10; 11].
Международным клубом асцита были предложены следующие критерии диагностики ГРС.
· хроническое или острое заболевание печени с печеночной недостаточностью и ПГ;
· снижение скорости клубочковой фильтрации, подтверждаемое увеличением в сыворотке крови креатинина более 1,5 мг/дл или 24-часовой клиренс креатинина менее 40 мл/мин;
· отсутствие шока, продолжающейся бактериальной инфекции и текущей или недавней терапии нефротоксическими препаратами; отсутствие желудочно-кишечных потерь жидкости (повторная рвота или интенсивная диарея) или почечной потери жидкости (потеря веса более 500 г/день в течение нескольких дней у пациентов с асцитом без периферических отеков или 1000 г/сут у пациентов с периферическими отеками);
· нет стойкого улучшения почечной функции (снижение сывороточного креатинина до 1,5 мг/дл и менее, или увеличение клиренса креатинина до 40 мл/мин или более) после приема диуретиков и восполнения объема циркулирующей крови при введении 1,5 л изотонического раствора;
Гепаторенальный синдром при циррозе что это

Российский университет дружбы народов
Термин «гепаторенальный синдром» был введен в 1932 г. K.Helwig и C.Schutz для обозначения почечной недостаточности, развивающейся после операций на желчных путях [1]. В настоящее время под гепаторенальным синдромом (ГРС) понимают функциональную почечную недостаточность, развившуюся на фоне декомпенсированного заболевания печени. В 1996 г. Международным обществом асцита были разработаны диагностические критерии ГРС [2]. Этот диагноз может быть установлен при наличии всех больших критериев, в то время как малые критерии имеют дополнительное значение.
Опубликовано в журнале «Клиническая фармакалогия и терапия», 2009, № 18 (4) 
Российский университет дружбы народов
Опубликовано в журнале «Клиническая фармакалогия и терапия», 2009, № 18 (4)
Термин «гепаторенальный синдром» был введен в 1932 г. K.Helwig и C.Schutz для обозначения почечной недостаточности, развивающейся после операций на желчных путях [1]. В настоящее время под гепаторенальным синдромом (ГРС) понимают функциональную почечную недостаточность, развившуюся на фоне декомпенсированного заболевания печени. В 1996 г. Международным обществом асцита были разработаны диагностические критерии ГРС [2]. Этот диагноз может быть установлен при наличии всех больших критериев, в то время как малые критерии имеют дополнительное значение. Большие критерии:
1. Хроническое или острое заболевание печени с печеночной недостаточностью и портальной гипертензией.
2. Низкая скорость клубочковой фильтрации (СКФ): сывороточный креатинин более 133 мкмоль/л или клубочковая фильтрация по эндогенному креатинину менее 40 мл/мин в течение суток при отсутствии диуретической терапии.
3. Отсутствие шока, бактериальной инфекции, потери жидкости (включая желудочно-кишечное кровотечение) или нефротоксической терапии.
4. Нет стойкого улучшения почечной функции (снижение сывороточного креатинина до 0,125 ммоль/л и менее или возрастания клубочковой фильтрации до 40 мл/мин или более) вслед за прекращением диуретической терапии и внутривенным введением 1,5 л жидкости.
5. Протеинурия менее 500 мг/сут и отсутствие признаков обструкции мочевыводящих путей или заболеваний почек по данным ультразвукового исследования. Дополнительные критерии:
1. Суточный диурез менее 500 мл.
2. Содержание натрия в моче менее 10 ммоль/л.
3. Осмоляльность мочи выше, чем плазмы.
Большая проблема заключалась в отсутствии корреляции между уровнем креатинина и СКФ, что могло быть связано как с неадекватным сбором мочи для исследования у пациентов с олигурией, так и с взаимодействием креатинина сыворотки с билирубином при рутинном определении фотометрическим методом (метод Яффе). У пациентов с высоким уровнем билирубина этот метод дает заниженный уровень креатинина. Внедрение новых точных кинетических методов определения креатинина сыворотки (РАР-метод) позволило отказаться от СКФ, как диагностического критерия ГРС. Олигурия и гипонатриемия, имеющие место у большинства пациентов с декомпенсированным циррозом печени, снижение содержания натрия в моче и повышение ее осмоляльности, продемонстрированные при остром канальцевом некрозе у пациентов с циррозом печени и асцитом, обусловили исключение и малых диагностических критериев ГРС. Также, ввиду высокой частоты у пациентов с циррозом печени, пересмотрено положение о том, что бактериальная инфекция и желудочно-кишечное кровотечение являются критериями исключения ГРС, кроме септического и геморрагического шока. В итоге, в 2005 г. в Сан-Франциско были утверждены новые диагностические критерии ГРС, предложенные специальной группой, входящей в состав Международного клуба асцита (табл. 1) [4].
ТАБЛИЦА 1. Критерии диагностики ГРС (F.Salerno, 2007)
1. Цирроз печени с асцитом.
2. Уровень сывороточного креатинина более 133 мкмоль/л (1,5 мг/дл).
3. Отсутствие нормализации содержания сывороточного креатинина (до 0,2).
A.Umgelter и соавт. изучили плазмовозмещающие эффекты однократного введения 200 мл 20% альбумина после лечебного парацентеза больным с циррозом печени, напряженным асцитом и ГРС, а также двукратного введения 200 мл 20% альбумина больным с ГРС. Исследователи пришли к выводу, что альбумин значительно улучшает гемодинамические параметры и улучшает функцию почек у этих пациентов [23,24].
Доказана эффективность альбумина и при других случаях почечной недостаточности на фоне декомпен-сированного заболевания печени. Во-первых, P.Sort и другие авторы продемонстрировали положительный эффект альбумина при спонтанном бактериальном перитоните с целью увеличения ОЦК и предотвращения ГРС [25]. В настоящее время изучается эффективность альбумина в профилактике почечной недостаточности у пациентов с циррозом печени и бактериальной инфекцией, не связанной со спонтанным бактериальным перитонитом [26]. Во-вторых, показанием к назначению альбумина при циррозе печени является профилактика коллапса в результате вазодилатации и снижения эффективного объема циркулирующей плазмы после лечебного парацентеза, а, следовательно, профилактика почечной недостаточности, в 20% случаев возникающей после данного вмешательства [27].
Другим патофизиологически обоснованным препаратом выбора при терапии пациентов с ГРС могли бы считаться биогенные амины, особенно при невозможности применения терлипрессина. Норадреналин оказывает сходное с терлипрессином действие при ГРС в сочетании с альбумином [28]. Допамин обладает вазо-прессорными свойствами, усиливает почечный кровоток и фильтрацию, ингибирует синтез альдостерона, повышение уровня которого отмечается у пациентов с ГРС [10]. Исторически допамин был первым препаратом, использованным для лечения ГРС. Имеется очень мало сообщений о купировании ГРС после инфузий допамина. В немногочисленных исследованиях продемонстрирован лишь незначительный эффект этого препарата. Тем не менее, допамин все еще используется в клинической практике у пациентов с ГРС [29].
D.Barnardo и соавт. показали, что низкие дозы допа-мина увеличивают почечный кровоток, но не улучшают функцию почек у пациентов с циррозом печени [30]. Позднее W.Bennett и соавт. изучили почечный кровоток с помощью ангиографии с ксеноном у 7 пациентов с циррозом печени и ГРС и 5 пациентов с циррозом печени без ГРС. В обеих группах почечный кровоток был снижен, особенно при ГРС. У больных ГРС внутривенная инфузия допамина в почечной дозе в течение 24 часов улучшила ангиогиографические показатели кровотока в коре почек. Увеличения диуреза и СКФ не наблюдали [31].
A.Hadengue и соавт. оценивали влияние допамина на системную и региональную гемодинамику, почечный кровоток и натрийурез у 12 пациентов с алкогольным циррозом печени и асцитом. С этой целью были катетеризированы печеночные, почечные вены и вена azygos и начата внутривенная инфузия допамина в дозе 0,05 мкг/кг/мин в первый час с увеличением дозы до 0,1 мкг/кг/мин в течение следующего часа. Спустя 120 минут АД нормализовалось. Почечный кровоток, количество выделяемой мочи и натрийурез не изменились. Печеночный венозный градиент давления и кровоток в системе вены azygos увеличились на 21%. Кроме того, при введении допамина отмечалось увеличение концентрации норадреналина и ренина плазмы. Портальное давление также увеличилось, вероятно, из-за увеличения брыжеечного кровотока. Эти результаты заставили ученых усомниться в пользе применения допамина у больных с циррозом печени и асцитом [32].
Y.Bacq и соавт. наблюдали 9 пациентов с циррозом печени, получавших допамин в дозе 1,5 мкг/кг/мин. Допамин значительно увеличил почечный кровоток на 31%, но СКФ не изменилась [33]. При применении до-памина в низкой дозе у больных с резистентным асцитом и ГРС и без него также отмечено улучшение некоторых почечных показателей [34,35].
S.Lin и соавт. наблюдали 5 пациентов с циррозом печени и рефрактерным асцитом без ГРС. Допамин вводили в дозе 2 мкг/кг/мин в течение суток. Эффективный почечный кровоток и СКФ измеряли до и после введения допамина. Авторы выявили незначительное увеличение диуреза и натрийуреза, а также существенное увеличение почечного кровотока, хотя уровни креатинина, мочевины сыворотки крови, СКФ, АД, частота сердечных сокращений, уровни натрия и альдостерона сыворотки не изменились [34]. Выборки ряда упомянутых исследований были небольшими и неоднородными.
В плацебо-контролируемом рандомизированном исследовании у 328 пациентов с почечной недостаточностью, развившейся на фоне цирроза печени, R.Bellomo и соавт. при лечении допамином в низкой дозе не выявили ни снижения уровня креатинина, ни увеличения диуреза. Авторы отметили, что вопрос о целесообразности назначения допамина остается спорным [36]. Тем не менее, в литературе описаны случаи купирования ГРС при использовании допамина в сочетании с вазоконст-рикторами, хотя это может быть связано с эффектами последних [37,38].
Некоторые авторы сообщают, что в 5% случаев после введения «почечных» доз допамина (2-4 мкг/кг/мин) у пациентов с ГРС, особенно при выраженной артериальной гипотонии, увеличивается диурез за счет натрий-уретического эффекта. Вводить допамин рекомендуется в течение 12-24 часов под контролем диуреза. Если количество мочи не увеличивается, следует прекратить лечение 41. В ряде сообщений отмечено, что допа-мин в дозе 1-5 мкг/кг/мин усиливает почечный кровоток, улучшает клубочковую фильтрацию и увеличивает диурез. Однако после отмены препарата олигурия, как правило, возобновляется. Влияние допамина на выживаемость больных с ГРС не доказано [43,44].
Мы оценили двухнедельную выживаемость при различных методах ведения больных с ГРС, применявшихся на разных этапах. На рис. 3 видно, что выживаемость пациентов, получавших допамин и симптоматическую терапию, различается лишь в течение короткого срока. Первоначальное улучшение выживаемости больных при введении допамина утрачивается к концу первой недели лечения. При изучении 5-дневной выживаемости пациентов, получавших допамин и симптоматическую терапию (рис. 4), выявлено достоверное ее различие между группами (p=0,028). Таким образом, допамин может улучшить выживаемость пациентов с ГРС только в течение очень короткого срока. Его применение может быть целесообразным у пациентов, ожидающих трансплантацию печени, с целью продления сроков подбора доноров.
Несмотря на неоднозначные мнения по поводу применения допамина [31,32,36,38,46], при гипотонии и олигоанурии он является препаратом выбора у пациентов с ГРС, особенно в условиях отмены диуретиков. Повышение краткосрочной выживаемости может иметь значение, когда речь идет о трансплантации печени.