Что влияет на величину электропроводности электролитов
Что влияет на величину электропроводности электролитов
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.4 ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
3.4.1 Удельная электропроводность растворов электролитов
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см 2 :
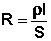
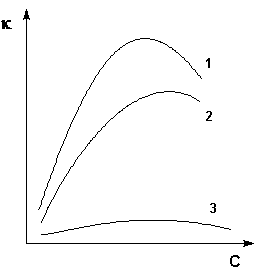
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов. Зависимость удельной электропроводности от концентрации раствора представлена на рис. 3.9.
Рис. 3.9 Зависимость удельной электропроводности электролитов от концентрации
(1 – H2SO4, 2 – KOH, 3 – CH3COOH)
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и κ сначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация. Для учета влияния на электрическую проводимость растворов электролитов их концентрации и взаимодействия между ионами введено понятие молярной электропроводности раствора.
3.4.2 Молярная электропроводность растворов электролитов
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
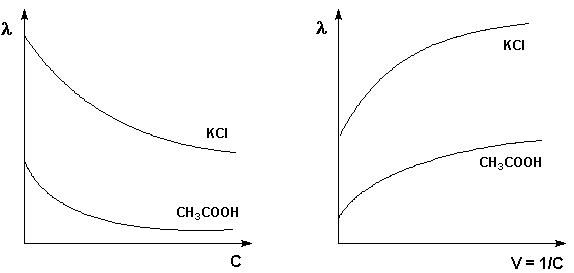
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λ o, называемого молярной электропроводностью при бесконечном разведении (рис. 3.10 – 3.11).
Рис. 3.10 Зависимость молярной Рис. 3.11 Зависимость молярной
электропроводности от концентрации. электропроводности от разведения
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса (III.35):
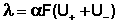
Ф. Кольрауш показал, что в молярную электропроводность бесконечно разбавленных растворов электролитов каждый из ионов вносит свой независимый вклад, и λ o является суммой молярных электропроводностей катиона и аниона λ + и λ – (т.н. подвижностей ионов), и сформулировал закон независимости движения ионов :
Молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита.
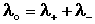
Подставив в это выражение уравнение Аррениуса (III.35) и приняв, что при бесконечном разведении степень диссоциации α равна единице, получим:
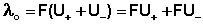
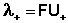
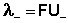
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.
Электропроводность электролитов. Факторы, влияющие на электропроводность растворов



Носителями электрического тока в растворах электролитов служат ионы, образующиеся вследствие электролитической диссоциации. Катионы и анионы под действием внешнего электрического поля движутся в противоположных направлениях.
Доля общего количества электричества, переносимого отдельными ионами, называется числами переноса, сумма которых для всех видов ионов, участвующих в переносе, равна единице.
Количественно электропроводность электролитов характеризуют эквивалентной электропроводностью λ
2.2.Эквивалентная электропроводностьλ—проводящая способность всех ионов, образующихся в 1 грамм-эквиваленте(см. приложение) электролита.
Эквивалентная электропроводность определяется проводимостью всех ионов, образующихся из количества электролита, соответствующего его химическому эквиваленту, в растворе данной концентрации. Наиболее эквивалентная электропроводность соответствует предельно разбавленному раствору.
Величина λ связана с удельной электропроводностью σ соотношением:
 | где σ — удельная проводимость,  — вектор плотности тока, — вектор плотности тока,  — вектор напряжённости электрического поля. — вектор напряжённости электрического поля. |
Плотность то́ка — векторная величина, имеющая смысл силы тока, протекающего через единицу площади. Например, при равномерном распределении плотности 

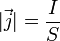
2.4.Факторы, влияющие на электропроводность растворов.
Существует три фактора, влияющие на удельную электропроводность растворов:
3.природа электролита (т.е. его степень электролитической диссоциации)
1.С увеличение температуры увеличивается скорость движения ионов (а, следовательно, и удельная электропроводность раствора электролита) за счет уменьшения вязкости раствора и уменьшения взаимодействия ионов[9]
2.Влияние концентрации раствора электролита на его электропроводность обуславливается тем, что имеющаяся около каждого иона ионная атмосфера несет заряд, противоположный иону, движется в противоположном направлении и тормозит движение иона.
Я бы хотела, чтобы в этом параграфе был описан способ измерения удельной электропроводности при помощи датчика электропроводности
Измерением электропроводности занимается наука кондуктометрия. Основными характеризующими величинами данной области электрохимии является эквивалентная и удельная электропроводность (см. стр. 6). метод кондуктометрии основывается на том, что в области разбавленных и умеренно концентрированных растворов электрическая проводимость растет с увеличением концентрации электролита.
В практической работе обычно используют заранее построенную градуировочную кривую зависимости электрической проводимости раствора от концентрации тех или иных электролитов. В связи с относительно близкими значениями подвижностей ионов кондуктометрические измерения дают информацию главным образом лишь об общей концентрации ионов в растворе.
Измерения электрической проводимости растворов широко применяют в титриметрическом анализе для определения точки эквивалентности (кондуктометрическое титрование). В методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах c – Vтитранта (удельная электропроводность – объем раствора титранта). Практически в этом методе могут быть использованы такие химические реакции, в ходе которых происходит резкое изменение (обычно возрастание) электрической проводимости после точки эквивалентности (реакции кислотно-основного взаимодействия, осаждения и т. д.).
Токи, имеющие частоту порядка мегагерц и десятков мегагерц, называют токами высокой частоты. При таких частотах в растворе начинают играть роль эффекты молекулярной, или деформационной, и ориентационной поляризации. Поляризация обоих типов вызывает кратковременный электрический ток (ток смещения). Кроме того, поляризация молекул приводит к существенному изменению диэлектрической и магнитной проницаемостей раствора, что открывает новую возможность исследования свойств системы при титровании.
При построении кривой высокочастотного титрования показания прибора откладывают по оси ординат как функцию объема добавленного титранта.
Саша, не нужно делать словарь терминов. Словарь терминов дается в словарях и учебных пособиях. У тебя другой жанр работы! Все определения нужно дать в основном тексте работы.
Грамм-эквивалент- число граммов химического элемента или соединения, равное массе его эквивалента химического. Г.-э. химического элемента численно равен частному от деления атомной массы элемента на его валентность
Кондуктометрическое титрование – метод анализа, основанный на определении содержания вещества по излому кривой титрования. Кривую строят по измерениям удельной электропроводности анализируемого раствора, меняющейся в результате химических реакций в процессе титрования
Константа диссоциации показывает склонность объекта диссоциировать обратимым образом на более маленькие объекты
Напряжённость электри́ческого по́ля — векторная физическая величина, характеризующая электрическое поле в данной точке и численно равная отношению силы 
Прямая кондуктометрия – метод, позволяющий непосредственно определять концентрацию электролита путем измерения электропроводности раствора с известным качественным составом
[3] Ссылка на источник www.physchem.chimfak.rsu.ru
[4] http://www.physchem.chimfak.rsu.ru/Source/PCC/Solutions_3.htm нужно указать на какое число действительна ссылка
[6] Карапетянц М.Х., Дракин С.и. Общая и неорганическая химия. Учебник для вузов. – 3-е издание, стер. – М.: Химия, 1994
[w1]нужно кратко перечислить те вопросы, которые ты освещаешь в работе
[w2]А почему этот источник оказался самым полезным? Укажи его основные достоинства (не только доступность!).
[w4]Автор у учебника есть?
[w5]Почему приведены в качестве примеров только формулы кислот? А другие вещества могут быть сильными, средними и слабыми электролитами.
[w6]Нужно в основном тексте работы, т.е в данном параграфе привести определение термина активность
Факторы, влияющие на электропроводность растворов
1. Природа ионов, природа растворителя
Подвижность тем больше, чем выше заряд и чем меньше размер иона, и чем меньше вязкость среды.


А) При повышении температуры вязкость раствора уменьшается, а подвижность ионов увеличивается.

В сильноразбавленных растворах концентрация ионов мала, и их движению ничего не препятствует. Для предельно разбавленных растворов Кольрауш сформулировал следующий закон (закон независимого движения Кольрауша): в бесконечно разбавленном растворе ионы движутся независимо друг от друга:
где lк 0 и lа 0 – молярные подвижности ионов при предельном разбавлении (предельные подвижности).
Это уравнение справедливо и для сильных и для слабых электролитов.
Казалось бы, молярная электропроводность рассчитывается уже с учетом концентрации и не должна от нее зависеть. Но с ростом концентрации электролита молярная электропроводность будет зависеть и от степени диссоциации (a, в основном для слабых электролитов) и от электрического взаимодействия между ионами (в основном для сильных электролитов).
Для чистого раствора слабого электролита:
Это соотношение называется уравнением Аррениуса. Подставляя его в закон разведения Оствальда Кд = α 2 с / (1- α), получим:
Графический вид зависимости молярной электропроводности l от концентрации представлен на рисунке.
Эта зависимость может быть объяснена только с позиций теории электрической проводимости сильных электролитов Дебая и Онзагера, которая основана на электростатической теории сильных электролитов Дебая и Хюккеля, и объясняет уменьшение молярной электропроводности при переходе от бесконечно разбавленного раствора к растворам конечных концентраций появлением эффектов торможения движения ионов.
1. Релаксационный эффект торможения связан с существованием ионной атмосферы. При перемещении под действием внешнего электрического поля центральный ион выходит из центра ионной атмосферы, которая вновь воссоздается в новом положении иона. Этот процесс происходит не мгновенно, а в течение некоторого времени (времени релаксации). Поэтому заряд ионной атмосферы позади центрального иона больше, чем впереди. Возникающие при этом силы электростатического притяжения тормозят движение иона.
2. Электрофоретический эффект торможения. Этот эффект торможения возникает за счет того, что сольватированная ионная атмосфера, обладая зарядом, противоположным по знаку заряду центрального иона, движется в противоположном направлении. Таким образом, сольватированный центральный ион под действием электрического напряжения перемещается не в неподвижной среде, а в среде, перемещающейся ему навстречу, что приводит к снижению его скорости движения.
Зависимость удельной электрической проводимости растворов от концентрации.
Графическая зависимость удельной электропроводности от концентрации имеет вид, изображенный на рис.
Электропроводность растворов находят кондуктометрическим методом, определяя сопротивление Rяч в специальной двухэлектродной ячейке с платиновыми электродами, включенной в мостовую схему переменнотоковых измерений (схему моста Уитстона). Удельную электропроводность находят по формуле:
где Кяч – постоянная данной ячейки.
Примеры решения задач
Пример 1.
Молярная электрическая проводимость находится по уравнению: λ = æ / С.
Для этого, найдет сначала молярную концентрацию: С = ν/V = m/(M·V).
Пусть масса раствора 100 г, тогда масса хлорида алюминия равна 12 г, молярная его масса будет равна 133,5 г/моль, объем раствора будет V = m / ρ, отсюда V = 90 мл, или 0,09 л.
Подставляя концентрацию в уравнение для нахождения молярной электропроводности и переходя к единицам измерения Си имеем: λ = 0,1041·10 2 /10 3 = 0,01041 См·м 2 /моль.
Ответ: 0,01041 См·м 2 /моль.
Пример 2.
Определяем эквивалентную электропроводность раствора по формуле λ = æ / С:
Степень диссоциации находим по уравнению:
Константу диссоциации найдем по уравнению Кд = λс С / λ 0 (λ 0 – λс):
Пример 3.
Для решения этой задачи воспользуется формулами:
α = 21,7 / 385,8 = 0,056.
Пример 4.
Подставим (4) в (3), затем (3) в (2) и, наконец, (2) в (1), и после сокращений, получим:
Пример 5.
По сопротивлению раствора можно найти удельную электропроводность:
Удельная и молярная электропроводности связаны через молярную концентрацию: λ = æ/С.
Электропроводность растворов электролитов



Коллоквиум IV
ЭЛЕКТРОХИМИЯ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Электропроводность растворов электролитов
Электролиты – вещества, растворы или расплавы которых обладают ионной проводимостью. По сравнению с металлами (сплавами металлов), проявляющими электронную проводимость и являющимися проводниками первого рода, электролиты относят к проводникам второго рода. Типичные проводники второго рода – это растворы кислот и оснований, расплавы и растворы солей. Так как все биологические жидкости и ткани организма обладают ионной проводимостью, то они относятся к растворам электролитов.
Важным свойством растворов электролитов является электрическая проводимость (электропроводность), которая характеризует их способность проводить электрический ток. Она является величиной, обратной электрическому сопротивлению. В свою очередь, сопротивление проводника любого вида R (согласно закону Ома) пропорционально его длине (l) и обратно пропорционально площади сечения (S):
 | (4.1) |
где ρ – удельное сопротивление, равное R при единичных длине и площади сечения проводника, Ом · м.
 | (4.2) |
Для характеристики электропроводности растворов электролитов чаще используют молярную электропроводность (λ, «ламбда»), т. е. электропроводность раствора, содержащего 1 моль электролита, помещенного между параллельными электродами, расположенными на расстоянии 1 м. «Рабочая» площадь электродов определяется объемом раствора. Молярная электропроводность связана с удельной электропроводностью следующим соотношением:
 | (4.3) |
гдеС – молярная концентрация раствора, моль/л; V – разведение (разбавление) раствора, т. е. объем раствора, в котором растворен один моль электролита, м 3 /моль.
Электропроводность растворов зависит от ряда факторов: природы растворителя, вязкости и температуры среды, радиуса и концентрации ионов в растворе. На кривых зависимости удельной электропроводности от концентрации (рис. 4.1) обычно наблюдается максимум.
Рис. 4.1. Зависимость удельной электропроводности от концентрации
для некоторых электролитов
С увеличением концентрации раствора удельная электропроводность сначала растет за счет увеличения числа ионов, достигая максимального значения. При дальнейшем увеличении концентрации сильных электролитов межионное взаимодействие возрастает настолько сильно, что приводит к снижению скорости движения ионов и уменьшению величины удельной электропроводности раствора. В растворе слабых электролитов скорость движения ионов мало зависит от концентрации, однако с ее увеличением уменьшается степень диссоциации, что также приводит к снижению величины удельной электропроводности.
Молярная (эквивалентная) электропроводность растворов электролитов при разбавлении раствора (уменьшении концентрации) увеличивается (рис. 4.2), достигая при бесконечном разбавлении максимального постоянного значения.
Рис. 4.2. Зависимость молярной электропроводности от разбавления
для некоторых электролитов
Это значение является определенным для каждого электролита и называется эквивалентной электропроводностью при бесконечном разбавлении (обозначается 
 | (4.4) |
гдеА – константа (при данной температуре) для данного электролита и растворителя.
Электропроводность электролитов связана со скоростями движения ионов в растворе. В бесконечно разбавленном растворе достигается полная диссоциация молекул и взаимодействие между ионами отсутствует. Каждый из ионов движется независимо от других, и молярная (эквивалентная) электропроводность в таком случае может быть представлена как сумма электропроводностей ионов. Та часть электропроводности, которая приходится на ионы одного вида, называется подвижностью (l) иона.
Согласно закону Кольрауша о независимости движения ионов, величина l¥ равна сумме подвижностей катиона(l+¥)и аниона(l–¥):
 | (4.5) |
Физический смысл закона Кольрауша заключается в том, что в растворе электролита ионы переносят электрический ток независимо друг от друга.
Подвижности ионов связаны с абсолютными скоростями движения ионов (U):
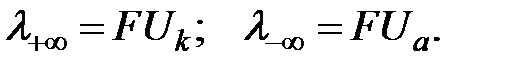 | (4.6) |
Предельные подвижности ионов водорода и гидроксид-ионов в водных растворах в несколько раз превышают подвижности других ионов. Это явление объясняется особым эстафетным механизмом их движения, согласно которому в кислой среде осуществляется перенос протона от иона гидроксония к соседней, соответствующим образом ориентированной молекуле воды:
 |
Аналогический перенос протона от молекулы воды к иону гидроксида происходит в щелочной среде:
 |
В растворах слабых электролитов молярная электропроводность при данном разбавлении ( 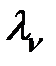
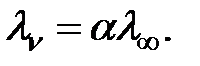 | (4.7) |
Степень диссоциации слабого электролита можно рассчитать по уравнению Аррениуса:
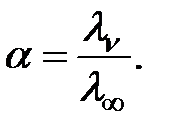 | (4.8) |
Значение 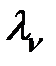

Кроме того, для слабых электролитов выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
 | (4.9) |
Подставляя значение a в уравнение (4.9), получают еще одну из форм закона разведения Оствальда для расчета константы диссоциации: