Что влияет на точность полученных результатов изотермический процесс
График изотермического процесса. Основные термодинамические процессы
Главным предметом изучения термодинамики газовых систем является изменение термодинамических состояний. В результате таких изменений газ может совершать работу и запасать внутреннюю энергию. Изучим в приведенной ниже статье разные термодинамические переходы в идеальном газе. Особое внимание будет уделено изучению графика изотермического процесса.
Идеальные газы
Уже судя по самому названию, можно сказать, что 100-процентных идеальных газов в природе не существует. Однако многие реальные вещества удовлетворяют этой концепции с приемлемой для практики точностью.

Идеальным называется любой газ, в котором можно пренебречь взаимодействиями между его частицами и их размерами. Оба условия удовлетворяются только в том случае, если кинетическая энергия молекул будет намного превышать потенциальную энергию связей между ними, а расстояния между молекулами будут намного больше размеров частиц.
Чтобы определить, является ли изучаемый газ идеальным, можно воспользоваться простым эмпирическим правилом: если температура в системе выше комнатной, давление не сильно отличается от атмосферного или меньше него, а составляющие систему молекулы являются химически инертными, то газ будет идеальным.
Главный закон
Речь идет об уравнении идеального газа, которое также называется законом Клапейрона-Менделеева. Записано это уравнение было в 30-е годы XIX века французским инженером и физиком Эмилем Клапейроном. Спустя несколько десятилетий оно было приведено русским химиком Менделеевым к современному виду. Это уравнение имеет следующий вид:
Закон Клапейрона-Менделеева впервые был получен из результатов предыдущих газовых законов, то есть в его основе лежала исключительно экспериментальная база. С развитием современной физики и кинетической теории текучих сред уравнение идеального газа может быть выведено из рассмотрения микроскопического поведения частиц системы.
Изотермический процесс
Касательно газа идеального отметим, что изотермический переход для него называется законом Бойля-Мариотта. Обнаружен этот закон был экспериментальным путем. Причем он стал первым в этой области (вторая половина XVII века). Его может получить каждый школьник, если рассмотрит поведение газа в закрытой системе (n = const) при постоянной температуре (T = const). Пользуясь уравнением состояния, получаем:
Последнее равенство представляет собой закон Бойля-Мариотта. В учебниках по физике можно также встретить такую форму его записи:
При переходе из изотермического состояния 1 в термодинамическое 2 произведение объема на давление остается постоянным для закрытой газовой системы.
Изучаемый закон говорит об обратной пропорциональности между величинами P и V:
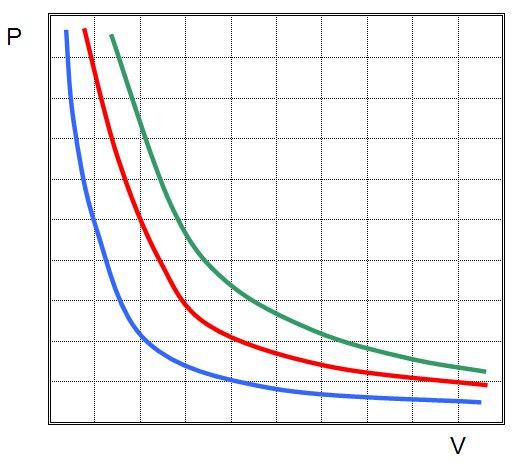
Это означает, что графиком изотермического процесса в идеальном газе будет кривая гипербола. Три гиперболы изображены на рисунке ниже.
Изменение внутренней энергии при изотермическом процессе
В физике идеальных газов под внутренней энергией понимают энергию кинетическую, связанную с вращательным и поступательным движением молекул. Из кинетической теории несложно получить следующую формулу для внутренней энергии U:
В случае процесса изотермического температура остается постоянной, значит, единственной причиной изменения внутренней энергии является выход или приход в систему частиц вещества. Таким образом, в закрытых системах во время изотермического изменения их состояния внутренняя энергия сохраняется.
Изобарный и изохорный процессы
Помимо закона Бойля-Мариотта, существуют еще два основных газовых закона, которые также были открыты экспериментальным путем. Они носят фамилии французов Шарля и Гей-Люссака. Математически их записывают так:
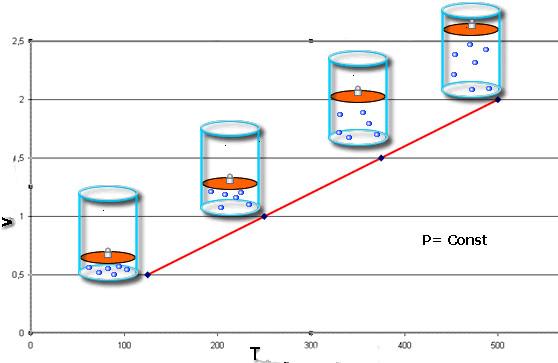
V / T = const при P = const;
P / T = const при V = const.
Закон Шарля говорит о том, что во время изобарного процесса (P = const) объем линейно зависит от абсолютной температуры. Закон Гей-Люссака свидетельствует о линейной зависимости между давлением и абсолютной температурой при изохорном переходе (V = const).
Из приведенных равенств следует, что от процесса изотермического графики изобарного и изохорного переходов отличаются существенным образом. Если изотерма имеет форму гиперболы, то изобара и изохора являются прямыми линиями.
Изобарно-изотермический процесс
Рассматривая газовые законы, иногда забывают, что, помимо величин T, P и V, также может изменяться и величина n в законе Клапейрона-Менделеева. Если зафиксировать давление и температуру, то мы получим уравнение изобарно-изотермического перехода:
n / V = const при T = const, P = const.
Линейная зависимость между количеством вещества и объемом говорит о том, что при одинаковых условиях разные газы, содержащие одно и то же количество вещества, занимают равные объемы. Например, при нормальных условиях (0 oC, 1 атмосфера) молярный объем любого газа составляет 22,4 литра. Рассмотренный закон называется принципом Авогадро. Он лежит в основе закона Дальтона об идеальных газовых смесях.
Исследование изотермического процесса
Исследование изотермического процесса
Цель работы: проверка соотношения между изменениями объема и давления определенного количества газа при его изотермическом сжатии.
Оборудование: Прозрачная трубка с кранами на концах, мерный цилиндр, измерительная лента.
В соответствии с законом Бойля-Мариотта соотношение между изменениями объема и давления определенного количества газа при его изотермическом сжатии должно иметь вид 




Объектом изучения в работе является воздух, находящийся внутри прозрачной трубки. В исходном состоянии он имеет следующие параметры. Давление равно атмосферному. Объем равен объему внутренней полости трубки. Температура соответствует температуре воздуха в помещении.
Второе состояние получают путем сжатия. Для этого кран на одном конце закрывают. Второй кран остается открытым. Конец трубки с открытым краном погружают в мерный цилиндр, который предварительно заполняют водой комнатной температуры, не долив до верхнего края 15 – 20 мм. Кран опускают до дна цилиндра. Через открытый кран в трубку заходит вода и сжимает воздух до тех пор, пока его давление не сравняется с внешним давлением. Таким образом параметры воздуха во втором состоянии окажутся следующими: объем будет равен объему внутренней полости за вычетом объема воды, вошедшей в трубку. Давление возрастет на величину гидростатического давления столба воды в цилиндре. Температура не изменится.
Объем внутренней полости определяется произведением площади поперечного сечения трубки на ее длину. Поскольку поперечное сечение трубки не меняется, объем воздуха удобно измерять в условных единицах. За условную единицу принимают единицу длины воздушного столба.
Итак, в исходном состоянии давление определяется по показаниям барометра-анероида, а объем – измерительной лентой по длине внутренней полости.
Для измерения давления во втором состоянии измеряют разницу уровней воды в мерном цилиндре и в трубке – h. По формуле для расчета гидростатического давления жидкости вычисляют давление столба воды: 

Для определения объема воздуха во втором состоянии измеряют длину столба воды, вошедшей в трубку. Из измеренной ранее длины трубки вычитают длину столба воды.
Завершив измерения, находят произведения давления на объем воздуха в первом и во втором состояниях. Сравнивая полученные числа, делают вывод о справедливости закона Бойля-Мариотта.
1. Подготовьте таблицу для записи результатов измерений и вычислений:
Лабораторная работа «Изучение изотермического процесса»
«Управление общеобразовательной организацией:
новые тенденции и современные технологии»
Свидетельство и скидка на обучение каждому участнику
Выберите документ из архива для просмотра:
Выбранный для просмотра документ Изучение изотермического процесса.docx
Лабораторная работа № 1
ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА
Исследовать зависимость давления газа данной массы от занимаемого им объёма при постоянной температуре.
Запаянная с одной стороны стеклянная трубка длиной около 60 см и диаметром 9 – 12 мм, заполненный водой комнатной температуры большой сосуд высотой не менее 60 см и шириной не менее 5 см, мерная лента, барометр-анероид (один на класс).
С точки зрения молекулярно-кинетической теории идеальный газ — это газ, при описании которого можно пренебречь силами взаимодействия между молекулами, а также размерами самих молекул. Из этого следует, что идеальный газ должен быть разреженным газом, в котором расстояния между молекулами велики и, следовательно, силы взаимодействия малы, а объём, суммарно занимаемый самими молекулами, существенно меньше объёма сосуда, в котором они находятся. Опыты показывают, что при атмосферном давлении реальные газы подчиняются газовым законам. Если газ подчиняется газовым законам, то его можно считать идеальным. Идеальный газ — модель реального газа. Уравнение Клайперона для идеального газа имеет вид:

при этом масса газа остаётся постоянной. Частный случай уравнения Клайперона — полученный экспериментально закон Бойля-Мариотта: “Для газа постоянной массы при постоянной температуре произведение давления газа на его объём есть величина постоянная:



Это уравнение можно записать по-другому:
Физика. 10 класс
Изучение изотермического процесса
Цель: исследовать зависимость давления газа данной массы от занимаемого им объёма при постоянной температуре.
Оборудование: прозрачная силиконовая трубка диаметром 8–10 мм с зажимом или пробкой на конце (стеклянная трубка диаметром 10–12 мм и длиной 60 см, запаянная с одного конца); мензурка (250 мл) с водой комнатной температуры; поддон; измерительная лента (линейка); барометр-анероид (один на класс).
Вывод расчётной формулы
Поскольку внутренняя полость трубки имеет форму цилиндра и площадь S её поперечного сечения одинакова по всей длине трубки, то V1 = Sl1 и V2 = Sl2, где l1 и l2 — длины столба воздуха в трубке в начальном и конечном состояниях соответственно.
При выполнении работы проверяют справедливость этого равенства.
Порядок выполнения работы
1. Закройте зажим на конце силиконовой трубки. Измерьте: длину l1 столба воздуха в трубке и давление p1 воздуха (используя барометр-анероид) в начальном состоянии.
2. Поставьте мензурку на поддон и заполните её водой комнатной температуры так, чтобы при погружении трубки вода в мензурке поднялась до её верхнего края. Погрузите в воду трубку так, чтобы её открытый конец оказался у дна мензурки ( рис. 229 ). Наблюдайте за поступлением воды в трубку. Когда оно прекратится, измерьте длину ΔL столба воды, вошедшей в трубку.
3. Измерьте разность уровней h воды в мензурке и трубке и вычислите длину l2 столба воздуха в трубке в конечном состоянии: l2 = l1 – ΔL.
Результаты измерений и вычислений занесите в таблицу в тетради.
| l1, м | р1, Па | ΔL, м | h, м | l2, м | рв, Па | р2, Па |
8. Запишите результаты измерений в виде двойных неравенств:
Сравните полученные интервалы значений и сделайте вывод.
Если интервалы перекрываются, то отношения давлений и длин столба воздуха в трубке при данной относительной погрешности измерений одинаковы, что и подтверждает справедливость проверяемого равенства.
Контрольные вопросы
1. При каких условиях для определения параметров состояния газа можно использовать уравнение pV = const?
2. Почему при выполнении данной работы процесс изменения объёма воздуха можно считать практически изотермическим?
3. Что влияет на точность полученных результатов?
Суперзадание
Определите математическую зависимость между плотностью и давлением воздуха в трубке. Используя результаты, полученные при выполнении данной работы, и термометр, постройте график зависимости плотности воздуха в трубке от давления.
Методическая разработка урока физики в 10-м классе «Исследование изотермического процесса»
Разделы: Физика
Тип урока: урок изучения нового материала.
Цель урока: установление зависимости между двумя термодинамическими параметрами при неизменном третьем в процессе изучения фундаментальных экспериментов Бойля и Мариотта и экспериментальная проверка справедливости газовых законов.
1. Подготовка к восприятию нового материала (работа с таблицами и проектом)
2. Изучение нового материала
Учитель сопровождает объяснение демонстрацией физического эксперимента и фрагментов проекта.
2.1. Определение уравнения состояния.
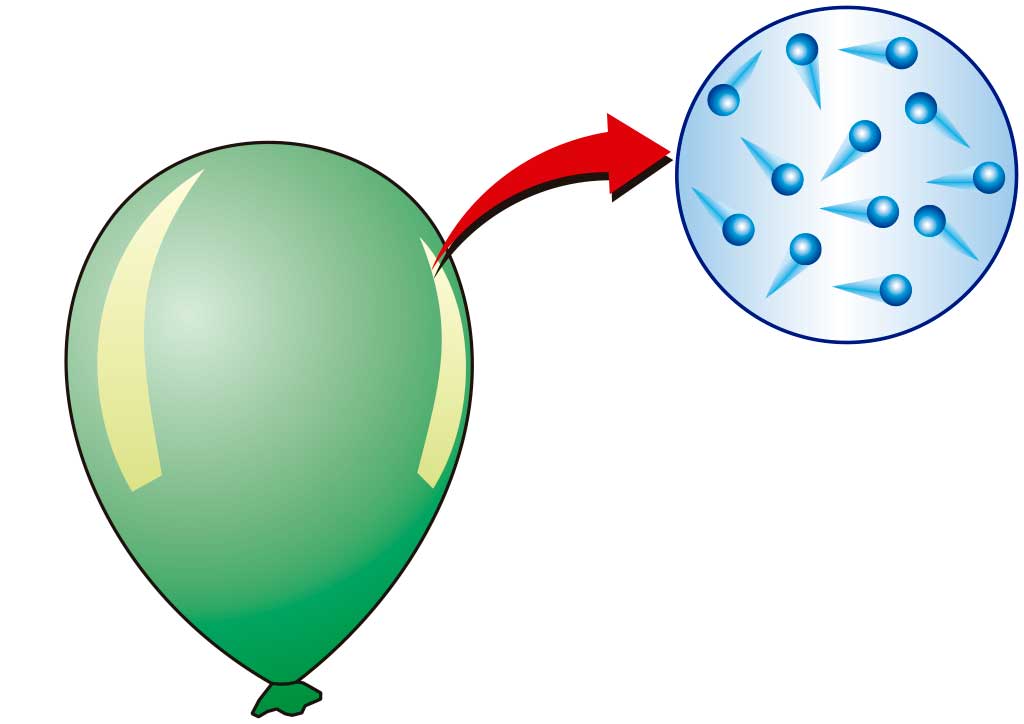
Опыт №1.
Под вакуумную тарелку насоса поместим надутый до размеров яблока воздушный шарик. Откачивая воздух из-под купола насоса, обнаружим увеличение размеров шарика в несколько раз. Процесс откачивания воздуха сопровождается охлаждением воздуха под куполом и внутри шарика. Объём, давление и температура воздуха в шарике изменяются.
Уравнение, определяющее связь температуры, объёма и давления тел, называют уравнением состояния.
2.2. Определение равновесных и неравновесных процессов.
При медленном протекании процесса в любой момент времени успевает устанавливаться новое состояние равновесия с новыми значениями давления и объёма. Такие медленные процессы называют равновесными. Если после медленного сжатия проводить процесс в обратном направлении, т.е. предоставить газу возможность медленно расширяться, то он пройдёт через ту же последовательность равновесных состояний, что и при сжатии. По этой причине равновесные процессы называются обратимыми.
2.3. Закон Бойля – Мариотта.
Первый газовый закон был открыт английским учёным Робертом Бойлем в 1662 году и опубликован во втором издании его книги «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал изменения давления газа в зависимости от объёма при постоянной температуре. Процесс изменения состояния термодинамической системы при постоянной температуре называют изотермическим (от греческих слов isos – равный, therme – тепло). Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении опыта.
Бойль наблюдал за изменением объёма воздуха, запертого в длинной изогнутой трубке столбом ртути. Вначале уровни ртути в обоих коленах трубки были одинаковыми, и давление воздуха было равно атмосферному, т.е. 760 мм ртутного столба. Доливая ртуть в длинное колено трубки, Бойль заметил, что объём воздуха уменьшился вдвое, когда разность уровней в обоих коленах оказалась равной 760 мм, и, следовательно, давление увеличилось вдвое. Это навело Бойля на мысль о том, что объём данной массы газа и его давление находятся в обратно пропорциональной зависимости. В 1667 году независимо от Бойля этот же закон установил французский физик Эдм Мариотт (1620-1684). Он проделал аналогичные опыты и в 1679 г. описал их в своей работе «Речи о природе воздуха». Поэтому закон, связывающий давление газа и его объём, называется законом Бойля – Мариотта. Согласно этому закону давление данной массы (или количества) газа при постоянной температуре обратно пропорционально объёму газа: p
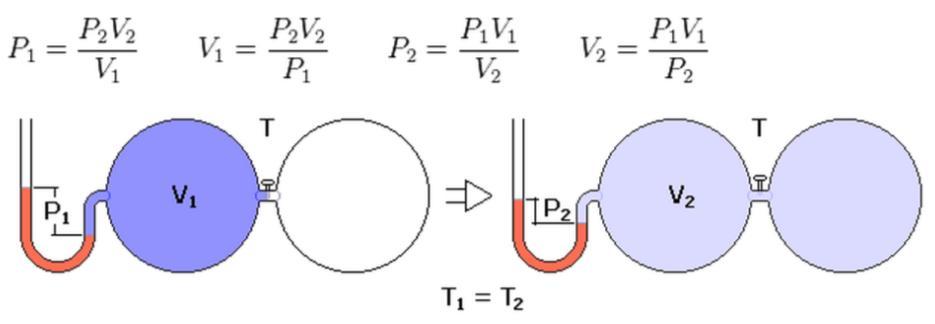
Опыт №2.
Герметичный гофрированный сосуд соединён с манометром, регистрирующим давление внутри сосуда. Вращением винта можно изменять объём сосуда. Об объёме можно судить с помощью линейки. Меняя объём и измеряя давление, можно заметить, что выполняется уравнение P * V = const при t = const. Произведение давления данной массы газа на его объём постоянно, если температура не меняется.
Опыт №3. «Экспериментальное определение зависимости давления газа от объёма при постоянной температуре».
Запустить программу L-физика. Выбрать раздел «Газовые законы и свойства насыщенных паров», а в нём – эксперимент «Изотермический процесс». Медленно вращая рукоятку винта, сжимаем газ и переводим поршень в другое предельное положение. Кривые и цифровые индикаторы на экране при этом показывают изменение давления и объёма газа от занимаемого им объёма. На экране монитора учащиеся видят гиперболу.
На втором экране те же самые полученные в эксперименте точки перестраиваются в координатах (1/V, P). Для изотермического процесса зависимость 1/V от Р представляет собой линейную функцию. [3]
Таблица 1. Характеристики изотермического процесса [2]
| Постоянный параметр | Название изопроцесса | Связь между другими параметрами | Объяснение связи между параметрами С точки зрения МКТ | Графики изопроцесса |
| T = const при m = const. | Изотермический (закон Бойля – Мариотта) | P * V = const или P |
1/V; то есть
P1 * V1 = P2 * V2
или p1/p2 = V2/V1.Давление газа зависит от числа ударов молекул о стенки сосуда.
Число ударов прямо пропорционально концентрации:
3. Закрепление учащимися нового материала в ходе выполнения лабораторной работы «Исследование изотермического процесса» [3]
Цель работы: проверить соотношение между объёмом и давлением определённого количества газа при его изотермическом сжатии. В соответствии с законом Бойля – Мариотта это соотношение должно иметь вид: V1P1 = V2P2, где V1 и V2 – объёмы, занимаемые газом соответственно до и после сжатия, а P1 и P2 – его давления.
Объектом изучения в работе является воздух, находящийся внутри прозрачной трубки. До сжатия он имеет следующие параметры: давление равно атмосферному, объём равен объёму внутренней полости трубки, температура – комнатная.
Для сжатия воздуха в трубке один из кранов закрывают. Второй кран оставляют открытым. Конец трубки с открытым краном погружают до дна мерного цилиндра, который предварительно заполняют водой комнатной температуры, не долив до края 15-20 мм. Через открытый кран в трубку заходит вода и сжимает воздух до тех пор, пока его давление не сравняется с внешним давлением. Таким образом, после сжатия параметры воздуха окажутся следующими. Объём будет равен объёму внутренней полости за вычетом объёма воды, вошедшей в трубку. Давление возрастает на величину гидростатического давления столба воды в цилиндре. Температура не изменится.
1. Подготовить таблицу для записи результатов измерений и вычислений (Табл.2):
4. После выполнения лабораторной работы учащиеся зачитывают свои выводы о выполнении закона Бойля – Мариотта, оценивают правдоподобность полученных результатов, предлагают способы улучшения эксперимента.