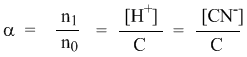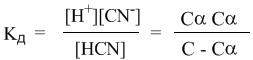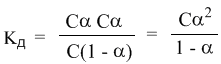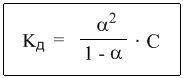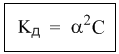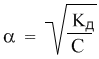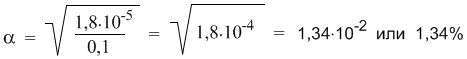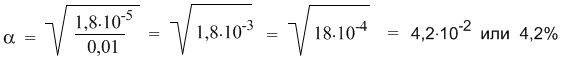чем больше разбавление раствора тем выше степень диссоциации
Степень диссоциации электролита. Закон разбавления Оствальда



Количественную характеристику равновесного состояния электролита дает его степень диссоциации (a), т.е. отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
a измеряется в % (долях). N – общее число молекул в растворе, n – число диссоциированных молекул.
Степень диссоциации электролита зависит от ряда факторов, среди которых:
Природа электролита – главный фактор, определяющий степень диссоциации. Чем более полярной является химическая связь между атомами или группами атомов в молекуле, тем сильнее растворитель с высоким значением диэлектрической проницаемости препятствует электростатическому взаимодействию ионов противоположного знака в растворе, тем больше степень диссоциации.
Природа растворителя также оказывает существенное влияние на степень диссоциации растворённого вещества. Степень диссоциации в значительной мере зависит от диэлектрической проницаемости растворителя. Диэлектрическая проницаемость (ξ) показывает, во сколько раз сила взаимодействия между двумя зарядами в данной среде меньше, чем в вакууме. Чем больше диэлектрическая проницаемость среды, тем больше степень электролитической диссоциации. Самое высокое значение ξ=81 имеет вода. Замена воды на растворитель с меньшей диэлектрической проницаемостью, например, на этиловый спирт (ξ=25), сильно понижает степень диcсоциации. Сильные электролиты в спирте становятся электролитами средней силы, а слабые – практически не диссоциируют.
Изменение концентрации раствора будет различно отражаться на процессах диссоциации и моляризации. Степень диссоциации электролита при разбавлении раствора увеличивается.
Все соли являются сильными электролитами. К сильным электролитам принадлежат следующие кислоты: HNO3, HClO4, HClO3, H2SO4, HCl, HBr, HI, HMnO4. К слабым кислотам относятся все органические кислоты, а также H2CO3, H2S, HCN, H2SiO3 и некоторые другие. К сильным основаниям относятся KOH, NaOH, Ca(OH)2, Ba(OH)2. К слабым основаниям принадлежат NH4OH, Al(OH)3, Zn(OH)2, Mg(OH)2, Cu(OH)2 и др.
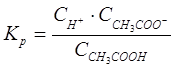
Чем меньше Кд, тем слабее электролит проявляет способность к диссоциации. Если молекула слабого электролита может диссоциировать на два и на большее число ионов, то диссоциация проходит по стадиям (ступенчатая диссоциация). При этом каждая стадия характеризуется своей константой диссоциации. Например, H3PO4 диссоциирует по уравнениям
Значение констант изменяется в ряду К1 > К2 > К3. Это положение имеет общее значение, т.к. отщепление второго и третьего ионов водорода требует большей энергии (приложение, табл. 1).
Константа полной диссоциации слабого электролита равна произведению констант его диссоциации по ступеням.
Константа диссоциации слабого электролита связана со степенью диссоциации. Обозначим: С – исходная концентрация электролита, α – степень диссоциации. Тогда концентрация ионов в состоянии равновесия для бинарного электролита Сα. Концентрация недиссоциированных молекул будет
Константу диссоциации для уксусной кислоты можно представить следующим образом:
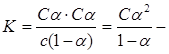
Таким образом, закон разбавления Оствальда формулируется следующим образом: степень диссоциации электролита при разбавлении раствора увеличивается.
При прибавлении в раствор слабой кислоты или основания соли, содержащей одноимённый анион или катион для кислоты или основания соответственно, то согласно принципу Ле-Шателье, следует ожидать смещения равновесия диссоциации влево, т.е. в сторону уменьшения степени диссоциации. Так, если к раствору уксусной кислоты добавить немного ацетата натрия, то добавленные ацетат-ионы смещают равновесие диссоциации кислоты
влево и степень диссоциации уксусной кислоты уменьшается. Об этом свидетельствуют приведенные ниже данные:
[СН3СООNa], моль/л 0,0 0,001 0,002 0,005 0,010 0,020
α СН3СООН, % 4,1 1,5 0,84 0,35 0,18 0,09
Подавление диссоциации под влиянием одноимённого иона называется “репрессией ионизации”. С репрессией ионизации связаны многие процессы, имеющие практическое значение. Так, её используют для уменьшения растворимости тех или иных соединений.
Чем больше разбавление раствора тем выше степень диссоциации
§10.2.** Зависимость степени диссоциации от концентрации. Закон разбавления Оствальда.
В предыдущем параграфе мы качественно, на основе принципа Ле Шателье установили, что разбавление раствора должно приводить к увеличению степени диссоциации α. Но эту взаимосвязь можно выразить и количественно.
Рассмотрим электролит, молекулы которого XY распадаются в растворе на два иона – катион и анион. Фактически, степень диссоциации α представляет собой долю распавшихся молекул. Если общую концентрацию электролита (С) умножить на эту долю, то получим концентрацию любого из ионов. Иными словами, αС = [X + ] моль/л, и αC = [Y – ] моль/л.
К физическому смыслу произведения αС можно прийти и другим путем. Допустим, имеется раствор циановодорода HCN (синильной кислоты) с концентрацией С моль/л. В растворе циановодород слабо диссоциирует на ионы:
HCN 
Напомним, что в выражении для степени диссоциации α величина n0 отражает количество молекул (или молей) HCN, изначально попавших в раствор. Иными словами, n0 = C моль/л. Напомним также, что n1 – это число молекул (или молей) HCN, распавшихся на ионы. Следовательно, n1 = [H + ] и n1 = [CN – ]. В этом случае:
Отсюда следует, что
Итак, мы приходим к тому же выводу: чтобы получить концентрацию любого из ионов в растворе, достаточно общую концентрацию вещества С умножить на коэффициент α – степень его диссоциации.
Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα:
Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение:
Или, в другой записи:
Это не что иное, как математическая формулировка закона разбавления Оствальда. Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности.
Однако в случае слабых электролитов величина (1 – α) очень мало отличается от единицы. Действительно, если α = 0,01, то (1 – 0,01) = 0,99, т.е. практически 1. Таким образом, для слабых электролитов закон разбавления Оствальда можно записать в более простом виде:

Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Подставляя в эту формулу численные значения, получим:
Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда:
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.
Рекомендуем решить приведенные ниже задачи на разбавление растворов – они тоже дают представление о сфере применимости только что рассмотренного закона.
10.5. **(ФМШ). Сколько воды надо прибавить к 300 миллилитрам 0,2 М раствора уксусной кислоты СН3СООН (Кд = 1,8·10 –5 ), чтобы степень диссоциации кислоты удвоилась?
10.6. **(ФМШ). Сколько воды надо прибавить к 200 мл 0,27 М раствора муравьиной кислоты НСООН (Кд = 1,8·10 –4 ), чтобы степень диссоциации увеличилась в 3 раза?
Подсказка к задаче 10.5. Эта задача проще, чем может показаться на первый взгляд. Численное значение константы диссоциации кислоты при решении вам не потребуется. В задаче оно приведено для того, чтобы было понятно, что кислота слабая и к ее растворам применим закон разбавления Оствальда в виде: Кд = α 2 С. По условию задачи степени диссоциации после разбавления и до разбавления соотносятся как α2 = 2α1. Если выразить обе α через закон разбавления, то при дальнейшем решении значения Кд сокращаются. Есть способ решения, в котором значение концентрации раствора 0,2 М тоже не обязательно использовать (напомним, что большая буква «М» означает «моль/л»). Попробуйте найти это решение.
Степень диссоциации. Сильные и слабые электролиты
В растворах некоторых электролитов диссоциирует лишь часть молекул. Способность вещества к электролитической диссоциации называется степенью диссоциации. Она показывает отношение числа молекул, продиссоциированных на ионы, к общему числу молекул растворенного электролита:

где α— степень диссоциации;
п — количество ионов в растворе;
N— общее число молекул в растворе.
По степени диссоциации в растворах все электролиты делятся на две группы. К первой группе относят электролиты, степень диссоциации которых в растворах α > 30 % и почти не зависит от концентрации раствора. Их называют сильными электролитами. К сильным электролитам в водных растворах относятся щелочи: КОН, NaOH, Ba(OH)2, Са(ОН)2; кислоты: HNO3, НСl, H2SO4, НClO4, а также их соли.
Электролиты, степень диссоциации которых в растворах α Читайте также: Основные химические понятия и физические величины
В растворах слабых электролитов процесс диссоциации протекает обратимо и его можно представить в виде обратимой химической реакции. Так, для процесса диссоциации уксусной кислоты:
константа равновесия этого процесса будет равна:

где [СНзСОО-], [Н+] — концентрация ионов;
[СН3СООН] — концентрация непродиссоциированных молекул.
Константа равновесия, соответствующая диссоциации слабого электролита, называется константой диссоциации.
Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, температуры и не зависит от концентрации раствора.
Константа диссоциации показывает устойчивость молекул вещества к диссоциации. Чем меньше значение константы диссоциации в данном растворе, тем слабее диссоциирует электролит.
Степень диссоциации a изменяется с изменением концентрации раствора. Рассмотрим эту зависимость на примере слабого электролита уксусной кислоты:
Принимая исходную концентрацию кислоты равной с, а степень диссоциация a, получаем, что концентрация части кислоты, которая диссоциирована, будет равна aс. Так как при диссоциации одной молекулы кислоты образуется по одному иону Н+ и СНзСОО-, то их концентрации будут равны aс. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна с — aс = с(1 — a). Подставив значения равновесных концентраций ионов и кислоты в уравнение (5.2), получим:

Уравнение (5.3) было получено В. Ф. Оствальдом и называется законом Оствальда. Если a Читайте также: Способы выражения состава растворов
Пример 3. Вычислите степень диссоциации хлорноватистой кислоты и концентрацию ионов водорода в растворе с молярной концентрацией 0,05 моль/дм3.
Решение. НСlO — слабый электролит: HCIO « Н+ + СlO-. Следовательно, в соответствии с законом разбавления Оствальда (5.4, б), определяем степень диссоциации:
Кдис(НСlO) = 5×10-8 моль/дм3.
Молярную концентрацию определяем по формуле (5.5). Так как при диссоциации НС1О « Н++ СlO- образуется один ион Н+ (k(Н+) =1), то
с(Н+) = 
Ответ: a(HClO) = 1 ×10-3; с(Н+) = 5×10 5 моль/дм3.
Решение. В уравнение закона разбавления Оствальда (5.3) подставим данные:
Ионное произведение воды, водородный показатель (рН). Вода является слабым электролитом и диссоциирует на ионы в незначительной степени. Процесс диссоциации воды может быть записан уравнением:
Константа диссоциации будет равна:
Преобразуем выражение (5.7) к следующему виду:
Концентрацию молекул воды можно рассчитать, разделив массу 1 дм3 на массу 1 моля:
Произведение двух постоянных величин есть величина постоянная <Кдис[HгО] = const = KH20), тогда уравнение (5.8) принимает вид:
Полученное уравнение показывает, что для воды и разбавленных водных растворов при постоянной температуре произведение концентрации ионов водорода и гидроксила есть величина постоянная.
Эта постоянная величина называется ионным произведением воды.
Численное значение ионного произведения равно:

Таким образом, произведение концентрации ионов водорода и гидроксильных ионов в растворе при температуре 295 К равно 10-14.
Отсюда, для чистой воды концентрация ионов при температуре 295 К равна:

Допустим, что концентрация ионов водорода при добавлении кислоты увеличилась в 1000 раз и стала [Н+] = 10-4 моль/дм3, тогда концентрация ионов [ОН-] в растворе будет равна:

Мы получаем, что в растворах с различной средой всегда присутствуют ионы Н+ и ОН-.
[Н+] Читайте также: Строение полимеров
Для характеристики кислотности (щелочности) среды введен специальный параметр — водородный показатель, или рН. Водородным показателем, или рН, называется взятый с обратным знаком десятичный логарифм концентрации ионов водорода в растворе:
Следовательно, если рН = 7 — нейтральная среда;
Чем больше разбавление раствора тем выше степень диссоциации
Кроме констант ионизации существует еще одна величина, которая количественно характеризует процесс ионизации слабого электролита – степень ионизации (a).
Степень ионизации (диссоциации) равна отношению числа ионизированных (или диссоциированных) молекул к общему числу растворенных молекул:
Между константой ионизации и степенью ионизации существует связь, которая математически описывается выражением закона разбавления Оствальда – с разбавлением раствора степень диссоциации слабого электролита увеличивается:
Если электролит слабый (a 400).
Степень ионизации увеличивается с повышением температуры.
Некоторые электролиты диссоциируют ступенчато. Это многоосновные кислоты и основания, а также кислые и основные соли. Например,
Степень диссоциации по каждой последующей ступени, как правило, на несколько порядков меньше по сравнению с предыдущей, поэтому, если в системе не происходят какие-либо сопряженные процессы, диссоциацию слабого электролита можно рассматривать только по первой ступени.
Сильные электролиты в растворах диссоциируют практически полностью. При написании уравнения диссоциации это подчеркивается стрелкой в одном направлении:
К сильным электролитам относятся:
1) практически все соли, за исключением малорастворимых;
2) минеральные кислоты: HCl, HClO4, HNO3, H2SO4 (по 1-й ступени), HBr, HJ;
3) основания, образованные щелочными и щелочноземельными металлами.
Слабые электролиты подвергаются ионизации. Этот процесс идет в незначительной степени, т.е. в растворе находится больше молекул, чем ионов и данный процесс обратим. При написании уравнения ионизации это подчеркивается стрелками в обоих направлениях:
Слабые электролиты: константа и степень диссоциации, закон разбавления Оствальда.



Для количественной характеристики полноты диссоциации ввели понятие степеньэлектролитической диссоциации.
α= (% или доли) N – число распавшихся молекул
В зависимости от степени электролитической диссоциации:
— сильные электролиты: практически полностью диссоцириуют на ионы; α> 30%; это почти все водорастворимые соли: НCl HNO3 KOH NaOH и др.
— слабые электролиты : практически не диссоциируют на ионы; α
[КnAm] – молярная равновесная концентрация не продиссоциирующих ионов.
Кд – константа диссоциации.
Данное выражение справедливо для разбавленных растворов слабых электролитов. Чем больше константа диссоциации, тем сильнее диссоциирует электролит.
Константа диссоциации зависит:
— от природы растворителя и электролита;
— не зависит от концентрации раствора.
Между константой диссоциации и степенью диссоциации есть взаимосвязь.
Закон разбавления Оствальда (сильные электролиты этому закону не подчиняются)
α – степень диссоциации
с – молярная концентрация электролита
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато.
Произведение растворимости.
Для насыщенного раствора труднорастворимого электролита произведение молярных концентраций ионов есть величина постоянная при данной температуре.
В чистой воде или в любом водном растворе при постоянной температуре ионное произведение воды – величина постоянная.
В чистой воде концентрация ионов водорода равна концентрации гидроксогрупп.
В качестве характеристики среды используют водородный и гидроксильный показатели.
Для определения реакции среды используют иономеры, а приближенное значение можно узнать с помощью индикаторов.