чардж синдром что это такое
Синдром Черджа-Стросс
Синдром Черджа-Стросс – воспалительно-аллергическое поражение мелких и средних сосудов (капилляров, венул, артериол), протекающее с образованием некротизирующих эозинофильных гранулем. Для синдрома Черджа-Стросс характерны гиперэозинофилия, поражение бронхо-легочной системы, сердца, ЖКТ, центральной и периферической нервной системы, кожи и суставов. Диагноз синдрома Черджа-Стросс основан на данных анамнеза, клинической картины, лабораторных исследований, рентгенографии органов грудной клетки, биопсии легких. В качестве основной терапии синдрома Черджа-Стросс показано назначение системных глюкокортикостероидов и цитостатиков.
Общие сведения
Причины
Причины синдрома Черджа-Стросс неизвестны. Патогенез связан с иммунным воспалением, пролиферативно-деструктивными изменениями и повышением проницаемости сосудистой стенки, тромбообразованием, кровоизлияниями и ишемией в зоне повреждения сосудов. Важную роль в развитии синдрома Черджа-Стросс играет повышенный титр антинейтрофильных цитоплазматических антител (ANCA), антигенными мишенями которых являются ферменты нейтрофилов (главным образом, протеиназа-3 и миелопероксидаза). ANCA вызывают преждевременную дегрануляцию и нарушение трансэндотелиальной миграции активированных гранулоцитов. Сосудистые изменения приводят к появлению многочисленных эозинофильных инфильтратов в тканях и органах с образованием некротизирующих воспалительных гранулем.
На первый план при синдроме Черджа-Стросс выходит поражение легких. При гистологическом исследовании выявляются интерстициальные и периваскулярные эозинофильные инфильтраты в стенках легочных капилляров, бронхов, бронхиол и альвеол, перивазальных и перилимфатических тканях. Инфильтраты имеют разнообразную форму, обычно локализуются в нескольких сегментах легкого, но могут распространяться на всю легочную долю. Кроме острофазных воспалительных реакций, отмечаются рубцовые склеротические изменения в сосудах и легочной ткани.
Спровоцировать развитие синдрома Черджа-Стросс могут вирусная или бактериальная инфекция (например, гепатит В, стафилококковое поражение носоглотки), вакцинация, сенсибилизация организма (аллергические заболевания, лекарственная непереносимость), стрессы, охлаждение, инсоляция, беременность и роды.
Симптомы
В своем развитии синдром Черджа-Стросс проходит три стадии.
Продромальная стадия может длиться несколько лет. При типичном течении синдром Черджа-Стросс начинается с поражения респираторного тракта. Появляются аллергический ринит, симптомы носовой обструкции, полипозные разрастания слизистой носа, рецидивирующие синуситы, затяжные бронхиты с астматическим компонентом, бронхиальная астма.
Вторая стадия синдрома Черджа-Стросс характеризуется повышением уровня эозинофилов в периферической крови и тканях; проявляется тяжелыми формами бронхиальной астмы с сильными приступами кашля и экспираторного удушья, кровохарканьем. Приступы бронхоспазма сопровождаются выраженной слабостью, длительной лихорадкой, миалгией, похуданием. Хроническая эозинофильная инфильтрация легких может привести к развитию бронхоэктатической болезни, эозинофильной пневмонии, эозинофильного плеврита. При появлении плеврального выпота отмечаются боли в грудной клетке при дыхании, усиление одышки.
Третья стадия синдрома Черджа-Стросс характеризуется развитием и доминированием признаков системного васкулита с полиорганным поражением. При генерализации синдрома Черджа-Стросс степень тяжести бронхиальной астмы уменьшается. Период между появлением симптомов бронхиальной астмы и васкулита составляет в среднем 2-3 года (чем короче промежуток, тем неблагоприятнее прогноз заболевания). Отмечается высокая эозинофилия (35-85%). Со стороны сердечно-сосудистой системы возможно развитие миокардита, коронарита, констриктивного перикардита, недостаточности митрального и трехстворчатого клапанов, инфаркта миокарда, пристеночного фибропластического эндокардита Леффлера. Поражение коронарных сосудов может стать причиной внезапной смерти больных синдромом Черджа-Стросс.
При синдроме Черджа-Стросс возникает полиморфное поражение кожи в виде болезненной геморрагической пурпуры на нижних конечностях, подкожных узелков, эритемы, крапивницы и некротических пузырьков. Часто наблюдаются полиартралгии и непрогрессирующий мигрирующий артрит. Поражение почек встречается редко, носит невыраженный характер, протекает в форме сегментарного гломерулонефрита и не сопровождается ХПН.
Диагностика
При синдроме Черджа-Стросс также выявляется анемия, лейкоцитоз, повышение СОЭ и уровня общего IgE. Для более половины случаев синдрома Черджа-Стросс характерно обнаружение перинуклеарных антител с антимиелопероксидазной активностью (рANCA).
Рентгенография органов грудной клетки при синдроме Черджа-Стросс позволяет обнаружить быстро исчезающие, ограниченные затемнения и очаговые тени в легких, наличие плеврального выпота. При биопсии легкого определяется гранулематозное воспаление мелких сосудов, инфильтраты в околососудистом пространстве, содержащие эозинофилы. Дифференциальную диагностику синдрома Черджа-Стросс следует проводить с узелковым полиартериитом, гранулематозом Вегенера, хронической эозинофильной пневмонией, идиопатическим гиперэозинофильным синдромом, микроскопическим полиангиитом.
Лечение синдрома Черджа-Стросс
Лечение предполагает длительное назначение высоких доз системных глюкокортикостероидов. По мере улучшения состояния дозу препаратов снижают. При наличии поражений сердечно-сосудистой системы, легких, множественного мононеврита возможно применение пульс-терапии метилпреднизолоном. При неэффективности глюкокортикостероидов используются цитостатики (циклофосфамид, азатиоприн, хлорбутин), которые способствуют более быстрой ремиссии и снижению риска рецидивов, но создают высокий риск инфекционных осложнений. Перед началом терапии отменяются все лекарственные препараты, к которым у больного выявлена сенсибилизация.
Прогноз
Без лечения прогноз синдрома Черджа-Стросс неблагоприятный. При полиорганном поражении происходит быстрое прогрессирование синдрома Черджа-Стросс с высоким риском смертельного исхода от сердечно-легочных нарушений. При адекватном лечении 5-летняя выживаемость составляет 60-80%.
Чардж синдром что это такое
Тем не менее появление генетического тестирования может выявлять мутации гена CHD7 в атипичных случаях, что может определить более высокую встречаемость.
Патогенез синдрома CHARGE. Ген CHD7, распоженный в 8ql2, — член суперсемейства генов ДНК-связанной хромодоменной хеликазы (CHD). Считают, что белки этого семейства влияют на структурный хроматин и экспрессию генов в ходе раннего эмбрионального развития.
Ген CHD7 экспрессируется повсеместно во множестве плодных и взрослых тканей, включая глаза, улитку уха, мозг, ЦНС, желудок, кишечник, скелет, сердце, почки, легкие и печень. У пациентов с синдромом CHARGE обнаружены гетерозиготные нонсенс- и миссенс-мутации в ген CHD7, а также делеции участка 8ql2, захватывающее ген CHD7, доказывающие, что болезнь вызывает гаплонедостаточность гена.
Тем не менее некоторые пациенты с синдромом CHARGE не имеют обнаруживаемых мутаций в гене CHD7, так что иногда в основе болезни могут быть мутации в других локусах.
Фенотип и развитие синдрома CHARGE
Акроним CHARGE (С — колобома, Н — сердегные дефекты, А — атрезия хоан, R — задержка роста и развития, G — аномалии гениталий, Е — аномалии уха), охватывая наиболее частые симптомы синдрома, принят дисмор-фологами как описательное название ассоциации аномалий неизвестной этиологии и патогенеза, наблюдаемых вместе чаще, чем ожидается.
С открытием мутаций в гене CHD7 при синдроме CHARGE заболевание отнесли к дисморфическим синдромам, т.е. характерным наборам причинно связанных аномалий. Текущие основные диагностические критерии синдрома — колобома глаза (захватывающая радужку, сетчатку, сосудистую оболочку или диск, с или без микрофтальма), атрезия хоан (односторонняя или двусторонняя; стеноз или атрезия), аномалии черепных нервов (с односторонним или двусторонним лицевым параличом, нейросенсорной глухотой или проблемами глотания) и характерные аномалии слуха (наружное ухо деформировано, чашеобразное, в среднем ухе порок развития слуховых косточек, смешанная глухота и кохлеарные пороки).
Реже обнаруживают множество других аномалий, например, расщелину губы или нёба, врожденные пороки сердца, задержку роста, трахеопищеводные свищи или атрезию пищевода. Синдром CHARGE диагностируют при наличии трех-четырех специфичных критериев или двух больших и трех малых критериев.
Перинатальная или ранняя детская смертность (до 6 мес жизни), наблюдаемая приблизительно у половины больных, коррелирует с наиболее тяжелыми врожденными аномалиями, включая двустороннюю атрезию хоан и врожденные пороки сердца. Значимая причина смертности и заболеваемости — гастроэзофагеальный рефлюкс.
Часто бывают проблемы глотания; до 50% подростков и взрослых нуждаются в установке гастростомической трубки. У большинства пациентов с синдромом CHARGE обнаруживают поведенческие аномалии (включая гиперактивность, нарушения сна и навязчивое поведение) и задержку наступления половой зрелости. Задержка физического и умственного развития может колебаться от легкой до тяжелой степени.
Поскольку исследование мутации CHD7 выявляет все больше индивидуумов с синдромом CHARGE, его симптоматика может стать более изученной, а фенотипический спектр расширится.
Особенности фенотипических проявлений синдрома CHARGE:
• Колобома радужки, сетчатки, оптического диска или зрительного нерва
• Пороки сердца
• Атрезия хоан
• Задержка роста и развития
• Аномалии полового развития
• Аномалии уха
• Паралич лица
• Расщелины губы
• Трахеопищеводные свищи
Лечение синдрома CHARGE
Если заподозрен синдром CHARGE, необходимо тщательное обследование для исключения возможной атрезии или стеноза (односторонних) хоан, врожденных пороков сердца, аномалий ЦНС, почек, утраты слуха и трудностей глотания. Оказание помощи включает хирургическую коррекцию пороков развития и тщательный уход. Важный компонент наблюдения — динамическая оценка состояния. При возможности тестирования мутаций в гене CHD7, по крайней мере, у 50% пациентов может быть установлен молекулярный диагноз.
Риски наследования синдрома CHARGE
Почти все случаи синдрома CHARGE — следствие новых доминантных мутаций с низким риском повторения у родителей. Имеется один известный пример монозиготных близнецов, имевших синдром CHARGE, а также одна семья с двумя больными сибсами (мужчина и женщина). Последняя ситуация указывает, что возможен половой мозаицизм. Если у больного обнаружена мутация в гене CHD7n оба родителя отрицательны по этой мутации, риск повторения для будущего потомства составляет менее 5%. Больной имеет 50% риск повторения у потомства.
Пример синдрома CHARGE. Девочка родилась в срок у 34-летней первоберемен-ной матери при неосложненной беременности. При родах отмечена чашеобразная форма ушной раковины справа, с поворотом ее кзади. Из-за затруднения кормления девочку перевели в отделение патологии новорожденных. Попытка проведения назогастрального зонда в правую ноздрю оказалась неудачной, что показало одностороннюю атрезию хоан. Генетик заподозрил синдром CHARGE.
Дальнейшее обследование включало эхокардиографию, обнаружившую небольшой дефект межжелудочковой перегородки, и офтальмологический осмотр, выявивший колобому сетчатки в левом глазу. Дефект межжелудочковой перегородки исправлен хирургически без осложнений.
В период новорожденности при скрининге на снижение слуха тест пройден отрицательно, и впоследствии диагностирована нейросенсорная глухота. Поиск мутаций в гене синдрома CHARGE, CHD7, показал наличие в экзоне 26 мутации 5418C>G в гетерозиготном состоянии, приводящей к образованию преждевременного стоп-кодона (Tyr1806Ter). Поиск мутации у родителей результата не дал, указывая, что мутация у ребенка произошла de novo, поэтому семью проинформировали о низком риске повторения при будущих беременностях. В возрасте 1 года девочка умеренно задержана в моторном и речевом развитии, ее рост и масса тела находятся в 5-м процентиле, окружность головки — в 10-м процентиле. Запланированы ежегодные осмотры.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Чардж синдром что это такое
Сотрудниками «Санкт-Петербургского государственного педиатрического медицинского университета» приводятся данные литературы и описание клинического наблюдения CHARGE-синдрома с аутосомно-доминантным типом наследования у ребенка 3 лет 7 мес.
Особенность представляемого клинического случая состоит в ранней диагностике CHARGE-синдрома.
CHARGE-синдром (OMIM 214800) обусловлен мутациями в гене CHD7 (локус 8q12.2), который кодирует ДНК-связывающий белок 7 хромодоменной геликазы (Chromodomain Helicase DNA binding protein 7). В литературе описан фенотип, вызванный мутацией в гене семафорин-3E
(SEMA3E; 608166) в хромосоме 7q21. Синдром наследуется по аутосомно-доминантному типу, чаще встречается спорадически, так как связан с мутациями, возникающими de novo. Распространенность CHARGE-синдрома в детской популяции 1 : 12 000.
Название синдрома – аббревиатура, образованная от терминов, означающих характерные аномалии развития: – «C» (coloboma) – одно- или двусторонняя колобома радужки, сетчатки, сосудистой оболочки, диска зрительного нерва с микрофтальмией или без таковой; – «H» (heart defects) – аномалии сердечно-сосудистой системы; – «A» (atresia of choanae) – одно- или двусторонняя атрезия либо стеноз хоан; – «R» (retardation of growth and development) – дефицит роста, отставание в развитии; – «G» (genital anomalies) – аномалии половых органов; – «E» (ear abnormalities and sensorineural hearing loss) – аномалии органа слуха. CHARGE-синдром характеризуется основными 6 признаками, однако еще более 20 врожденных аномалий могут встречаются в различных вариациях.
Диагноз CHARGE-синдрома ставится при наличии у пациента 4 или 3 основных и 3 второстепенных диагностических характеристик. При наличии одного или 2 основных и нескольких второстепенных признаков диагноз CHARGE-синдрома возможен. Из 4 наблюдаемых детей с редким CHARGE-синдромом приводим клинический случай.
Клиническое наблюдение
Пациент – мальчик И. 3 лет 7 мес. Из анамнеза известно, что ребенок от 2-й беременности, родился в срок с массой тела 3590 г, длиной 55 см. При рождении состояние тяжелое: асфиксия, дыхательная недостаточность III степени. С периода новорожденности ребенок наблюдается неврологом по поводу резидуального поражения ЦНС, псевдобульбарного синдрома, задержки психомоторного развития, пареза лицевого нерва справа. В связи с нарушением глотания при аспирации с 1 мес ребенок находился на зондовом питании (назогастральный зонд) до 1 года. В возрасте 13 мес у ребенка предположена тугоухость, на основании клинических проявлений генетиком предположен CHARGE-синдром. Мальчик с периода новорожденности воспитывается в психоневрологическом доме ребенка.
В 1 год 10 мес ребенок поступил в отделение оториноларингологии клиники СПбГПМУ для сурдологического обследования. При поступлении у пациента выявлена задержка психомоторного и психоречевого развития. Ходить, стоять, сидеть самостоятельно без поддержки не может. Навыков самообслуживания нет. В зондовом питании не нуждается, способен глотать измельченную пищу. Имеется асимметрия лица за счет пареза лицевого нерва справа. Поведенческие реакции на звуковые стимулы в диапазоне речевых частот нестабильные (за счет неврологической симптоматики), отмечаются при интенсивности стимула 80–100 дБ. Речевая продукция представлена гласными звуками. Реакция на обращенную речь отсутствует. Отоскопия: заушные области не изменены, при пальпации и перкуссии безболезненны. Уши гиперэластичные. Наружные слуховые проходы сужены в костных отделах, барабанные перепонки мутные, просвечивает экссудат, опознавательные пункты барабанных перепонок четко не визуализируются. Результаты сурдологического обследования: тимпанометрия справа и слева тип «В» (характерен для экссудативного отита); задержанная, вызванная отоакустическая эмиссия отсутствует слева и справа; отоакустическая эмиссия на частоте продукта искажения (ОАЭПИ) отсутствует слева и справа; коротколатентные стволовые вызванные потенциалы КСВП (CE – Chirp, воздушный телефон): справа, слева более 100 дБ нПС, слева зарегистрирован низкоамплитудный микрофонный потенциал, справа микрофонный потенциал не зарегистрирован. КСВП (CE – Chirp, костный телефон): справа, слева более 50 дБ нПС. Поведенческая аудиометрия – нестабильные реакции в диапазоне речевых частот на тональные стимулы 80–100 дБ нПС, что соответствует IV степени тугоухости (коррелируют с результатами КСВП).
Мальчику проведен курс консервативной терапии с последующим двусторонним шунтированием барабанных перепонок. В результате обследования диагностирована хроническая двусторонняя сенсоневральная тугоухость IV степени, слева по типу слуховой нейропатии. Произведено бинауральное слухопротезирование сверхмощными аппаратами заушного типа; регулярно проводятся занятия со специальным педагогом по развитию речи.
В возрасте 2 лет 1 мес ребенок обследован в специализированной нефрологической клинике СПбГПМУ. При осмотре обращают внимание выраженная асимметрия лица, задержка психоречевого развития, пониженное питание (масса тела 12,2 кг), задержка роста (84,5 см), хроническая белково-энергетическая недостаточность II степени, смешанного генеза. Рост ребенка в 3 года 7 мес 84,5 см, что соответствует 1-му центильному интервалу ребенка 2,5-летнего возраста. Отмечены сколиоз, полифалангия (удвоение ногтевой фаланги) большого пальца левой кисти. Наружные половые органы сформированы по мужскому типу, правое яичко отсутствует, выявлены генитальная гипоплазия, гипоспадия, крипторхизм, микропенис, фимоз.
По данным ультразвукового исследования, объем почек снижен. Констатирована двусторонняя гипоплазия почек. В возрасте 2 года 1 мес у ребенка скорость клубочковой фильтрации по формуле Schwartz составляла 91,4 мл/мин/1,73 м2, в возрасте 3 года 7 мес – 68,8 мл/мин/1,73 м2, что соответствует хронической болезни почек, стадии 2 (ХБП С2).
У пациента диагностирован врожденный порок сердца – открытый аортальный проток, открытое овальное окно, недостаточность кровообращения 0. По данным эхокардиографии определяются открытое овальное окно до 2 мм, открытый аортальный проток диаметром до 3,5 мм. Электрокардиография: синусовый ритм с частотой сердечных сокращений 130 в минуту, электрическая ось сердца отклонена влево, неполная блокада правой ножки пучка Гиса, синусовая брадиаритмия стоя.
При неврологическом исследовании выявлено резидуально-органическое поражение ЦНС. Диффузная мышечная гипотония. Парез n. facialis справа. Задержка психомоторного, психоречевого развития. Псевдобульбарный синдром. При офтальмологическом исследовании диагностирована колобома сосудистой оболочки и диска зрительного нерва, правостороннее сходящееся косоглазие.
Таким образом, комплексное обследование выявило у ребенка 5 основных и 2 второстепенных критерия диагностики CHARGE-синдрома со стороны органов мочевой и половой систем (двусторонняя гипоплазия почек, гипоплазия гениталий – микро-пенис, крипторхизм, фимоз); сердечно-сосудистой системы (врожденный порок сердца без гемодинамически значимых нарушений); зрительного аппарата (колобома сосудистой оболочки и диска зрительного нерва, правостороннее сходящееся косоглазие); слухового аппарата (аномалия формы ушных раковин, хроническая двусторонняя нейросенсорная тугоухость IV степени, слева по типу слуховой нейропатии, двусторонний экссудативный отит); нервной системы (резидуально-органическое поражение ЦНС, задержка психоречевого развития, парез лицевого нерва справа, асимметрия лица, диффузная мышечная гипотония, псевдобульбарный синдром); костной системы (сколиоз, полифалангия); задержка роста, хроническая белково-энергетическая недостаточность II степени.
Обсуждение
Считают, что наиболее опаснен для жизни пациентов с CHARGE-синдромом период новорожденности. Двусторонняя атрезия хоан вызывает респираторный дистресс-синдром, требующий немедленной реанимации. Односторонняя атрезия хоан может оставаться не диагностированной до тех пор, пока у ребенка не проявится постоянная односторонняя ринорея. В нашем наблюдении у мальчика в настоящее время атрезия хоан не установлена.
Аспирация и нарушения глотания у детей с CHARGE-синдромом в основном являются результатом аномалий IX/X пары черепных нервов, встречается при атрезии хоан или расщеплении неба. Кормление детей сопровождается кашлем, удушьем, носовой регургитацией, аспирированием и/или гастроэзофагеальным рефлюксом. У нашего пациента в первый год жизни отмечались трудности с кормлением и нарушения глотания, обусловленные псевдобульбарным синдромом. В настоящее время сохраняется периодический аспирационный синдром, с которым связаны проблемы с дыханием, в раннем детстве ребенок долгое время получал питание через назогастральный зонд.
Врожденные пороки сердца встречаются у 75 –85% детей с CHARGE-синдромом. У нашего пациента выявлен открытый аортальный проток без нарушения гемодинамики. Колобома определяется у 80% больных. У мальчика выявлена двухсторонняя колобома – ретинальная и диска зрительного нерва, правостороннее сходящееся косоглазие.
Потеря слуха служит наиболее характерным проявлением CHARGE-синдрома. Парез лицевого нерва сочетается с сенсоневральной потерей слуха, что отмечено в нашем наблюдении. Отсутствие или гипоплазия полукружных каналов ухудшает равновесие, способствует задержке двигательной активности детей, что не диагностировано в описываемом клиническом случае.
В 50–60% случаев пациенты имеют генитальную патологию. В нашем наблюдении у мальчика выявлены микропенис, крипторхизм, фимоз.
У 30% пациентов наблюдаются клинодактилия, полидактилия, контрактуры, брахидактилия, гипермобильность, отсутствие ребер и аномальные позвонки, сколиоз. У наблюдаемого пациента выявлены сколиоз, полифалангия большого пальца левой кисти.
При CHARGE-синдроме описаны дисплазия, гипоплазия, агенезия почек, подковообразная почка, гидронефроз уретеронефроз, пузырно-мочеточниковый рефлюкс, дивертикул мочевого пузыря, стеноз уретры с прогрессированием в хроническую болезнь почек, что определяет неблагоприятный прогноз. У представленного нами пациента установлены двусторонняя гипоплазия почек, хроническая болезнь почек стадии 2, что относится к второстепенным признакам синдрома.
Дифференциальная диагностика проводилась с синдромом делеции 22q11.2, папиллоренальным синдромом, синдромами Каллмана (Kallman), Кабукки I тип (Kabuki), Жубера II тип (Joubert) I, кошачьего глаза, брахиооторенальным (BOR), с врожденной атрезией хоан, VACTERL-ассоциацией.
Прогноз заболевания зависит от степени тяжести врожденных аномалий. Поражение органов мочевой системы при CHARGE-синдроме нередко уже в детском возрасте прогрессирует в хроническую болезнь почек.
Заключение
Представлено клиническое наблюдение пациента с CHARGE-синдромом с сочетанными аномалиями развития органов и систем, включающих 5 основных признаков и 2 второстепенных. Особенность данного клинического наблюдения состоит в отсутствии у пациента атрезии хоан.
Выпуск: Российский вестник перинатологии и педиатрии 2020; 65:(1): 116–121.
Левиашвили Ж.Г., Савенкова Н.Д., Горкина О.К., Павлов П.В., Захарова М.Л., Бреусенко Д.В.
Семейный случай гипогонадотропного гипогонадизма как проявление синдрома CHARGE
Полный текст:
Аннотация
Синдром CHARGE — это редкое аутосомно-доминантное заболевание, обусловленное патологическими изменениями в гене CHD7. Особенностью данного синдрома является выраженный клинический полиморфизм даже среди носителей идентичной мутации. Спектр клинических проявлений варьирует от изолированной задержки полового созревания без необходимости в гормональной заместительной терапии до тяжелых множественных полиорганных пороков развития, требующих мультидисциплинарного терапевтического подхода. Диагноз можно заподозрить на основании сочетания главных и второстепенных критериев, однако окончательная верификация диагноза требует молекулярно-генетического исследования. Точная диагностика необходима не только для выбора корректной тактики ведения пациента, но и для информирования пациентов относительно всех возможных клинических проявлений заболевания, включая репродуктивный потенциал и риски наследования заболевания. Наиболее частым эндокринным отклонением при синдроме CHARGE является изменение гонадотропной функции от позднего пубертата до необратимого вторичного гипогонадотропного гипогонадизма, сочетающегося с нарушением обоняния различной степени выраженности, что обусловлено особенностями экспрессии гена CHD7 в эмбриональном периоде.
В статье представлено клиническое описание семейного варианта синдрома со значимой внутрисемейной вариабельностью клинических проявлений вследствие мутации в гене CHD7.
Ключевые слова
Для цитирования:
Хабибуллина Д.А., Калинченко Н.Ю., Егорова С.В., Васильев Е.В., Петров В.М., Тюльпаков А.Н. Семейный случай гипогонадотропного гипогонадизма как проявление синдрома CHARGE. Проблемы Эндокринологии. 2021;67(3):68-72. https://doi.org/10.14341/probl12748
For citation:
Khabibullina D.A., Kalinchenko N.Yu., Egorova S.V., Vasilyev E.V., Petrov V.M., Tiulpakov A.N. Familial case of hypogonadotropic hypogonadism as the CHARGE syndrome manifestation. Problems of Endocrinology. 2021;67(3):68-72. (In Russ.) https://doi.org/10.14341/probl12748
АКТУАЛЬНОСТЬ
CHARGE-синдром (OMIM no. 214800) представляет собой редкое генетическое заболевание с аутосомно-доминантным типом наследования, в основе которого лежат мутации в гене CHD7. Частота заболеваемости колеблется от 1:12 000 до 1:15 000 новорожденных [1][2].
Термин «CHARGE» — это аббревиатура, описывающая совокупность наиболее часто встречающихся клинических признаков, включающая колобому (Сoloboma), пороки сердца (Heart defects), атрезию/стеноз хоан (Сhoanal atresia), задержку роста и/или развития (Retardation of growth and/or development), пороки развития мочеполовой системы (Genitourinary Malformation) и аномалии развития уха (Ear abnormalities).
Первые клинические описания встречаются в литературе с 1979 г., когда Hitter и соавт. и Hall независимо друг от друга описали фенотипические особенности, присущие синдрому. В 1981 г. Pagon et al. [3] предложили объединить основные клинические проявления в аббревиатуру. В настоящий момент синдром CHARGE считается клиническим диагнозом, основанным на сочетании главных и второстепенных критериев, предложенных Blake и соавт. в 1998 г., а чуть позже расширенных и модифицированных Verloes и соавт. в 2005 г. [4]. Авторами также предложено выделять типичные/атипичные и парциальные формы синдрома (табл. 1).
Таблица 1. Диагностические критерии синдрома CHARGE
Критерии Blake (1998)
Критерии Verloes (2005)
Модифицированные критерии Hale et al. (2016)
Диагноз сомнений не вызывает: 4 больших критерия
или 3 больших + 3 малых (второстепенных).
Диагноз возможен: 1–2 больших критерия и несколько второстепенных
Типичная форма: 3 больших критерия
или 2 больших + 2 малых.
Атипичная форма: 2 больших критерия при отсутствии малых или 1 большой + 2 малых.
Парциальная форма:
2 больших + 1 малый
CHARGE: 2 больших + несколько малых
БОЛЬШИЕ КРИТЕРИИ
•Гипо- или аплазия полуокружных каналов внутреннего уха.
•Дисфункция черепных нервов (преимущественно VII и VIII пары)
•Гипо- или аплазия полуокружных каналов внутреннего уха
•Аномалии уха, включая гипо- или аплазию полуокружных каналов.
•Патогенные варианты гена CHD7
МАЛЫЕ КРИТЕРИИ
•Гипоплазия половых органов.
•Пороки лицевого черепа.
•Дисфункция ромбоэнцефалических структур мозга (ствол/ черепные нервы).
•Дисфункция гипоталамо-гипофизарной оси.
•Мальформации внутреннего/наружного уха.
•Аномалии внутренних органов (сердце, пищевод).
•Дисфункция черепных нервов.
•Структурные аномалии головного мозга.
•Задержка развития/ расстройства интеллекта.
•Дисфункция гипоталамо-гипофизарной оси.
•Аномалии половых и внутренних органов (сердце, пищевод, почки)
В 2004 г. Vissers L.E. и соавт. [5] идентифицировали у пациентов с синдромом CHARGE патологические изменения в гетерозиготном состоянии в гене CHD7 (OMIM no. 608892), установив, таким образом, молекулярно-генетическую основу заболевания.
Благодаря возможности молекулярно-генетической верификации диагноза в литературе все чаще появляются описания синдрома CHARGE, ассоциированного с мутациями в гене CHD7, но без полной клинической картины заболевания, или так называемые атипичные мягкие фенотипы. Более того, отмечена значительная фенотипическая вариабельность даже среди членов одной семьи, имеющих одну и ту же патологическую замену. В связи с чем, учитывая аутосомно-доминантный тип наследования, наличие патогенного варианта CHD7 у членов одной семьи в сочетании с одним из больших диагностических критериев рекомендовано считать достаточным для подтверждения синдрома CHARGE, что позволяет поставить диагноз пациентам с атипичной или парциальной формой патологии [1][5].
В отечественной литературе описания синдрома CHARGE встречаются крайне редко, с преимущественным акцентом на тактику своевременных хирургических и терапевтических методов лечения врожденных пороков развития, начиная с раннего неонатального периода [6][7].
В статье представлено клиническое описание семейного варианта синдрома со значимой внутрисемейной вариабельностью клинических проявлений — от мягкой формы, характеризующейся изолированным нарушением полового созревания, до типичной формы с полным спектром клинических проявлений в результате дефекта гена CHD7.
ОПИСАНИЕ СЛУЧАЯ
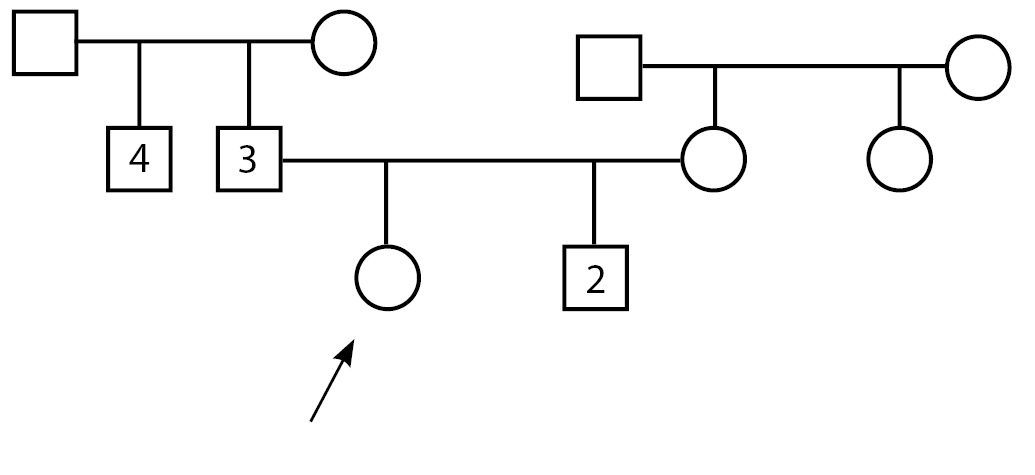
Пациентка А. впервые поступила в детское отделение ФГБУ «НМИЦ эндокринологии» Минздрава России в возрасте 14 лет с жалобами на задержку полового развития, низкие темпы роста, аносмию. По месту жительства проведено кариотипирование — кариотип 46,XX. Ребенок от 2-й нормально протекавшей беременности, 2-х самостоятельных срочных родов. При рождении длина тела 54 см, вес 3270 г. Из анамнеза известно, что брак родителей не близкородственный, наследственность отягощена: у отца — гипоосмия, задержка полового развития в анамнезе (в возрасте 25 лет получал терапию хорионическим гонадотропином (ХГЧ) и 3-месячный курс заместительной терапии препаратами эфиров тестостерона, после чего отмечено начало самостоятельного полового созревания), конечный рост — 180 см. У дяди по отцовской линии — два бесплодных брака. У родного брата пробанда — врожденная колобома, левосторонняя микрофтальмия, подковообразная почка, в возрасте 14 лет получал комбинированное лечение по поводу герминомы левого яичка, с 17 лет — гормональная заместительная терапия препаратами эфиров тестостерона. Мать — рост 160 см, менархе в 12,5 года (рис. 1). С рождения пациентка наблюдается в МНТК «Микрохирургия глаза» по поводу хориоретинальной центральной колобомы глаза, захватывающей диск зрительного нерва (ДЗН), врожденного микрофтальма правого глаза.
Рисунок 1.
Примечание: у родного брата пробанда (2) — врожденная колобома, левосторонняя микрофтальмия, подковообразная почка, в анамнезе комбинированное лечение по поводу герминомы левого яичка, с 17 лет — гормональная заместительная терапия препаратами эфира тестостерона; у отца (3) — гипоосмия, задержка полового развития в анамнезе; у дяди по отцовской линии (4) — два бесплодных брака (не обследован).
В гормональном профиле отмечались допубертатные базальные значения половых гормонов: лютеинизирующий гормон (ЛГ) — 0,2 Ед/л (2,6–12,1), фолликулостимулирующий гормон (ФСГ) — 0,66 Ед/л (1,9–11,7), эстрадиол — 53,4 пмоль/л (97–592), антимюллеров гормон (АМГ) — 2,8 нг/мл (0,1–9,85), ингибин В — 18,7 пг/мл (0–273), пролактин — 73,6 мЕд/л. Для уточнения характера задержки полового развития проведена проба с аналогом гонадотропин-рилизинг-гормона (ГнРГ), по результатам которой максимальный выброс ЛГ составил 0,9 Ед/л, что свидетельствует в пользу вторичного генеза гипогонадизма (табл. 2). Однако, учитывая семейный анамнез, не исключено более позднее начало самостоятельного полового развития.
Таблица 2. Гормональный профиль пациентки до пробы с аналогом гонадотропин-рилизинг-гормона и по ее результатам
ЛГ, Ед/л
ФСГ, Ед/л
УЗИ органов малого таза: размеры матки и яичников соответствовали возрастной группе 2–7 лет. На рентгенограмме кистей отмечалась значимая задержка костного возраста (КВ соответствовал 11,5 годам по атласу TW20). При проведении МРТ головного мозга выявлены гипоплазия обонятельной луковицы справа и аплазия обонятельной луковицы слева. Учитывая отягощенный семейный анамнез по задержке полового развития, проведено молекулярно-генетическое исследование — секвенирование нового поколения с использованием панели «Гипогонадотропный гипогонадизм», где было выявлено наличие гетерозиготного варианта c.6193C>T:p.R2065C в гене CHD7 (NM_017780.4), описанного ранее в литературе при синдроме Кальмана (СК) [6]. Аналогичная замена обнаружена у отца и брата пробанда. На основании клинической картины, данных наследственного анамнеза, низких базальных показателей гонадотропинов и эстрадиола, данных пробы с аналогом ГнРГ в сочетании с аносмией и гипоплазией обонятельных луковиц по данным МРТ установлен диагноз: CHARGE-синдром: колобома, аносмия, гипогонадотропный гипогонадизм. В связи с чем был проведен скрининг на наличие других возможных компонентов заболевания: данных за наличие патологии сердца, органов мочевыделительной системы, хоан, органа слуха не получено.
Учитывая значимое отставание костного возраста, а также наличие генетически подтвержденного заболевания, с целью улучшения ростового прогноза и социальной адаптации пациентке была рекомендована заместительная гормональная терапия препаратами эстрадиола гемигидрата в минимальных стартовых дозах.
ОБСУЖДЕНИЕ
CHARGE-синдром — патологическое состояние, обусловленное мутациями гена CHD7 (Chromodomain Helicase DNA binding protein 7), также известного как ДНК-связывающий белок 7 хромодоменной хеликазы. Ген локализован на длинном плече 8-й хромосомы (8q12) и состоит из 38 экзонов, первый из которых является некодирующим.
В течение первых 22 дней эмбрионального развития CHD7 экспрессируется повсеместно, регулируя транскрипцию ряда тканеспецифичных генов-мишеней, эффекты которых зависят от типа ткани и стадии развития. Поскольку максимальная экспрессия гена отмечена в недифференцированном нейроэпителии и мезенхиме нервного гребня, многие особенности синдрома можно отнести к нарушению процесса миграции клеток последнего [8].
На сегодняшний день описано более 500 патогенных вариантов CHD7. Наиболее распространенными являются нонсенс-мутации, вторыми по частоте — мутации со сдвигом рамки считывания, значительно реже встречаются сплайсинг-мутации. Миссенс-мутации чаще выявляются при изолированном варианте гипогонадотропного гипогонадизма и ассоциированы с более мягкими фенотипами [9]. При сдвиге рамки считывания или нонсенс-мутациях, приводящих к формированию функционально неактивного или аномального белка, чаще отмечается более тяжелое течение заболевания с вовлечением в патологический процесс более чем одного органа. Однако точной корреляции между типом мутации и степенью выраженности клинических проявлений сопутствующих дефектов даже среди пациентов с идентичными мутациями не отмечено [2][10–12].
Наиболее частой эндокринной аномалией, обнаруживаемой при синдроме CHARGE, является гипогонадотропный гипогонадизм (60–80% случаев). Клинические проявления изменений гонадотропной функции могут варьировать от позднего пубертата до стойкого вторичного гипогонадизма. У мальчиков гипогонадизм может быть заподозрен при наличии микропениса при рождении, чаще в сочетании с крипторхизмом. У девочек диагноз может быть заподозрен только в период пубертата, при отсутствии спонтанного полового созревания.
Частое сочетание гипогонадотропного гипогонадизма и аносмии, обусловленное нарушением миграции нейронов ГнРГ, является хорошо известным признаком СК. Поскольку CHD7 участвует в регуляции экспрессии генов во время эмбрионального развития, не исключено его влияние на действие или экспрессию ANOS1, FGFR1, FGF8, PROK2 и PROKR2 — генов, патологические изменения которых сопряжены с клиническими проявлениями СК. Поскольку СК является одним из фенотипов, наблюдаемых при CHARGE, авторы рекомендуют проводить скрининг CHD7 у пациентов с гипогонадизмом и аносмией, диагноз которых не был подтвержден молекулярно-генетически [8][9][13].
К настоящему моменту в литературе имеется упоминание двух случаев гипогонадотропного гипогонадизма, обусловленного гетерозиготным вариантом c.6193C>T:p.R2065C в гене CHD7 (NM_017780.4). У обоих описанных пациентов отсутствовал полный фенотип синдрома CHARGE. В обоих случаях представлены описания задержки полового развития с нарушением обоняния разной степени выраженности, в сочетании с фенотипическими особенностями, ассоциированными с атипичной и парциальной формой синдрома CHARGE (врожденный порок сердца, лицевого скелета и слуха), а также с упоминаниями о задержке полового развития у членов семьи пробандов. Таким образом, патогенность мутации не вызывает сомнений, подтверждая при этом литературные данные о значимом полиморфизме клинических проявлений [9][14].
ЗАКЛЮЧЕНИЕ
Молекулярно-генетическое подтверждение диагноза важно для генетического консультирования и информирования пациентов относительно всех возможных клинических проявлений заболевания, в частности о потенциальных репродуктивных возможностях (в ряде случаев возможна более поздняя самостоятельная активация гипоталамо-гипофизарной оси, что не требует гормональной заместительной терапии или ее кратковременного назначения), а также рисках передачи заболевания своему потомству.
Список литературы
1. Hale CL, Niederriter AN, Green GE, Martin DM. Atypical phenotypes associated with pathogenic CHD7 variants and a proposal for broadening CHARGE syndrome clinical diagnostic criteria. Am J Med Genet Part A. 2016;170(2):344-354. doi: https://doi.org/10.1002/ajmg.a.37435
2. Chetty M, Roberts TS, Elmubarak M, et al. CHARGE syndrome: genetic aspects and dental challenges, a review and case presentation. Head Face Med. 2020;16(1):10. doi: https://doi.org/10.1186/s13005-020-00224-4
3. Pagon RA, Graham JM, Zonana J, Yong S-L. Coloboma, congenital heart disease, and choanal atresia with multiple anomalies: CHARGE association. J Pediatr. 1981;99(2):223-227. doi: https://doi.org/10.1016/S0022-3476(81)80454-4
4. Verloes A. Updated diagnostic criteria for CHARGE syndrome: A proposal. Am J Med Genet Part A. 2005;133A (3):306-308. doi: https://doi.org/10.1002/ajmg.a.30559
5. Vissers LELM, van Ravenswaaij CMA, Admiraal R, et al. Mutations in a new member of the chromodomain gene family cause CHARGE syndrome. Nat Genet. 2004;36(9):955-957. doi: https://doi.org/10.1038/ng1407
6. Leviashvili JG, Savenkova ND, Gorkina OK, et al. CHARGE syndrome. Ross Vestn Perinatol i Pediatr (Russian Bull Perinatol Pediatr). 2020;65(1):116-121. doi: https://doi.org/10.21508/1027-4065-2020-65-1-116-121
7. Garbaruk ES, Nnomzoo AA, Pavlov PV, Gorkina OC. Algorithm of hearing monitoring of children with congenital heart disease. Pediatr (St Petersburg). 2019;10(2):129-135. doi: https://doi.org/10.17816/PED102129-135
8. Balasubramanian R, Crowley WF. Reproductive endocrine phenotypes relating to CHD7 mutations in humans. Am J Med Genet Part C Semin Med Genet. 2017;175(4):507-515. doi: https://doi.org/10.1002/ajmg.c.31585
9. Marcos S, Sarfati J, Leroy C, et al. The Prevalence of CHD7 Missense Versus Truncating Mutations Is Higher in Patients With Kallmann Syndrome Than in Typical CHARGE Patients. J Clin Endocrinol Metab. 2014;99(10): E2138-E2143. doi: https://doi.org/10.1210/jc.2014-2110
10. Basson MA, van Ravenswaaij-Arts C. Functional Insights into Chromatin Remodelling from Studies on CHARGE Syndrome. Trends Genet. 2015;31(10):600-611. doi: https://doi.org/10.1016/j.tig.2015.05.009
11. Dijk DR, Bocca G, van Ravenswaaij-Arts CM. Growth in CHARGE syndrome: optimizing care with a multidisciplinary approach. J Multidiscip Healthc. 2019; 12: 607-620. doi: https://doi.org/10.2147/JMDH.S175713
12. Moccia A, Srivastava A, Skidmore JM, et al. Genetic analysis of CHARGE syndrome identifies overlapping molecular biology. Genet Med. 2018;20(9):1022-1029. doi: https://doi.org/10.1038/gim.2017.233
13. Lee YL, Toh L, Yap F. Delayed puberty and anosmia in charge syndrome: A case report. J ASEAN Fed Endocr Soc. 2020;35(1):122-124. doi: https://doi.org/10.15605/jafes.035.01.21
14. Izumi Y, Suzuki E, Kanzaki S, et al. Genome-wide copy number analysis and systematic mutation screening in 58 patients with hypogonadotropic hypogonadism. Fertil Steril. 2014;102(4):1130-1136. doi: https://doi.org/10.1016/j.fertnstert.2014.06.017
Об авторах
Хабибуллина Дина Альбертовна.
117036, Москва, ул. Дм. Ульянова, д. 11.
eLibrary SPIN: 1303-9678
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием и публикацией настоящей статьи.
117036, Москва, ул. Дм. Ульянова, д. 11.
eLibrary SPIN: 6727-9653
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием и публикацией настоящей статьи.
Егорова Светлана Викторовна.
eLibrary SPIN: 9027-8178
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием и публикацией настоящей статьи.
117036, Москва, ул. Дм. Ульянова, д. 11.
eLibrary SPIN: 5767-1569
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием и публикацией настоящей статьи.
117036, Москва, ул. Дм. Ульянова, д. 11.
eLibrary SPIN: 4358-2147
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием и публикацией настоящей статьи.
eLibrary SPIN: 8396-1798
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием и публикацией настоящей статьи.