Высокое давление при химиотерапии что делать
Гипертония и рак
В последние годы в связи с развитием современных методов лечения онкологических заболеваний растет количество пациентов, которые успешно лечатся или вылечились, увеличивается и продолжительность жизни онкологических больных. В то же время это приводит и к росту сердечно-сосудистых заболеваний, которые развиваются как во время, так и после лечения рака.
По статистике, частота сердечно-сосудистых заболеваний у онкопациентов, которые ранее получали какой-либо вид противоопухолевой терапии, значительно выше, чем у неонкологических пациентов.
У онкологических и сердечно-сосудистых заболеваний есть общие факторы риска: курение, сахарный диабет, ожирение. На фоне онкологического заболевания могут появиться заболевания почек, артериальная гипертензия, которая также опосредованно, через заболевание почек, может приводить к развитию или прогрессированию уже существующих сердечно-сосудистых заболеваний.
Заболевания, характеризующиеся повышением артериального давления
Заболевания, характеризующиеся повышением артериального давления, разделяют на две группы:
Существуют различные нейроэндокринные опухоли, которые также выбрасывают в кровь вазоактивные катехоламины, повышающие артериальное давление.
При адренокортикальном раке опухоль продуцирует вазоактивные глюкокортикостероиды и альдостерон.
В общем, артериальная гипертензия – наиболее многочисленная группа осложнений. Она составляет 1/3 всех кардиоваскулярных осложнений у пациентов, которые получают противоопухолевое лечение. Также существуют данные, что при первичном раке почки артериальная гипертензия может встречаться у более 70 % пациентов.
Виды противоопухолевого лечения, вызывающие повышение артериального давления
Все эти виды лечения, как в совокупности, так и по отдельности, могут вызывать артериальную гипертензию и дестабилизацию имеющейся первичной гипертонической болезни.
Наиболее часто артериальную гипертензию вызывают ингибиторы тирозинкиназ или ингибиторы фактора роста сосудистого эндотелия.
Механизм возникновения артериальной гипертензии в этом случае состоит из следующих процессов:
Что необходимо сделать до начала терапии ингибиторами VEGE?
На основе результатов этих базовых исследований врач определит профиль риска пациента.
Как часто нужно контролировать артериальное давление во время терапии ингибиторами фактора роста сосудистого эндотелия?
Согласно современным представлениям, в течение первого цикла терапии артериальное давление необходимо контролировать ежедневно. Если по окончании первого цикла терапии давление остается на целевом уровне, то измерение можно проводить каждые 2–3 недели. Важно учитывать, что изменения в антигипертензивной медикаментозной терапии лучше производить в перерывах между циклами противоопухолевой терапии.
Как правильно измерять артериальное давление?
Измерение артериального давления – это основной показатель, который важен для правильного подбора терапии и ее изменения.
Какие целевые уровни измерения артериального давления?
Целевые уровни измерения артериального давления отличаются в зависимости от того, какой способ измерения используется.
Офисное артериальное давление (которое измеряется на приеме у врача) – границей гипертензии является уровень более 140 и 90 мм рт. ст. Если используется суточное мониторирование артериального давления, то днем градация составляет – 135 и 85 мм рт. ст., ночью – 120 и 70 мм рт. ст. Если артериальное давление измеряется самим пациентом в домашних условиях, то здесь уровень целевой уровень – 135 и 85 мм рт. ст.
При каком уровне артериального давления необходимо начинать лечение артериальной гипертензии?
Существует много классификаций степеней артериальной гипертензии, различных градаций, но существует один уровень, ниже которого рекомендуется поддерживать артериальное давление – это менее 140 и 90 мм рт. ст. К таким показателям и необходимо стремиться.
Лечебная тактика при артериальной гипертензии
Лечебная тактика при артериальной гипертензии состоит из двух блоков:
Существуют две цели, которые необходимо достигать путем снижения артериального давления:
Целью является уровень менее 140 и 90 мм ртутного столба, в идеале – менее 120 и 80 мм ртутного столба, если это достижимо.
Какие препараты используются для лечения артериальной гипертензии, индуцированной факторами роста сосудистого эндотелия?
Препараты первой линии – ингибиторы ангиотензин-превращающего фермента. Это достаточно распространенные препараты – энелаприл, лизиноприл, рамиприл, периндоприл, фозиноприл. Это блокаторы рецепторов ангиотензина 2 типа – валсартан, лозартан, телмисартан. Антагонисты кальция – амплодипин, фелодипин, диуретики и бета-блокаторы.
Стратегия медикаментозной терапии артериальной гипертензии
В начале лечения необходимо использовать комбинированную терапию. Препаратами первой линии являются комбинации ингибиторов ангиотензин- превращающего фермента или блокатора к рецепторам ангиотензина 2 типа с блокаторами кальциевых каналов.
Если такая комбинированная терапия не позволяет достичь удовлетворительного уровня артериального давления, то рекомендуется переходить к добавлению диуретиков. Если и такая терапия не имеет успеха, то рекомендуется добавлять спиронолактон или пробовать другие диуретеки, также возможно использование альфа-блокаторов, бета-адреноблокаторов.
Когда все-таки необходимо отменять терапию ингибиторами фактора роста сосудистого эндотелия?
Иногда пациентов волнует вопрос, не снижает ли антигипертензивная терапия эффективность противоопухолевой терапии. На настоящий момент нет ни одного доказательства, которое бы об этом свидетельствовало.
Заключение
Онкологические пациенты имеют более высокий риск развития артериальной гипертензии.
Артериальная гипертензия приводит к увеличению риска развития серьезных сердечно-сосудистых заболеваний: инфаркт, инсульт, сердечная недостаточность.
Важен контроль за измерением артериального давления.
Выбор антигипертензивных препаратов следует проводить с учетом индивидуальных особенностей пациента и проводимого противоопухолевого лечения.
Список литературы
Авторская публикация:
Козявин Никита Александрович
Заведующий Консультативно-диагностическим центром ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, врач-онколог, кардиолог, терапевт
Правила проведения химиотерапии: что нужно знать пациенту
Лекарственную противоопухолевую терапию получают практически все пациенты, болеющие злокачественными новообразованиями. Особенностью этого лечения является его длительность и повторяемость. Отдельные курсы введения препарата проводятся на протяжении нескольких лет, иногда в течение всей жизни больного. Какие правила необходимо соблюдать при получении этого вида лечения, чтобы сохранить качество жизни, рассказала кандидат медицинских наук Елена Викторовна Ткаченко – онколог, химиотерапевт, заведующая отделением краткосрочной химиотерапии НМИЦ онкологии имени Н.Н. Петрова.
– Елена Викторовна, когда применяют химиотерапевтическое лечение?
– Химиотерапию применяют на разных стадиях онкологического заболевания: на начальной стадии проводят предоперационную (неоадъювантную) и послеоперационную (адъювантную) терапию, также на более поздних стадиях, когда оперативное вмешательство по каким-то причинам уже невозможно. Противоопухолевая лекарственная терапия проводится и тогда, когда заболевание вернулось после радикального лечения. Поэтому многие наши пациенты получают это лечение и месяцы, и годы. И в этом нет ничего страшного или удивительного. Например, пациенты с сахарным диабетом, гипертонической или ишемической болезнями постоянно соблюдают определенные условия жизни и принимают специальные препараты. Так и онкологическое заболевание является хроническим, и, к сожалению, нередко даже после завершения лечения, через некоторое время вновь приходится его возобновлять.
– Какие побочные действия у химиотерапии?
– Побочные действия свойственны всем видам противоопухолевого лечения, даже если оно проводится по современным стандартам. Это связано с механизмом действия противоопухолевых препаратов. Осложнения бывают четырех степеней: побочные эффекты первой и второй степени больше тревожат самих пациентов, но врачи к ним относятся спокойно, потому что эти осложнения часто неизбежны и угрозы для жизни не представляют. В основном это изменения самочувствия пациента и лабораторных показателей, нетребующие лечения, например, выпадение волос или некоторое снижение лейкоцитов по результатам анализов. К третьей и четвертой степеням относятся так называемые жизнеугрожающие осложнения, они требуют серьезного внимания со стороны лечащего врача.
– Лекарственное противоопухолевое лечение пациент в основном получает через вену. Есть ли способы подготовить вены, чтобы избежать возможных побочных эффектов?
– Да, существует ряд рекомендаций, выполняя которые пациент может научиться тренировать свои вены перед введением препаратов.
– Какие побочные эффекты от введения препаратов бывают?
– При внутривенном введении цитостатиков нередко развиваются воспалительно– склеротические реакции со стороны вен. Они проявляются разнообразно: от выраженной боли по ходу сосудов уже во время инъекции до подострых флебитов, тромбофлебитов, флеботромбозов с исходом в облитерацию вен, иначе говоря, зарастание вены. При длительном введении фторурацила стенки сосудов пропитываются препаратом. Этот побочный эффект возникает практически в 100% случаев при применении некоторых препаратов. Зуд и эритема кожи по ходу вены во время введения цитостатиков отмечаются примерно в 3% инфузий, они проходят в течение 30 минут без осложнений и не свидетельствуют о подтекании препарата. Попадание под кожу раздражающих препаратов (цисплатин, дакарбазин, этопозид, фторурацил, паклитаксел, винорельбин) может вызвать жгучую боль и покраснение в месте инъекции, но если принять правильные меры, то к некрозу это не приведет.
– Существуют способы избежать осложнений или их облегчить?
– Медицинский персонал знает, как профилактировать осложнения со стороны вен. Полезно это знать и пациентам. Дело в том, что инъекции растворов цитостатиков вводятся только в минимально допустимых концентрациях. Капельные инфузии с большим количеством жидкости служат лучшим способом предупреждения повреждений стенки вен (только в случаях, когда это рекомендовано как способ введения цитостатика). Если препарат необходимо вводить струйно, то его разводят в 20-30 мл рекомендуемого растворителя, а после инъекции промывают вены изотоническим раствором NaCl. При попадании некоторых препаратов под кожу возникает гиперемия, воспаление. В трети случаев может возникнуть некроз, который без вмешательства не заживет. В этом случае необходимо обратиться за хирургической помощью.
– Что нужно делать, если химиопрепарат всё-таки попал под кожу?
– Подачу препарата необходимо остановить, но иглу или катетер вытаскивать из вены не нужно, через них медсестра извлечет попавший под кожу препарат. Для некоторых химиопрепаратов существуют антидоты (противоядия), но, к сожалению, есть они не для всех препаратов. Антидотом медсестра обколет место инъекции, а затем уже удалит из вены иглу или катетер. Пораженной конечности следует придать приподнятое положение на 48 часов, чтобы уменьшить риск воспаления и отека. Для этого достаточно закрепить руку в согнутом положении с помощью перевязки или косынки.
При попадании под кожу таких препаратов как винкристин, винбластин, винорельбин, этопозид прикладывают теплый компресс на 15-20 минут не менее четырех раз в сутки в течение 24- 48 часов. При воспалительной реакции возможна аппликация гидрокортизоновой мази.
Если развился флебит (т.е. воспаление вены), то он лечится по таким же принципам, как и обычные флебиты вне химических ожогов: применяются низкомолекулярные гепарины, антикоагулянты непрямого действия, антиагреганты.
– Почему лекарственное противоопухолевое лечение можно получать только в специализированных клиниках?
– Дело в том, что у каждого препарата свой срок и скорость введения, и для дробного и длительного введения применяется специальное оборудование. Именно поэтому ни в коем случае нельзя капать химиотерапию дома или в поликлинике, где не знают, что такое противоопухолевая лекарственная терапия. Давно уже, по крайней мере, в Санкт-Петербурге, комитетом по здравоохранению врачам, медсестрам запрещено капать противоопухолевые препараты на дому после смерти нескольких пациентов. Вы можете проводить химиотерапию только в специализированной клинике, где можно быть уверенным, что врач и медсестра понимают, что делают. Препараты должны определенным образом разводиться, капаться, храниться, их нельзя смешивать. Есть только пара препаратов, которые смешивают в одном флаконе. Все остальные должны капаться поочередно, да еще и между препаратами необходимо промывать систему физраствором. Каждый препарат должен разводиться определенным раствором: глюкозой, раствором Рингера, водой для инъекций или физраствором. Это сложная наука.
– Какое оборудование для введения препаратов сегодня используется?
– Существует несколько типов медицинского оборудования для длительного и дробного введения препаратов. Например, перфузоры – это устройства, позволяющие вводить медикаментозные препараты и растворы с исключительно высокой точностью. Порой счёт идет на десятые доли миллилитров в час (особенно часто это применяется в отделении реанимации, где скорости введения медикаментов, как правило, 1 мл/час, 5.6 мл/час и т.д.). Перфузоры могут быть механическими или электронными. Они имеют несколько названий: инфузоматы, линеаматы, шприцевые насосы, шприцевые дозаторы и др. Есть микроинфузионная помпа (инфузор) – безопасное и эффективное медицинское изделие, предназначенное для длительного, дозированного, контролируемого введения лекарственных препаратов, используемых в медикаментозной терапии (в том числе и химиотерапии). Как правило, такие помпы называют инфузор или инфузомат. Так же можно встретить названия: шприцевой насос, дозатор медицинский, инфузионный насос и др.
При использовании микроинфузионной помпы обеспечивается постепенное поступление препарата в организм за счет механизма сокращения резервуара и трубки инфузора.
– Какие правила введения противоопухолевых препаратов должен знать пациент?
– Введение противоопухолевых препаратов должно выполняться только в отделениях, специализирующихся на цитотоксической химиотерапии исключительно под наблюдением компетентного врача. Этот метод лечения требует специальной подготовки, тщательности при приготовлении растворов препаратов и соблюдения всех правил их введения, указанных в инструкциях. Поэтому к выполнению работ с цитостатиками должны допускаться медицинские сестры, прошедшие специальную подготовку, обученные безопасным методам и приемам работы. Также необходимо соблюдать последовательность и скорость введения препаратов, учитывать химические свойства при использовании оборудования для их введения. Соблюдать правила и сроки хранения препаратов как в аптечной упаковке, так и после их приготовления. Ни в коем случае нельзя смешивать препараты «в одном флаконе», если в инструкции по применению данных препаратов нет для этого особых указаний. Необходимо знать и соблюдать все условия хранения препарата и его транспортировки, если он приобретается и доставляется в клинику самим пациентом. Это очень важно. Потому что многие пациенты говорят: «Я куплю, привезу, а вы мне прокапайте!» Если вы купите, например, герцептин в аптеке и привезете его к нам не в холодильнике, а в обычной упаковке, что мы получим? В лучшем случае – воду. В случае личного приобретения препаратов уточните правила хранения и транспортировки у своего врача.
– Какие способы внутривенной доставки препаратов сегодня используются?
– На сегодняшний день существует несколько способов: через иглу, переферический венозный катетер, центральный венозный катетер и имплантируемый порт. Вы знаете, когда я начала работать в медицине, мы работали еще многоразовыми иглами. Они были тупые, поэтому могли долго стоять в вене. А как только появились одноразовые иглы, стали возникать сложности. Они же острые, чуть пациент шевельнулся, она прокалывает вену моментально. Поэтому если необходимо вводить препарат долго, то делать это лучше через переферический венозный катетер. Если его устанавливать в асептических условиях, правильно ухаживать, то до 10 дней им можно пользоваться.
Для более длительного венозного доступа используют центральный венозный катетер, особенно в тех случаях, когда необходимо обеспечить полное парентеральное питание у хронических больных. Край центрального венозного катетера вводится в пустотелую вену. У этих катетеров много преимуществ. Но неправильный уход за ними может привести и к серьезным осложнениям. Поскольку если возникнет воспаление, то оно будет не местным, а общим. Поэтому центральный венозный катетер требует профессионального использования и тщательного ухода.
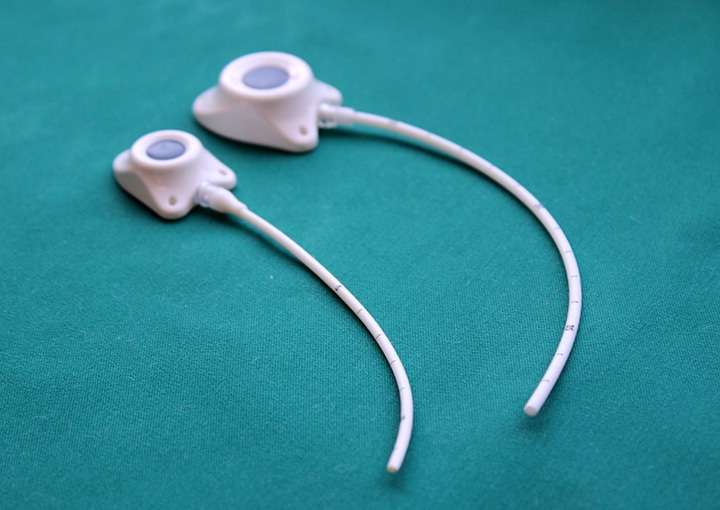
Еще существует порт-система. Это инвазионный порт, который представляет собой титановый резервуар в виде толстой монеты диаметром около 4-4,5 см и толщиной около 1 см, который покрыт изнутри биоинертным полимером. На верхней плоской части установлена мембрана из многослойного силикона, через которую вводят лекарственные препараты. Порт имеет тонкую трубочку-катетер длиной до 10-15 см, которая пропускается в яремную вену и реже в артерию.
Показания к применению порт-системы:
Есть свои противопоказания, но они все относительны, и доктора сами принимают решение, учитывать их или нет.
– Какие очевидные преимущества у порт-системы?
– Их много. Главное, что человек может вести привычный образ жизни. Венозный порт имплантируется под кожу пациента, он не виден снаружи, поэтому не может быть задет одеждой, инфицироваться при приеме ванны, «выскочить» из вены. Люди с установленными портами могут заниматься спортом, выполнять физическую нагрузку, плавать, путешествовать, отдыхать заграницей и т.д. Им можно проходить МРТ и КТ исследования, он совместим с магнитным полем. При правильной эксплуатации порт-система может работать 5-7 лет. Существуют наблюдения, что если за порт-системой правильно ухаживать, то фактически она может использоваться пожизненно. В некоторых странах установка порт-системы является неотъемлемой частью «золотого стандарта» лечения. В Западной Европе порты широко применяются у пациентов с впервые выявленным онкологическим заболеванием, которым планируется проведение множественных сеансов химиотерапии, особенно цитостастическими препаратами, которые вызывают повреждение периферических вен. Кроме того, инфузионные порты устанавливаются пациентам с тонкими периферическими венами на верхних и нижних конечностях. В отечественной онкологической практике порты пока используются редко.
– Как происходит установка инфузионного порта?
– Процедура имплантации порта проводится под местной анестезией и абсолютно безболезненна. Порт, как правило, имплантируется в правую подключичную область, хотя место может быть любым, главное, чтобы рядом была проходимая вена. Процедура занимает от 10 до 30 минут и не требует длительной госпитализации. Пациент находится в стационаре около часа после установки, а потом самостоятельно может ехать домой. Врач предоставляет ему необходимую информацию о правилах поведения после операции и о лекарствах, которые необходимо принимать в течение нескольких дней после процедуры.
– Как ухаживать за порт-системой?
– О каких «сигналах тревоги» должен знать пациент с установленным портом?
– Надо понимать, что при использовании порт-системы бывают и осложнения. Пациент должен насторожиться и обратиться к врачу в случае:
Источники
Материал подготовила:
НАТАЛЬЯ СУББОТИНА
специалист по связям с общественностью
НМИЦ онкологии им Н.Н. Петрова,
Кемеровский государственный университет, факультет филологии и журналистики, отделение журналистики
Материал подготовила:
ЮЛИЯ КОБЛЯКОВА
специалист по связям с общественностью
НМИЦ онкологии им Н.Н. Петрова,
Санкт-Петербургский политехнический университет Петра Великого
Кафедра рекламы и связей с общественностью
Противоопухолевая терапия: как защитить сердечно-сосудистую систему
Успехи в разработке новых методов лечения рака не только привели к улучшению выживаемости больных с онкологическими заболеваниями, но и повысили заболеваемость и смертность вследствие побочных эффектов.
Кардиоваскулярные осложнения относятся к наиболее частым из них, что, в свою очередь, привело к существенному увеличению внимания к данной проблеме.
Основными и наиболее значимыми сердечно-сосудистыми осложнениями являются:
Дисфункция миокарда и сердечная недостаточность
Дисфункция миокарда относится к наиболее серьезным сердечно-сосудистым осложнениям системного противоопухолевого лечения. Она связана с поражением миокарда и снижением его систолической (сократительной) функции, которое может привести к возникновению сердечной недостаточности.
При возникновении дисфункции миокарда для понимания дальнейшей тактики важно знать, какие препараты для системного противоопухолевого лечения, используемые в настоящее время, вызывают дисфункцию миокарда.
Основные препараты, вызывающие дисфункцию миокарда и сердечную недостаточность:
Существуют данные о частоте встречаемости дисфункции миокарда при использовании различных противоопухолевых препаратов. Здесь стоит отметить, что у антрациклинов имеется четкий дозозависимый эффект, и частота развития дисфункции миокарда, сердечной недостаточности увеличивается с увеличением дозы препарата. К сожалению, такие данные существуют не для всех противоопухолевых препаратов, но основные, наиболее часто используемые, имеют данную статистику.
Частота возникновения дисфункции миокарда и сердечной недостаточности
Лекарственный препарат
Частота возникновения (%)
Доксорубицин (Адриабластин)
Эпирубицин (>900 мг/м2)
Циклофосфамид (Эндоксан, Циклофосфан)
Доцетаксел (Таксотер)
Что необходимо предпринять до начала противоопухолевого лечения?
До того как станет понятно, что будет проводиться противоопухолевое потенциально кардиотоксичное лечение, необходимо провести оценку состояния сердечно-сосудистой системы пациента:
При обращении к врачу необходимо сообщить, какие методы противоопухолевого лечения использовались ранее – как лекарственного, так и лучевого, в частности, проводилась ли лучевая терапия грудной клетки или средостения, также какие есть болезни миокарда, есть ли факторы риска, связанные с образом жизни и другие.
Факторы, повышающие риск дисфункции миокарда:
Базовая оценка кардиального статуса:
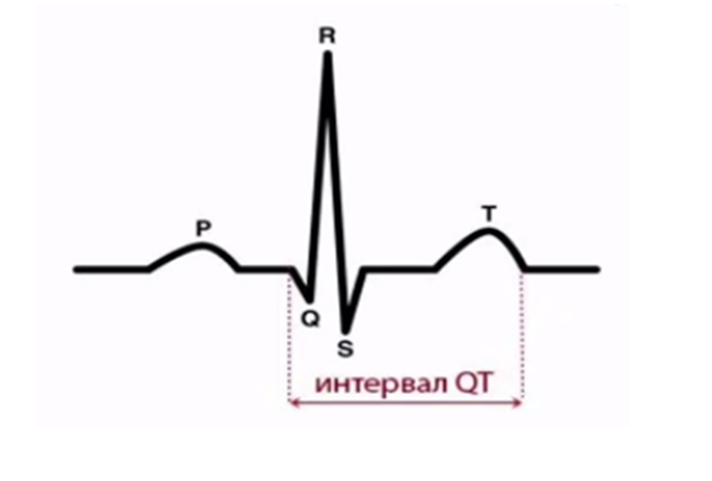
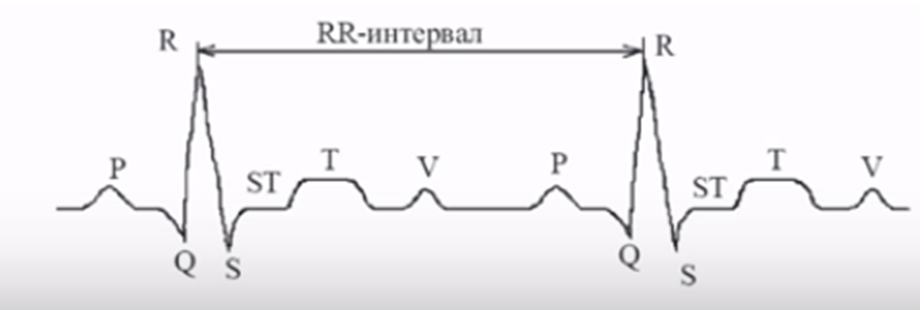
1. ЭКГ в 12 отведениях с расчетом интервала QTc.
2. Оценка систолической функции левого желудочка:
3. Оценка уровня биомаркеров (в качестве дополнения, особенно у пациентов с высоким риском развития дисфункции).
Методы оценки систолической функции левого желудочка:
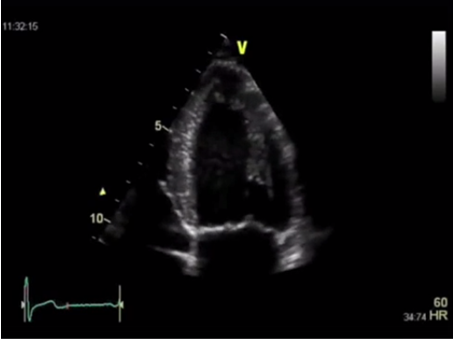
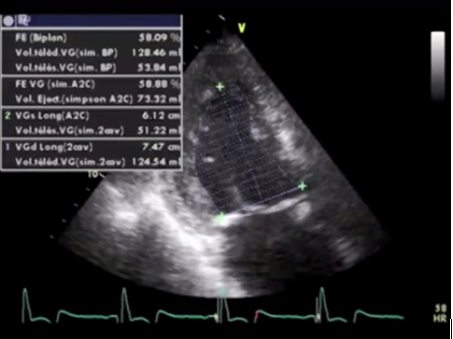
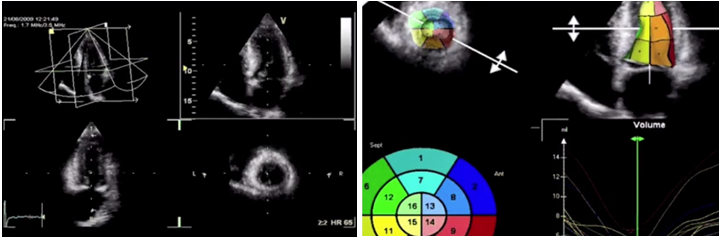
Методом выбора в оценке систолической функции миокарда является исследование фракций выброса левого желудочка при помощи эхокардиографии. Наилучшими являются измерения при помощи трехмерной эхокардиографии, а используемые иногда измерения в одномерном М-режиме по методу Тейхольца проводить нельзя, в связи с большим количеством неточностей и погрешностей. И при отсутствии трехмерной эхокардиографии исследование выполняется в двухмерном режиме по методу Симпсона.
Измерение ФВ ЛЖ в 2D режиме по Simpson
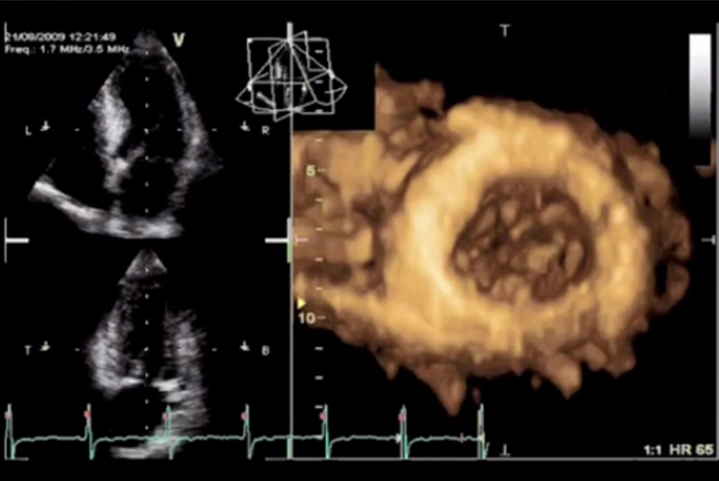
Измерение ФВ ЛЖ в 3D режиме
И разброс данных, получаемых при трехмерной эхокардиографии, даже у одного врача может составлять около 6%, а при двухмерной – около 10%.
Разница между измерениями в двухмерном и в трехмерном режимах может достигать 23%.
Стоит отметить, что положительной стороной исследования фракции с помощью эхокардиографии является ее доступность. Основные ее ограничения: от качества оборудования зависит качество изображения, имеет значение и опыт врача. Поэтому для серийной оценки фракции выброса левого желудочка необходимо использовать одно и то же оборудование, а измерения, желательно, чтобы выполнял один и тот же врач.
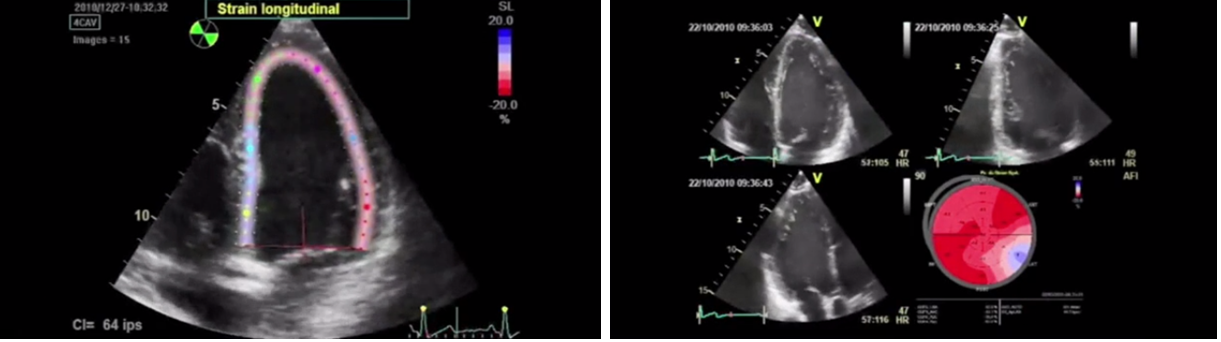
Измерение глобальной продольной деформации (global longitudinal strain или GLS)
Стоит отметить, что снижение фракции выброса левого желудочка – это достаточно позднее проявление кардиотоксичности, когда повлиять на ее исходы уже проблематично. Поэтому важной целью является ранняя диагностика доклинической дисфункции левого желудочка. И перспективным методом ранней диагностики кардиотоксичности является так называемая спекл-трекинговая эхокардиография, когда с помощью определенных программ исследуется так называемая глобальная продольная деформация миокарда. Относительное процентное снижение показателя, получаемого при измерении, более 15% от исхода считается патологическим и является признаком ранней доклинической дисфункции левого желудочка.
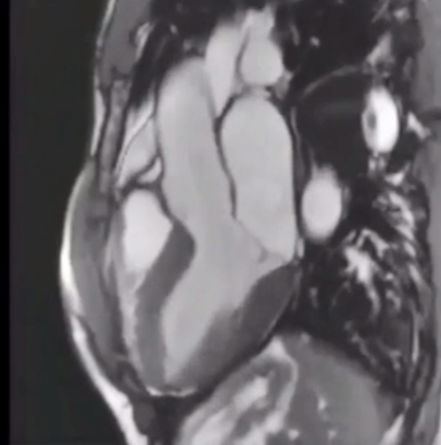
Магнитно-резонансная томография сердца (cardiovascular magnetic resonance или CMR)
Существенную роль в определении причин дисфункции левого желудочка может оказать и магнитно-резонансная томография сердца.
Обычно данный метод используется, если другие методики не информативны или чтобы подтвердить наличие дисфункции, если фракция выброса левого желудочка находится на нижней границе нормы.
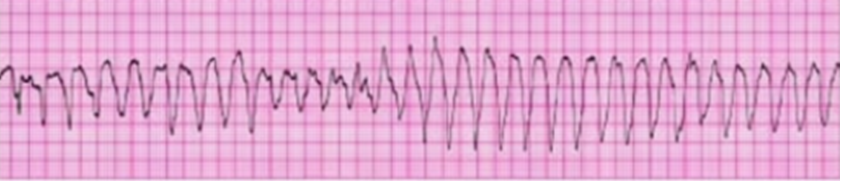
Радионуклидная равновесная вентрикулография (nuclear cardiac imaging или MUGA)
Также для измерения систолической функции левого желудочка возможно применение радионуклидной равновесной вентрикулографии. Но стоит отметить, что существенным ограничением данного метода является излишняя лучевая нагрузка.
Оптимальный метод исследования сократительной функции сердца должен выбирать врач, исходя из сложившейся ситуации.
Биомаркеры
Исследование уровня сердечных биомаркеров может рассматриваться в качестве дополнения к исследованию фракций выброса левого желудочка для выявления доклинической дисфункции миокарда.
Исследование уровня высокочувствительного тропонина I является наиболее изученным. Также в настоящее время проводится исследование по использованию и применению других биомаркеров. Необходимо отметить, что до сих пор остается нерешенным вопрос о сроках лабораторного обследования после проведения противоопухолевого лечения, о референтных значениях тех или иных биомаркеров и дальнейшей тактики при получении определенных результатов. Единственное, что можно сказать: для увеличения сопоставимости результатов разумно использовать одни и те же анализы в период наблюдения.
Основные принципы наблюдения во время проведения противоопухолевой терапии:
Что необходимо делать после старта химиотерапии?
Алгоритм мониторинга во время проведения противоопухолевой терапии:
Антрациклины
Трастузумаб
Наблюдения во время таргетной терапии трастозумабом требуют исследования:
Другие препараты
Существенным моментом является то, что для всех остальных препаратов периодичность мониторинга, к сожалению, не регламентирована. Поскольку четкого алгоритма нет, то периодичность мониторинга определяется клинической необходимостью и уровнем сердечно-сосудистого риска. При наличии повышенного риска на фоне лечения необходимо посещать кардиолога хотя бы 1 раз в 3 месяца.
Какие способы профилактики существуют?
Профилактика дисфункции миокарда может осуществляться путем реализации
онкологической или кардиологической стратегии.
Онкологические стратегии основаны на изменении режимов использования противоопухолевых препаратов, использовании липосомальных форм антрациклинов и применении дексразоксана.
Онкологические стратегии
Эти подходы реализует врач-онколог, только он может вносить изменения в противоопухолевую терапию.
Кардиологические стратегии
Кардиологические подходы к профилактике основаны на строгом контроле факторов риска. Это всецело зависит от самого пациента. Необходим отказ от курения, контроль за потреблением алкоголя, регулярные физические нагрузки, контроль за массой тела, правильное питание. Врач кардиолог при необходимости прибегает к назначению кардиопротективных лекарственных препаратов.
Мы будем говорить только о лекарственных препаратах, которые показали свою пользу в клинических исследованиях, т.е. их применение основано на имеющихся доказательствах их эффективности.
К основным группам кардиопротективных препаратов относятся:
— ингибиторы ангиотензин-превращающего фермента — иАПФ (эналаприл, периндоприл);
— блокаторы рецепторов ангиотензина II – БРА (кандесартан, телмисартан);
— бета-адреноблокаторы – ББ (карведилол, небиволол);
— статины (симвастатин, аторвастатин, розувастатин) – при использовании антрациклинов;
— антагонисты альдостерона (верошпирон) – при использовании антрациклинов.
Назначение этих препаратов также должно проводиться врачом-кардиологом.
Что нужно учитывать при использовании антрациклинов?
Пациенты с высоким риском развития дисфункции миокарда, получающие любые дозы антрациклинов, и пациенты с низким риском развития дисфункции миокарда, получающие высокие дозы антрациклинов, должны принимать кардиопротективные препараты в сочетании с регулярными физическими нагрузками.
— Пациентам с высоким риском развития дисфункции миокарда, получающим любые дозы антрациклинов назначаются АПФ (или БРА), ББ, статины в оптимальных дозировках, регулярные аэробные физические нагрузки (3-5 раз в неделю не менее 20 мин.);
— Пациентам с низким риском развития дисфункции миокарда, получающим высокие дозы антрациклинов (>250 мпм2 доксорубицина или эквивалента) назначаются АПФ (или БРА), ББ, статины в оптимальных дозировках, регулярные аэробные физические нагрузки (35 раз в неделю не менее 20 мин.);
— Пациентам с низким риском развития дисфункции миокарда и низкими дозами антрациклинов назначается ББ (карведилол).
Также стоит отметить, что крупные рандомизированные контролируемые исследования о пользе медикаментозной профилактики при применении других потенциально кардиотоксичных противоопухолевых препаратов в настоящее время отсутствуют.
Лечебные стратегии
При развитии симптомной сердечной недостаточности, развитии клинических проявлений сердечной недостаточности (инспираторная одышка, снижение толерантности к физическим нагрузкам, отеки, сердцебиение) на фоне проведения противоопухолевого лечения необходимо:
— Обратиться за консультацией к кардиологу. Лечение должно проводиться согласно действующим рекомендациям по сердечной недостаточности. Важное прогностическое значение имеет максимально раннее начало терапии.
— После подтверждения диагноза проведение противоопухолевой терапии может быть приостановлено. Решение о приостановке противоопухолевой терапии всегда принимается коллегиально – онкологом и кардиологом. После чего назначается терапия согласно действующим рекомендациям по лечению сердечной недостаточности.
Дисфункция миокарда ЛЖ (без симптомов сердечной недостаточности), соответствующая критерию снижения ФВ ЛЖ >10% от исходной и ниже 50%
При развитии бессимптомной дисфункции миокарда, диагностированной на основании данных только инструментальных исследований, также необходимо обратиться к кардиологу. Врач может принять решение временно приостановить проведение противоопухолевой терапии.
Консультация кардиолога необходима для назначения иАПФ (или БРА), ББ для предупреждения дальнейшего ухудшения систолической функции ЛЖ или развития симптоматической сердечной недостаточности.
Так же проводится повторная оценка ФВ ЛЖ через 2-3 недели (оценка в динамике).
Вопрос о продолжении противоопухолевой терапии и дальнейшей тактике решается коллегиально после оценки рисков с учетом мнения онколога и кардиолога.
Существуют данные о пользе первичной профилактики развития дисфункции миокарда, если у пациента имеется бессимптомное повышение уровня тропонина I.
При повышении тропонина на фоне терапии антрациклинами применяется иАПФ (зналаприл).
Ишемическая болезнь сердца
Различные формы ишемической болезни сердца наравне с дисфункцией миокарда и сердечной недостаточностью также являются очень грозными и значимыми осложнениями системной противоопухолевой терапии.
Ишемическая болезнь сердца возникает в результате снижения кровотока по коронарным артериям, которые снабжают кровью сердечную мышцу, в результате чего наступает несоответствие между потребностью миокарда в кислороде и его доставкой кровью.
Наибольший риск возникновения различных форм ишемической болезни сердца имеется у больных, которые получают различные фторпиримидины препараты платины и ингибиторы фактора роста эндотелия сосудов.
Патогенез, риск возникновения