Высокий риск втэо при беременности что это
пУПВЕООПУФЙ РТПЖЙМБЛФЙЛЙ ЧЕОПЪОЩИ ФТПНВПЬНВПМЙЮЕУЛЙИ ПУМПЦОЕОЙК (чфьп) Ч УЧСЪЙ У ВЕТЕНЕООПУФША Й ТПДБНЙ
3.6. пУПВЕООПУФЙ РТПЖЙМБЛФЙЛЙ чфьп Ч УЧСЪЙ У ВЕТЕНЕООПУФША Й ТПДБНЙ
рТЙ ОБМЙЮЙЙ чфьп Ч БОБНОЕЪЕ, Б ФБЛЦЕ ОБУМЕДУФЧЕООПК ЙМЙ РТЙПВТЕФЕООПК ФТПНВПЖЙМЙЙ ТЙУЛ ТБЪЧЙФЙС чфьп РТЙ ВЕТЕНЕООПУФЙ ХЧЕМЙЮЙЧБЕФУС. вЕТЕНЕООПУФШ СЧМСЕФУС ЖБЛФПТПН ТЙУЛБ чфьп, ПДОБЛП Ч РТЕДЕМБИ 4—6 ОЕД РПУМЕ ТПДПЧ ПРБУОПУФШ фзч ЧЩЫЕ, ЮЕН ЧП ЧТЕНС ВЕТЕНЕООПУФЙ.
чЩДЕМСАФ РТЕДЫЕУФЧХАЭЙЕ ВЕТЕНЕООПУФЙ ЖБЛФПТЩ ТЙУЛБ, БЛХЫЕТУЛЙЕ ЖБЛФПТЩ ТЙУЛБ Й ЧПЪОЙЛЫЙЕ ЧП ЧТЕНС ВЕТЕНЕООПУФЙ ФТБОЪЙФПТОЩЕ ЖБЛФПТЩ ТЙУЛБ. жБЛФПТЩ ТЙУЛБ чфьп ЧП ЧТЕНС ВЕТЕНЕООПУФЙ, ТПДПЧ Й РПУМЕТПДПЧПЗП РЕТЙПДБ, РПДИПДЩ Л ЙОДЙЧЙДХБМШОПК ПГЕОЛЕ ТЙУЛБ Й РТПЖЙМБЛФЙЛЕ чфьп РТЕДУФБЧМЕОЩ Ч ФБВМ. 16—18.
фБВМЙГБ 16. пГЕОЛБ ТЙУЛБ Й РТПЖЙМБЛФЙЛБ чфьп ЧП ЧТЕНС ВЕТЕНЕООПУФЙ
| жБЛФПТ ТЙУЛБ | лПМЙЮЕУФЧП ВБММПЧ |
| I. дБООЩЕ БОБНОЕЪБ | |
| дМЙФЕМШОЩК РТЙЕН БОФЙЛПБЗХМСОФПЧ, ЙУРПМШЪХЕНЩК ДП ВЕТЕНЕООПУФЙ РП РПУФПСООЩН РПЛБЪБОЙСН | 2 |
| рТЕДЫЕУФЧХАЭЙЕ ТЕГЙДЙЧЙТХАЭЙЕ чфьп | 2 |
| рТЕДЫЕУФЧХАЭЕЕ чфьп Ч УПЮЕФБОЙЙ У ФТПНВПЖЙМЙЕК ЧЩУПЛПЗП ТЙУЛБ (ДЕЖЙГЙФ БОФЙФТПНВЙОБ, БОФЙЖПУЖПМЙРЙДОЩК УЙОДТПН), ВЕЪ МЕЮЕОЙС БОФЙЛПБЗХМСОФБНЙ ДП ВЕТЕНЕООПУФЙ | 2 |
| рТЕДЫЕУФЧХАЭЙЕ чфьп, ОЙЮЕН ОЕ УРТПЧПГЙТПЧБООЩЕ ЙМЙ УЧСЪБООЩЕ У РТЙЕНПН ЬУФТПЗЕОПЧ ЙМЙ ВЕТЕНЕООПУФША | 1 |
| рТЕДЫЕУФЧХАЭЙЕ УРТПЧПГЙТПЧБООЩЕ чфьп Ч УПЮЕФБОЙЙ У ФТПНВПЖЙМЙЕК ОЙЪЛПЗП ТЙУЛБ | 1 |
| II. вЕУУЙНРФПНОЩЕ ФТПНВПЖЙМЙЙ | |
| зПНПЪЙЗПФЩ РП ЖБЛФПТХ V мЕКДЕОБ | 1 |
| зПНПЪЙЗПФЩ РП РТПФТПНВЙОХ G20210A | 1 |
| дЕЖЙГЙФ БОФЙФТПНВЙОБ | 1 |
| III. рТЕИПДСЭЙЕ ЖБЛФПТЩ ЧП ЧТЕНС ВЕТЕНЕООПУФЙ | |
| уФТПЗЙК РПУФЕМШОЩК ТЕЦЙН 7 Й ВПМЕЕ ДОЕК Х ЦЕОЭЙО У йнф >25 ЛЗ/Н2 | 1 |
| оЕБЛХЫЕТУЛПЕ ИЙТХТЗЙЮЕУЛПЕ ЧНЕЫБФЕМШУФЧП ЧП ЧТЕНС ВЕТЕНЕООПУФЙ | 1 |
| уРПУПВ РТПЖЙМБЛФЙЛЙ чфьп | уХННБ ВБММПЧ |
| рТПЖЙМБЛФЙЮЕУЛЙЕ ДПЪЩ онз Ч ФЕЮЕОЙЕ ЧУЕК ВЕТЕНЕООПУФЙ Й 6 ОЕД РПУМЕ ТПДПЧ | 1 |
| фЕТБРЕЧФЙЮЕУЛБС ДПЪБ онз Ч ФЕЮЕОЙЕ ЧУЕК ВЕТЕНЕООПУФЙ Й 6 ОЕД РПУМЕ ТПДПЧ | ™2 |
фБВМЙГБ 17. пГЕОЛБ ТЙУЛБ Й РТПЖЙМБЛФЙЛБ чфьп ЧП ЧТЕНС ТПДПЧ Й Ч РПУМЕТПДПЧПН РЕТЙПДЕ
| жБЛФПТ ТЙУЛБ | лПМЙЮЕУФЧП ВБММПЧ |
| I. дБООЩЕ БОБНОЕЪБ | |
| рТЕДЫЕУФЧХАЭЙЕ ТЕГЙДЙЧЙТХАЭЙЕ чфьп | 3 |
| рТЕДЫЕУФЧХАЭЙЕ чфьп, ОЙЮЕН ОЕ УРТПЧПГЙТПЧБООЩЕ ЙМЙ УЧСЪБООЩЕ У РТЙЕНПН ЬУФТПЗЕОПЧ | 3 |
| рТЕДЫЕУФЧХАЭЙЕ УРТПЧПГЙТПЧБООЩЕ чфьп | 2 |
| уЕНЕКОЩК ФТПНВПФЙЮЕУЛЙК БОБНОЕЪ | 1 |
| II. уПНБФЙЮЕУЛЙЕ ЖБЛФПТЩ | |
| чПЪТБУФ ВПМЕЕ 35 МЕФ | 1 |
| лХТЕОЙЕ | 1 |
| пЦЙТЕОЙЕ (йнф >30 ЛЗ/Н2) | 1 |
| чБТЙЛПЪОПЕ ТБУЫЙТЕОЙЕ ЧЕО ОЙЦОЙИ ЛПОЕЮОПУФЕК | 1 |
| уПНБФЙЮЕУЛЙЕ ЪБВПМЕЧБОЙС (БТФЕТЙБМШОБС ЗЙРЕТФЕОЪЙС, ОЕЖТПФЙЮЕУЛЙК УЙОДТПН, ЪМПЛБЮЕУФЧЕООЩЕ ЪБВПМЕЧБОЙС, УБИБТОЩК ДЙБВЕФ 1-ЗП ФЙРБ, ЙОЖЕЛГЙПООП-ЧПУРБМЙФЕМШОЩЕ ЪБВПМЕЧБОЙС Ч БЛФЙЧОПК ЖБЪЕ, улч, ЪБВПМЕЧБОЙС МЕЗЛЙИ Й УЕТДГБ, УЕТРПЧЙДОП-ЛМЕФПЮОБС БОЕНЙС) | 2 |
| III. бЛХЫЕТУЛП-ЗЙОЕЛПМПЗЙЮЕУЛЙЕ ЖБЛФПТЩ | |
| фТЙ Й ВПМЕЕ ТПДПЧ Ч БОБНОЕЪЕ | 1 |
| нОПЗПРМПДОБС ВЕТЕНЕООПУФШ | 1 |
| дЕЗЙДТБФБГЙС | 1 |
| ъБФСЦОЩЕ ТПДЩ (>24 Ю) | 1 |
| рПМПУФОЩЕ ЙМЙ ТПФБГЙПООЩЕ ЭЙРГЩ | 1 |
| ьЛУФТЕООПЕ ЛЕУБТЕЧП УЕЮЕОЙЕ | 1 |
| дМЙФЕМШОБС ЙННПВЙМЙЪБГЙС (>4 УХФ) | 1 |
| иЙТХТЗЙЮЕУЛЙЕ ЧНЕЫБФЕМШУФЧБ ЧП ЧТЕНС ВЕТЕНЕООПУФЙ ЙМЙ Ч РПУМЕТПДПЧПН РЕТЙПДЕ | 2 |
| рПУМЕТПДПЧПЕ ЛТПЧПФЕЮЕОЙЕ ВПМЕЕ 1 М, ФТЕВХАЭЕЕ ЗЕНПФТБОУЖХЪЙЙ | 1 |
| рТЕЬЛМБНРУЙС | 1 |
| фСЦЕМБС ЖПТНБ РТЕЬЛМБНРУЙЙ, ЧОХФТЙХФТПВОБС ЗЙВЕМШ РМПДБ ЧП ЧТЕНС ДБООПК ВЕТЕНЕООПУФЙ | 2 |
| IV. фТПНВПЖЙМЙЙ | |
| зПНПЪЙЗПФЩ РП ЖБЛФПТХ V мЕКДЕОБ, ЗПНПЪЙЗПФЩ РП РТПФТПНВЙОХ G20210A, БОФЙЖПУЖПМЙРЙДОЩК УЙОДТПН, ДЕЖЙГЙФ БОФЙФТПНВЙОБ, ДЕЖЙГЙФ РТПФЕЙОПЧ S ЙМЙ C | 3 |
| уРПУПВ РТПЖЙМБЛФЙЛЙ чфьп | уХННБ ВБММПЧ |
| ьМБУФЙЮОБС ЛПНРТЕУУЙС ОЙЦОЙИ ЛПОЕЮОПУФЕК | 0—1 |
| рЕТЕНЕЦБАЭБСУС РОЕЧНБФЙЮЕУЛБС ЛПНРТЕУУЙС ОЙЦОЙИ ЛПОЕЮОПУФЕК, онз Ч ФЕЮЕОЙЕ 6—7 ДОЕК РПУМЕ ТПДПЧ | 2 |
| рЕТЕНЕЦБАЭБСУС РОЕЧНБФЙЮЕУЛБС ЛПНРТЕУУЙС ОЙЦОЙИ ЛПОЕЮОПУФЕК, онз Ч ФЕЮЕОЙЕ 6 ОЕД РПУМЕ ТПДПЧ | ™3 |
дМС РТПЖЙМБЛФЙЛЙ чфьп ЧП ЧТЕНС ВЕТЕНЕООПУФЙ УМЕДХЕФ ЙУРПМШЪПЧБФШ РТПЖЙМБЛФЙЮЕУЛЙЕ ЙМЙ ВПМЕЕ ЧЩУПЛЙЕ (РТПНЕЦХФПЮОЩЕ) ДПЪЩ онз ЙМЙ ожз, УТЕДУФЧПН ЧЩВПТБ СЧМСАФУС онз. рТЙОЙНБФШ бчл ЧП ЧТЕНС ВЕТЕНЕООПУФЙ ОЕ ТЕЛПНЕОДХЕФУС, ПДОБЛП ЙИ НПЦОП ОБЪОБЮЙФШ РПУМЕ ТПДПЧ; ГЕМЕЧПЕ ноп РТЙ ЬФПН УПУФБЧМСЕФ 2,5 (2,0—3,0).
х ВЕТЕНЕООЩИ ВЕЪ ФТПНВПЖЙМЙЙ, У ЕДЙОУФЧЕООЩН ЬРЙЪПДПН фзч ЙМЙ фьмб Ч БОБНОЕЪЕ, УЧСЪБООЩН У ПВТБФЙНЩН ЖБЛФПТПН ТЙУЛБ, ЛПФПТЩК Ч ОБУФПСЭЕЕ ЧТЕНС ПФУХФУФЧХЕФ, ТЕЛПНЕОДХЕФУС ЛМЙОЙЮЕУЛПЕ ОБВМАДЕОЙЕ (У ЙУРПМШЪПЧБОЙЕН ПВЯЕЛФЙЧОЩИ НЕФПДПЧ ДЙБЗОПУФЙЛЙ РТЙ РПДПЪТЕОЙЙ ОБ чфьп) У ОБЮБМПН РТПЖЙМБЛФЙЛЙ БОФЙЛПБЗХМСОФБНЙ РПУМЕ ТПДПЧ.
еУМЙ РТЕИПДСЭЙН ЖБЛФПТПН ТЙУЛБ, УЧСЪБООЩН У чфьп Ч БОБНОЕЪЕ, ВЩМБ ВЕТЕНЕООПУФШ ЙМЙ РТЙНЕОЕОЙЕ ЬУФТПЗЕОПЧ, УМЕДХЕФ ТБУУНПФТЕФШ ГЕМЕУППВТБЪОПУФШ ЧЧЕДЕОЙС ПВЩЮОПК РТПЖЙМБЛФЙЮЕУЛПК ЙМЙ ВПМЕЕ ЧЩУПЛПК (РТПНЕЦХФПЮОПК) ДПЪЩ онз ЙМЙ ожз (ФБВМ. 19) ЧП ЧТЕНС ВЕТЕНЕООПУФЙ У РТПДПМЦЕОЙЕН РТПЖЙМБЛФЙЛЙ БОФЙЛПБЗХМСОФБНЙ РПУМЕ ТПДПЧ.
фБВМЙГБ 19. дПЪЩ онз ДМС РТПЖЙМБЛФЙЛЙ чфьп ЧП ЧТЕНС ВЕТЕНЕООПУФЙ Й РПУМЕ ТПДПЧ
| нБУУБ ФЕМБ, ЛЗ | ьОПЛУБРБТЙО | дБМФЕРБТЙО | оБДТПРБТЙО |
| рТПЖЙМБЛФЙЮЕУЛЙЕ ДПЪЩ** | |||
| 170 | 0,6 НЗ/ЛЗ/УХФ* | 75 ед/ЛЗ/УХФ* | 86 ед/ЛЗ/УХФ |
| чЩУПЛБС РТПЖЙМБЛФЙЮЕУЛБС(РТПНЕЦХФПЮОБС) ДПЪБ РТЙ НБУУЕ ФЕМБ 50—90 ЛЗ | 40 НЗ ЛБЦДЩЕ 12 Ю | 5000 ед ЛБЦДЩЕ 12 Ю | 5700 не ЛБЦДЩЕ 12 Ю |
| фЕТБРЕЧФЙЮЕУЛБС ДПЪБ*** | 1 НЗ/ЛЗ ЛБЦДЩЕ 12 Ю ЙМЙ 1,5 НЗ/ЛЗ ЛБЦДЩЕ 24Ю ДП Й РПУМЕ ТПДПЧ | 100 ед/ЛЗ ЛБЦДЩЕ 12 Ю ЙМЙ 200 ед/ЛЗ ЛБЦДЩЕ 24Ю ДП Й РПУМЕ ТПДПЧ | 86 ед/ЛЗ ЛБЦДЩЕ 12 Ю |
рТЙНЕЮБОЙЕ. * — ДПЪБ НПЦЕФ ВЩФШ ТБЪДЕМЕОБ ОБ ДЧЕ; ** — ЕУМЙ ЛМЙТЕОУ ЛТЕБФЙОЙОБ НЕОЕЕ 30 НМ/НЙО, УМЕДХЕФ РТЙНЕОСФШ ВПМЕЕ ОЙЪЛЙЕ ДПЪЩ ЬОПЛУБРБТЙОБ Й ДБМФЕРБТЙОБ; *** — РТЙ ДЕЖЙГЙФЕ БОФЙФТПНВЙОБ НПЗХФ РПФТЕВПЧБФШУС ВПМЕЕ ЧЩУПЛЙЕ ДПЪЩ онз (УЛПТТЕЛФЙТПЧБООЩЕ РП НБУУЕ ФЕМБ: 75 ЙМЙ 100% ПФ ФЕТБРЕЧФЙЮЕУЛПК ДПЪЩ) ЙУИПДС ЙЪ ХТПЧОЕК БОФЙ-иБ-БЛФЙЧОПУФЙ.
х ВЕТЕНЕООЩИ ВЕЪ ФТПНВПЖЙМЙЙ, У ЕДЙОУФЧЕООЩН ЬРЙЪПДПН ЙДЙПРБФЙЮЕУЛПЗП фзч ЙМЙ фьмб Ч БОБНОЕЪЕ, ЛПФПТЩЕ Л ОБЮБМХ ВЕТЕНЕООПУФЙ ХЦЕ РЕТЕУФБМЙ РПМХЮБФШ БОФЙЛПБЗХМСОФЩ, ТЕЛПНЕОДХЕФУС ПДЙО ЙЪ УМЕДХАЭЙИ РПДИПДПЧ.
х ВЕТЕНЕООЩИ У ФТПНВПЖЙМЙСНЙ, УЙМШОП РПЧЩЫБАЭЙНЙ ТЙУЛ чфьп (ДЕЖЙГЙФ БОФЙФТПНВЙОБ, РПУФПСООПЕ РТЙУХФУФЧЙЕ БОФЙЖПУЖПМЙРЙДОЩИ БОФЙФЕМ, УПЮЕФБОЙЕ ЗЕФЕТПЪЙЗПФОПУФЙ РП ЧБТЙБОФХ РТПФТПНВЙОБ G20210A Й ЖБЛФПТХ V мЕКДЕОБ ЙМЙ ЗПНПЪЙЗПФОПУФШ РП ЬФЙН ОБТХЫЕОЙСН), Й ЕДЙОУФЧЕООЩН ЬРЙЪПДПН чфьп Ч БОБНОЕЪЕ, ЛПФПТЩЕ Л ОБЮБМХ ВЕТЕНЕООПУФЙ ХЦЕ РЕТЕУФБМЙ РПМХЮБФШ БОФЙЛПБЗХМСОФЩ, ТЕЛПНЕОДХЕФУС ЙУРПМШЪПЧБФШ ПВЩЮОХА РТПЖЙМБЛФЙЮЕУЛХА ЙМЙ ВПМЕЕ ЧЩУПЛХА ДПЪХ онз ЙМЙ ожз ЧП ЧТЕНС ВЕТЕНЕООПУФЙ У РТПДПМЦЕОЙЕН РТПЖЙМБЛФЙЛЙ БОФЙЛПБЗХМСОФБНЙ РПУМЕ ТПДПЧ.
х ВЕТЕНЕООЩИ У ВПМЕЕ ЮЕН ПДОЙН ЬРЙЪПДПН чфьп Ч БОБНОЕЪЕ, ЛПФПТЩЕ Л ОБЮБМХ ВЕТЕНЕООПУФЙ ХЦЕ РЕТЕУФБМЙ РПМХЮБФШ БОФЙЛПБЗХМСОФЩ, ГЕМЕУППВТБЪОП ЙУРПМШЪПЧБФШ ПВЩЮОХА РТПЖЙМБЛФЙЮЕУЛХА, ВПМЕЕ ЧЩУПЛХА ЙМЙ МЕЮЕВОХА ДПЪХ онз ЙМЙ ожз ЧП ЧТЕНС ВЕТЕНЕООПУФЙ У РТПДПМЦЕОЙЕН РТПЖЙМБЛФЙЛЙ БОФЙЛПБЗХМСОФБНЙ РПУМЕ ТПДПЧ.
х ВПМШОЩИ, ЛПФПТЩЕ Л ОБЮБМХ ВЕТЕНЕООПУФЙ РТПДПМЦБМЙ РПМХЮБФШ БОФЙЛПБЗХМСОФЩ Ч УЧСЪЙ У РЕТЕОЕУЕООЩН фзч ЙМЙ фьмб, ЧП ЧТЕНС ВЕТЕНЕООПУФЙ ТЕЛПНЕОДХЕФУС ПДЙО ЙЪ УМЕДХАЭЙИ РПДИПДПЧ: ЙУРПМШЪПЧБФШ МЕЮЕВОХА ДПЪХ онз ЙМЙ ожз, ЧЧПДЙФШ 75% МЕЮЕВОПК ДПЪЩ онз ЙМЙ РТЙНЕОСФШ ДПЪХ онз, ВПМШЫХА, ЮЕН ПВЩЮОБС РТПЖЙМБЛФЙЮЕУЛБС ДП ТПДПЧ, У ЧПЪПВОПЧМЕОЙЕН ПВЩЮОПЗП РПДИПДБ Л РТЙНЕОЕОЙА БОФЙЛПБЗХМСОФПЧ РПУМЕ ТПДПЧ. х ЧУЕИ ВЕТЕНЕООЩИ У чфьп Ч БОБНОЕЪЕ ЦЕМБФЕМШОП ЙУРПМШЪПЧБОЙЕ ЛПНРТЕУУЙПООПЗП ФТЙЛПФБЦБ ЛБЛ ЧП ЧТЕНС ВЕТЕНЕООПУФЙ ДП ТПДПЧ, ФБЛ Й РПУМЕ ОЙИ.
х ВЕТЕНЕООЩИ У ФТПНВПЖЙМЙЕК ВЕЪ чфьп Ч БОБНОЕЪЕ ТЕЫЕОЙЕ П ГЕМЕУППВТБЪОПУФЙ РТЙНЕОЕОЙС БОФЙЛПБЗХМСОФПЧ ДП ТПДПЧ ДПМЦОП РТЙОЙНБФШУС У ХЮЕФПН ЙОДЙЧЙДХБМШОПК ПГЕОЛЙ ТЙУЛБ ЧПЪОЙЛОПЧЕОЙС фзч. рТЙ ФТПНВПЖЙМЙСИ У ЧЩУПЛЙН ТЙУЛПН чфьп (РП ЛТБКОЕК НЕТЕ У ДЕЖЙГЙФПН БОФЙФТПНВЙОБ) ГЕМЕУППВТБЪОБ РТПЖЙМБЛФЙЛБ ЛБЛ ДП ТПДПЧ, ФБЛ Й РПУМЕ ОЙИ. ч ПУФБМШОЩИ УМХЮБСИ НПЦОП ПЗТБОЙЮЙФШУС ЛМЙОЙЮЕУЛЙН ОБВМАДЕОЙЕН ЙМЙ ЧЧЕДЕОЙЕН ПВЩЮОЩИ РТПЖЙМБЛФЙЮЕУЛЙИ ДПЪ онз ЙМЙ ожз ДП ТПДПЧ У РТПДПМЦЕОЙЕН РТПЖЙМБЛФЙЛЙ БОФЙЛПБЗХМСОФБНЙ РПУМЕ ТПДПЧ.
уНПФТЙ ФБЛЦЕ УРЙУПЛ БОБМЙЪПЧ РТЙ ФТПНВПЖЙМЙЙ.
рТЙ ЛЕУБТЕЧПН УЕЮЕОЙЙ Х ЦЕОЭЙО ВЕЪ ДПРПМОЙФЕМШОЩИ ЖБЛФПТПЧ ТЙУЛБ чфьп НЕДЙЛБНЕОФПЪОБС РТПЖЙМБЛФЙЛБ ОЕ ФТЕВХЕФУС. рПЛБЪБОП ТБООЕЕ ЧПУУФБОПЧМЕОЙЕ РПДЧЙЦОПУФЙ. ч ПУФБМШОЩИ УМХЮБСИ Ч РЕТЙПД ЗПУРЙФБМЙЪБГЙЙ ЧПЪНПЦОП РТЙНЕОЕОЙЕ РТПЖЙМБЛФЙЮЕУЛЙИ ДПЪ ЗЕРБТЙОБ, НЕИБОЙЮЕУЛЙИ УРПУПВПЧ (ЬМБУФЙЮЕУЛЙЕ ЮХМЛЙ, РЕТЕНЕЦБАЭБСУС РОЕЧНБФЙЮЕУЛБС ЛПНРТЕУУЙС ОЙЦОЙИ ЛПОЕЮОПУФЕК)ЙМЙ ЙИ УПЮЕФБОЙС. ч ТСДЕ УМХЮБЕЧ РТЙ ЧЩУПЛПН ТЙУЛЕ чфьп ГЕМЕУППВТБЪОП РТПДМЙФШ РТПЖЙМБЛФЙЛХ ЧРМПФШ ДП 4—6 ОЕД РПУМЕ ТПДПЧ.
Тромбоэмболические осложнения во время беременности и низкомолекулярный гепарин
Особенно высокий риск тромбоэмболических осложнений при беременности характерен для женщин с тромбозами в анамнезе. По ретроспективным данным частота рецидивов ВТЭ в последующую беременность достигает 15% (19), что может свидетельствовать о важной роли генетических факторов в развитии тромбоэмболических осложнений.
Однако несмотря на столь тщательное изучение факторов риска ВТЭ причина развития этого осложнения остается не известной приблизительно в половине случаев (т.е. наблюдаются так называемые идиопатические тромбозы) (16). В последнее время все больше внимания уделяется изучению роли тромбофилических состояний в развитии как тромбоэмболических, так и акушерских осложнений. Под тромбофилией понимают наследственные или приобретенные (АФС) аномалии в системе гемостаза, предполагающие к развитию тромбозов.
Исследования последних лет свидетельствуют о четкой связи генетических тромбофилий и АФС с такими осложнениями беременности, как синдром потери плода, внутриутробная задержка роста плода (ЗВУРП), внутриутробная гибель плода, преждевременная отслойка нормально расположенной плаценты (ПОНРП), тяжелые формы гестоза (20, 21, 22). Если ранее роль тромбофилии в патогенезе осложнений беременности рассматривалась только с точки зрения процессов микротромбирования сосудов плацентарного ложа, то в настоящее время взгляды на патогенетическое влияние тромбофилии значительно расширились. Это связано с изучением роли системы гемостаза и нетромботических эффектов тромбофилии еще на этапах имплантации плодного яйца и инвазии трофобласта.
При ряде тромболических состояний риск ВТЭ повышается более чем в 100 раз, особенно при наличии гомозиготных, мультигенных форм тромбофилии или комбинированных форм (генетические тромбофилии + АФС) (23). В различных исследованиях показана взаимосвязь между развитием ВТЭ во время беременности и наличием таких мутаций, как FV Leiden, мутация протромбина G20210A, мутация MTHFR C677C, дефектов антикоагулянтной системы (дефицит антитромбина III, протеинов С и S) (24-27).
Резистентность к активированному протеину С встречается в среднем у 3-7% среди европейской популяции и у 20-30% пациентов с тромбозами (28). Классическим примером резистентности к АРС является мутация FV Leiden, при которой фактор V и VIII становятся нечувствительными к инактивирующему влиянию протеина С, что приводит к избыточному формированию тромбина и торможению фибринолиза (рисунок 1). Резистентность к АPC также может иметь место и при других мутациях фактора V (FV Hong-Kong, FV Cambridge, HRII-гаплотип), а также при целом ряде приобретенных факторов, включая циркуляцию АФА и, что немаловажно, может сопровождать физиологическое течение беременности. В исследовании А. Gerhardt и соавт. (2000) у женщин с эпизодами ВТЭ во время беременности мутация FV Leiden выявлена почти в половине случаев (43,7%), в то время как в контрольной группе – только у 7,7% (29).
При сохранении прокоагулянтной активности фактора V повреждается его антикоагулянтная функция. Вследствие АРС-резистентности не происходит деградация факторов Va и VIIIa. Это приводит к увеличению образования тромбина и возникновению состояния гиперкоагуляции.
Связываясь с тромбомодулином на эндотелиальной поверхности, тромбин увеличивает синтез TAPI. TAPI ингибирует фибринолиз путем отщепления лизилового фрагмента от молекул фибрина, что предотвращает ее связывание с плазмином и t-PA.
Помимо генетических причин резистентности к АРС, существует и целый ряд приобретенных факторов.
Причины приобретенного дефицита протеина С и резистентности к АРС:
Резистентность к активированному протеину С усугубляется при циркуляции антифосфолипидных антител. При наличии физиологической резистентности к протеину С, которая развивается во время беременности, может произойти декомпенсация системы гемостаза и развитие тромбоза.
Мутация протромбина G20210A ассоциируется с повышением уровня протромбина (активность фактора II достигает 130% и выше) и выявляется у 2-5% здорового населения. При этой мутации риск ВТЭ повышается в среднем в 3 раза (1). Мутация протромбина G20210A была выявлена у 16,9% беременных с ВТЭ по сравнению с 1,3% в контрольной группе (29).
До 40% пациентов с тромбозами имеют комбинированные формы тромбофилии: сочетание мутации FV Leiden с мутацией протромбина G20210A. При этом риск тромбозов повышается в 50-80 раз, т.е. риск ВТЭ становится сопоставимым с таковым при гомозиготной мутации FV Leiden (30).
Нарушения в системах протеина С и протеина S встречаются в среднем c частотой 0,14-0,5% в общей популяции и у 3,2% пациентов с тромбозами. Риск развития тромбоза во время беременности составляет от 3 до 10% для пациенток с дефицитом протеина С и до 6% для пациенток с дефицитом протеина S. В послеродовом периоде риск тромбозов повышается до 7-19% для пациенток с дефицитом протеина С и до 7-22% для пациенток с дефицитом протеина S (1, 31).
Имеющиеся на сегодня данные по риску развития тромбоэмболических осложнений во время беременности при наличии дефицита естественных антикоагулянтов представлены в таблице 1.
АФС является одним из наиболее важных факторов риска тромбоэмболических осложнений во время беременности. В настоящее время под АФС понимают симптомокомплекс, сочетающий клинические признаки и лабораторные данные, – наличие антифосфолипидных антител в сочетании с артериальными и/или венозными тромбозами и/или акушерскими осложнениями (34). Для установления диагноза АФС достаточно одного лабораторного и одного клинического критерия. Во время беременности тромбозы манифестируют у 30% пациенток с АФС (35). Риск рецидива ВТЭ при АФС значительно выше, чем в общей популяции и достигает 70% (36).
Современные критерии антифосфолипидного синдрома (34):
В настоящее время активно изучается роль генетических дефектов фибринолиза в повышении риска артериальных и венозных тромбозов. Доказана связь мутации t-PA I/D с увеличением риска венозных тромбозов в общей популяции (41, 42). Поскольку фактор XII вовлекается не только в контактную активацию коагуляционного каскада, но и в генерацию плазмина, его дефицит в большей степени связан с развитием не геморрагических тромботических осложнений (рисунок 2). В европейской популяции выраженный дефицит фактора XII выявляется у 1,5-3% населения и у 9-15% пациентов с ВТЭ (43). У носителей мутации 46ТТ риск ВТЭ возрастает в 3 раза (44).
PAI-1 обеспечивает до 60% общей ингибиторной активности в отношении активатора плазминогена в плазме крови и тем самым играет важную роль в регуляции фибринолиза. Наиболее частый полиморфизм 4-гуанодина (4G/5G) в промоторе PAI-1 ассоциируется с повышенной активностью PAI-1. Частота полиморфизма PAI-1 в общей популяции достигает 20%. При варианте 4G/4G уровень PAI-1 повышается на 25% (31). Обнаружена связь между повышенным уровнем PAI-1 и метаболическим синдромом, сахарным диабетом, гиперлипидемией. Это объясняет увеличение риска атеротромботических осложнений при наличии мутации PAI-1 (45).
Фактор XII является активатором свертывания крови по внутреннему пути, но еще и регулятором фибринолиза. Фактор XIIa способствует активации каллекреина, который в свою очередь поддерживает u-PA-зависимую активацию плазмина. ВМК – высокомолекулярный киноген; u-PA – активатор плазминогена урокиназного типа.
Большое значение имело открытие и изучение нетромботических эффектов тромбофилий, в частности, их влияния на процессы имплантации и инвазии трофобласта. Обнаружена взаимосвязь между гипофибринолизом и такими акушерскими осложнениями, как синдром потери плода, неудачи экстракорпорального оплодотворения, гестозы (46-48). В условиях гипофибринолиза (как в результате полиморфизма PAI-1, так и других причин) происходит десинхронизация локальных процессов фибринолиза и фибринообразования при имплантации. В такой ситуации протеаз, синтезируемых бластоцистой, становится относительно недостаточно, чтобы разрушить экстрацеллюлярный матрикс в эндометрии и внедриться на достаточную глубину. Недостаточная инвазия трофобласта в дальнейшем определяет феномен эндотелиальной дисфункции при гестозе.
Нами было обследовано 47 пациенток с тромбоэмболическими осложнениями во время беременности (средний возраст 28 ± 5,2 года). Группа I составила 47 пациенток с тромбозами: подгруппа 1 (n = 27) – пациентки с тромбозами в предыдущую беременность, подгруппа 2 (n = 20) – пациентки с тромбозами в настоящую беременность; группу II (контрольную) составили здоровые беременные (n = 40). Все женщины были обследованы на генетические тромбофилии (метод ПЦР) и антифосфолипидные антитела (АФА): волчаночный антикоагулянт (ВА) (тест с ядом гадюки Рассела), антикардиолипины (аКЛ), анти-бета2-гликопротеин I (метод ELISA). Базовая терапия при подготовке и на протяжении всей беременности у пациенток с тромбозами в анамнезе (подгруппа 1) включала низкомолекулярный гепарин (НМГ) под контролем D-димера (ELISA), антиоксиданты – омега 3, витамины группы В, фолиевую кислоту (до 4 мг/сут в случае гипергомоцистеинемии), а также аспирин (80-100 мг/сут) (во II триместре и примерно до 34 недель беременности) и натуральный прогестерон при АФС. У женщин с тромбоэмболическими осложнениями во время беременности антикоагулянтная терапия была начата после развития клинических симптомов.
У 26 (55%) пациенток тромбозы развились во время беременности (с 20 по 38 неделю), у 21 пациентки – в послеродовом периоде. У 7 из них тромбозы возникли после экстренного кесарева сечения. У 9 (19%) пациенток ВТЭ были рецидивирующими. У 26 (55%) выявлена ТЭЛА, у 20 пациенток (42,5%) – ТГВ, у одной пациентки в послеродовом периоде развился тромбоз яичниковой вены.
Обращает на себя внимание более высокая частота тромбозов в семейном анамнезе у пациенток с ВТЭ (в 38% случаев по сравнению с 8,5% в контрольной группе женщин с физиологической беременностью), что может указывать на наличие генетической предрасположенности к тромбозам у таких пациенток.
Важно отметить, что даже при тщательном анализе факторов риска дополнительные факторы развития тромбоза не были обнаружены у 36% пациенток.
Обнаружение крайне высокой частоты тяжелых акушерских осложнений в личном анамнезе у пациенток с ВТЭ (таблица 2) позволило еще до проведения исследований системы гемостаза сделать предположение о наличие тромбофилических состояний.
При анализе генетических форм тромбофилии и АФС у пациенток с ВТЭ получены следующие результаты (рисунок 3):
У пациенток с тромбозами в настоящую беременность после появления симптомов применялись терапевтические дозы НМГ под контролем D-димера до родов и после в течение минимум 6 недель. Летальный исход, связанный с массивной ТЭЛА, был зарегистрирован в 2 случаях (7,4%). Рождением живого плода у женщин из 1 подгруппы беременность закончилась в 89% случаев. Акушерские осложнения в этой подгруппе во время настоящей беременности составили 60% (тяжелые гестозы, антенатальная гибель плода, отслойка плаценты, СЗРП, ФНП). При сравнении подгруппы 2, в которой профилактика проводилась начиная с этапов планирования беременности, с подгруппой 1 рецидива ВТЭ не было ни в одном случае, акушерские осложнения наблюдались у 16% пациенток (легкие формы гестоза) (p
Оценка риска тромботических осложнений
Тромбозы, инсульты и инфаркты – серьезные угрожающие жизни осложнения, которые могут развиться у пациентов любого возраста при наличии факторов риска. Для женщин, планирующих беременность или программу ЭКО, определение степени риска тромбоза вдвойне актуально.
Во-первых, потому что во время беременности и в послеродовом периоде тромбозы случаются во много раз чаще. Во-вторых, потому что нарушения свертывания крови, приводящие к тромбозам, одновременно представляют потенциальную угрозу и для вынашивания беременности.
Вопреки распространенному мнению, риск тромбоза (повышение активности свертывания крови) практически невозможно определить с помощью анализов на свертываемость. Степень риска может рассчитать для себя каждый человек, используя специальные шкалы. Мы приводим две наиболее актуальные шкалы определения риска тромботических осложнений: первая – для акушерской практики (для беременных и женщин, планирующих беременность либо программу ЭКО), вторая – для любых пациентов, в том числе мужчин.
Шкала оценки риска тромботических осложнений для акушерской практики
1. Факторы, которые можно оценить уже на этапе планирования беременности / программы ЭКО:
А) Оцениваемые в 3 балла:
Б) Оцениваемые в 2 балла:
В) Оцениваемые в 1 балл:
2. Факторы, которые могут присоединиться непосредственно во время беременности или родов:
А) Оцениваемые в 2 балла:
Б) оцениваемые в 1 балл:
Если сумма баллов 0-1, риск тромбоза низкий. Если 2 балла – умеренный. Если 3 – высокий, 4 – очень высокий.
Высокий и умеренный риск требует совместного планирования и ведения беременности с гемостазиологом. Умеренный риск требует как минимум консультации гемостазиолога перед родами.
Шкала оценки риска тромбоза Каприни для всех пациентов, обращающихся за медицинской помощью, в том числе на госпитализацию
1. Факторы, оцениваемые в 5 баллов:
2. Факторы, оцениваемые в 3 балла:
3. Факторы, оцениваемые в 2 балла:
4. Факторы, оцениваемые в 1 балл:
Риск тромбоза очень высокий – 5 баллов и более; высокий – 3-4 балла, умеренный – 2 балла, низкий – 0-1 балл.
Автор статьи: Бузян Л.О., врач терапевт-гемостазиолог Нова Клиник
Лечебная тактика на этапе родоразрешения
Нет доказанных данных о преимущественном способе родоразрешения у женщин с ТГВ, тактика определяется конкретной акушерской ситуацией.
Перед родоразрешением лечебные дозы НМГ и нефракционированного гепарина отменяются за 24 ч, а в случае, когда сроки родов неизвестны, должен применяется только нефракционированный гепарин.
Оптимальным методом обезболивания при оперативном родоразрешении является регионарная анестезия (спинальная, эпидуральная). Безопасность регионарной анестезии и приема антикоагулянтов обеспечивается тщательным соблюдением временных интервалов (приложение 10).
В послеродовом периоде. Независимо от метода родоразрешения пациентка должна быть активизирована как можно раньше – через несколько часов после родов или операции.
При планировании долгосрочной (месяцы) тромбопрофилактики терапия варфарином начинается с первых суток после родоразрешения и сочетается с применением НМГ в течение 4-5 суток для достижения МНО – 2,0-3,0. После эпизода ТГВ во время беременности антикоагулянтная терапия после родов продолжается не менее 3 месяцев (в основном подобранной дозой варфарина).
В случае невозможности ранней активизации (продленная ИВЛ) для тромбопрофилактики используется перемежающаяся компрессия нижних конечностей на весь период иммобилизации. Данная методика
противопоказана только в остром периоде тромбоза глубоких вен.
ЛЕЧЕБНАЯ ТАКТИКА ПРИ ТРОМБОЭМБОЛИИ ЛЕГОЧНОЙ АРТЕРИИ
Клинические проявления ТЭЛА неспецифичны и её верификация требует использования комплекса биомаркеров и инструментальных методов исследования, наиболее точные из которых недоступны большинству ЛПУ.
Клинические проявления:
Признаки
ТЭЛА подтверждена
ТЭЛА исключена
Боль в груди (плевральная)
Боль в груди (загрудинная)
Одышка (более 20/мин)
Тахикардия (более 100/мин.)
Лихорадка (более 38,5C)
Инструментальные исследования:
Дуплексное УЗИ глубоких вен нижних конечностей
Эхокардиграфия для оценки функции правого желудочка
Ангиография легочной артерии
Биомаркеры:
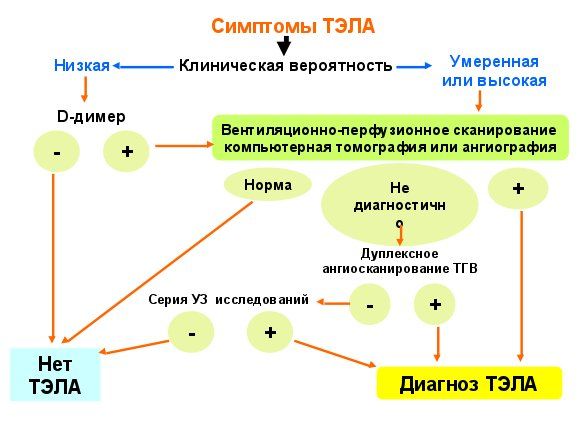
D-димер (активация фибринолиза в
ответ на тромбоз – высокая негативная диагностическая ценность (95 %), но низкая специфичность (
положительный результат не означает ТГВ/ТЭЛА). При низкой и умеренной клинической вероятности ТЭЛА отрицательный тест с D-димером исключает диагноз ТЭЛА. При высокой клинической вероятности ТЭЛА исследование D-димера неинформативно.
Предсердный натрийуретический пептид типа В (BNP)
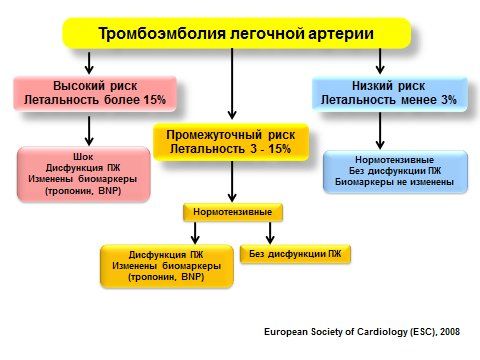
Для оценки риска ТЭЛА используются несколько шкал (приложение 12). В истории болезни обязательно фиксируется риск тромбоэмболических осложнений (низкий, умеренный и высокий) и соответствующие
профилактические мероприятия.
Рис.2 Алгоритм диагностики ТЭЛА во время беременности
Лечебная тактика при ТЭЛА во время беременности.
Начальная терапия антикоагулянтами при высокой клинической вероятности ТЭЛА или при его верификации представлена тремя вариантами применения гепаринов:
Внутривенное введение
нефрационированного гепарина – 5000 ЕД в/в болюсно и затем постоянная внутривенная инфузия 1000-2000 ЕД/ч. Контроль АПТВ проводится через 6 ч после начала терапии и его значения должны увеличиваться по отношению к норме в 1,5-2,5 раза. Уровень анти-Ха активности должен быть в пределах 0,35-0,7 ЕД/мл.
Рис. 3Оценка риска ТЭЛА
Подкожное введение низкомолекулярного гепарина. Оценка эффективности применения НМГ проводится по уровню анти-Ха активности – она должна быть 0,8-1,0 ЕД/мл через 3-4 ч после введения препарата. Определение количества тромбоцитов необходимо через 5-7 суток после начала лечения.
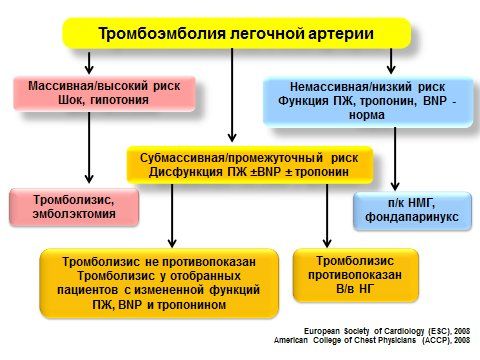
Применениетромболизиса во время беременности относительно противопоказано и при ТЭЛА без гемодинамических нарушений тромболизис использоваться не должен.
Для коррекции артериальной гипотонии/шока должны
использоваться вазопрессоры (норадреналин 2-30 мкг/мин,адреналин, домпин) и инотропные препараты при дисфункции правого желудочка (добутамин5 мкг/кг/мин,левосимендан).
Массивная инфузионная терапия для коррекции гемодинамических нарушений при ТЭЛА противопоказана.
Рис. 4Лечебная тактика при ТЭЛА в зависимости от формы.
Показана респираторная терапия (ингаляция кислорода, ИВЛ).
Все пациентки с любой формой ТЭЛА консультируются сосудистым хирургом для определения показаний к хирургическим методам профилактики (кава-фильтр) и лечения.
Оценка риска ВТЭО во время беременности, RCOG,2009
Степень риска
Факторы
Тактика
Высокий
Единственный предыдущий ВТЭО+
тромбофилия или семейная история ВТЭО
не связан с эстрогенами
Предыдущий или текущий ВТЭО (> 1)
Обязательна тромбопрофилактика НМГ в течение всей беременности
Умеренный
Единственный предыдущий ВТЭО без семейной
истории или тромбофилии
Тромбофилия без ВТЭО
Экстрагенитальная патология: болезни сердца или заболевание легких, СКВ, воспалительные заболевания, нефротический синдром, серповидно-клеточная анемия., рак
Хирургические операции во время беременности
Возможна тромбопрофилактика НМГво время беременности по согласованию со специалистами
Низкий
Тучность (BMI> 30 кг/м2)
Варикозная болезнь вен
Длительная иммобилизация, например, параплегия, SPD, дальний авиаперелет
Многоплодная беременность или ВРТ
3 и более или 2 при госпитализации
Возможна тромбопрофилактика НМГ
Мобилизация и предупреждение дегидратации
Оценка риска ВТЭО после родов, RCOG,2009
Степень риска
Факторы
Тактика
Высокий
Любой предыдущий ВТЭО
Применение НМГ во время беременности
Обязательна тромбопрофилактика НМГ не менее 6 недель
Умеренный
Кесарево сечение в родах
Ожирение BMI> 40 кг/м 2
Тромбофилия без ВТЭО
Экстрагенитальная патология: болезни сердца или заболевание легких, СКВ, воспалительные заболевания,
нефротический синдром, серповидно-клеточная анемия.
Тромбопрофилактика НМГ в течение 7 суток
Низкий
Тучность (BMI> 30 кг/м2)
Варикозная болезнь вен
Длительная иммобилизация, например, параплегия, SPD
Длительные роды более 24 ч
Любые хирургические операции после родов
Послеродовое кровотечение более 1000 мл и гемотрансфузия
Тромбопрофилактика НМГ в течение 7 суток
Мобилизация и предупреждение дегидратации
Шкала оценки риска тромбоэмболических осложнений во время беременности и тактика
тромбопрофилактики (Schoenbeck D.,2011)
Фактор риска
Баллы
Эпизод ВТЭО у родственников первой и второй степени
Предыдущий неакушерский спровоцированный эпизод ВТЭО
Предыдущий неакушерский неспровоцированный эпизод ВТЭО
Предыдущий эпизод ВТЭО на фоне приема пероральных контрацептивов
Предыдущий акушерский эпизод ВТЭО
Дефицит протеина C
Дефицит протеина S
Мутация фактора V Лейдена
Мутация протромбина (G20210A)
Менее 1,0 балла – без фармакологической тромбопрофилактики
1,0-1,5 балла –применение НМГ до 6 недель после родов
2,0-2,5 балла – применение НМГ с 28 недель
беременности до 6 недель после родов
3,0 и более баллов – применение НМГ в течение всей беременности 6 недель после родов
Шкала оценки риска тромбоэмболических осложнений во время беременности и тактика тромбопрофилактики (LindqvistP.G.,2008)
Риск 1 балл ( 5-ти кратное увеличение риска)
Мутация Лейдена (гетерозиготная)
Мутация протромбина (гетерозиготная)
Избыточный вес ( ИМТ > 28 в начале беременности)
Семейный анамнез тромбоза (более 60 лет)
Возраст более 40
лет
Риск 2 балла (25-кратное увеличение риска)
Дефицит протеина С
Дефицит протеина S
Иммобилизация более 1 недели
Синдром
гиперстимуляции яичников
Риск 3 балла (125-ти кратное увеличение риска)
Мутация Лейдена (гомозиготная)
Мутация протромбина (гомозиготная)
Риск более 4 баллов (до 10% риск венозноготромбоэмболизма)
Предшествующий венозный тромбоз
Антифосфолипидный синдром без ВТЭО
Очень высокий риск (>15% риск венозноготромбоэмболизма)
Протезированные клапаны сердца
Постоянный прием варфарина
Антифосфолипидный синдром с предшествующимВТЭО
Ранняя мобилизация, эластическая компрессия
Ранняя мобилизация, эластическая компрессия
НМГ в течение 7 суток после родов
НМГ или варфарин 6 недель после родов
НМГ во время беременности, НМГ или варфарин 6 недель после родов
НМГ + аспирин во время беременности, НМГ или варфарин 12 недель после родов
Факторы риска для послеродовых ВТЭО (АССР, 2012)
Высокие факторы риска: присутствие, по крайней мере, одного фактора рискапредлагает рискпослеродовых ВТЭО до 3 %
Неподвижность (строгий постельный режим в течение 1 недели)
Послеродовое кровотечение 1000 мл и более с хирургическим вмешательством
Преэклампсия с задержкой развития плода
Фактор V Лейдена (гомозиготный или
гетерозиготный)
Протромбин G20210A (гомозигоготный или гетерозиготный)
Системная красная волчанка
Незначительные факторы риска: присутствие, по крайней мере,двух факторов риска или одного фактора риска при экстренной операции кесарева сечения обусловливает риск послеродовых ВТЭОболее 3%
Поселродовое
кровотечение более 1000 мл
Курение более 10 сигарет в день
Задержка развития плода
Дефицит протеина C
Дефицит протеина S
Тактика ведения женщин с тромбофилией во время беременности и после родоразрешения (ACOG,2010)
Клинический сценарий
Во время беременности
После родоразрешения
Тромбофилия низкого риска без эпизода ВТЭО
Наблюдение без антикоагулянтов
Наблюдение без антикоагулянтов или послеродовая тромбопрофилактика при дополнительных факторах риска
Тромбофилия низкого риска с единственным эпизодом ВТЭО без долгосрочнойантикоагуляции
Профилактическая или промежуточная доза НГ/НМГ или наблюдение без антикоагулянтов
Послеродовая тромбопрофилактика НМГ
Тромбофилия высокого риска без эпизода ВТЭО
Профилактические
дозы НГ или НМГ
Послеродовая тромбопрофилактика НМГ
Тромбофилия высокого риска с единственным эпизодом ВТЭО без долгосрочнойантикоагуляции
Профилактическая или промежуточная доза НГ или НМГ
Послеродовая тромбопрофилактика 6 нед.
Единственный предыдущий эпизод ВТЭО, связанный с преходящим фактором (беременность, эстрогены) без тромбофилии
Наблюдение без антикоагулянтов
Единственный эпизод ВТЭО, связанный с непреходящим фактором без тромбофилии
Наблюдение без антикоагулянтов или профилактическая или промежуточная доза НГ/НМГ
Послеродовая тромбопрофилактика
промежуточными дозами НМГ
Два или более эпизода ВТЭО с тромбофилией или без тромбофилии без долгосрочной антикоагуляции
Профилактическая или, промежуточная доза НГ или НМГ
Лечебная или промежуточная доза НГ/НМГ течение 6 нед.
Два или более
эпизода ВТЭО с тромбофилией или без тромбофилии с долгосрочнойантикоагуляцией
Отрегулированная доза НМГ или НГ
American College of Obstetricians and Gynecologists (ACOG).Inherited thrombophilias in pregnancy. Washington (DC): American College of Obstetricians and Gynecologists (ACOG); 2010 Apr. 11 p. (Practice bulletin; no. 111).
Особенности дозирования гепаринов во время беременности
Во время беременности имеется ряд особенностей, которые существенно влияют на эффективность гепарина и НМГ, а именно:
Увеличение объема распределения
Увеличение скорости клубочковой фильтрации
Большее связывание гепарина с белками плазмы
У гепаринов более короткий период полужизни
Более низкие пиковые концентрации в плазме
В связи с этим введено понятие «промежуточных доз» гепаринов:
Нефракционированный гепарин каждые 12 ч для достижения анти-Xa уровня 0,1 к 0,3 ЕД/мл
НМГ: дальтепарин 5 000 ЕД подкожно каждые 12 ч или эноксапарин 40 мг подкожно каждые 12 ч, анти-Ха уровень
– 0,2-0,6 ЕД/мл
Профилактические дозы нефракционированного гепарина и НМГ
Препарат
Профилактические дозы
5000 ЕД подкожно через 8-12 ч
20–40 мг 1 раз в сутки
2500–5000 МE 1–2 раза /сут
0,3–0,6 мл (2850–5700 ME)1 раз /сут
Профилактические дозы эноксапарина в зависимости от массы тела (RCOG,2009)
Доза эноксапарина
Промежуточная доза (при весе 50-90 кг)
40 мг 2 раза в сутки
1,0 мг/кг 2 раза в сутки – во время беременности
1,5 мг/кг в сутки –после родов
Лечебные дозы
нефракционированного гепарина и НМГ
Препарат
Лечебная доза
Нефракционированный гепарин (1С) в/в
Старт: 80 ЕД/кг или 5000 ЕД поддерживающая доза: 18 ЕД/кг/ч
Нефракционированный гепарин (1С) подкожно
Старт: в/в болюс 5000 ЕД, поддерживающая доза: 17500-18000 ЕД, или 250 ЕД/кг п/к через 12 ч
1 мг/кг каждые 12 ч, 1,5 мг/кг 1 раз в сут (1С)
120 ЕД/кг каждые 12 ч, 200 ЕД/кг в сут (1С)
п/к при массе тела 100 кг – 10 мг в сутки (1С)
Тромбопрофилактика после предудущего эпизода тромбоза у пациенток группы высокого риска
Риск
История
Профилактика
Очень высокий
ПредыдущийВТЭО с долгосрочным приемом варфарина
Дефицит антитромбина III
Антифосфолипидный синдром с ВТЭО
Лечебные дозы НМГ во время беременности и как минимум 6 недель после родов прием НМГ или варфарина
Высокий
Предыдущие или текущие неспровоцированные ВТЭО
ВТЭОсвязанные с эстрогенами, ВТЭО и тромбофилия
ВТЭО и семейный анамнез
Бессимптомная тромбофилия (комбинированные факторы, гомозиготный FVL)
Профилактические дозы НМГ во время беременности и 6 недель после родов
Умеренный
Единственный предыдущий ВТЭО, связанный с преходящим фактором без тромбофилии, семейного анамнеза и других факторов
Бессимптомная тромбофилия (исключая дефицит антитромбина, комбинированные факторы, гомозиготный FVL)
НМГ во время беременности по согласованию
НМГ в профилактических дозах 6 недель после родов
Схема применения варфарина и НМГ в послеродовом периоде
Дни перед процедурой
Варфарин
Лечебные дозы НГ или НМГ
24 ч до родоразрешения
Во время беременности не применяется
Лечебная доза однократно –не менее, чем за 18 ч до процедуры
После процедуры лечебна доза вводится не менее через 12 ч
Спустя 24 ч после родоразрешения
Лечебная доза два раза в сутки
Спустя 48 ч после родоразрешения
Лечебная доза два раза в сутки
Спустя 72 ч после родоразрешения и далее
Сочетанное применение варфарина и НМГ продолжается до достижения терапевтического уровня МНО (от 2,0 до 3,0)в течение 2 дней после чего НМГ отменяются
Основныепринципыпроведениярегионарнойанестезииипримененияантикоагулянтов(American Society of Regional Anesthesia and Pain Medicine, European Society of Anaesthesiology, 2010, 9th ed: American College of Chest Physicians, 2012)*
Препараты
Доза
Отмена до операции
Начало после операции/удаления катетера
Удаление катетера после приема/введения препарата
Нефракционированный гепарин
Проф.
Низкомолекулярный гепарин
Проф.
6-8 ч
10-12ч
24 ч
24 ч
Антагонисты рецепторов IIb/IIIaabciximab
2 недели, но в целом применение нежелательно
Прямые ингибиторы тромбина (
desirudin (Revasc), lepirudin (Refludan), bivalirudin (Angiomax)
При экстренном применении тромболитиков необходим постоянный неврологический контроль и уровень фибриногена (более 1,0 г/л)
*- в акушерстве используются только гепарин и НМГ
Противопоказания к применению антикоагулянтов во время беременности
Врожденная или приобретенная каогулопатия с повышенной кровоточивостью
Активное кровотечение во время беременности или после родов
Высокий риск кровотечения (предлежание, врастание плаценты)
Тромбоцитопения (менее 75*10 9 )
Ггеморрагический инсульт в пределах 4 недель
Тяжелая почечная недостаточность (КФ менее 30 мл/мин/1,73 м 2 )
Тяжелые заболевания печени (увеличение МНО, варикозно расширенные вены пищевода)
Неконтролируемая артериальная гипертензия (более 200/120 мм рт.ст.)
Pulmonary embolism severity index (P.E.S.I)
Признак
Баллы
Хронические обструктивные заболевания легких (ХОБЛ)
ЧСС более 110 в мин
АДсист менее 100 мм рт.ст.
Частота дыханий более 30 в мин
Температура тела менее 36 0
Делирий, нарушения сознания
менее 65 — I класс — летальность 0,7%
66-85 — II класс – летальность 1,2%
86-105 — III класс –летальность 4-8%
106-125 — IV класс– летальность 13,6%
Более 125 — V класс – летальность 25%
Модифицированная Женевская шкала риска ТЭЛА
Признаки
Баллы
Предрасполагающие факторы
Возраст более 65 лет
ТГВ или ТЭЛА в анамнезе
Операции или переломы в течение 1 месяца
Симптомы
Односторонняя боль в нижней конечности
Клинические проявления
ЧСС более 95 в мин
Боль в нижней конечности при пальпации и односторонний отек
Низкий риск – 0-3 балла
Умеренный риск 4-10 баллов
Высокий риск – более 11 баллов
Критерии
Баллы
Альтернативный диагноз менее вероятен чем ТЭЛА
Тахикардия > 100 ударов в минуту
Иммобилизация или операция в течение ближайших 4 недель
ТГВ или ТЭЛА в анамнезе
Злокачественная опухоль (химиотерапия в течение ближайших 6 месяцев или паллиативное лечение)
Диапазон
Средняя вероятность ТЭЛА, %
% с данными баллами
Интерпретация риска
2 — 6 баллов
> 6 баллов
Шкала оценки вероятности тромбоза глубоких вен WellsP.S., 1997
Клиническая особенность
Баллы
Активный рак (химиотерапия в течение ближайших 6 месяцев, или паллиативное лечение)
Паралич, парез, или иммобилизация нижней конечности
Постельный режим более 3 дней, операция в течение 4 недель
Локальная болезненность по ходу глубоких вен
Увеличение объема нижней конечности
Односторонний увеличение голени более чем на 3 см (ниже большеберцового бугра)
Односторонний отёк и изъязвление нижней конечности
Коллатерали поверхностных вен
Альтернативный диагноз столь же вероятен или более вероятен, чем ТГВ
Интерпретация вероятности ТГВ:
> или = 3 балла: высокий риск (75 %);
1 — 2 балла: умеренный риск (17 %);
Пункт о профилактике лечению венозных тромбоэмболических осложнений в акушерстве (Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений, 2009, Москва)
4.5. Особенности профилактики венозных тромбоэмболических осложнений в связи с беременностью и родами
Беременность является
фактором риска ВТЭО, однако в пределах 4—6 нед после родов опасность развития ТГВ выше, чем во время беременности. Для профилактики ВТЭО во время беременности следует использовать НМГ или НФГ, средством выбора являются НМГ. Принимать АВК во время беременности не рекомендуется, однако их можно назначить после родов; целевое МНО при этом составляет 2,5 (2,0—3,0). У беременных без тромбофилии, с единственным эпизодом ТГВ или ТЭЛА в анамнезе, связанным с обратимым фактором риска, который в настоящее время отсутствует, рекомендуется клиническое наблюдение (с использованием объективных методов диагностики при подозрении на ВТЭО) с началом профилактики антикоагулянтами после родов. Если преходящим фактором риска, связанным с ВТЭО в анамнезе, была
беременность или применение эстрогенов, следует рассмотреть целесообразность введения обычной профилактической или несколько более высокой дозы НМГ или НФГ во время беременности с продолжением профилактики антикоагулянтами после родов. У беременных без тромбофилии, с
единственным эпизодом идиопатического ТГВ или ТЭЛА в анамнезе, которые к началу беременности уже перестали получать антикоагулянты, рекомендуется один из следующих подходов:
1) использовать обычную профилактическую или несколько более высокую1 дозу НМГ или НФГ во время беременности с продолжением профилактики антикоагулянтами после родов;
2) осуществлять клиническое наблюдение до родов и использовать антикоагулянты после родов. У беременных с тромбофилиями, сильно повышающими риск ВТЭО (дефицит
антитромбина, постоянное присутствие антифосфолипидных антител, сочетание гетерозиготности по варианту протромбина G20210A и фактору V Лейдена или гомозиготность по этим нарушениям), и единственным эпизодом ВТЭО в анамнезе, которые к началу беременности уже перестали получать
антикоагулянты, рекомендуется использовать обычную профилактическую или несколько более высокую дозу НМГ или НФГ во время беременности с продолжением профилактики антикоагулянтами после родов. У беременных с более чем одним эпизодом ВТЭО в анамнезе, которые к началу беременности уже перестали получать антикоагулянты, целесообразно использовать обычную профилактическую, несколько более высокую или лечебную дозу НМГ или НФГ во время беременности с продолжением профилактики антикоагулянтами после родов. У больных, которые к началу беременности продолжали получать антикоагулянты в связи с перенесенным ТГВ или ТЭЛА, во время беременности рекомендуется один из следующих подходов: использовать лечебную дозу НМГ или НФГ, вводить 75% лечебной
дозы НМГ или применять дозу НМГ, несколько большую обычной профилактической, до родов, с возобновлением обычного подхода к применению антикоагулянтов после родов.
У всех беременных с ВТЭО в анамнезе желательно использование компрессионного трикотажа как во время беременности до родов, так и после них.
У беременных с тромбофилией без ВТЭО в анамнезе решение о целесообразности применения антикоагулянтов до родов должно приниматься с учетом индивидуальной оценки риска возникновения ТГВ. При тромбофилиях с высоким риском ВТЭО (по крайней мере, дефицит антитромбина) целесообразна профилактика как до родов, так и после них. В остальных случаях можно ограничиться клиническим наблюдением или введением обычных профилактических доз НМГ или НФГ до родов с продолжением
профилактики антикоагулянтами после родов.
При кесаревом сечении у женщин без дополнительных факторов риска ВТЭО медикаментозной профилактики не требуется. Показано
раннее восстановление подвижности. В остальных случаях в период госпитализации возможно использование профилактических доз гепарина, механических способов (эластичные чулки, перемежающаяся пневматическая компрессия нижних конечностей) или их сочетания. В ряде случаев при высоком риске ВТЭО целесообразно продлить профилактику вплоть до 4—6 нед. после родов.
ЛИТЕРАТУРА
American College of Obstetricians and Gynecologists (ACOG). Inherited thrombophilias in pregnancy. Washington (DC): American College of Obstetricians and Gynecologists (ACOG); 2010 Apr. 11
p. (Practice bulletin; no. 111).
American College of Obstetricians and Gynecologists Thromboembolism in Pregnancy Practice Bulletin Number 123, September 2011
Bagaria SJ, Bagaria VB. Strategies for Diagnosis and Prevention of Venous Thromboembolism during Pregnancy. J Pregnancy.
2011;2011:206858. Epub 2011 Jul21.
Baglin T, Gray E, Greaves M, Hunt BJ,
Keeling D, Machin S, Mackie I, Makris M Nokes T, Perry D, Tait RC, Walker I, Watson H; British Committee for Standards in Haematology. Clinical guidelines for testing for heritable thrombophilia. Br J Haematol. 2010 Apr;149(2):209-20.
Bates SM, Greer IA, Pabinger I, Sofaer S, Hirsh J; American College of Chest Physicians. Venous thromboembolism, thrombophilia, antithrombotic therapy, and pregnancy: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest.
2008 Jun;133(6Suppl):844S-886S.
Bates SM. Pregnancy-associated
venous thromboembolism: prevention and treatment. SeminHematol. 2011 Oct;48(4):271-84.
Chan WS. Venous thromboembolism in pregnancy. Expert Rev CardiovascTher. 2010 Dec;8(12):1731-40.
Chauleur C, Gris JC, Seffert P, Mismetti P. News on antithrombotic therapy and pregnancy.
Therapie. 2011 Sep-Oct;66(5):437-43.
CheYaakobCA, DzarrAA, IsmailAA, ZukyNikLahNA,
HoJJ. Anticoagulant therapy for deep vein thrombosis (DVT) in pregnancy. CochraneDatabaseSystRev. 2010 Jun 16;(6): CD007801.
Conard J, Horellou MH, Samama MM; American College of Chest Physicians (ACCP). Pregnancy and venous thromboembolism. North-American and European guidelines. American College of Chest Physicians. J Mal Vasc. 2009Nov;34(5):300-13.
European Society of Gynecology; Association for European Paediatric Cardiology; German Society for Gender Medicine; Authors/Task Force Members, ESC Guidelines on the management of cardiovascular diseases during
pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J. 2011 Dec;32(24):3147-97.
Fogerty AE, Connors JM. Treating venous thromboembolism in pregnancy. HematolOncol Clin North Am. 2011 Apr;25(2):379-91,
Gray G, Nelson-Piercy C. Thromboembolic disorders in obstetrics. Best Pract Res Clin Obstet Gynaecol. 2012 Feb;26(1):53-64. Epub 2011 Nov 23.
Horlocker TT, Wedel DJ, Rowlingson JC, Enneking FK, Kopp SL, Benzon HT, Brown DL, Heit JA, Mulroy MF, Rosenquist RW, Tryba M, Yuan CS. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine Evidence-
Based Guidelines (Third Edition). RegAnesth Pain Med. 2010 Jan-Feb;35(1):64-101.
Hunt JM, Bull TM. Clinical review of pulmonary embolism: diagnosis, prognosis,and treatment. Med Clin North Am. 2011 Nov;95(6):1203-22.
James A. H. Venous Thromboembolism in PregnancyArteriosclerosis, Thrombosis, and Vascular Biology.2009;29:326.
James A; Committee on
Practice Bulletins—Obstetrics. Practice bulletin no.123: thromboembolism in pregnancy. Obstet Gynecol. 2011 Sep;118(3):718-29.
James AH. Pregnancy and thrombotic risk. Crit Care Med. 2010 Feb;38(2 Suppl):S57-63.
James AH. Pregnancy-associated thrombosis. Hematology Am SocHematolEduc Program. 2009:277-85.
Jurus D, Duhl A, Ural SH. A review of
thromboembolic complications in pregnancy. Minerva Ginecol. 2010 Apr;62(2):121-8.
Kesteven P, Hanley J, Loughney AD. Pregnancy-associated venous thrombosis. Phlebology. 2012;27Suppl 2:73-80.
Kostrubiec M, Niewegłowska N, Pruszczyk P. Diagnosis and treatment of pulmonary embolism in pregnancy. Ginekol Pol. 2010 Apr;81(4):283-6.
Lenchus JD. Strategies
for venous thromboembolism prophylaxis programs. PostgradMed. 2011 Nov;123(6):91-101.
Lindqvist P.G., Torsson J., Almqvist Å. Postpartum thromboembolism: Severe events might be preventable using a new risk score model. Vasc Health Risk Manag. 2008 October; 4(5): 1081–1087
Lockwood C, Wendel G; Committee on Practice Bulletins— Obstetrics. Practice bulletin no. 124: inherited thrombophilias in pregnancy. Obstet Gynecol. 2011 Sep;118(3):730-40.
Lussana F, Coppens M, Cattaneo M, Middeldorp S. Pregnancy-related venous thromboembolism: Risk and the effect of thromboprophylaxis. Thromb Res. 2012Jun;129(6):673-80.
Lussana F, Dentali F, Abbate R, d’Aloja E, D’Angelo A, De Stefano V, Faioni EM, Grandone E, Legnani C, Martinelli I, Simioni P, Tormene D; Italian Society for Haemostasis and Thrombosis. Screening for thrombophilia and antithrombotic prophylaxis in pregnancy: Guidelines of the Italian Society for Haemostasis and Thrombosis (SISET). Thromb Res. 2009 Nov;124(5):e19-25.
Marik PE. Venous thromboembolism in pregnancy. Clin Chest Med. 2010 Dec;31 (4) : 731-40.
Martineau M, Nelson-Piercy C. Venous thromboembolic disease and pregnancy.Postgrad Med J. 2009 Sep;85(1007):489-94.
McLintock C, Brighton T, Chunilal S, Dekker G, McDonnell N, McRae S, Muller P,Tran H, Walters BN, Young L; Councils of the Society of Obstetric edicine of Australia and New Zealand; Australasian Society of Thrombosis and Haemostasis.Recommendations for the diagnosis and treatment of deep venous
thrombosis and pulmonary embolism in pregnancy and the postpartum period. Aust N Z J Obstet Gynaecol. 2012 Feb;52(1):14-22.
McLintock C, Brighton T, Chunilal S, Dekker G, McDonnell N, McRae S, Muller P,Tran H, Walters BN, Young L; Councils of the Society of Obstetric Medicine of Australia and New Zealand; Australasian Society of Thrombosis and Haemostasis. Recommendations for the prevention of pregnancy-associated venous thromboembolism. Aust N Z J Obstet Gynaecol. 2012 Feb;52(1):3-13.
Miller MA, Chalhoub M, Bourjeily G. Peripartum pulmonary embolism. Clin Chest Med. 2011
Mar;32(1):147-64,
Mos IC, Klok FA, Kroft LJ, de Roos A, Huisman M.V. Imaging tests in the
diagnosis of pulmonary embolism. SeminRespirCrit Care Med. 2012 Apr;33(2):138-43. Epub 2012 May 30.
Okoroh EM, Azonobi IC, Grosse SD, Grant AM, Atrash HK, James AH. Prevention of venous thromboembolism in pregnancy: a review of guidelines, 2000-2011. J WomensHealth (Larchmt). 2012 Jun;21(6):611-5.
Pajor A. Thromboembolism and antithrombotic management in pregnancy. OrvHetil. 2011 May 22;152(21):815-21.
Pengo V, Tripodi A, Reber G, Rand JH, Ortel TL, Galli M, De Groot PG;Subcommittee on Lupus Anticoagulant/Antiphospholipid Antibody of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. Update of the guidelines for lupus anticoagulant detection. Subcommittee on Lupus Anticoagulant/Antiphospholipid Antibody of the Scientific and Standardisation Committee of the International Society on Thrombosis and Haemostasis. J ThrombHaemost. 2009 Oct;7(10):1737-40.
Reid R; Society of Obstetricians and Gynaecologists of Canada. SOGC clinical practice guideline. No. 252, December 2010. Oral contraceptives and the risk of venous thromboembolism: an update. J Obstet Gynaecol Can. 2010 Dec;32(12):1192-
204.
Rodger M. Evidence base for the management of venous thromboembolism in pregnancy. Hematology Am SocHematolEduc Program. 2010;2010:173-80.
Selby R, Geerts W.
Prevention of venous thromboembolism: consensus, controversies, and challenges. Hematology Am SocHematolEduc Program. 2009:286-92.
Shannon M. Bates, Ian A. Greer, SaskiaMiddeldorp, David L. Veenstra, Anne-Marie Prabulos, and Per Olav Vandvik VTE, Thrombophilia, Antithrombotic Therapy, and Pregnancy: Antithrombotic Therapy and Prevention of Thrombosis, 9 th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines Chest
February 2012 141:2 suppl e691S-e736S; doi:10.1378/chest.11-2300
Sultan AA, West J, Tata LJ, Fleming KM,
Nelson-Piercy C, Grainge MJ. Risk of first venous thromboembolism in and around pregnancy: a population-based cohort study. Br J Haematol. 2012 Feb;156(3):366-73.
Tan M, Huisman M.V. The diagnostic management of acute venous thromboembolism during pregnancy: recent advancements and unresolved issues. Thromb Res. 2011 Feb;127Suppl 3:S13-6.
Tooher R, Gates S, Dowswell T, Davis LJ. Prophylaxis for venous thromboembolic disease in pregnancy and the early postnatal period. Cochrane Database Syst Rev.2010 May 12;(5):CD001689.
Заболотских И.Б., Синьков С.В., Шапошников С.А. Диагностика и коррекция расстройств системы гемостаза. Руководство для врачей. – Москва: Практическая медицина. – 2008. – 333 с.
Макацария А.Д. Антифосфолипидный синдром в акушерской практике. М., «Руссо»- 2002- 344 с.
Макацария А.Д. Системные синдромы в акушерско-гинекологической клинике. М.,-«Медицинское информационное агентство»- 2010-888 c.
Макацария А.Д., Бицадзе В.О., Акиньшина С.В. Тромбозы и тромбоэмболии в акушерско-гинекологической клинике. М.,- «Медицинское информационное агентство»- 2007
Макацария А.Д., Мищенко А.С., Бицадзе В.О. Синдром диссеминированного внутрисосудистого свертывания (ДВС) крови в акушерской практике. М., «Триада-Х».- 2006-496 с.
Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений – Флебология-2010-т.4-№ 2-С.6-27
Синьков С.В., Заболотских И.Б., Пенжоян Г.А., Музыченко В.П. Тромбофоилии и принципы тромбопрофилактики в акушерстве. – Анестезиология и реаниматология, 2011, №2. – с.66-70.
Чуриков Д. А., Кириенко А. И. Ультразвуковая диагностика болезней вен.-Издательство: Litterra, 2011 – 96 с.