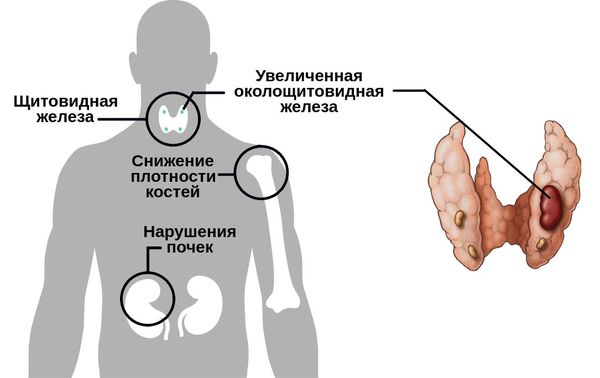
Высокий фосфор в крови что делать
Какова норма фосфора в крови. Описание причин повышенного или пониженного фосфора
Пониженный фосфор: причины и признаки
Прием алкоголя ухудшает усвоение фосфора
К развитию гипофосфатемии приводит недостаточный уровень элементов, необходимых для усвоения Р. Например, дефицит в рационе белка сопровождается снижением уровня Р в крови. Постоянное употребление алкоголя провоцирует развитие хронической недостаточности Р. Нарушение всасывания микроэлемента происходит при различных синдромах мальабсорбции.
Повышенная потеря Р с мочой является результатом заболеваний эндокринной системы, когда синтез паратгормона превышает физиологическую потребность. Другая причина — избыточная дозировка диуретиков.
Снижению концентрации Р в крови сопутствует нарушение кислотно-щелочного баланса, когда соединения щелочи накапливаются в организме. Избыток некоторых элементов приводит к развитию фосфорной недостаточности, в первую очередь — кальция, а также алюминия и магния.
Мышечная слабость может быть признаком гипофосфатемии
Перемещение соединений Р из внеклеточного пространства в клетки происходит при интенсивном лечении диабетического кетоацидоза, возобновлении нормального питания после длительного недоедания, восстановлении после удаления паращитовидных желез, дыхательном алкалозе.
Острая гипофосфатемия происходит при интоксикации алкоголем, обширных ожогах, усиленной вентиляции лёгких, в постоперационный период.
Лёгкая форма дефицита Р обычно не проявляется клинически, при значительном снижении концентрации Р в крови ощущается мышечная слабость, боли в костях, судорожный синдром. Наблюдаются симптомы нарушения функций печени, патологические переломы, размягчение и деформация костей скелета.
Низкое содержание
Нередко снижение фосфата в крови возникает и при достаточном поступлении с пищей. Пониженное содержание данного минерала считается опасным. Связано это явление с:
Симптомы нехватки Р обычно проявляются в виде отклонения работы мышечной и нервной систем. Появляются:
При продолжительной нехватке фосфора появляется опасный недуг – гипофосфатемия. Тогда вероятно усугубление симптомов и появление:
Норма фосфора в крови
Фосфор в организм поступает с пищей, ведь химические элементы не могут вырабатываться в организме. Для того чтобы усвоение его проходило правильно, требуется присутствие достаточного количества кальция и витамина D. Значительно понижают усвоение данного химического элемента чрезмерное содержание в организме железа, магния и алюминия. Принятая норма фосфора в крови, в зависимости от возраста, будет следующей:
После перехода возрастного рубежа в 60 лет значение нормы фосфора в крови у женщин и у мужчин разнится. Для женщины норма составляет от 0,90 до 1,32 ммоль/л. Для мужчин показатель находится в пределах от 0,74 до 1,2 ммоль/л.
Повышенные показатели

Это значит, что они начинают накапливаться в различных органах, в частности костной ткани, а это в свою очередь начинает нарушать работу почек, сердца или нервной системы, могут появиться даже эпизоды судорог.
Причины
Рассмотрим причины состояние, когда фосфор в крови повышен. Итак, что это значит и каковы основные причины, если наблюдается повышенный уровень содержания неорганического фосфора у ребенка или взрослого:
Основные симптомы
Важно! Наличие данных симптомов означает необходимость незамедлительного посещения врача.
Чем опасны отклонения от нормы
Значительные колебания фосфора — причина сосудистых катастроф
При избыточной концентрации Р в организме нарушается обмен веществ, наиболее частым последствием является вымывание кальция из костей. Повреждение костной ткани сопровождается разрушением зубов, частыми переломами костей. При этом кальций перемещается в кровеносное русло, что приводит к образованию отложений кальция в сосудах. Подобное состояние провоцирует развитие сердечно-сосудистых патологии, в частности, ишемической болезни сердца и сердечной недостаточности.
Последствиями гиперфосфатемии являются поражения кишечника и печени, отложение конкрементов в почках. Характерно снижение числа лейкоцитов и развитие анемии. Снижаются защитные функции организма, учащаются случаи инфекционных заболеваний, возможно появление спонтанных кровоизлияний. Рост уровня Р в крови повышает риск инфаркта и летального исхода от сердечно-сосудистых патологий.
Нарушение чувствительности — последствия отклонений фосфора
Гипофосфатемия у младенцев приводит к формированию рахита, нарушению процессов роста костей. Иммунная система, как у детей, так и у взрослых не в состоянии обеспечить полноценную защиту организма, так как нарушаются функции лейкоцитов. Работоспособность и концентрация внимания снижаются, нервная система претерпевает изменения — апатия чередуется с повышенной возбудимостью и раздражительностью. Возможно снижение чувствительности вплоть до онемения кожных покровов либо чрезмерная чувствительность к холоду, прикосновениям к коже.
Нарушается процесс сокращения мышц, в том числе сердечной мышцы. Отмечается негативное влияние дефицита фосфора на общий метаболизм организма и кислотно-щелочное равновесие.
При тяжёлых формах фосфорной недостаточности наблюдается повреждение головного мозга, что может привести к коме и летальному исходу.
Что такое гиперпаратиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., терапевта со стажем в 27 лет.
Определение болезни. Причины заболевания
Гиперпаратиреоз — это эндокринное заболевание, развивающееся при чрезмерном количестве паратиреоидного гормона (паратгормона) в организме, который выделяется околощитовидными железами.
Существуют разные формы данного нарушения.
Первичный гиперпаратиреоз помимо нарушения околощитовидных желёз и избыточного выделения паратиреоидного гормона сопровождается верхне-нормальным или повышенным содержанием кальция в крови. Среди эндокринных заболеваний он встречается довольно часто: по распространённости эта форма гиперпаратиреоза находится на третьем месте после сахарного диабета и патологий щитовидной железы.
Ежегодная заболеваемость первичной формой составляет около 0,4–18,8% случаев на 10000 человек, а после 55 лет — до 2% случаев. [6] [12] У женщин эта патология возникает чаще, чем у мужчин — примерно 3:1. Преобладающее число случаев первичного гиперпаратиреоза у женщин приходится на первое десятилетия после менопаузы.
Первичный гиперпаратиреоз может быть как самостоятельным заболеванием, так и сочетаться с другими наследственными болезнями эндокринной системы. [1] [12] Он проявляется многосимптомным поражением различных органов и систем, что приводит к значительному снижению качества жизни с последующей инвалидизацией, а также к риску преждевременной смерти.
Причины возникновения связаны с развитием в одной или нескольких околощитовидных железах таких патологий, как:
В 5% случаев на возникновение первичного гиперпаратиреоза влияет наследственность.
При вторичном гиперпаратиреозе кроме общих клинических признаков заболевания отличается снижением кальция и повышением фосфора в крови. Эта форма болезни обычно развивается как реакция компенсации и сочетает в себе усиленный синтез паратгормона и изменения в паращитовидных железах. Как правило, обнаруживается при синдроме недостаточного всасывания кальция в тонком кишечнике, дефиците витамина D и хронической почечной недостаточности.
Третичный гиперпаратиреоз развивается в случае аденомы околощитовидной железы и повышенном выделении паратгормона в условиях длительного вторичного гиперпаратиреоза.
Псевдогиперпаратиреоз развиваться п ри других злокачественных опухолях, которые способны продуцировать вещество, похожее на паратгормон.
Симптомы гиперпаратиреоза
Гиперпаратиреоз протекает длительно и бессимптомно и может быть выявлен случайно во время обследования по поводу другого заболевания.
У пациентов с гиперпарат иреозом одновременно возникают симптомы поражения различных органов и систем: язва желудка, остеопорозные проявления, мочекаменная и желчнокаменная болезни и другие. При пальпации шеи в зоне паращитовидных желёз можно нащупать достаточно большую «аденому».
Развивается быстрая утомляемость при физической повседневной нагрузке, мышечная слабость, ноющая головная боль, затруднение при ходьбе (особенно во время подъёма по лестнице или при преодолении больших расстояний), формируется как бы переваливающаяся походка.
У большинства людей с гиперпаратиреозом нарушено восприятие и память, они эмоционально неуравновешенны, тревожны, депрессивны.
При опросе пациенты с подозрением на нарушение функции околощитовидных желёз обычно жалуются на:
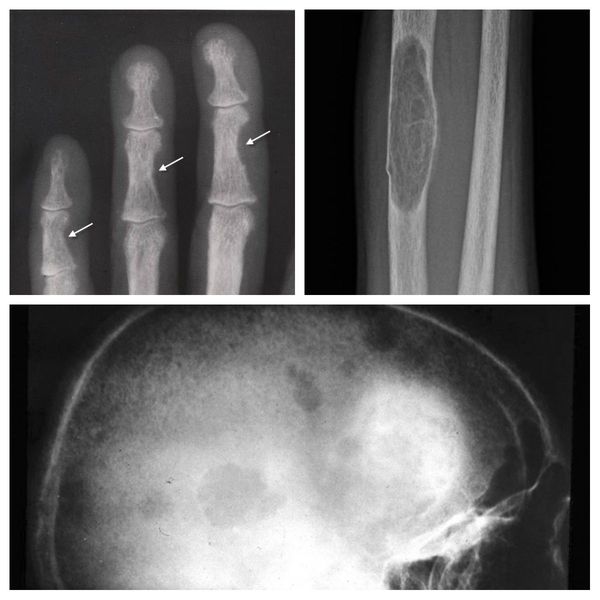
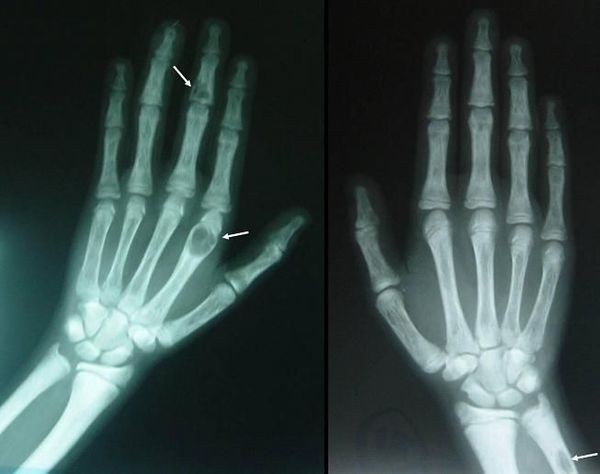
Если патологический процесс в костях продолжает развиваться, это может стать причиной расшатывания и выпадения здоровых зубов, а также деформации костей скелета, в связи с которой пациенты становятся ниже ростом. Возникающие переломы очень медленно восстанавливаются, часто с деформациями р ук и ног и образованием непрочных суставов. На конечностях появляются кальцинаты — результат отложения солей.
У женщин с повышенной функцией щитовидной железы в менопаузе риск костных осложнений возрастает.
В большинстве случаев первые проявления гиперпаратиреоза сопровождаются:
При развитии поражения сосудов в виде кальциноза и склероза нарушается питание тканей и органов, а повышенный уровень кальция в крови способствует развитию и ухудшению ишемической болезни сердца.
Гиперпаратиреоз с нехарактерными симптомами и постепенным началом часто сопровождается:
Патогенез гиперпаратиреоза
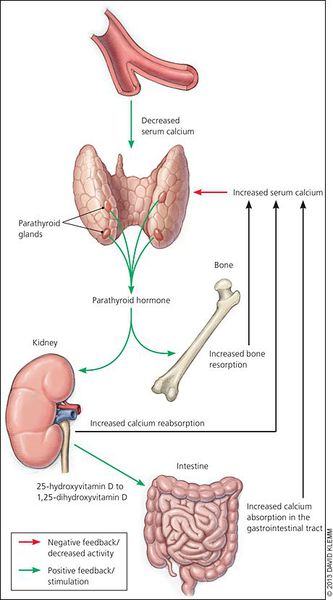
Кальций является важным компонентом, который влияет на прочность костей и обменные процессы в организме. В норме уровень кальция, а также фосфора поддерживает паратгормон, выделяемый околощитовидными железами.
При аденоме или ином нарушении этих желёз взаимосвязь кальция и паратгормона нарушается: если раньше повышенное содержания кальция сдерживало уровень паратгормона, то теперь развивается дефект рецепторов, чувствительных к кальцию, которые расположены на поверхности главных клеток паращитовидных желёз.
В связи с этим в организме происходит ряд нарушений:
При избытке паратгормона усиливается выведение из костной ткани кальция и фосфора. Клинически это проявляется изменениями в костях: их искривлением и размягчением, возникновением переломов. При этом уровень кальция в костях снижается, а его уровень в крови заметно увеличивается, т. е. возникает гиперкальциемия. Она проявляется мышечной слабостью, избыточным выделением минералов с мочой при усиленном мочеиспускании и постоянной жаждой, что приводит к почечнокаменной болезни и нефрокальцинозу — накоплению и отложению солей кальция в главной ткани почек. Также избыток кальция в крови становится причиной нарушения тонуса сосудов и возникновения артериальной гипертензии. [1] [12]
У пациентов с первичным гиперпаратиреозом часто наблюдается острая нехватка витамина D, а после оперативного лечения заболевания повышается вероятность развития синдрома голодных костей — последствия гиперкальциемии. [15]
Классификация и стадии развития гиперпаратиреоза
Как уже говорилось, бывает первичный, вторичный и третичный гиперпаратиреоз. При этом первичную форму заболевания разделяют на три вида:
Согласно МКБ 10, выделяют четыре формы заболевания:
Другая классификация гиперпаратиреоза, опубликованная в 2014 году, по степени выраженности симптомов разделяет заболевание на три формы:
В зависимости от того, какие именно органы или системы поражены, выделяют:
Осложнения гиперпаратиреоза
Длительное течение заболевания сказывается на формировании костей. Так, н а поздних стадиях вовремя не диагностированного гиперпаратиреоза наблюдаются:
Самое тяжёлое осложнение гиперпаратиреоза — гиперкальциемический криз. Он возникает внезапно после резкого повышения уровня кальция в крови до 3,5-5 ммоль/л (в норме этот показатель составляет 2,15-2,50 ммоль/л). [17] Проявляется резким обострением всех симптомов гиперпаратиреоза.
Пусковые механизмы осложнения — острые инфекционные заболевания (чаще всего ОРВИ), внезапный перелом, длительный постельный режим, беременность, бесконтрольный приём препаратов, содержащих кальций и витамин D, а также тиазидных мочегонных средств.
Риск возникновения криза зависит от того, насколько повышен уровень кальция в крови. [17]
Опыт лечения тяжелых нарушений фосфорно-кальциевого обмена при терминальной почечной недостаточности с использованием цинакалцета
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их ле
Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их лечения [1]. Анализ Базы данных пациентов с заболеваниями почек (USRDS) и результатов исследования NHANES III в США показал, что около 26 млн взрослых, то есть примерно 14,6% от числа населения старше 20 лет, страдают хроническими заболеваниями почек [4]. За последние пять лет число больных, находящихся на заместительной почечной терапии, увеличилось более чем на 25% и на данный момент составляет более 2 млн человек. При этом наибольшее количество больных, получающих заместительную почечную терапию, зарегистрировано в Японии (2230 пациентов на 1 млн жителей) и в США (1650 больных на 1 млн жителей). Наибольший рост числа таких пациентов зафиксирован в развивающихся странах (в том числе в России) — свыше 50% за 5 лет [6].
Исходя из данных о весьма значительной распространенности хронических заболеваний почек и динамике прироста терминальной стадии хронической почечной недостаточности в течение последних 20 лет эксперты прогнозируют и в будущем дальнейший рост численности этой категории больных, тем более что, благодаря значительному техническому прогрессу, заместительная почечная терапия в настоящее время может применяться практически без ограничений [4].
Проблема лечения терминальной стадии хронической почечной недостаточности усугубляется тем, что, несмотря на значительный прогресс в заместительной почечной терапии, ее прогноз все еще остается весьма неблагоприятным. В США сохраняется высокая годичная летальность пациентов, находящихся на заместительной почечной терапии, — более 20%. Ожидаемая продолжительность их жизни значительно короче, чем в сходной возрастной группе. Так, для пациентов в возрасте от 40 до 44 лет она составляет 7,1–11,5 года, а для пациентов от 60 до 64 лет — 2,7–3,9 года. Частота сопутствующих заболеваний у больных с хроническими заболеваниями почек также высока. Их среднее количество у больного, находящегося на заместительной почечной терапии, равно четырем, и основную роль при этом играют заболевания сердечно-сосудистой системы [22].
Пациенты с хроническими заболеваниями почек имеют большую вероятность умереть от осложнений своего заболевания, чем дожить до потребности в диализе. Летальность вследствие заболеваний сердца среди пациентов с терминальной стадией хронической почечной недостаточности в 10 раз выше, чем в общей популяции. Например, по данным американского регистра 2002 года у больных с почечной недостаточностью в 24,8% случаев выявлена ишемическая болезнь сердца, а в 8,7% — инфаркт миокарда [29]. У пожилых пациентов с хронической почечной недостаточностью частота ишемической болезни сердца выше на 22%, латентной ишемии — на 16%, а новых коронарных событий — в 3,4 раза по сравнению с пациентами без нарушения функции почек [6]. По данным исследования HOPE легкая почечная недостаточность (креатинин плазмы 124–200 мкмоль/л), независимо от других факторов риска и лечения, ассоциировалась с увеличением сердечно-сосудистой смертности от инфаркта миокарда и инсульта на 40% [25].
Предметом интереса недавних исследований стал вопрос, в какой мере сопутствующие сердечно-сосудистые заболевания могут быть связаны с нарушениями функции паращитовидных желез, развивающимися параллельно со снижением функции почек. Концепция, в соответствии с которой воздействие на рецепторы, подобные рецепторам паращитовидных желез, обнаруженные во многих органах и тканях, могут играть определенную роль в развитии и прогрессировании сердечно-сосудистых заболеваний у пациентов с хроническими заболеваниями почек, является относительно новой [2].
Вторичный гиперпаратиреоз при хронических заболеваниях почек
У пациентов с хроническими заболеваниями почек нарушенный синтез гормонально-активного витамина D в сочетании с длительной гиперкальциемией и повышенным уровнем фосфатов приводит к вторичному гиперпаратиреозу, одному из наиболее частых и тяжелых осложнений (около 30% пациентов, находящихся на программном гемодиализе) [12]. Это состояние, характеризующееся компенсаторной гиперсекрецией паратиреоидного гормона, приводит как к морфологическим изменениям паращитовидных желез, так и к развитию фиброзного остеита, потере костной массы и к сопутствующим сердечно-сосудистым заболеваниям [20]. Как правило, уровни паратиреоидного гормона в крови начинают повышаться при уменьшении скорости клубочковой фильтрации ниже 60 мл/мин/1,73 м2 [22]. К настоящему времени вопрос о времени появления у пациентов с хроническими заболеваниями почек сопутствующих сердечно-сосудистых заболеваний, их каузальной связи с дисфункцией паращитовидных желез и возможности обратного развития на фоне патогенетического лечения вторичного гиперпаратиреоза до конца не ясен [2, 3].
Давно известно, что паратиреоидный гормон оказывает воздействие на функционирование многих органов и систем [3]. При уремии, выделяясь в супрафизиологических концентрациях, он приобретает черты «универсального уремического токсина», вызывая плейотропную органную дисфункцию. Гиперсекреция паратиреоидного гормона способствует развитию ренальной остеодистрофии, уремической кардиомиопатии, «кальцификации миокарда», клапанов сердца и его проводящей системы, диффузному фиброзу миокарда, внескелетной кальцификации, артериальной гипертензии, ускорению развития атеросклероза, генерализованной васкулопатии, энцефалопатии; влияет практически на все стадии гемопоэза; нарушает секрецию инсулина [3, 15, 17, 20, 25, 31]. Эти события неразрывно связаны (по крайней мере, частично) с избыточной концентрацией паратиреоидного гормона и плохо корригируются заместительной почечной терапией.
Вторичная гиперплазия паращитовидных желез с повышением уровня паратиреоидного гормона в крови развивается практически у всех больных с хроническими заболеваниями почек. Вторичный гиперпаратиреоз у больных с хроническими заболеваниями почек — это компенсаторная гиперфункция паращитовидных желез, исходно направленная на поддержание физиологических параметров минерального и костного обмена, приводящая при прогрессировании почечной недостаточности к необратимым морфологическим изменениям (гипертрофии и гиперплазии главных клеток) паращитовидных желез [3].
Таким образом, своевременная диагностика, профилактика и адекватное лечение вторичного гиперпаратиреоза чрезвычайно важны для повышения качества и продолжительности жизни пациентов с хроническими заболеваниями почек.
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек до конца не ясен и продолжает уточняться. В развитии вторичного гиперпаратиреоза играют роль разнообразные факторы, что приводит к запуску целого каскада биохимических и патофизиологических изменений, приводящих к необратимым морфологическим изменениям паращитовидных желез [2, 3, 22, 23]: транзиторная и/или персистирующая гиперфосфатемия (ретенция фосфатов); резистентность рецепторов органов-мишеней к паратиреоидному гормону; изменение метаболизма витамина D.
На сегодняшний день в целом остается верной гипотеза Bricker N.?S. (1972), в основу которой были положены представления о том, что при хронической почечной недостаточности главным стимулом к развитию вторичного гиперпаратиреоза является гипокальциемия, которая возникает в ответ на гиперфосфатемию, связанную с ретенцией фосфатов [7, 8]. При хронической почечной недостаточности, особенно в терминальной ее стадии, происходит патологическая фенотипическая модуляция рецепторов (в т. ч. из-за изменения молекулярной структуры и их количества) к ионизированному кальцию на поверхности клеток паращитовидной железы и других органов-мишеней (кость, кишечник, сосуды и прочее), что кардинально изменяет гомеостаз кальция. В результате происходит сдвиг секреторной set-point и клетки паращитовидных желез начинают высвобождать паратиреоидный гормон в ответ не только на низкую, но и на нормальную концентрацию ионизированного кальция в крови больного [5, 9]. Снижение концентрации в крови 1,25-дигидроксихолекальциферола и увеличение концентрации фосфатов также являются прямыми стимуляторами синтеза паратиреоидного гормона [7, 8].
Эти представления легли в основу широкого клинического применения у пациентов, находящихся на заместительной почечной терапии, гипофосфатной диеты, фосфат-связывающих препаратов и кальцитриола. В результате удалось добиться более благоприятного течения ренальных остеодистрофий. Однако это не уменьшило остроту проблемы вторичного гиперпаратиреоза и связанных с ним осложнений со стороны сердечно-сосудистой системы.
Современные стандартные подходы к лечению вторичного гиперпаратиреоза при хронических заболеваниях почек
Современная (стандартная) терапия нарушений минерального обмена и связанных с ним осложнений включает диетические рекомендации по ограничению приема фосфатов, прием аналогов витамина D и фосфат-связывающих препаратов. Это в ряде случаев позволяет контролировать показатели фосфорно-кальциевого обмена и уровень паратиреоидного гормона в пределах целевых значений, установленных K/DOQI [22]. Целью терапии вторичного гиперпаратиреоза является снижение четырех лабораторных показателей: уровня паратиреоидного гормона, кальция и фосфора в сыворотке крови, а также фосфорно-кальциевого произведения (табл. 1).
Cтандартная терапия нарушений минерального и костного обмена по данным литературы более чем в половине случаев не позволяет достичь необходимого клинического эффекта, а в некоторых ситуациях даже противопоказана [20].
Так, лишь 47,5% пациентов, находящихся на программном гемодиализе, соблюдают диету, направленную на ограничение фосфатов, при этом уровень фосфора и кальция сыворотки у этой группы больных не имеет достоверных различий по сравнению с пациентами, не соблюдающими диету. Кроме того, содержание фосфора в различных диетах, назначаемых пациентам, варьирует от 550 до 1000 мг/сутки (18–36 ммоль/сутки), что затрудняет контроль количества поступающих с пищей фосфатов [2].
Адекватный гемодиализ также не всегда позволяет справиться с нарушениями минерального обмена. Известно, что современная гемодиализная терапия позволяет удалять лишь лимитированное количество фосфатов: от 20 до 40 ммоль за сеанс, что за неделю составляет 60–120 ммоль [24]. Более того, риск развития тяжелых форм гиперпаратиреоза (и, как следствие,?— относительный риск смерти) у таких больных прямо пропорционален продолжительности нахождения на гемодиализе (смертность в этой группе больных составляет 44% за 4 года) [1]. Эффективным является увеличение диализного клиренса фосфатов с использованием ежедневного дневного или ночного гемодиализа, гемодиафильтрации [11]. Однако такой подход неприменим в широкой клинической практике.
Эффективность терапии активными формами витамина D, например кальцитриолом, также зачастую не оправдывает ожиданий. Применение этой группы препаратов ограничено, во-первых, из-за исходной или развивающейся на фоне лечения резистентности, что требует назначения их в дозах, превышающих физиологические. Во-вторых, имея относительно узкое «терапевтическое окно» и усиливая всасывание кальция и фосфора в желудочно-кишечном тракте, они приводят к гиперкальциемии, усугубляют гиперфосфатемию и увеличивают фосфорно-кальциевое произведение [28]. Предполагаемые механизмы резистентности к лечению активированными аналогами витамина D при хронической почечной недостаточности включают в себя: опосредованные уремией снижение транспорта кальцитриола в паращитовидные железы; снижение образования комплекса кальцитриол–рецепторы к витамину D; снижение содержания функциональных рецепторов к витамину D в ткани паращитовидных желез [12]. Парикальцитол (Земплар) — синтетический селективный активатор рецепторов витамина D.
Подобные парикальцитолу модифицированные аналоги витамина D имеют меньший кальциемический эффект и, соответственно, более широкое терапевтическое окно [12, 19]. Кроме того, они быстрее, чем кальцитриол, подавляют секрецию паратиреоидного гормона и приводят к менее выраженному увеличению концентрации кальция и фосфора в сыворотке [27]. Парикальцитол сохраняет свою способность снижать паратиреоидный гормон у пациентов с гиперфосфатемией или с устойчивостью к терапии кальцитриолом [18].
Традиционное применение кальциевых фосфат-биндеров позволяет в ряде случаев корригировать гиперфосфатемию и гипокальциемию. Однако эта группа препаратов позволяет абсорбировать не более 50% потребляемого фосфора [16]. Кроме того, как любой другой препарат, фосфат-биндеры не лишены побочных эффектов: гиперкальциемия за счет всасывания кальция; связывание в кишечнике железа наряду с фосфатом; желудочно-кишечные расстройства. Необходимо считаться с тем, что на стандартной диете (1–1,2 г/кг/сутки белка) эффективны только высокие дозы карбоната кальция (9–10 г/сутки). Длительное применение таких доз карбоната кальция в 60% случаев осложняется гиперкальциемией. В настоящее время созданы фосфат-биндеры на полимерной основе, не содержащие ни алюминия, ни кальция и не всасывающиеся в кишечнике: севеламера гидрохлорид (RenaGel), севеламера карбонат (Renvela), Genzyme, Ирландия. Основное различие между ними состоит в том, что последний не вызывает метаболического ацидоза и таким образом не способствует прогрессированию костной болезни. Однако опыта применения этой группы препаратов в России пока нет [2].
В качестве крайней меры пациентам с осложненными формами вторичного гиперпаратиреоза применяется оперативное лечение, которое, к сожалению, подчас также оказывается неэффективным [2].
Указанные трудности в лечении нарушений минерального и костного обмена у больных с хроническими болезнями почек способствовали разработке и внедрению в клиническую практику принципиально новой группы препаратов — кальцимиметиков, изменяющих чувствительность рецепторов паращитовидных желез. Цинакалцет (Код АТХ: Н05ВХ01) производится международной биотехнологической компанией AMGEN (США) и зарегистрирован в Северной Америке под торговым названием Сенсипар, а в Европе — Мимпара.
В России препарат появился относительно недавно, поэтому достаточный опыт его практического применения еще не накоплен. За рубежом цинакалцет активно применяется с 2004 года более чем в 34 странах и хорошо зарекомендовал себя не только с клинической, но и с экономической точки зрения, позволяя заметно снизить затраты на лечение тяжелых осложнений хронических заболеваний почек.
Цинакалцет обладает прямым кальцимиметическим действием, непосредственно снижающим уровень паратиреоидного гормона, повышая чувствительность рецептора к внеклеточному кальцию. Снижение уровня паратиреоидного гормона коррелирует с концентрацией цинакалцета в крови. После перорального приема цинакалцета его максимальная концентрация в плазме крови достигается примерно через 2–6 часов, что сопровождается максимальным снижением уровня паратиреоидного гормона в крови. После этого концентрация цинакалцета начинает снижаться, а уровень паратиреоидного гормона повышается в течение 12 часов после введения дозы, в последующем супрессия паратиреоидного гормона остается примерно на одном и том же уровне до конца суточного интервала при режиме дозирования один раз в день. Примерно 80% вводимой дозы цинакалцета выводится почками, 15% — через желудочно-кишечный тракт. Снижение концентрации цинакалцета происходит в два этапа: первоначальный период полувыведения составляет примерно 6 часов, окончательный — от 30 до 40 часов. Стабильное содержание препарата достигается в течение 7 дней с минимальной кумуляцией. После достижения стабильной фазы концентрация кальция в сыворотке крови остается на постоянном уровне в течение всего интервала между приемами препарата. По данным литературы цинакалцет позволяет существенно снизить уровень паратиреоидного гормона уже к концу второй недели лечения.
В качестве иллюстрации вышесказанному приводится следующий клинический пример:
Больная Х., 64 года, с декабря 2005 года находится на лечении программным гемодиализом (в ГВКГ им. Н.?Н.?Бурденко с апреля 2007 года) по поводу терминальной почечной недостаточности в исходе диабетической нефропатии в сочетании с хроническим пиелонефритом. С 1965 года диагностируется алиментарно-конституциональное ожирение 2–3 степени, с 1996 года — сахарный диабет 2-го типа средней тяжести, а затем — тяжелого течения. С 1998 года — ишемическая болезнь сердца: клиника нагрузочной стенокардии отсутствовала, диагноз верифицирован на основании признаков «безболевой ишемии» миокарда и AV-блокады I степени по данным суточного мониторирования электрокардиограммы. Примерно с того же времени повышение уровня артериального давления (АД) до 220 и 140 мм рт. ст., адаптирована к АД 160/100 мм рт. ст. Постоянная четырехкомпонентная гипотензивная терапия в составе: Альбарел 2 мг/сутки, Амловас 20 мг/сутки, Аккупро 20 мг/сутки, Эгилок 100 мг/сутки — позволяла поддерживать целевой уровень АД (не свыше 140/90 мм рт. ст.) до 2005 года. С целью профилактики атеросклеротических осложнений постоянно принимала статины в суточной дозе 10 мг.
С начала 2005 года присоединяются клинико-лабораторные и инструментальные признаки прогрессирования атеросклероза, «озлокачествления» гипертензивного синдрома: в январе 2005 года появляется микроальбуминурия, которая уже в марте сменяется протеинурией до 1,5 г/сутки; несмотря на регулярный прием рекомендованных гипотензивных препаратов развивается лабильность АД. В связи с этим по рекомендации врачей поликлиники при ситуационном повышении АД свыше 160/100 мм рт. ст. (до двух-трех раз в неделю) принимала дополнительно Кордафлекс 40 мг/сутки. По данным визуализирующих методов исследования (эхокардиографии, рентгенографии органов грудной клетки) определяется достаточно быстрое увеличение массы миокарда (исходно 345 г, в последующем 436 г) с появлением признаков диастолической дисфункции первого типа и клинических симптомов хронической сердечной недостаточности на уровне функциональной классификации (ФК) II, метастатической кальцификации мягких тканей, крупных сосудов и створок аортального клапана (атеросклеротический стеноз устья аорты), что в тот период времени трактовалось как следствие особенно тяжелого течения атеросклероза, и в связи с этим увеличивается суточная доза статинов до 20 мг.
В декабре 2005 года на фоне роста азотемии (креатинин сыворотки крови 780 мкмоль/л) в результате обострения пиелонефрита, присоединения пневмонии у больной диагностируется терминальная стадия хронической почечной недостаточности и начинается лечение программным гемодиализом (3 раза в неделю по 4 часа), проведение которого вначале сопровождалось усугублением тяжести гипертензивного синдрома (АД до 240/140 мм рт. ст.). В марте 2006 и феврале 2007 года на фоне плохо поддающейся коррекции артериальной гипертензии переносит повторные острые нарушения мозгового кровообращения в бассейне левой среднемозговой артерии с исходом в правосторонний гемипарез и сенсорно-моторную афазию. В апреле 2007 года для продолжения лечения переводится в ГВКГ им. Н.?Н.?Бурденко.
В этот период у больной сохраняется выраженная артериальная гипертензия (180–200/80–90 мм рт. ст.), резистентная к стандартной ультрафильтрации и вышеуказанной медикаментозной терапии. Проведение гемодиализа с ультрафильтрацией в ежедневном режиме в течение 6 дней в неделю позволило снизить «сухой вес» на 6 кг, что сопровождалось стабилизацией АД на уровне 160/90 мм рт. ст. Концентрация фосфора в сыворотке крови составляла 2,51 ммоль/л, кальция — 2,62 ммоль/л (фосфорно-кальциевое произведение = 6,58 ммоль2/л2), уровень паратиреоидного гормона — 24,8 пг/мл. Учитывая «высокое» фосфорно-кальциевое произведение и нормальное содержание паратиреоидного гормона, медикаментозная терапия не назначалась, больной рекомендовалась гипофосфатная диета и прием карбоната кальция (до 3 г в сутки), однако соблюдение диетических правил оказалось невозможным из-за двигательных расстройств (правосторонняя гемиплегия) и низкого комплаенса (дисциркуляторная энцефалопатия с выраженными когнитивными расстройствами). Это в течение трех месяцев привело к усугублению гиперфосфатемии и гиперкальциемии (3,0 ммоль/л и 2,7 ммоль/л соответственно).
Несмотря на почти полное обездвиживание больной, предрасполагающее к развитию адинамической болезни кости, появляются лабораторные и клинические признаки гиперпаратиреоза: увеличение уровня паратиреоидного гормона до 488 пг/мл, присоединение нестерпимого кожного зуда. Ультразвуковое исследование паращитовидных желез не выявило аденоматозных изменений. Высокий уровень фосфора сделал невозможным назначение активированных аналогов витамина D. Было принято решение об изменении диализной программы с увеличением времени диализа до 15 часов в неделю и добавлением к стандартному гемодиализу еженедельно проводимой гемодиафильтрации (конвекционный клиренс — 21 литр в неделю), использовались также индивидуальные диализаторы с мембраной повышенной сорбционной активности (полиметилметакрилат) с достижением недельного Kt/V до 3,75. Это позволило приостановить прогрессирование клинических и лабораторных признаков гиперпаратиреоза (уровень паратиреоидного гормона к декабрю 2008 года составлял 504 пг/мл), выраженность кожного зуда уменьшилась, однако уровень фосфора и кальция по-прежнему оставался высоким (фосфорно-кальциевое произведение > 8,2 ммоль2/л2). Когда все методы современной терапии нарушений фосфорно-кальциевого и костного обмена были исчерпаны, нами был назначен цинакалцет (декабрь 2008 года) в стартовой дозе 30 мг/сутки.
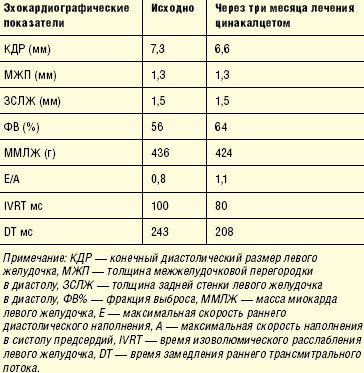
В дальнейшем контроль показателей фосфорно-кальциевого обмена и уровня паратиреоидного гормона осуществлялся один раз в месяц. С целью оценки возможного влияния цинакалцета на уровень АД, функцию сердечной мышцы ежемесячно выполнялись трансторакальная эхокардиография, суточное мониторирование АД и ЭКГ. Оценка нарушений диастолической функции левого желудочка сердца выполнялась по общепринятым критериям [10, 13, 14]. Ежедневно контролировались масса тела, уровень АД и частота сердечных сокращений (ЧСС) (утром и вечером).
Динамический контроль за указанными параметрами показал, что через 2 недели лечения у больной Х. стойко снизился уровень как систолического, так и диастолического АД (со 160/90 мм рт. ст. до 140/80 мм рт. ст.), уменьшилась ЧСС (с 90 до 78 ударов в минуту), что подтверждалось данными СМАД и ХМЭКГ в январе 2009 года. Снижение АД и урежение ЧСС позволило откорректировать в сторону уменьшения состав гипотензивной терапии: постепенно были полностью отменены Эгилок и Кордафлекс. Уровни паратиреоидного гормона, кальция и фосфора крови оставались прежними. Поскольку в «Инструкции по применению цинакалцета» заявлено, что транзиторное снижение паратиреоидного гормона начинается через 6 часов после приема первой дозы, а стойкое — через 7 дней лечения, отсутствие эффекта через месяц приема препарата у нашей больной было расценено как следствие недостаточной начальной дозы, в связи с чем она была увеличена до 60 мг/сутки (2 таблетки). Однако появление через два дня стойкой тошноты заставило нас вернуться к исходной дозе цинакалцета 30 мг в сутки. Начальное снижение уровня паратиреоидного гормона до 345 пг/мл отмечено лишь в феврале 2009 года — на третьем месяце лечения цинакалцетом в дозе 30 мг/сутки. Еще через месяц начали снижаться уровни кальция, фосфора в крови и фосфорно-кальциевое произведение. Прием цинакалцета в той же дозе в монотонном режиме в течение четырех месяцев позволил практически нормализовать концентрацию кальция и фосфора сыворотки крови (соответственно 2,06 и 2,24 ммоль/л) к июлю 2009 года, а также снизить активность паратиреоидного гормона до 155 пг/мл.
Исходно масса миокарда была повышена до 436 г за счет концентрической гипертрофии и в последующем не изменилась, однако через три месяца лечения цинакалцетом улучшились эхокардиографические показатели функционального состояния сердечной мышцы. Если в начале периода наблюдения имелись все признаки диастолической дисфункции первого типа, характеризующейся нарушением релаксации левого желудочка (аномальная релаксация) и патогенетически связанной с гипертрофией левого желудочка, повышенным уровнем артериального давления и паратиреоидного гормона, то через три месяца лечения цинакалцетом они регрессировали (табл. 2). Незначительно увеличилась фракция изгнания левого желудочка.
Обсуждение
Таким образом, только комплексный подход к лечению нарушений фосфорно-кальциевого обмена и вторичного гиперпаратиреоза с включением в фармакологическую комбинацию кальцимиметиков (цинакалцет) у больной, находящейся на заместительной почечной терапии, позволил поддерживать целевые уровни фосфорно-кальциевого обмена и паратиреоидного гормона, рекомендованные K/DOQI.
В приведенном клиническом случае традиционные подходы к коррекции минерального и костного обмена и связанного с ними вторичного гиперпаратиреоза у больной с терминальной стадией хронической почечной недостаточности, находящейся на гемодиализе, оказались неэффективными, как нам видится, по следующим причинам: невозможность соблюдения гипофосфатемической диеты и приема фосфат-биндеров (карбоната кальция) пациенткой с интеллектуально-мнестическими и двигательными расстройствами; назначение аналогов активированного витамина D (кальцитриол) было ограничено гиперкальциемией.
Дополнение комплексного лечения нарушений минерального обмена цинакалцетом позволило в течение трех месяцев достичь целевых значений минерального обмена и уровня паратиреоидного гормона. Преимуществом цинакалцета в данном случае мы считаем, помимо его очевидной эффективности в отношении гиперфункции паращитовидных желез и минерального обмена, возможность точного дозирования и однократного приема в течение суток.
Более спокойное течение артериальной гипертензии на наш взгляд явилось следствием комплекса причин: сыграли свою роль устранение гипергидратации (исходная масса тела составляла 90 кг, в последующем — 84 кг), успешная коррекции фосфорно-кальциевого обмена и снижение уровня паратиреоидного гормона. Учитывая относительно быстрое достижение нормотензии без увеличения количества и суточной дозировки антигипертензивных препаратов, нельзя исключать непосредственный гипотензивный эффект цинакалцета. Экспериментально были установлены как прямой, так и опосредованный повышенной продукцией NO вазодилятирующий эффект цинакалцета [26], а также его ингибирующее влияние на выработку ренина юкстагломерулярным аппаратом почек [23].
Диспептический синдром в виде тошноты и тяжести в эпигастрии, развившийся на следующий день после увеличения вдвое (до 60 мг) суточной дозы цинакалцета, регрессировал после возвращения к исходной дозе 30 мг так же быстро, как и развился, что не потребовало отмены препарата. Лабораторно-инструментальное обследование (фиброгастродуоденоскопия, ультразвуковое исследование органов брюшной полости, биохимическое тестирование общей и панкератической амилазы в крови и диастазы в моче) не выявило какой-либо патологии со стороны дуоденохоледохопанкреатической зоны, что позволило нам рассматривать развитие данного симптомокомплекса в рамках побочного действия цинакалцета и сделать предварительный вывод о хорошей переносимости препарата. По результатам контролируемых клинических исследований (данные о 656 больных, принимавших цинакалцет, и о 470 больных, принимавших плацебо) наиболее часто встречающимися побочными эффектами были тошнота и рвота, которые отмечались у 31% больных в группе терапии цинакалцетом и у 19% больных в группе плацебо, а также у 27% больных в группе терапии цинакалцетом и у 15% в группе плацебо. Тошнота и рвота были легкой и умеренной степени выраженности и в большинстве случаев носили кратковременный характер. Прекращение терапии в результате развития нежелательных эффектов было вызвано главным образом тошнотой (5%) и рвотой (4%).
Причиной нарушения диастолической функции левого желудочка у больной Х. на наш взгляд являлась концентрическая гипертрофия миокарда, как один из наиболее часто встречающихся вариантов ремоделирования левого желудочка у больных, длительно страдающих артериальной гипертензией и сахарным диабетом. Через три месяца приема цинакалцета стали регрессировать клинические симптомы хронической сердечной недостаточности и эхокардиографические признаки диастолической дисфункции, что более вероятно обусловлено как снижением АД до целевого уровня, так и устранением кардиотоксического действия супрафизиологических коцентраций паратиреоидного гормона. Сыграла свою роль и отмена бета-блокаторов, что стало возможным после назначения цинакалцета, поскольку эта группа препаратов негативно влияет на податливость миокарда. К сожалению, четких рекомендаций и схем терапии больных с диастолической хронической сердечной недостаточностью в настоящее время не существует. Европейское общество кардиологов (ESC) в 1997 г. опубликовало лишь общие направления терапии хронической сердечной недостаточности у больных с диастолической дисфункцией [29]. Поэтому любой положительный опыт лечения нарушений диастолической функции левого желудочка должен тщательно анализироваться.
Кроме того, минимальная эффективная поддерживающая доза цинакалцета 30 мг/сутки, что соответствует 1 упаковке (28 таблеток) на месяц, позволяет говорить о приемлемом фармакоэкономическом профиле препарата.
Таким образом, первый опыт применения цинакалцета при вторичном гиперпаратиреозе у пациентки с терминальной стадией хронической почечной недостаточности, находящейся на программном гемодиализе, оказался более чем положительным. Конечно, для выявления корреляции между снижением уровня паратиреоидного гормона и улучшением течения сердечно-сосудистой патологии необходимо накопить достаточный клинический опыт. Последующие исследования могут подтвердить или опровергнуть данное утверждение.