Выраженная бронходилятация что это значит
Хронический и острый бронхит: чем опасна болезнь и как её лечить
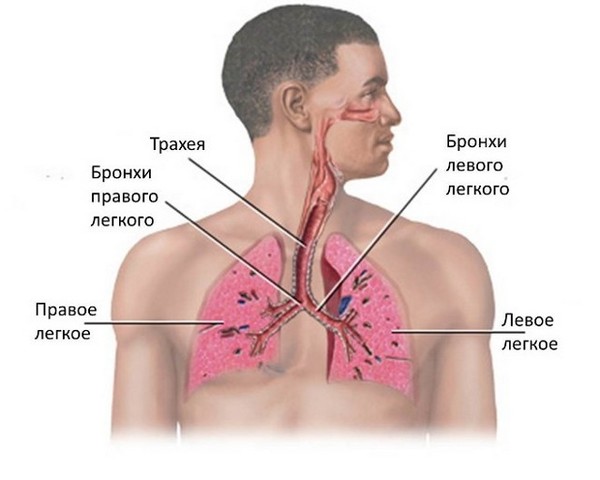
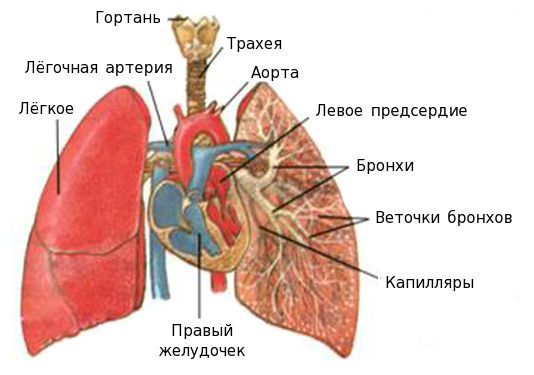
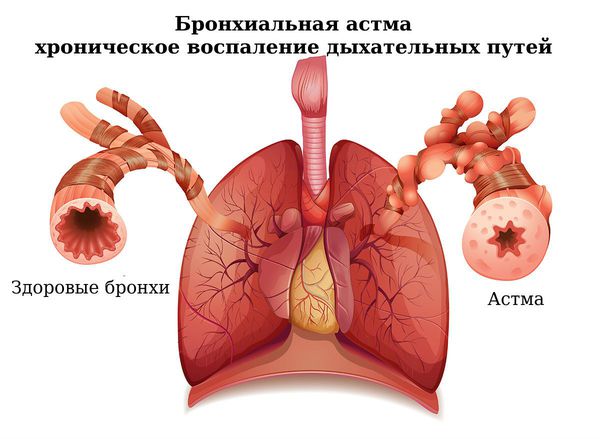
Бронхит – это патологическое состояние, при котором развивается воспаление бронхов. В свою очередь, бронхи – это пути, которые проводят воздух от трахеи к тканям легких, согревают воздушный поток, увлажняют и очищают его. Находятся они в нижней части трахеи и представляют собой две крупных ветви.
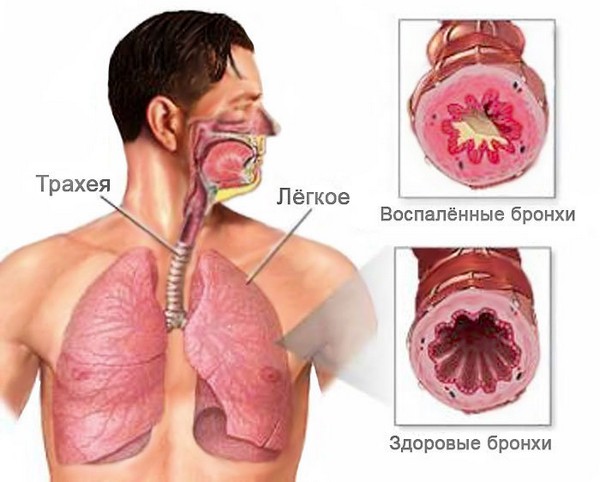
Болезнь вызывает воспаление слизистой оболочки или всей толщи бронхиальных стенок. Начинается чрезмерное выделение слизи, затрудняется дыхание. Организм пытается самостоятельно вывести лишнюю слизь, поэтому появляется сильный мучительный кашель. Патология может переходить из кратковременной острой в продолжительную хроническую форму, поэтому требует комплексного незамедлительного лечения.
Острый бронхит
Развивается в подавляющем большинстве случаев и представляет собой распространенное осложнение острой респираторной инфекции. Зачастую диагностируется у детей, так как они более восприимчивы к подобным инфекциям.
При остром поражении бронхов происходит размножение условно-патогенной микрофлоры. Слизистая меняет свою структуру, развивается поражение верхних слоев и стенок бронхов. Формируется отек слизистой, эпителиальные клетки отторгаются организмом, появляются инфильтраты на подслизистом слое. Процессы сопровождаются тяжелым продолжительным кашлем, который может сохраняться даже после излечения пациента.
Острая форма лечится в течение 3-4 недель. На протяжении этого времени восстанавливается структура и функции бронхов. При правильной и своевременной терапии прогноз благоприятный.
Хронический бронхит
При хроническом бронхите кашель с выделением мокроты наблюдается на протяжении не менее двух лет в течение трех месяцев ежегодно. При этом важно исключить наличие других причин кашля.
Такая форма чаще возникает у взрослых, так как формируется только при длительном раздражении бронхов. Причиной раздражения может быть не только многократно перенесенное острое заболевание, но и сигаретный дым, газы, пыль, химические испарения и прочие отрицательные факторы.
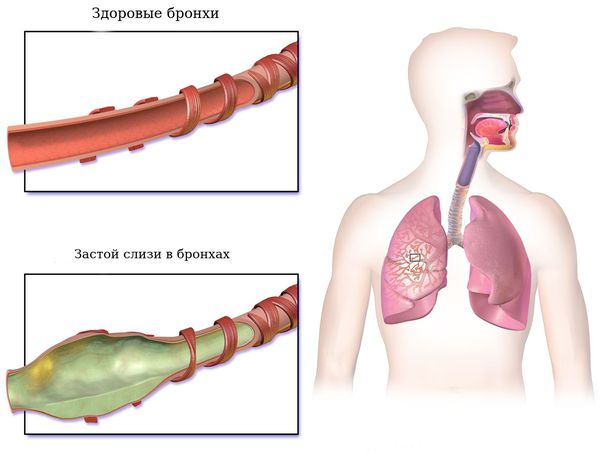
Продолжительное воздействие на слизистую бронхов неблагоприятных факторов вызывает изменения в слизистой, постепенное повышение выделения мокроты. Существенно снижается способность бронхов проводить воздух, а вентиляция легких нарушается.
Формы хронического бронхита
В зависимости от характера воспалительных процессов выделяют:
С учетом наличия нарушения проходимости (обструкции) дыхательных путей бронхит может быть:
По причинам развития болезни выделяют:
Причины заболевания
При острой и хронической формах причины развития патологического состояния бронхов несколько отличаются.
Острый бронхит в 90% случаев формируется в результате попадания в организм вирусной инфекции: гриппа, аденовируса, респираторно-синцитиального, коревого или коклюшного вируса, а также прочих возбудителей. Реже болезнь становится результатом бактериального поражения стафилококком, стрептококком, пневмококком и др.
Среди прочих факторов, которые способствуют развитию острой формы болезни:
При хронической форме основной причиной развития признано курение. У курильщиков болезнь диагностируют в 2-5 раз чаще, чем у некурящих людей. Табачный дым наносит вред как при активном, так и при пассивном курении.
Среди прочих предпосылок развития хронической формы – повторно перенесенные и частые острые бронхиты, ОРВИ, пневмонии, болезни носоглотки. Инфекционная составляющая в таких условиях усугубляет уже имеющееся поражение бронхов.
Симптомы бронхита
Признаки патологии отличаются в зависимости от острой или хронической формы течения болезни:
Осложнения
Острый бронхит может провоцировать осложнение в виде бронхопневмонии – инфекционно-воспалительного процесса, который поражает легкие, вызывает лихорадку, сухой кашель, общую слабость.
Бесконтрольное прогрессирование хронического заболевания приводит к регулярным острым пневмониям и со временем переходит в обструктивную болезнь легких. При этом сужается просвет и отекает слизистая дыхательных путей, частично разрушаются легочные ткани.
Хронический бронхит также может стать причиной развития легочной гипертензии, сердечно-легочной недостаточности, эмфиземы легких, бронхоэктатичской болезни, пневмонии и ряда других опасных заболеваний.
Когда стоит обратиться к врачу
Крайне важно не пускать болезнь на самотек. К врачу нужно обращаться при появлении первых симптомов возможного бронхиального поражения: кашля, повышенной температуры, недомогания. Врач проведет диагностику, укажет, как и чем лечить бронхит и кашель, а дальнейшая терапия пройдет в домашних условиях под контролем доктора. В большинстве случаев патология не требует госпитализации.
Бесконтрольное течение острой болезни в большинстве случаев приводит к усугублению симптоматики, повторному развитию заболевания, переходу в хроническую болезнь и формированию осложнений.
Чтобы определить болезнь и изучить степень поражения бронхов, необходима комплексная диагностика пациента и изучение клинической картины. Этим занимается терапевт или педиатр, который назначает необходимые для диагностики обследования. При необходимости он направляет пациента на консультации к пульмонологу и другим смежным специалистам.
Если по результатам опроса и осмотра у врача появились подозрения на бронхит или другие схожие болезни, назначаются дополнительные обследования:
Среди возможных дополнительных исследований: эхокардиография, электрокардиография, бронхография и др.
Лечение
Терапия бронхита носит комплексный характер, так как преследует цель избавить организм от инфекции, восстановить проходимость бронхов, устранить усугубляющие болезнь факторы.
В первые дни острой фазы необходимо придерживаться постельного режима, много пить, соблюдать молочно-растительную диету. Крайне важно отказаться от курения и поддерживать влажность воздуха в помещении, где находится больной, на уровне 40-60%.
Медикаментозная терапия острой стадии cводится к приему препаратов, которые облегчают симптомы и предотвращают развитие осложнений. Для этого используют:
Важную роль играет физиотерапия. Улучшить состояние пациента помогает лечебная гимнастика, физиотерапия, вибрационный массаж.
Хроническая форма заболевания требует продолжительного лечения как при обострении, так и во время ремиссии. Схема терапии предусматривает прием перечисленных препаратов по назначению врача, а также интенсивную программу легочной реабилитации, которая помогает снизить проявления болезни.
Максимально важно устранить из жизни пациента причину, которая спровоцировала развитие хронического бронхита, вести здоровый образ жизни, укреплять иммунитет и правильно питаться.
Профилактика бронхита
Профилактика легочных заболеваний – это комплексный и систематический процесс, цель которого – укрепить защитные силы организма и минимизировать воздействие факторов риска. Для этого необходимо в первую очередь отказаться от курения, защищать легкие от пыли, вредных химических соединений, слишком горячего или сухого воздуха. В рамках профилактики важно своевременно лечить хронические инфекции, предотвращать аллергические реакции и обязательно обращаться к врачу при первых признаках заболевания, проходить ежегодную вакцинацию от гриппа и пневмонии.
Что такое бронхоэктатическая болезнь? Причины возникновения, диагностику и методы лечения разберем в статье доктора Никитиной Лидии Юрьевны, пульмонолога со стажем в 18 лет.
Определение болезни. Причины заболевания
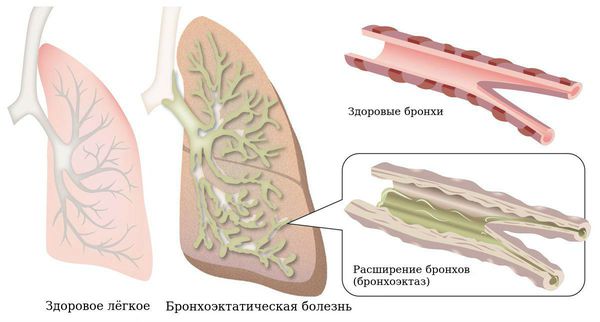
Что такое бронхоэктазы
Бронхоэктазы — это расширение и разрушение крупных бронхов, вызванные воспалением и хронической инфекцией.
Причины заболевания
Заболевание может развиться в результате перенесённой дыхательной инфекции — при нелеченной пневмонии, после кори, коклюша, аденовирусной инфекции. Туберкулезные и нетуберкулезные микобактерии также могут как стать причиной бронхоэктазов.
Помимо этого, к расширению бронхов могут приводить и другие факторы.
Ошибки в лечении острых воспалительных процессов в лёгких, возникших вследствие локальных нарушений структуры бронхов.
Генетические факторы
К бронхоэктазам могут приводить наследственные структурные аномалии развития лёгких, ассоциированные со слабостью бронхиальной стенки:
Иммунные расстройства (нарушение продукции клеток иммунного ответа и иммуноглобулинов) также могут быть причиной наследственного характера бронхоэктазов.
Вдыхание (аспирация) инородных тел, секрета носоглотки, токсическое и химическое поражение лёгких.
Можно ли вылечить бронхоэктатическую болезнь
Бронхоэктатическая болезнь относится к хроническим заболеваниям с необратимой структурной перестройкой бронхиального дерева.
Симптомы бронхоэктатической болезни
Кашель
Боли в груди
В период обострений могут появляться боли в грудной клетке. Это связано с вовлечение плевры. Боль может усиливаться при глубоком вдохе, но иногда не имеет чёткой локализации и сопровождается ощущением сдавления, распирания, затруднённого дыхания. Часто во время обострений повышается температура тела, лихорадка имеет длительный характер, сочетается с ознобами, потливостью, слабостью, повышенной утомляемостью.
Одышка и хрипы
При распространённом процессе и присоединении бронхиальной обструкции пациенты могут жаловаться на одышку смешанного характера и свистящие хрипы.
Снижение трудоспособности
Нередко больных беспокоит снижение переносимости физической нагрузки, развивается дыхательная недостаточность — снижение способности лёгких поддерживать необходимую концентрацию кислорода в крови.
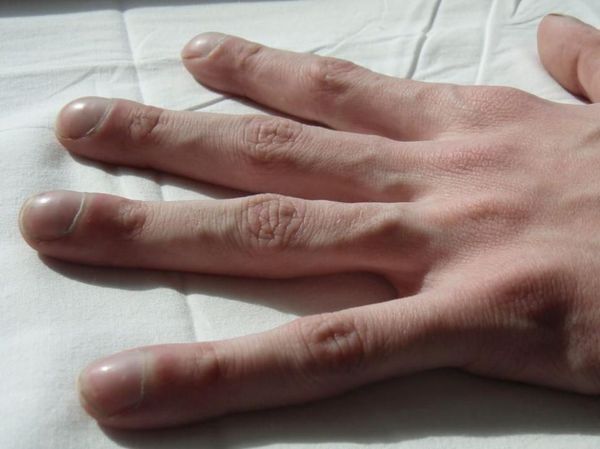
Пальцы Гиппократа
Симптом «пальцев Гиппократа», или «барабанных палочек» отмечается при многолетнем течении заболевания с частыми обострениями. Для него характерно колбовидное утолщение концевых фаланг пальцев кистей. Также при длительном течении заболевания возможна потеря веса.
Отставание в развитии
Отставание в развитии для бронхоэктатической болезни не характерно, встречается в редких случаях при врождённых аномалиях бронхов.
Патогенез бронхоэктатической болезни
Хронический воспалительный процесс с вовлечением бактерий снижает эластические свойства бронхиальной стенки, она вытягивается и выпячивается, из-за этого истончается. Вокруг лёгких развиваются рубцовые изменения межуточной (соединительной) ткани, что приводит к дополнительному вытяжению просвета воздухоносных путей. Выпячивание стенки осуществляется посредством её локального повреждения.
Классификация и стадии развития бронхоэктатической болезни
Бронхоэктазы классифицируют по происхождению, распространённости, характеру деформации лёгких и по другим признакам.
По происхождению
По клиническому течению
По распространённости
При использовании инструментальных методов исследования, таких как компьютерная томография, бронхоскопия, можно определить характер распределения бронхоэктазов:
По характеру деформации лёгких
По тяжести заболевания
По причине возникновения
Постинфекционные:
Обструктивные:
Ингаляционные повреждения:
Аспирационные:
Хронические диффузные заболевания легких:
Идиопатические воспалительные расстройства (при заболеваниях неустановленной этиологии):
Стадии заболевания
Первая стадия — ограниченные изменения мелких бронхов с заполнением их слизью.
Вторая стадия — воспаление и нагноение с нарушением целостности слоя клеток, выстилающего просвет бронхов изнутри, развитие рубцовой ткани в толще бронхов.
Осложнения бронхоэктатической болезни
Длительный характер заболевания с частыми обострениями способствует развитию осложнений.
Лёгочные кровотечения
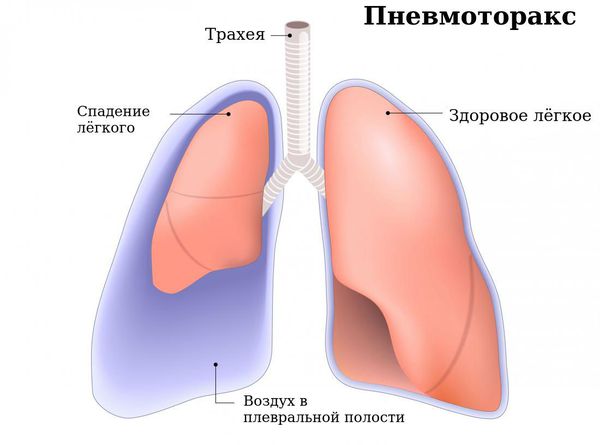
Спонтанный пневмотракс
К симптомам бронхоэктазов может присоединиться картина внезапного разрыва лёгочной ткани с появлением воздуха в плевральной полости (спонтанный пневмоторакс) — 0,7 % случаев.
Это состояние проявляется резкой интенсивной («кинжальной») болью в грудной клетке на стороне разрыва, внезапным появлением и усилением одышки, возникающей на вдохе. В это время усиливается кашель, при накоплении и увеличении количества воздуха в плевральной полости снижается артериальное давление и повышается пульс. Пациент может потерять сознание вследствие сдавления свободным воздухом сердца и крупных сосудов, расположенных в пространстве между лёгкими (средостение).
Хроническая дыхательная недостаточность
Хроническая дыхательная недостаточность (ХДН) проявляется одышкой, снижением переносимости физической нагрузки, характеризуется увеличением частоты дыхания. Критерием ХДН является снижение сатурации крови (насыщения кислородом) до 95 % и ниже.
Пневмосклероз
Пневмосклероз может не проявляться клинически при локальном процессе, при распространении заболевания отмечаются проявления дыхательной недостаточности.
Лёгочное сердце
«Лёгочное сердце» — это увеличение и расширение правых отделов сердца, развившееся вследствие заболеваний лёгких. Изначально «лёгочное сердце» может протекать бессимптомно, хотя у пациентов обычно наблюдаются выраженные проявления основного заболевания (например, одышка). Первым проявлением «лёгочного сердца» является учащённое сердцебиение.
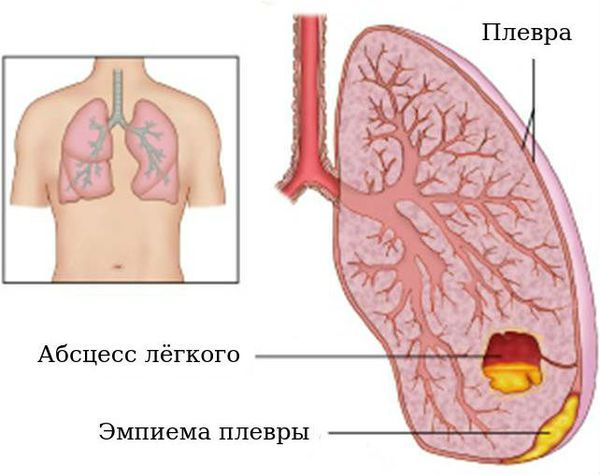
Абседирование
Среди осложнений бронхоэктатической болезни также встречаются нагноительные процессы с распространением на лёгочную ткань и плевру: абсцесс лёгких (1,8 %), эмпиема (0,4 %). Абсцедирование — образование обширной гнойной полости в лёгких. При формировании абсцесса отмечается стойкое повышение температуры тела, при его вскрытии в бронхах отмечается обильное отхождение гнойной мокроты («полным ртом»). Данное осложнение нередко нуждается в хирургическом лечении.
Эмпиемы плевры
Эмпиемы плевры — появление свободного гноя в плевральной полости, сопровождающееся выраженной интоксикацией, болью в грудной клетке на стороне поражения. Это состояние наряду с абсцессом лёгких представляет угрозу для жизни и нуждается в активном дренировании (удалении гноя) и наблюдении хирурга.
Септицемия (заражение крови)
Амилоидоз
Диагностика бронхоэктатической болезни
Консультация ЛОР-врача
При обнаружении симптомов заболевания необходимо обратиться к терапевту или пульмонологу. В ряде случаев присутствуют симптомы хронической заложенности носа, как проявление хронического синусита. При наличии данных симптомов необходима дополнительная консультация ЛОР-врача. Рутинный осмотр пациентов с бронхоэктатической болезнью ЛОР-врачом проводится один раз в год.
Осмотр пациента
При внешнем осмотре пациента обращает на себя внимание утолщение концевых фаланг по типу «барабанных палочек» и деформация ногтей («часовые стёкла») при длительном течении процесса.
Выслушивание лёгких
При выслушивании лёгкого с помощью фонендоскопа (аускультация) определяются фокусы влажных хрипов различных по калибру в зависимости от диаметра бронхов, подвергшихся изменениям. Дыхание может быть жёстким (выдох выслушивается на всём его протяжении) или ослабленным (бесшумный выдох).
Лабораторные исследования
Общий анализ крови, мочи и биохимический анализ крови исследуется один раз в 6 месяцев и при обострениях заболевания. Необходимо обращать особое внимание на уровень эритроцитов, гемоглобина (вторичный эритроцитоз), уровень лейкоцитов и характер лейкоцитарной формулы, уровень С-реактивного белка.
В моче следует контролировать протеинурию, удельный вес (проявление вторичного амилоидоза почек).
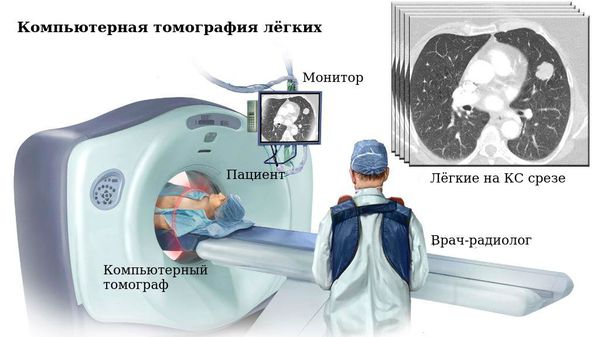
Инструментальные методы исследования
В постановке диагноза ключевое значение имеют инструментальные методы исследования, среди которых ведущим я вляется компьютерная томография лёгких.
Чёткая картина распространённости, формы и характера бронхоэктазий регистрируется при спиральной компьютерной томографии. Она позволяет определить неравномерность просвета бронхов, отсутствие сужения бронхов от центра к периферии («симптом трамвайных путей»), наличие секрета в их просветах, расширение бронха с сохранённым диаметром просвета подлежащего сосуда («симптом перстня»). Сопутствующие признаки пониженной и повышенной лёгочной вентиляции, рубцовые изменения, формирование осложнений в виде абсцесса также можно обнаружить при данном виде визуализации.
Рентген лёгких
Обзорная рентгенография и цифровая флюорография выявляет тяжистость, ячеистость, кистовидную деформацию лёгочного рисунка, участки уплотнения и повышенной воздушности лёгочной ткани.
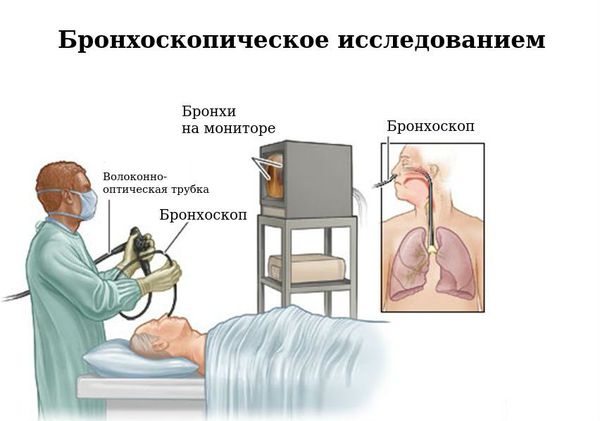
Бронхоскопия
Бронхоскопическое исследование служит хорошим дополнением компьютерной томографии в определении бронхоэктазов. При её проведении возможно взятие смывов бронхов, биопсийного материала слизистой при необходимости. Кроме того, бронхоскопия используется в лечебных целях.
Функциональные пробы
Исследование функции внешнего дыхания с бронходилатационным тестом (исследование расслабления бронхов) применяют для назначения и корректировки ингаляционной терапии. Пробы наиболее информативны при из проведении в утренние часы (до 11:00), проводятся натощак или после лёгкого завтрака. Накануне исследования необходимо отказаться от ингаляционной терапии.
Бронхография
Бронхография в настоящее время не применяется для диагностики бронхоэктазов по причине её инвазивности (глубокого проникновения по трахеобронхиальной системе) и плохой переносимости.
Электрокардиография
Электрокардиограмма проводится один раз в год для оценки возможных нарушений ритма, утолщения правых отделов сердца при развитии лёгочной гипертензии и лёгочного сердца.
Лечение бронхоэктатической болезни
В основе лечения бронхоэктатической болезни лежит принцип своевременной противовоспалительной и дренирующей терапии, которая направлена на эвакуацию секрета из расширенных бронхов. Также важна минимальная инвазивность процедур, поскольку каждый эпизод проникновения инородных предметов (в том числе эндоскопических трубок) в лёгкие увеличивает риск дополнительного инфицирования повреждённых участков бронхов.
Медикаментозное лечение
Инструментальные методы
Хирургическое лечение
Хирургические методы лечения показаны при локальном процессе в следующих случаях:
Соблюдение правильного питания
В лечении больных бронхоэктатической болезнью наряду с другими методами большое значение имеет лечебное питание. В диете должно содержаться повышенное количество белка (до 160 г), умеренное количество жира и углеводов. Необходимо включать в рацион витамины А, В1, В2 и С. Витамин А способствует улучшению регенерации слизистой оболочки дыхательных путей, витамины В1, В2 и С улучшают окислительные процессы, белковый обмен. Ограничивается содержание соли. Питание должно быть не менее пяти раз в сутки. Рекомендуется диета № 5 с повышенным содержанием белка и витаминов.
Кислородотерапия
При наличии хронической дыхательной недостаточности со снижением сатурации крови до 89 % и менее рекомендована длительная кислородотерапии в домашних условиях с использованием концентраторов кислорода. Также ситуационная кислородотерапия проводится в условиях стационара на этапе лечения обострений заболевания, сопровождающихся снижением сатурации до 95% и менее.
Физиотерапия
В период обострения процесса применяется электрофорез и УВЧ-терапия на грудную клетку — слаботепловая доза продолжительностью 10-15 минут. В период ремиссии проводятся общее УФ-облучение и ингаляции муколитических средств. Для улучшения функционального состояния лёгких и дренажной функции бронхов применяется массаж грудной клетки. Вибрационный массаж проводится с помощью специального жилета или при непосредственном перкуссионном воздействии на грудную клетку в положении лежа по направлению снизу вверх. Его лучше проводить после ингаляционной процедуры, чтобы повысить скорость дезинтеграции (распада) мокроты и её удаления из воздухоносных путей.
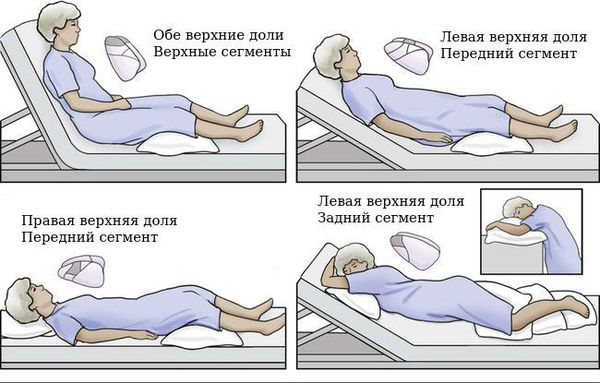
При заболевании важна эвакуация секрета бронхов. Для этого применяют статический и динамический постуральный дренаж — принятие положения тела, при котором наиболее эффективно происходит откашливание мокроты.
Лечебная физкультура должна проводиться пациентом с бронхоэктатической болезнью постоянно. Используются упражнения для увеличения движения диафрагмы, межрёберных мышц в сочетании с постуральным дренажем бронхов (положение тела для лучшего отхождения мокроты зависит от локализации бронхоэктазов). Дыхательная гимнастика повышает давление, создаваемое в просвете бронхов, способствует их очищению и более равномерному наполнению воздухом на вдохе. Гимнастику можно делать самостоятельно либо с подключением портативных тренажёров, некоторые из них могут создавать дополнительную вибрацию.
Противопоказания для лечебной физкультуры: лёгочное кровотечение; сердечно-сосудистая недостаточность III стадии; повышение температуры до 38—39 ° С, не обусловленное скоплением мокроты. При наличии мокроты лечебную гимнастику начинают с упражнений, способствующих выведению мокроты: применяют постуральный дренаж; дренирующие упражнения и их сочетание. При выделении большого количества мокроты упражнения, дренирующие бронхи, выполняют до 8-10 раз в день: утром до завтрака в течение 20-25 минут, через 2 часа после завтрака, обеда, каждый час до ужина и за час перед сном.
Прогноз. Профилактика
Выраженная бронходилятация что это значит
Российская медицинская академия непрерывного профессионального образования, Москва, Россия
Введение
В последние годы благодаря более глубокому пониманию патологических процессов, лежащих в основе хронической обструктивной болезни легких (ХОБЛ), и обогащению терапевтического потенциала современного врача существенно изменились и подходы к ведения этой категории пациентов. Стратегия, предлагаемая экспертами GOLD, основана на учете трех основных переменных характеристик ХОБЛ: степени тяжести бронхиальной обструкции, выраженности клинических симптомов и частоте повторных обострений болезни [1]. Напротив, испанские эксперты в основу разработанного ими терапевтического алгоритма положили принцип клинической фенотипизации больных ХОБЛ [2], нашедший поддержку и в ряде других стран. Впрочем, знакомство с обновленными версиями этих документов [3, 4] свидетельствует, что, несмотря на имеющиеся различия, оба они объединены глобальной целью повышения индивидуализации лечения.
Выбор бронходилататоров в качестве приоритетного направления лечения больных ХОБЛ аргументируется их многочисленными саногенетическими эффектами (табл. 1), достигаемыми главным образом прямым стимулирующим действием на β2-адренорецепторы (β2-агонисты) и непрямым – посредством блокады влияния ацетилхолина на мускариновые холинорецепторы (холиноблокаторы или антихолинергические препараты).
β2-агонисты
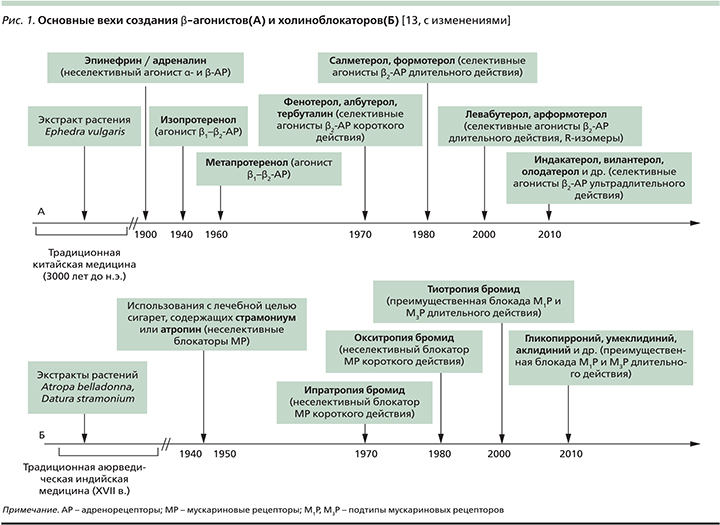
Краткая история создания и применения
История применения симпатомиметиков с лечебной целью, продолжающаяся в наши дни созданием селективных β2-агонистов короткого, длительного и ультрадлительного действий, берет свое начала в недрах традиционной китайской медицины (3000 лет до н.э.). Уже в то время существовала практика использования экстракта растения Ephedra vulgaris (Ma Huang) в лечении больных одышкой [12] (рис. 1). Начало XIX в. ознаменовалось многочисленными усилиями по выделению экстракта надпочечников и использованию его в клинической практике. Первая успешная попытка подкожного введения эпинефрина (адреналина) с целью купирования астматического приступа датируется 1903 г., хотя бронходилатирующие свойства препарата будут установлены лишь через 4 года [14]. Инъекции водного раствора и суспензии эпинефрина в ургентной терапии острого бронхоспазма будут широко применяться вплоть до начала 1980-х гг. Менее популярным был опыт клинического использования препарата в форме аэрозоля [15].
В 1950-х гг. создаются первые неселективные β1/β2-агонисты в форме аэрозоля – изопротеренол и метапротеренол, которые на ближайшие несколько десятилетий станут «препаратами выбора» в лечении больных астмой [16]. Однако, несмотря на демонстративный бронходилатирующий эффект, эти препараты ввиду неселективности их β-агонистической активности, т.е. стимуляции β1-рецепторов сердечной мышцы, гладких мышц внутренних органов и др., характеризовались широким спектром серьезных нежелательных лекарственных реакций (табл. 2).
Начало 1980-х гг. было ознаменовано созданием прототипа селективных β2-агонистов – сальбутамола, характеризовавшегося быстрым началом и ограниченной продолжительностью (4–6 часов) бронходилатирующего эффекта. За этим последовала очередь β2-агонистов длительного действия (до 12 часов) – салметерола, формотерола, и наконец «венцом» эволюции этого класса лекарственных препаратов стали β2-агонисты ультрадлительного действия (до 24 часов) – индакатерол, олодатерол, вилантерол, кармотерол, абедитерол, PF-610355, AZD-3199 и др. [18].
Механизм действия
В основе механизма действия β-агонистов лежит их связывание с одной или несколькими цепочками ассоциированного с G-белком адренорецептора, следствием чего является стимуляция аденилатциклазы (рис. 2).
Аденилатциклаза, в свою очередь, стимулирует превращение аденозинтрифосфата в циклический 3’-5’-аденозинмонофосфат, активирующий протеинкиназу [20]. Далее, под влиянием протеинкиназы происходит фосфорилирование кальциевых каналов гладкомышечных клеток бронхов, что приводит к снижению захвата Ca2+ из внеклеточного пространства, усилению его депонирования в саркоплазматическом ретикулуме миоцита, и как итог, – к падению внутриклеточной концентрации и связанной с этим миорелакции. Напротив, фосфорилирование кальциевых каналов миокарда сопровождается усилением притока Ca2+ из внеклеточного пространства, что, обусловливая повышение активности контрактильных белков, характеризуется положительными инотропным и хронотропным эффектами.
Поскольку β2-адренорецепторы помимо миокарда и гладкомышечных клеток бронхов представлены еще и в подслизистых железах, эндотелии кровеносных сосудов, на поверхности тучных клеток, лейкоцитов, эозинофилов и лимфоцитов, то это объясняет многообразие «бронхолегочных» эффектов β2-агонистов:
Холиноблокаторы/антихолинергические препараты
Краткая история создания и применения
В течение нескольких столетий (с XVII в.) аюрведические хилеры в Индии использовали ингаляции паров Dature spp., содержащие алкалоиды белладонны (атропин, скополамин), для лечения больных астмой [13] (рис. 1). В последующем практика курения с лечебной целью сигарет, содержащих листья дурмана («divine stramonium» – «божественный, или волшебный, дурман»), была «импортирована» в Англию и просуществовала вплоть до конца 1970-х гг. [22]. Позднее удалось создать синтетические производные природных алкалоидов, относящиеся к четвертичным аммониевым соединениям, характеризующихся минимальной системной абсорбцией и ограниченной гематоэнцефалической проницаемостью. Минимальными оказались и другие потенциальные нежелательные лекарственные реакции синтетических холиноблокаторов, включая возможное влияние на объем экспекторируемого бронхиального секрета и его реологические свойства [18].
В 1987 г. первым коммерчески доступным ингаляционным холиноблокатором стал ипратропия бромид [23]. Он демонстрировал неселективную блокаду М1-, М2- и М3-холинорецепторов и относительно небольшую продолжительность бронхолитического действия. А на рубеже XX и XXI вв. появился тиотропия бромид, который в отличие от ипратропиума не только обеспечивал длительную бронходилатацию (≈24 часа), но и обладал т.н. кинетической селективностью, т.е. обеспечивал более продолжительную блокаду М1- и М3-рецепторов. Последнее представлялось очень важным с клинической точки зрения, поскольку антагонизм с эффекторными М3-рецепторами корреспондирует с выраженностью бронхолитического эффекта препарата [24] и сдерживает гиперсекрецию муцина, «запускаемую» нейтрофильной эластазой [25]. «Монополия» тиотропия как единственного холиноблокатора длительного действия закончилась через 10 лет, когда один за другим стали появляться и остальные представители этого подкласса антихолинергических препаратов – гликопиррония бромид, аклидиния бромид, умеклидиния бромид, CHF 5407, троспиум (ALKS27) и PF-4522971 [18].
Механизм действия
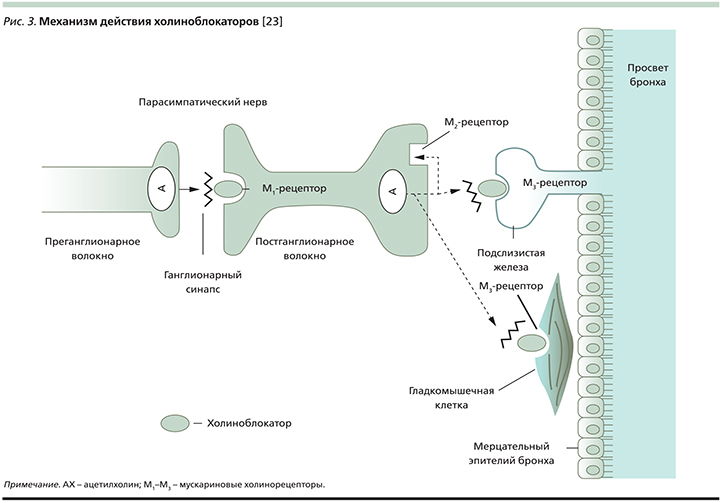
Три (М1–М3) из пяти выделенных подтипов мускариновых холинорецепторов локализуются на протяжении парасимпатических нервных волокон, ответственных за контроль тонуса воздухоносных путей, на поверхности гладкомышечных клеток бронхов и бронхиальных желез (рис. 3). Передача нервных импульсов через парасимпатический ганглий осуществляется при участии никотиновых и М1-холинорецепторов, возбуждение которых ускоряет процесс нейротрансмиссии. Возбуждение пресинаптических М2-холинорецепторов прерывает высвобождение ацетилхолина в синаптическую щель, а стимуляция постсинаптических М3-холинорецепторов вызывает сокращение гладкомышечных клеток бронхов. Суммарный эффект холиноблокаторов характеризуется падением тонуса воздухоносных путей и улучшением бронхиальной проходимости [26].
Наибольшее клиническое значение играет блокада постсинаптических М3-холинорецепторов. И здесь важно подчеркнуть, что современные холиноблокаторы (тиотропий и др.) обладают селективным антагонизмом в отношении соответствующих подтипов мускариновых рецепторов, а именно, характеризуясь сопоставимо высокой степенью сродства к М1–М3-холинорецепторам, они демонстрируют существенно более медленную диссоциацию с М3-рецепторами (в отличие от М2-рецепторов), что обеспечивает продолжительную бронходилатацию и исключает парадоксальный бронхоспазм [27].
Роль и место бронходилататоров в лечении ХОБЛ
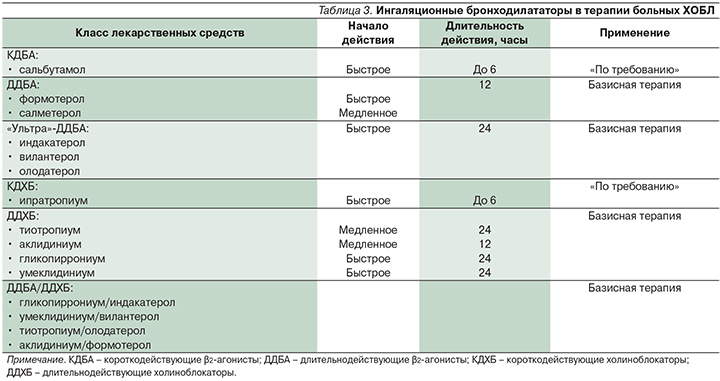
Как уже говорилось выше, декларируемым международными экспертами целям фармакотерапии ХОБЛ (контроль симптомов заболевания, повышение переносимости физических нагрузок, улучшение качества жизни, снижение частоты и тяжести обострений) [28] наилучшим образом соответствует терапия бронходилататорами длительного действия, возможности которой за последнее время существенно расширились (табл. 3).
С внедрением в клиническую практику во второй половине 1990-х гг. длительно действующих β2-агонистов (ДДБА) – формотерола и салметерола – было показано, что у больных с стабильным течением ХОБЛ эти препараты имеют очевидные клинические преимущества по сравнению с плацебо и бронходилататорами короткого действия. Причем это касалось не только более удобного режима дозирования соответствующих лекарственных средств и, как следствие, – лучшей приверженности пациентов врачебным рекомендациям [29], но и оптимизации таких спирометрических/клинических параметров, как объем форсированного выдоха за первую секунду (ОФВ1), качество жизни пациентов, частота обострений забо-левания [30–32].
Новые возможности терапии больных ХОБЛ появились с выходом на фармацевтический рынок бронходилататоров, эффект которых сохранялся ≥24 часов. И первым в этом ряду суждено было стать длительнодействующему холиноблокатору (ДДХБ) тиотропия бромиду. Препарат на долгие годы обрел устойчивые позиции «лидера» в ряду бронходилататоров, что аргументировалось многочисленными доказательствами его благотворного влияния на функциональные параметры, качество жизни пациентов, частоту повторных обострений заболевания, а у отдельных категорий больных – на скорость падения ОФВ1 и кумулятивную смертность [33–36].
2010-е гг. ознаменовались появлением ряда ДДБА и ДДХБ (табл. 3), а также их фиксированных комбинаций (табл. 4).
По мнению экспертов программы GOLD, фиксированные комбинации ДДБА/ДДХБ следует рассматривать как препараты «первой линии» для большинства больных с симптоматическим течением ХОБЛ и практически для каждого, кто нуждается в регулярной поддерживающей терапии [1]. Более точное определение места фиксированным комбинациям ДДБА/ДДХБ мы находим на страницах Испанских рекомендаций – их назначение приоритетно для всякого больного высокого риска независимо от клинического фенотипа, что определяется тяжелой/крайне тяжелой бронхиальной обструкцией или выраженной одышкой (mMRC1 ≥2), или, по крайней мере, двумя эпизодами нетяжелого обострения, или потребовавшим госпитализации одним эпизодом тяжелого обострения за истекший год, или комбинациями указанных факторов [4].
Фармакологическая основа кооперативного взаимодействия между β2-агонистами и холиноблокаторами очень сильна. Действительно, β2-агонисты вызывают бронходилатацию посредством релаксации гладкомышечных клеток бронхов независимо от характера констриктивных стимулов, т.е. выступают в качестве функциональных антагонистов бронхоконстрикции. В противоположность этому, холиноблокаторы ингибируют бронхоконстрикторные эффекты ацетилхолина, вступают с ним в конкурентный антагонизм за взаимодействие с эффекторными мускариновыми рецепторами, дополняя и потенцируя функциональный антагонизм β2-агонистов [37].
К настоящему времени накоплен огромный фактический материал по оценке эффективности и безопасности фиксированных комбинаций ДДБА/ДДХБ, полученный в рамках плацебо-контролируемых исследований и исследований с активным контролем (ДДБА, ДДХБ и ИГКС/ДДБА2) [38, 39]. Так, в частности, согласно выводам недавно опубликованного систематического обзора и метаанализа, включивших 23 исследования (20 185 больных), фиксированные комбинации ДДБА/ДДХБ в ходе рандомизированных контролируемых исследований продолжительностью ≥12 недель превосходят холиноблокаторы и ИГКС/ДДБА по величине прироста «наименьшего» (предбронхолитического) ОФВ1, причем в большинстве случаев прирост этого показатели превышал минимальные клинически значимые величины (>100 мл); достоверным было превосходство комбинированной терапии и во влиянии на выраженность одышки (транзиторный индекс одышки), формализованные критерии качества жизни (вопросник SGRQ3), на частоту ситуационного применения брнходилататоров короткого действия. Важнейшим с клинической точки зрения стало достоверное преимущество ДДБА/ДДХБ над ИГКС/ДДБА во влиянии на частоту среднетяжелых и тяжелых обострений ХОБЛ (отношение шансов [ОШ] – 0,82; 95% доверительный интервал [ДИ] – 0,75–0,91) [40]. Более привлекательным представлялся и профиль безопасности фиксированных комбинаций ДДБА/ДДХБ, характеризовавшийся по сравнению с ИГКС/ДДБА меньшим риском развития нежелательных лекарственных реакций (ОШ – 0,94; 95% ДИ – 0,89–0,99), в т.ч. и ятрогенной пневмонии (ОШ – 0,59; 95% ДИ – 0,43–0,81]), а также минимальной (по сравнению с ДДХБ) вероятностью прекращения терапии ввиду ее неэффективности (ОШ – 0,66; 95%ДИ – 0,51–0,87) или (по сравнению с ИГКС/ДДБА) вследствие развития нежелательных лекарственных реакций (ОШ – 0,83; 95% ДИ – 0,69–0,99) [40].
Таким образом, фиксированные комбинации ДДБА/ДДХБ по эффективности превосходят монокомпонентную терапию и комбинацию ИГКС/ДДБА, характеризуясь меньшим риском развитии ятрогенной пневмонии по сравнению с лечебной программой, включающей ИГКС. Назначение последних становится оправданным лишь в случаях повторных обострений ХОБЛ, несмотря на продолжающийся прием ДДБА/ДДХБ, а также для отдельных категорий больных, воспалительный профиль заболевания которых предполагает «ответ» на ИГКС [41, 42].
Как уже говорилось выше, в настоящее время доступны пять фиксированных комбинаций ДДБА/ДДХБ, четыре из которых зарегистрированы в нашей стране (табл. 4). И в связи с этим возникает закономерный вопрос: являются ли продемонстрированные в ходе контролируемых исследований, систематических обзоров и метаанализов эффекты различных фиксированных комбинаций ДДБА/ДДХБ в равной степени характерными для каждого из представителей этого класса лекарственных средств, а если нет, то какое клиническое значение могут иметь существующие между ними различия?
Однозначно ответить на этот вопрос сегодня не представляется возможным. Во-первых, большинство из проведенных ранее исследований, где оценивалась эффективность и безопасность фиксированных комбинаций ДДБА/ДДХБ, отличались между собой характеристиками пациентов, длительностью самих исследований, выбором препаратов активного контроля и «конечных точек» оценки эффективности. Во-вторых, до недавнего времени отсутствовали исследования прямого сравнения («head-to-head») отдельных представителей класса ДДБА/ДДХБ.
Очевидно, первым подобным опытом прямого сравнения стало рандомизированное перекрестное открытое исследование G.J. Feldman et al. [43], в ходе которого сравнивались вилантерол/умеклидиниум (25/62,5 мкг 1 раз в сутки) и олодатерол/тиотропиум (5/5 мкг 1 раз в сутки) в группе симптоматических больных ХОБЛ (mMRC ≥2) 40 лет и старше (n=236) со среднетяжелой бронхиальной обструкцией (70% ≥ОФВ1 ≥50%), не получавших ИГКС (рис. 4). Авторами было показано, что эффективность вилантерола/умеклидиниума при оценке степени повышения конечного («наименьшего» или предбронхолитического) ОФВ1 к исходу 8-недельного лечебного периода (первичная «конечная точка») превосходила таковую олодатерола/тиотропиума на 41%: 180 и 128 мл соответственно (р
1. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for the Diagnosis, Management and Prevention of COPD. 2011.
2. Miravitllesa M., Soler-Cataluna J.J., Calle M., et al. Spanish COPD Guidelines (GesEPOC): Pharmacological treatment of stable COPD. Aten Primaria. 2012;44:425–37. Doi: 10.1016/j.aprim.2012.04.005.
3. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global Strategy for the Diagnosis, Management and Prevention of COPD. 2018.
4. Miravitlles M., Soler-Cataluna J.J., Calle M., et al. Spanish guidelines for management of chronic obstructive pulmonary disease (GesEPOC) 2017: pharmacological treatment of stable phase. Arch Bronconeumol. 2017;53:324–35. Doi: 10.1016/j.arbres.2017.03.018.
5. Qaseem A., Wilt T.J., Weinberger S.E., et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann Intern Med. 2011;155:179–91. Doi: 10.7326/0003-4819-155-3-201108020-00008.
6. Broncopneumopatia cronica ostruttiva. Linee guida nazionali di riferimento er la prevenzione e la terapia.
7. Aisanov Z., Avdeev S., Arkhipov V., et al. Russian guidelines for the management of COPD: algorithm of pharmacologic treatment. Int J COPD. 2018;13:183–87. Doi: 10.2147/COPD.S153770.
8. Johnson M., Rennard S. Alternative mechanisms for long-acting beta (2)-adrenergic agonists in COPD. Chest. 2001;120:258–70.
9. Hanania N.A., Moore R.H. Anti-inflammatory activities of beta2-agonists. Curr Drug Targets Inflamm Allergy. 2004; 3:271–77.
10. Bennett W.D., Almond M.A., Zeman K.L., et al. Effect of salmeterol on mucociliary and cough clearance in chronic bronchitis. Pulm Pharmacol Ther 2006;19:96–100.
11. Profita M., Giorgi R.D., Sala A., et al. Muscarinic receptors, leukotriene B4 production and neutrophilic inflammation in COPD patients. Allergy 2005;60:1361–69.
12. Chen K.K., Schmodt C.F. The action and clinical use of ephedriean alkaloid isolated from the Chinese drug, ma huang. JAMA. 1926;87:836–42.
13. Cazzola M., Page C.P., Calzetta L., et al. Pharmacology and therapeutics of bronchodilators. Pharmacol Rev. 2012;64:450–504.
14. Bullowa J.G.M., Kaplan D.M. On the hyperdermatic use of adrenalin chloride in the treatment of asthmatic attacks. Med News 1903;83:787.
15. Barger G., Dale H.H. Chemical structure and sympathomimetic action of amines. J Physiol. 1910;4:19.
16. Leifer K.N., Wittig H.J. The beta-2 sympathomimetic aerosols in the treatment of asthma. Ann Allergy. 1975;35:69–80.
17. Williams D.M., Rubin B.K. Clinical pharmacology of bronchodilator medications. Respir Care. 2018;63:641–54. Doi: 10.4187/respcare.06051.
18. Chronic obstructive pulmonary disease. A systemic inflammatory disease. Eds. H. Nakamura, K. Aoshiba. Springer Nature: Singapore, 2017.
19. Rau J.L. Inhaled adrenergic bronchodilators: historical development and clinical application. Respir Care. 2000;45:854–63.
20. Billington C.K., Penn R.B., Hall I.P. β2-Agonists. Handb Exp Pharmacol. 2017;237:23–40. Doi: 10.1007/164_2016_64.
21. Bateman E.D., Rennard S., Barnes P.J., et al. Alternative mechanisms for tiotropium. Pulm Pharmacol Ther. 2009;22:533–42. Doi: 10.1016/j.pupt.2009.06.002.
22. Jackson M. «Divine stramonium»: the rise and fall of smoking for asthma. Med Hist. 2010;54:171–94.
23. Rau J.L. Design principles of liquid nebulization devices currently in use. Respir Care. 2002;47:1257–75.
24. Alagha K., Palot A., Safalvi T., et al. Long-acting muscarinic receptor antagonists for the treatment of chronic airway diseases. Ther Adv Chronic Dis. 2014;5:85–98. Doi: 10.1177/2040622313518227.
25. Komiya K., Kawano S., Suzaki I., et al. Tiotropium inhibits mucin production stimulated by neutrophil elastase but not by IL-13. Pulm Pharm Therap. 2018; 48:161–67. Doi: 10.1016/j.pupt.2017.11.008.
26. Fryer A.D., Jacoby D.B. Muscarinic receptors and control of airway smooth muscle. Am J Respir Crit Care Med. 1998;158(5 Pt 3):154–60.
27. Kruse A.C., Li J., Hu J., et al. Novel insights into M3 muscarinic acetylcholine receptor physiology and structure. J Mol Neurosci. 2014;53:316–23. Doi: 10.1007/s12031-013-0127-0.
28. Miravitlles M., Vogelmeier C., Roche N., et al. A review of national guidelines for management of COPD in Europe. Eur Respir J. 2016;47:625–37. Doi: 10.1183/13993003.01170-2015.
29. Cramer J.A., Bradley-Kennedy C., Scalera A. Treatment persistence and compliance with medications for chronic obstructive pulmonary disease. Can Respir. J 2007;14:25–29.
30. Boyd G., Morice A.H., Piunsford J.C., et al. An evaluation of salmeterol in the treatment of chronic obstructive pulmonary disease (COPD). Eur Respir J. 1997; 10:815–21.
31. Stockley R.A., Chorpa N., Rice L. Addition of salmeterol to existing treatment in patients with COPD: a 12-month study. Thorax. 2006;61:122–28.
32. Jones P.W., Bosh T.K. Quality of life changes in COPD patients treated with salmeterol. Amer J Respir Crit Care Med. 1997;155:1283–89.
33. Tashkin D.P., Celli B., Senn S., et al. A 4-yaer trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med. 2008;359:1543–54.
34. Celli B., Decramer M., Kesten S., et al. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Amer J Resir Crit Care Med. 2009; 180:948–55. Doi: 10.1164/rccm.200906-0876OC.
35. Karner C., Chong J., Poole P. Tiotropium versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014;(7):CD009285. Doi: 10.1002/14651858.CD009285.pub3.
36. Cheyne L., Irvin-Sellers M.J., White J. Tiotropium versus ipratropium bromide for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2013;(9):CD009552. Doi: 10.1002/14651858.CD009552.pub2.
37. Cazzola M., Molimard M. The scientific rationale for combining long-acting beta-2-agonists and muscarinic antagonists in COPD. Pulm Pharmacol Ther. 2010;23:257–67. Doi: 10.1016/j.pupt.2010.03.003.
38. Miravitlles M., Baek S., Vithlani V., Lad R. Optimal bronchodilation for COPD patients: are all long-acting β2-agonist/long-acting muscarinic antagonists the same? Tuberc Respir Dis. 2018; 81:198–215. Doi: 10.4046/trd.2018.0040.