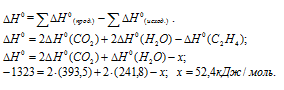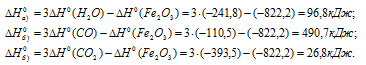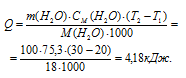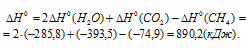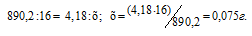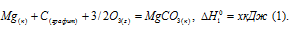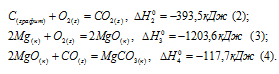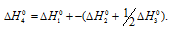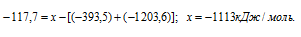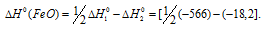Вычислите энтальпию реакции окисления mn до mno2 если известно что энтальпия реакции
Задачи к разделу Основы термодинамики с решениями
Здесь вы найдете примеры задач на вычисление таких термодинамических параметров как энтальпия, энтропия, энергия Гиббса. Определение возможности самопроизвольного протекания процесса, а также составление термохимических уравнений.
Задачи к разделу Основы термодинамики с решениями
Задача 1. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. Определите в каком направлении при 298 °К (прямом или обратном) будет протекать реакция. Рассчитайте температуру, при которой равновероятны оба направления реакции.
Fe2O3 (к) + 3H2 = 2Fe(к) + 3H2O(г)
Используя справочные данные стандартных энтальпий веществ, находим:
Используя справочные данные стандартных энтропий веществ, находим:
При Т=298°К, ΔG > 0 – реакция не идет самопроизвольно, т.е. реакция будет протекать в обратном направлении.
Чтобы рассчитать температуру, при которой равновероятны оба направления реакции, надо ΔG приравнять к нулю:
При Т = 705,83 К реакция будет идти равновероятно как в прямом так и в обратном направлении.
Задача 2. Вычислите энергию Гиббса и определите возможность протекания реакции при температурах 1000 и 3000 К.
| Cr2O3 (т) + 3C (т) = 2Cr (т) + 3CO (г) | ||||
| ΔH298, кДж/моль | — 1141 | 0 | 0 | — 110,6 |
| ΔS298, Дж/(моль×К) | 81,2 | 5,7 | 23,6 | 197,7 |
Вычисления энергии Гиббса проводим согласно выражению:
Необходимо рассчитать энтальпию и энтропию химической реакции.
Используя справочные данные стандартных энтальпий веществ, находим:
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
Найдем энергию Гиббса при 1000 К
ΔG1000 > 0, следовательно, реакция самопроизвольно не идет.
Найдем энергию Гиббса при 3000 К
ΔG3000 ˂ 0, следовательно, реакция протекает самопроизвольно.
Задача 3. Определите тепловой эффект сгорания жидкого CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла?
Уравнение реакции сгорания жидкого сероуглерода следующее:
Тепловой эффект реакции вычислим подставляя справочные данные стандартных энтальпий веществ в выражение:
Т.е. при сгорании 1 моля сероуглерода выделяется 1075,1 кДж тепла
а при сгорании x молей сероуглерода выделяется 700 кДж тепла
Найдем х:
x = 700·1/1075,1 = 0,65 моль
Итак, если в результате реакции выделится 700 кДж тепла, то в реакцию вступят 0,65 моль CS2
Реакция восстановления оксида железа (II) водородом имеет следующий вид:
4. FeO (к) + H2 (г) = Fe (к) + H2O (г)
Чтобы вычислить тепловой эффект реакции необходимо применить закон Гесса, т.е. реакцию 4. можно получить, если сложить реакции 1. и 2. и вычесть реакцию 1.:
Таким образом, тепловой эффект реакции восстановления оксида железа (II) водородом равен
Задача 5. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными.
Тепловой эффект реакции равен:
В нашем случае ΔHр-ции = – 3135,6 кДж, найдем теплоту образования жидкого бензола:
Теплотворная способность жидкого бензола вычисляется по формуле:
М(бензола) = 78 г/моль
QТ = – 3135,6· 1000 / 78 = — 4,02·10 4 кДж/кг
Теплотворная способность жидкого бензола QТ = — 4,02·10 4 кДж/кг
Исходя из приведенных данных, запишем термохимическое уравнение:
Тепловой эффект реакции равен:
Используя справочные данные теплот образования веществ, найдем теплоту образования С2Н5ОН(ж):
ΔH 0 парообразования = — 235,31 + 277,36 = 42,36 кДж/моль
Мы определили, что теплота образования С2Н5ОН(ж) равна
ΔH 0 парообразования = 42,36 кДж/моль
Задача 7. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция:
СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж)?
Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
Рассчитаем ΔG данной реакции:
Для этого сначала определим ΔH и ΔS реакции:
Используя справочные данные стандартных энтальпий веществ, находим:
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
Найдем энергию Гиббса при стандартных условиях
следовательно, реакция самопроизвольно не идет.
Найдем при каких температурах данная реакция становится самопроизвольной.
В состоянии равновесия ΔGр-ции= 0, тогда
Задача 8. Рассчитав на основании табличных данных ΔG и ΔS, определите тепловой эффект реакции:
2 NO (г) + Cl2 (г) ↔ 2 NOCl(г).
При постоянных температуре и давлении, изменение энергии Гиббса связано с энтальпией и энтропией выражением:
На основании табличных данных рассчитаем ΔG и ΔS
ΔH = — 40,64 + 298 · (-121,04/1000) = — 76,7 кДж/моль
Тепловой эффект реакции ΔH = — 76,7 кДж/моль
Задача 9. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с алюминием или с оловом? Ответ дайте, рассчитав ΔG 0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с алюминием
В реакции принимает участие 2 моль Al(т), тогда ΔGр-ции1 1 моля Al(т) равно
Рассчитаем ΔG 0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с оловом:
Задача 10. Не прибегая к вычислениям, определите, какие знаки (>0, 0.
Расчет энтальпии и энтропии химической реакции с использованием 3-го следствия из закона Гесса
Расчет энтальпии и энтропии реакции горения ацетилена
Задача 1.
Реакция горения ацетилена протекает по уравнению: С2Н2(г) + 5/2О2(г) = 2СО2(г) + Н2О(ж).
Вычислите изменение энтропии системы в стандартных условиях и объясните причины её уменьшения.
Решение.
Согласно следствию из закона Гесса, изменение энтропии определяется как разность сумм энтропий продуктов и реагентов процесса с учетом стехиометрических коэффициентов реакции. Тогда
∆S 0 х.р. = [2·S 0 обрСО2(г) + S 0 обрН2О(ж)] – [S 0 обрС2Н2(г) + (5/2)·S 0 обрО2(г)].
По табличным данным найдем значения энтропии для требуемых веществ:
S 0 обрСО2(г) = 213,65Дж/моль·К;
S 0 обрН2О(ж) = 69,94Дж/моль·К;
S 0 обрС2Н2(г) = 219,45Дж/моль·К;
S 0 обрО2(г) = 205,03Дж/моль·К.
Подставив эти значения в уравнение изменения энтропии процесса, и произведя расчеты, получим:
Уменьшение энтропии процесса объясняется ростом упорядоченности системы, так как количество вещества газов в продуктах реакции в 2,7 раза меньше, чем в реагентах (5,5/2).
Расчет энтальпии и энтропии реакции разложения нитрата магния
Задача 2.
Реакция разложения магния нитрата по уравнению:2Mg(NO3)2(т) = 2MgO(т) + 4NO2(г) + O2(г) сопровождается увеличением энтропии системы на 891 Дж/К и изменением энтальпии на 510 кДж. Рассчитайте стандартную энтальпию образования и энтропию образования магния нитрата. Определите, какой из факторов – энтальпийный или энтропийный – способствует самопроизвольному протеканию этого процесса.
Решение:
Расчеты ∆H 0 обр[Mg(NO3)2(т)] и S 0 обр[Mg(NO3)2(т)] произведем на основании 3-го следствия из закона Гесса, согласно которому:
Используя данные таблицы, найдем значения энтальпий образования и энтропий продуктов реакции:
Подставив найденные значения в уравнения а) и б), рассчитаем искомые величины:
Как известно, самопроизвольному протеканию реакции способствует уменьшение её энтальпийного фактора (∆H 0 х.р. 0 х.р. > 0). Согласно данным условия задачи, энтропия во время процесса возрастает, и, следовательно, возрастает и произведение Т·∆S 0 х.р., что способствует его самопроизвольному протеканию. С другой стороны, возрастает и энтальпия реакции, что не способствует самопроизвольности процесса в прямом направлении.
Вычисление значений энтальпии, энтропии и энергии Гиббса химических реакций
Изменение энтропии для химических процессов
Задача 55.
Вычислите изменение энтропии для химических процессов, протекающих по уравнениям:
a) 2NO(г) + O2(г) = 2NO2(г);
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Решение:
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
a) 2NO(г) + O2(г) = 2NO2(г)
Для этой реакции составaим уравнение расчета изменения энтропии в стандартных условиях:
По табличным данным установим значения энтропий (S°) участников процесса (Дж/моль·К):
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
Заметим при этом, что отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
б) 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(ж).
Для этой реакции составим уравнение расчета изменения энтропии в стандартных условиях:
ΔS° = [2 · S0SO2(г) + 2 · S0H2O(ж)] – [2 · S0H2S(г) + 3S°O2(г)].
По табличным данным установим значения энтропий (S0) участников процесса (Дж/моль·К):
Подставив найденные значения энтропий в искомое уравнение, и произведя расчеты, получим:
Таким образом, отрицательное значение изменения энтропии (убывание энтропии) свидетельствует о невозможности осуществления указанного процесса самопроизвольно в стандартных условиях.
Вычисление энтальпии реакции
Задача 56.
Экспериментально установлено, что при взаимодействии 2,3 г натрия с водой выделяется 14,0 кДж теплоты. Вычислите энтальпию реакции.
Решение:
m(NaOH) = 2,3 г;
М(NaOH) = 46 г/моль;
Q = 14,0 кДж.
Уравнение реакции:
Можно проверить, используя табличные данные и следствие из закона Гесса, получим:
Р.S. Слишком большое расхождение с табличными данными (-1808,6 кДж/моль) указывает на то, что ∆H° = –1587 кДж, указанное значение в условии задачи, иное (-381,6 кДж/моль).
Определение температуры наступления равновесия реакции
2. Находим ∆S°х.р. для данной системы
Согласно 3-му следствию из закона Гесса, изменение энтропии химического процесса (ΔS°) определяется как разность сумм энтропий продуктов реакции и реагентов с учетом их стехиометрических коэффициентов в уравнении реакции. Расчет энтропии будем вести по формуле Гесса:
Ответ: равновесие системы наступит при 386,9 К.
Определение направления химической реакции
Переведем температуру из шкалы Цельсия в шкалу Кельвина: Т = 273 + 25 = 298 К. Для расчета ∆G°(298) воспользуемся уравнением:
Расчет энергии Гиббса реакции образования беспорядочного клубка лизин
Задача 60.
В отсутствии денатурирующих агентов константа равновесия Кр реакции образования беспорядочного клубка лизина при 298 К и рН = 7 равна 7,8. Рассчитать ∆G° 298 и оценить биологический аспект полученной величины.
Решение:
Рассчитаем ∆G°298 из формулы ∆G° = –RTlnK, получим:
Так как ∆G° имеет отрицательное значение, (∆G°
Если ∆G° равно нулю (∆G° = 0), то реакция находится в равновесном состоянии.
Если ∆G° положительно (∆G° > 0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Вычислить тепловой эффект Q реакции 3 MnO2(тв) = Mn3O4(тв)+ О2(г), исходя из тепловых эффектов следующих реакций: 1) 4 MnO2(тв) = 2 Mn2O3(тв) + О2(г) – 213,7 кДж; 2) 6 Mn2O3(тв) = 4 Mn3O4(тв) + О2(г) –165,1 кДж.
| 🎓 Заказ №: 22229 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Вычислить тепловой эффект Q реакции 3 MnO2(тв) = Mn3O4(тв)+ О2(г), исходя из тепловых эффектов следующих реакций: 1) 4 MnO2(тв) = 2 Mn2O3(тв) + О2(г) – 213,7 кДж; 2) 6 Mn2O3(тв) = 4 Mn3O4(тв) + О2(г) –165,1 кДж.
Решение: Чтобы найти тепловой эффект Q реакции, воспользуемся законом Гесса. Для этого умножим уравнение 1) на 3 и сложим с уравнением 2). 12 6 6 3 4 641,1 ( 165,1)
Готовые задачи по химии которые сегодня купили:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Закономерности протекания химических реакций. Теплоты образования веществ
Задача 293.
Определить 
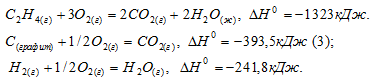
Решение:
Обозначим искомую величину [ 

Ответ: 52,4 кДж/моль.
Ответ: а) 96,8 кДж; б) 490,7 кДж; в) 26,8 кДж.
Задача 295.
Найти массу метана, при полном сгорании которой (с образованием жидкой воды) выделяется теплота, достаточная для нагревания 100 г воды от 20 до 30°С. Мольную теплоемкость воды принять равной 75,3Дж/(моль . К).
Решение:
Мольная теплоёмкость (CM) – это количество теплоты, необходимое для нагревания одного киломоля вещества на один градус. Находим количество теплоты необходимое для нагревания 100 г воды от 20 0 С до 30 0 С по формуле:
Стандартную энтальпию реакции рассчитаем, используя уравнение из следствия закона Гесса:
Теперь, учитывая, что при сгорании 1 моля метана выделяется 890,2 кДж теплоты, рассчитаем его массу, которая необходима для выделения 4,18 кДж теплоты из пропорции:
Ответ: 0,075г.
Задача 296.
Вычислить 
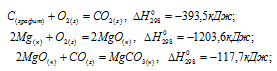
Решение:
Обозначим искомую величину через x, запишем термохимическое уравнение образования MgCO3 из простых веществ:
Затем запишем уравнения реакций образования CO2, MgO и MgCO3 из CO2 и MgO:
Из уравнений (1), (2) и (3) можно получить уравнение (4). Для этого нужно из уравнения (1) вычесть сумму уравнения (2) и ½ уравнения (3), получим:
Подставляя значения энтальпий образования веществ, находим искомую величину:
Задача 297.
Исходя из 
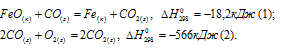
вычислить 
FeO(к) + Н2(г) = Fe(к) + Н2О(г) (3)
Решение:
Так как оксид железа (II) при взаимодействии с оксидом углерода (II) образует железо и оксид углерода (IV), то значение 
Тогда