Выберите формулу которая составлена неправильно если известно что валентность хлора равна i
Валентность хлора
Валентность хлора.
Валентность хлора:
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
| Валентность хлора в соединениях | |
| I | NaCl, NaClO, Cl2O |
| III | NaClO2 |
| IV | ClO2 |
| V | KClO3 |
| VI | Cl2O6 |
| VII | KClO4, Cl2O7 |
Валентность хлора
Общие сведения о валентности хлора
Хлор – активный окислитель.
Молекула хлора двухатомна Cl2.
Валентность хлора в соединениях
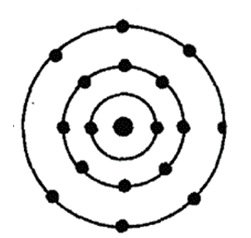
Хлор — семнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в VIIA группе. В ядре атома хлора содержится 17 протонов и 18 нейтронов (массовое число равно 35). В атоме хлора есть три энергетических уровня, на которых находятся 17 электронов (рис. 1).
Рис. 1. Строения атома хлора.
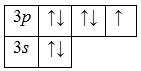
Электронная формула атома хлора в основном состоянии имеет следующий вид:
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
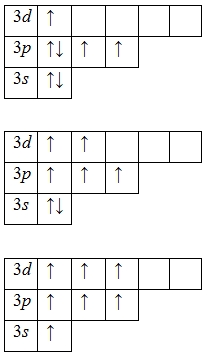
Наличие трех, пяти и семи неспаренных электронов в возбужденном состоянии свидетельствует о том, что хлор проявляет в своих соединениях валентности III (NaCl III O2), V (KCl V O3) и VI (KCl VII O4, Cl VII 2O7) (высшая валентность).
Формально хлор может проявлять валентности IV (ClO2) и VI (Cl2O6).
Примеры решения задач
| Задание | Какой объем хлора надо взять для реакции с 10 л водорода? Газы находятся при одинаковых условиях. |
| Решение | Запишем уравнение реакции взаимодействия хлора с водородом: |
Рассчитаем количество вещества водорода, вступившего в реакцию:
n (H2)= 10 / 22,4 = 0,45 моль.
Согласно уравнению, n (H2)= n (Cl2)= 0,45 моль. Тогда, объем хлора, вступившего в реакцию взаимодействия с водородом равен:
Тест с ответами: “Валентность”
1. Валентность:
а) способность присоединять атомы +
б) способность обмениваться атомами
в) способность отделять атомы
2. К элементам с постоянной валентностью относится:
а) сера
б) водород +
в) марганец
3. К элементам с переменной валентностью не относится:
а) железо
б) марганец
в) водород +
4. Какая связь происходит за счет образования общих электронных пар:
а) ковалентная связь +
б) металлическая связь
в) водородная связь
5. Какое из утверждений является верным:
а) валентность не имеет знака и может быть равной нулю
б) валентность имеет знак и не может быть равной нулю
в) валентность не имеет знака и не может быть равной нулю +
6. Как выглядит формула хлористого водорода, если известно, что валентность хлора равна единице:
а) HCl2
б) HCl +
в) HCl4
7. Какая валентность у марганца в данном соединении – Mn2O7:
а) II
б) IV
в) VII +
8. Какова валентность у углерода в формуле CH4:
а) IV +
б) VII
в) VI
9. Один из видов валентности:
а) непостоянная
б) временная
в) постоянная +
10. Один из видов валентности:
а) временная
б) переменная +
в) непостоянная
11. Сколько атомов водорода присутствует в молекуле воды:
а) 2 +
б) 3
в) 1
12. Степень окисления:
а) число, равное количеству электронов внешнего уровня атома
б) условный заряд атома, вычисленный на основе предположения, что соединение построено по ионному типу +
в) число химических связей, образуемых атомом химического элемента
13. Максимальная валентность атома фосфора:
а) V +
б) IV
в) +5
17. Этимологию термина валентность возможно отследить, начиная с этого года:
а) 1525
б) 1542
в) 1425 +
18. В этом году Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества:
а) 1709
б) 1789 +
в) 1889
19. Точное и позже полностью подтверждённое понимание феномена валентности было предложено в этом году:
а) 1952
б) 1825
в) 1852 +
20. Решающую роль в создании теории валентности сыграл:
а) Менделеев
б) Кекуле +
в) Ломоносов
21. Огромным достоинством теории валентности явилась возможность наглядного изображения:
а) молекулы +
б) атома
в) частицы
22. В 1860-х годах появились первые:
а) молярные модели
б) молекулярные модели +
в) ионные модели
23. Первоначально за единицу валентности была принята валентность атома:
а) гелия
б) кислорода
в) водорода +
24. Валентность кислорода, как правило, равна:
а) трем
б) двум +
в) одному
25. У большинства элементов значения валентности в водородных и в кислородных соединениях:
а) равные
б) одинаковы
в) различны +
26. В монооксиде углерода валентность углерода равна:
а) 3
б) 2 +
в) 4
27. В соединениях с такими связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей:
а) ковалентными +
б) валентными
в) ионными
28. В современной химии активно используется метод молекулярных орбиталей, в котором отсутствуют какие-либо аналоги понятия валентности:
а) частицы
б) ядра
в) атома +
29. В неорганической химии во многих случаях понятие валентности элемента теряет:
а) определённость +
б) однозначность
в) неопределенность
30. По валентности элементов можно составлять такие формулы соединений:
а) правдивые
б) истинные +
в) настоящие
Валентность хлора
Таблица валентностей химических элементов.Таблица валентности. Стандартные, высшие, низшие, редкие валентности, исключения. Максимальная валентность, минимальная валентность. Версия для печати
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..