Вторичная гипогаммаглобулинемия что это
Публикации в СМИ
Агаммаглобулинемии
• Синдром Вудса–Блэка–Норбери (*300076, синдром иммуноневрологический X-сцепленный, Xq26-qter, ген INDX, À доминантное): множественные неврологические поражения, новорождённые мальчики обычно гибнут после рождения.
• Агаммаглобулинемия швейцарского типа (*202500, r ). Характерны: выраженная подверженность инфекциям любой этиологии, гипоплазия тимуса (нет Т-лимфоидных клеток и телец Хасселла — эпителиальных «жемчужин» в вилочковой железе), гипогаммаглобулинемия. Известны фенокопии вследствие внутриутробного инфицирования вирусом краснухи. Синонимы: тяжёлый комбинированный иммунодефицит типа I; алимфоцитарная агаммаглобулинемия. Существует вариант с метафизарной хондродисплазией (200900, r ).
• Гипогаммаглобулинемия и изолированная недостаточность соматотрофного гормона (СТГ) (*307200, Xq21.3–q22, ген AGMX1, 300300, À ). Клиническая картина: низкий рост, недостаточность СТГ, задержка полового развития, отставание костного возраста от паспортного, интермиттирующие инфекции дыхательных путей. Лабораторные исследования: гипогаммаглобулинемия, нарушение выработки иммуноглобулинов in vitro, снижение содержания циркулирующих B-лимфоцитов.
• Изолированный дефицит иммуноглобулина A (IgA; *137100). Характерен дефицит IgA как в крови, так и в секретах слизистых оболочках. Клиническая картина: рецидивирующие инфекции дыхательных путей, хроническая диарея. У больных часто выявляют атопические и аутоиммунные заболевания. У многих больных в крови присутствуют АТ к IgA и при переливании крови или иммуноглобулинов возможно развитие тяжёлых анафилактических реакций. Лечение симптоматическое.
МКБ-10• D80 Иммунодефициты с преимущественной недостаточностью АТ
Код вставки на сайт
Агаммаглобулинемии
• Синдром Вудса–Блэка–Норбери (*300076, синдром иммуноневрологический X-сцепленный, Xq26-qter, ген INDX, À доминантное): множественные неврологические поражения, новорождённые мальчики обычно гибнут после рождения.
• Агаммаглобулинемия швейцарского типа (*202500, r ). Характерны: выраженная подверженность инфекциям любой этиологии, гипоплазия тимуса (нет Т-лимфоидных клеток и телец Хасселла — эпителиальных «жемчужин» в вилочковой железе), гипогаммаглобулинемия. Известны фенокопии вследствие внутриутробного инфицирования вирусом краснухи. Синонимы: тяжёлый комбинированный иммунодефицит типа I; алимфоцитарная агаммаглобулинемия. Существует вариант с метафизарной хондродисплазией (200900, r ).
• Гипогаммаглобулинемия и изолированная недостаточность соматотрофного гормона (СТГ) (*307200, Xq21.3–q22, ген AGMX1, 300300, À ). Клиническая картина: низкий рост, недостаточность СТГ, задержка полового развития, отставание костного возраста от паспортного, интермиттирующие инфекции дыхательных путей. Лабораторные исследования: гипогаммаглобулинемия, нарушение выработки иммуноглобулинов in vitro, снижение содержания циркулирующих B-лимфоцитов.
• Изолированный дефицит иммуноглобулина A (IgA; *137100). Характерен дефицит IgA как в крови, так и в секретах слизистых оболочках. Клиническая картина: рецидивирующие инфекции дыхательных путей, хроническая диарея. У больных часто выявляют атопические и аутоиммунные заболевания. У многих больных в крови присутствуют АТ к IgA и при переливании крови или иммуноглобулинов возможно развитие тяжёлых анафилактических реакций. Лечение симптоматическое.
МКБ-10• D80 Иммунодефициты с преимущественной недостаточностью АТ
Актуальность и методы коррекции вторичной гипогаммаглобулинемии в клинической практике
Полный текст:
Аннотация
Современные протоколы терапии многих онкологический, гематологических и некоторых наследственных заболеваний могут приводить к развитию тяжелой вторичной гипогаммаглобулинемии. В частности, причиной ее нередко становятся терапия моноклональными антителами к В-клеткам (ритуксимаб, белимумаб, инотузумаб) и ингибиторами тирозинкиназ (иматиниб, дезатиниб), а также применение целого ряда иммуносупрессивных и химиотерапевтических агентов (глюкокортикостероидов, азатиаприна, циклофосфамида и др.). При хроническом лимфолейкозе и множественной миеломе причиной гипогаммаглобулинемии может быть не только специфическая терапия, но и некоторые особенности самих заболеваний. Трансплантация гемопоэтических стволовых клеток также приводит к развитию тяжелой и длительной гипогаммаглобулинемии. Это ассоциировано как с проводимой интенсивной иммуно-/миелоаблативной терапией, так и с особенностями иммунологической реконституции после проведенного лечения. Современные препараты внутривенных иммуноглобулинов (ВВИГ) обладают широким репертуаром патоген-специфической активности при достаточно высоком профиле безопасности и являются неотъемлемой частью сопроводительной терапии пациентов с вторичной гипогаммаглобулинемией. В работе представлен обзор литературных данных о применении ВВИГ в различных клинических ситуациях, а также несколько клинических примеров из собственного опыта.
Ключевые слова
Об авторе
Балашов Дмитрий Николаевич, доктор медицинских наук, заведующий отделением трансплантации гемопоэтических стволовых клеток № 2, врач-гематолог
117997, Москва, ГСП-7, ул. Саморы Машела, 1
Список литературы
1. Bruton O.C. Agammaglobulinemia. Pediatrics 1952 Jun; 9 (6): 722–8.
2. Furst D.E. Serum immunoglobulins and risk of infection: how low can you go? Semin Arthritis Rheum 2009 Aug; 39 (1): 18–29.
3. Orange J.S., Grossman W.J, Navickis R.J., Wilkes M.M. Impact of trough IgG on pneumonia incidence in primary immunodeficiency: A meta-analysis of clinical studies. Clin Immunol 2010 Oct; 137 (1): 21–30.
4. Oscier D., Dearden C., Eren E., Erem E., Fegan C., Follows G., et al. Guidelines on the diagnosis, investigation and management of chronic lymphocytic leukaemia. Br J Haematol 2012; 159: 541–64.
5. Ravandi F., O’Brien S. Immune defects in patients with chronic lymphocytic leukemia. Cancer Immunol Immunother 2006 Feb; 55 (2): 197–209.
6. Morrison V.A. Infectious complications of chronic lymphocytic leukaemia: pathogenesis, spectrum of infection, preventive approaches. Best Pract Res Clin Haematol 2010 Mar; 23 (1): 145–53.
7. Raanani P., Gafter-Gvili A., Paul M., Ben-Bassat I., Leibovici L., Shpilberg O. Immunoglobulin prophylaxis in hematological malignancies and hematopoietic stem cell transplantation. Cochrane Database Syst Rev 2008 Oct; 8 (4): CD006501
8. Orange J.S., Hossny E.M., Weiler C.R., Ballow M., Berger M., Bonilla F.A., et al. Use of intravenous immunoglobulin in human disease: a review of evidence by members of the Primary Immunodeficiency Committee of the American Academy of Allergy, Asthma and Immunology. J Allergy Clin Immunol 2006 Apr; 117 (4 Suppl): S525–53.
9. Freeman J.A., Crassini K.R., Best O.G., Forsyth C.J., Mackinlay N.J., Han P., et al. Immunoglobulin G subclass deficiency and infection risk in 150 patients with chronic lymphocytic leukemia. Leuk Lymphoma 2013 Jan; 54 (1): 99–104.
10. Nucci M., Anaissie E. Infections in patients with multiple myeloma in the era of high-dose therapy and novel agents. Clin Infect Dis 2009 Oct 15; 49 (8): 1211–25.
11. Ludwig H., Zojer N. Supportive care in multiple myeloma. Best Pract Res Clin Haematol 2007 Dec; 20 (4): 817–35.
12. Chapel H.M., Lee M., Hargreaves R., Pamphilon D.H., Prentice A.G. Randomised trial of intravenous immunoglobulin as prophylaxis against infection in plateau- phase multiple myeloma. The UK Group for Immunoglobulin Replacement Therapy in Multiple Myeloma. Lancet 1994; 343 (8905): 1059–63.
13. Avivi I., Stroopinsky D., Katz T. Anti-CD20 monoclonal antibodies: beyond B-cells. Blood Rev 2013; 27 (5): 217–23.
14. Kano G., Nakatani T., Yagi K., Sakamoto I., Imamura T. Complicated pathophysi- ology behind rituximab-induced persistent hypogammaglobulinemia. Immunol Lett (2014) 159(1–2):76–8.
15. Cooper N., Davies E.G., Thrasher A.J. Repeated courses of rituximab for autoimmune cytopenias may precipitate profound hypogammaglobulinaemia requiring replacement intravenous immunoglobulin. Br J Haematol (2009) 146(1): 120–2.
16. De La Torre I., Leandro M.J., Valor L., Becerra E., Edwards J.C., Cambridge G. Total serum immunoglobulin levels in patients with RA after multiple B-cell deple- tion cycles based on rituximab: relationship with B-cell kinetics. Rheumatology 2012; 51 (5): 833–40.
17. Levy R., Mahevas M., Galicier L., Boutboul D., Moroch J., Loustau V., et al. Profound symptomatic hypogammaglobulinemia: a rare late complication after rituximab treatment for immune thrombocytopenia. Report of 3 cases and systematic review of the literature. Autoimmun Rev 2014; 13 (10): 1055–63.
18. Makatsori M., Kiani-Alikhan S., Manson A.L., Verma N., Leandro M., Gurugama N.P., et al. Hypogammaglobulinaemia after rituximab treatment-incidence and outcomes. QJM 2014; 107 (10): 821–8.
19. Miles S.A., McGratten M. Persistent panhypogammaglobulinemia after CHOP- rituximab for HIV-related lymphoma. J Clin Oncol 2005; 23 (1): 247–8.
20. Nishio M., Endo T., Fujimoto K., Sato N., Sakai T., Obara M., et al. Persis- tent panhypogammaglobulinemia with selected loss of memory B cells and impaired isotype expression after rituximab therapy for post-transplant EBV- associated autoimmune hemolytic anemia. Eur J Haematol 2005; 75 (6): 527–9.
21. Kelesidis T., Daikos G., Boumpas D., Tsiodras S. Does rituximab increase the incidence of infectious complications? A narrative review. Int J Infect Dis 2011; 15 (1): e2–1.
22. Casulo C., Maragulia J., Zelenetz A.D. Incidence of hypogammaglobulinemia in patients receiving rituximab and the use of intravenous immunoglobulin for recurrent infections. Clin Lymphoma Myeloma Leuk 2013; 13 (2):106–11.
23. Cabanillas F., Liboy I., Pavia O., Rivera E. High incidence of non-neutropenic infections induced by rituximab plus fludarabine and associated with hypogammaglobulinemia: a frequently unrecognized and easily treatable complication. Ann Oncol 2006; 17 (9): 1424–7.
24. Imashuku S., Teramura T., Morimoto A., Naya M., Kuroda H. Prolonged hypogam- maglobulinemia following rituximab treatment for post transplant Epstein-Barr virus-associated lymphoproliferative disease. Bone Marrow Transplant 2004; 33 (1): 129–30.
25. Lim S.H., Zhang Y., Wang Z., Esler W.V., Beggs D., Pruitt B., et al. Maintenance rituximab after autologous stem cell transplant for high-risk B-cell lymphoma induces prolonged and severe hypogammaglobulinemia. Bone Marrow Transplant 2005; 35(2): 207–8.
26. van Vollenhoven R.F., Emery P., Bingham C.O. III, Keystone E.C., Fleischmann R.M., Furst D.E., et al. Long-term safety of rituximab in rheumatoid arthri- tis: 9.5-year follow-up of the global clinical trial programme with a focus on adverse events of interest in RA patients. Ann Rheum Dis 2013; 72 (9): 1496–502.
27. Zaja F., Volpetti S., Chiozzotto M., Puglisi S., Isola M., Buttignol S., et al. Long-term follow-up analysis after rituximab salvage therapy in adult patients with immune thrombocytopenia. Am J Hematol 2012: 87 (9): 886–9.
28. Arnold D.M., Dentali F., Crowther M.A., Meyer R.M., Cook R.J., Sigouin C., et al. Systematic review: efficacy and safety of rituximab for adults with idiopathic thrombocytopenic purpura. Ann Intern Med 2007: 146 (1): 25–33.
29. Storek J., Dawson M.A., Storer B., Stevens-Ayers T., Maloney D.G., Marr K.A., et al. Immune reconstitution after allogeneic marrow transplantation com- pared with blood stem cell transplantation. Blood 2001; 97: 3380–9.
30. Storek J., Ferrara S., Ku N., Giorgi J.V., Champlin R.E., Saxon A. B-cell reconstitution after human bone marrow transplantation: recapitulation of ontogeny? Bone Marrow Transplant 1993; 12: 387–98.
31. Small T.N., Keever C.A., WeinerFedus S., Heller G., O’Reilly R.J., Flomenberg N. B-cell differentiation follow- ing autologous, conventional, or T-cell depleted bone marrow transplantation: a recapitulation of normal B-cell ontogeny. Blood 1990; 76: 1647–56.
32. Burns D.M., Tierney R., ShannonLowe C., Croudace J., Inman C., Abbotts B., et al. Memory B-cell reconstitution following allogeneic haematopoietic stem cell transplantation is an EBV-associated transformation event. Blood 2015; 126 (25): 2665–75.
33. Marie-Cardine A., Divay F., Dutot I., Green A., Perdrix A., Boyer O., et al. Transitional B-cells in humans: characterization and insight from B lymphocyte reconstitution after hematopoietic stem cell transplantation. Clin Immunol 2008; 127: 14–25.
34. Matsue K., Lum L.G., Witherspoon R.P., Storb R. Proliferative and differentiative responses of B cells from human marrow graft recipients to T-cell-derived factors. Blood 1987; 69: 308–15.
35. Saliba R.M., Rezvani K., Leen A., Jorgensen J., Shah N., Hosing C., et al. General and virus-specific immune cell reconstitution after double cord blood transplantation. Biol Blood Marrow Transplant 2015; 21 (7): 1284–90.
36. Maury S., Mary J.Y., Rabian C., Schwarzinger M., Toubert A., Scieux C., et al. Prolonged immune deficiency following allogeneic stem cell transplantation: risk factors and complications in adult patients. Br J Haematol 2001; 115: 630–41.
37. Matsue K., Lum L.G., Witherspoon R.P., Storb R. Proliferative and differentiative responses of B cells from human marrow graft recipients to T-cell-derived factors. Blood 1987; 69: 308–15.
38. Velardi A., Cucciaioni S., Terenzi A., Quinti I., Aversa F., Grossi C.E., et al. Acquisition of Ig isotype diversity after bone marrow transplantation in adults. A recapitulation of normal B-cell ontogeny. J Immunol 1988; 141: 815–20.
39. Ringhoffer S., Rojewski M., Dohner H., Bunjes D., Ringhoffer M. T-cell reconstitution after allogeneic stem cell transplantation: assessment by measurement of the sjTREC/betaTREC ratio and thymic naive T-cells. Haematologica 2013; 98: 1600–8.
40. Mackall C.L., Hakim F.T., Gress R.E. T-cell regeneration: all repertoires are not created equal. Immunol Today 1997; 18: 245–51.
41. Sullivan K.M., Kopecky K.J., Jocom J., Fisher L., Buckner C.D., Meyers J.D., et al. Immunomodulatory and antimicrobial efficacy of intravenous immunoglobulin in bone marrow transplantation. N Engl J Med 1990; 323: 705–12.
42. Bass E.B., Powe N.R., Goodman S.N., Graziano S.L., Griffiths R.I., Kickler T.S., Wingard J.R. Efficacy of immune globulin in preventing complications of bone marrow transplantation: a metaanalysis. Bone Marrow Transplant 1993; 12: 273–82.
43. Wolff S.N., Fay J.W., Herzig R.H., Greer J.P., Dummer S., Brown R.A., et al. High-dose weekly intravenous immunoglobulin to prevent infections in patients undergoing autologous bone marrow transplantation or severe myelosuppressive therapy: A study of the American Bone Marrow Transplant Group. Ann Intern Med 1993; 118: 937–42.
44. Winston D.J., Antin J.H., Wolff S.N., Bierer B.E., Small T., Miller K.B., et al. A multicenter, randomized, double-blind comparison of different doses of intravenous immunoglobulin for prevention of graft-versus-host disease and infection after allogeneic bone marrow transplantation. Bone Marrow Transplant 2001; 28: 187–96.
45. Raanani P., Gafter-Gvili A., Paul M., Ben-Bassat I., Leibovici L., Shpilberg O. Immunoglobulin prophylaxis in hematopoietic stem cell transplantation: systematic review and meta-analysis. J Clin Oncol 2009; 27: 770–81.
46. Buser A., Stern M., Arber C., Medinger M., Halter J., Rovo A., et al. Impaired B-cell reconstitution in lymphoma patients undergoing allogeneic HSCT: an effect of pretreatment with rituximab? Bone Marrow Transplant 2008; 42: 483–7.
47. Schmidt-Hieber M., Schwarck S., Stroux A., Ganepola S., Reinke P., Thiel E., et al. Immune reconstitution and cytomegalovirus infection after allogeneic stem cell transplantation: the important impact of in vivo T-cell depletion. Int J Hematol 2010; 91: 877–85.
48. Kalwak K., Gorczyńska E., Toporski J., Turkiewicz D., Slociak M., Ussowicz M., et al. Immune reconstitution after haematopoietic cell transplantation in children: immunophenotype analysis with regard to factors affecting the speed of recovery. Br J Haematol 2002; 118: 74–89.
49. Gluckman E., Traineau R., Devergie A., Esperou-Bourdeau H., Hirsch I. Prevention and treatment of CMV infection after allogeneic bone marrow transplant. Ann Hematol 1992; 64 (suppl): A158–161.
50. Winston D.J., Ho W.G., Lin C.H., Bartoni K., Budinger M.D., Gale R.P., Champlin R.E. Intravenous immune globulin for prevention of cytomegalovirus infection and interstitial pneumonia after bone marrow transplantation. Ann Intern Med 1987; 106: 12–8.
51. Winston D.J., Ho W.G., Lin C.H., Budinger M.D., Champlin R.E., Gale R.P. Intravenous immunoglobulin for modification of cytomegalovirus infections associated with bone marrow transplantation. Preliminary results of a controlled trial. Am J Med 1984; 76: 128–33.
52. Graham-Pole J., Camitta B., Casper J., Elfenbein G., Gross S., Herzig R., et al: Intravenous immunoglobulin may lessen all forms of infection in patients receiving allogeneic bone marrow transplantation for acute lymphoblastic leukemia: A pediatric oncology group study. Bone Marrow Transplant 1988; 3: 559–66.
53. Cordonnier C., Chevret S., Legrand M., Rafi H., Dhédin N., Lehmann B., et al. Should immunoglobulin therapy be used in allogeneic stem-cell transplantation? A randomized, double-blind, dose effect, placebo-controlled, multicenter trial. Ann Intern Med 2003; 139: 8–18.
54. Goldstein G., Rutenberg T.F., Mendelovich S.L., Hutt D., Oikawa M.T., Toren A., Bielorai B. The role of immunoglobulin prophylaxis for prevention of cytomegalovirus infection in pediatric hematopoietic stem cell transplantation recipients. Pediatr Blood Cancer 2017 Jul; 64 (7). DOI: 10.1002/pbc.26420
55. Ljungman P., Engelhard D., Link H., Biron P., Brandt L., Brunet S., et al. Treatment of interstitial pneumonitis due to cytomegalovirus with ganciclovir and intravenous immune globulin: experience of European Bone Marrow Transplant Group. Clin Infect Dis 1992; 14: 831–5.
56. Boeckh M. The challenge of respiratory virus infections in hematopoietic cell transplant recipients. Br J Haematol 2008 Nov; 143 (4): 455–67.
57. Tomblyn M., Chiller T., Einsele H., Gress R., Sepkowitz K., Storek J., et al. Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Blood Marrow Transplant 2009 Oct; 15 (10): 1143–238.
58. Rand K.H., Gibbs K., Derendorf H., Graham-Pole J. Pharmacokinetics of Intravenous Immunoglobulin (Gammagard) in Bone Marrow Transplant Patients. J Clin Pharmacology 1991; 31: 1151–54.
59. Cowan J., Cameron D.W., Knoll G., Tay J. Protocol for updating a systematic review of randomised controlled trials on the prophylactic use of intravenous immunoglobulin for patients undergoing haematopoietic stem cell transplantation. BMJ Open 2015 Aug 21; 5 (8): e008316. DOI: 10.1136/bmjopen-2015-008316
60. Data on file. CSL Behring
Для цитирования:
Балашов Д.Н. Актуальность и методы коррекции вторичной гипогаммаглобулинемии в клинической практике. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2019;18(3):145-153. https://doi.org/10.24287/1726-1708-2019-18-3-145-153
For citation:
Balashov D.N. Relevance and management of secondary hypogammaglobulinema in clinical practice. Pediatric Hematology/Oncology and Immunopathology. 2019;18(3):145-153. (In Russ.) https://doi.org/10.24287/1726-1708-2019-18-3-145-153
Избыточный бактериальный рост в тонкой кишке у больного общей вариабельной гипогаммаглобулинемией
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Общая вариабельная гипогаммаглобулинемия (ОВГГГ)— наследственно передаваемая неспособность дифференцироваться вплазматические клетки ипродуцировать основные классы иммуноглобулинов M, AиG. Заболевание возникает влюбом возрасте: удетей после 2 лет, увзрослых— после 16, чаще— втретьем десятилетии жизни. ОВГГГ относится кредким болезням— частота еевобщей популяции составляет 4:106 для мужчин и15:106 для женщин. Клинически этот вид нарушения гуморального иммунитета проявляется повторными бактериальными инфекциями, повышенной частотой аутоиммунных заболеваний излокачественных опухолей [1]. Вполе зрения гастроэнтеролога больные ОВГГГ попадают всвязи срецидивирующей диареей инарушением всасывания втонкой кишке. Хроническая диарея обусловлена обсеменением тонкой кишки разнообразной кишечной микробиотой, включая вирусы, паразиты ипростейшие. Часто обнаруживаются лямблии. Причиной мальабсорбции являются воспалительные изменения слизистой оболочки тонкой кишки (СОТК), вызываемые микрофлорой [2].
Ключевые методы диагностики ОВГГГ — исследование иммуноглобулинов в сыворотке крови и оценка макро- и микроскопической картины СОТК. У всех больных в той или иной мере снижена концентрация IgG, IgA и IgM. При рентгенологическом и эндоскопическом исследовании выявляется необычный бугристый рельеф внутренней поверхности тонкой кишки. Он создается скоплениями лимфоцитов в собственной пластинке СОТК, именуемых диффузной узловой лимфоидной гиперплазией (ДУЛГ). Патогномоничным признаком служит характерный клеточный инфильтрат, представленный лимфоцитами с уменьшением или полным отсутствием зрелых лимфоцитов (плазмоцитов) [3]. Для лечения больных ОВГГГ применяют иммуноглобулины (400–600 мг/кг каждые 3–4 нед.), антибактериальные препараты, например, (сульфаметоксазол + триметоприм) по 3–5 мг/кг/сут, а также иммуномодуляторы (полиоксидоний, аминодиоксотетрагидрофталазиндион натрия и др.). Прогноз зависит от степени тяжести инфекций, возникновения аутоиммунных заболеваний и успешности профилактики инфекций [4].
В качестве примера приводим наше наблюдение, демонстрирующее успешную диагностику ОВГГГ с умеренной депрессией гуморального иммунитета, протекающей с преобладанием в клинической картине синдрома избыточного бактериального роста (СИБР) в тонкой кишке, с хорошим ответом на антибактериальную терапию.
Больной Б., 33 года, поступил в отделение патологии кишечника МКНЦ с жалобами на обильный жидкий стул 3 р./сут, боли вокруг пупка, стихающие после стула, иногда тошноту и рвоту съеденной пищей, похудение на 11 кг за 3 мес.
В детстве перенес сальмонеллез и гепатит А. В школьном возрасте часто болел бронхитом, пневмонией и пансинуситом. В ноябре 2013 г. появились подъемы температуры до 38°С, диарея и боли вокруг пупка. При обследовании в поликлинике обращено внимание на множественные участки гиперплазии слизистой оболочки двенадцатиперстной кишки (ДПК) до 0,2 см диаметром. С предположительным диагнозом «болезнь Крона» направлен в МКНЦ.
При поступлении состояние больного удовлетворительное. Правильного телосложения. Рост — 174 см, вес — 89 кг. Кожа и видимые слизистые нормальной окраски. Периферические лимфатические узлы не увеличены. система — без особенностей. Грудная клетка правильной формы. При перкуссии границы легких в пределах нормы, легочный звук ясный. При аускультации дыхание везикулярное с рассеянными сухими хрипами. Пульс — 88 уд./мин. АД — 135/80 мм рт. ст. Границы сердца в норме, тоны ясные, ритм правильный. Язык влажный, не обложен. Живот правильной формы, участвует в акте дыхания, при пальпации мягкий, безболезненный. Печень, селезенка и почки не пальпируются. Мочеиспускание свободное, безболезненное. Симптом поколачивания с обеих сторон отрицательный. Щитовидная железа не увеличена.
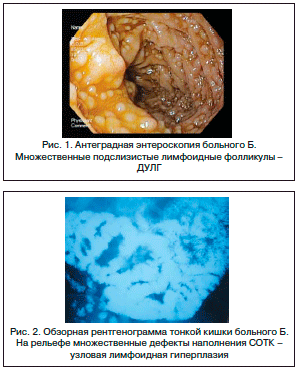
При глубокой антеградной энтероскопии обращал на себя внимание необычный рельеф слизистой оболочки ДПК и тощей кишки, напоминавший картину «булыжной мостовой» за счет многочисленных полушаровидных образований от 0,2 до 0,5 см диаметром (рис. 1), что давало основания для дифференциальной диагностики ДУЛГ с болезнью Крона и полипозом тонкой кишки.
При рентгенологическом исследовании тонкой кишки (после приема 400 мл бариевой взвеси) на всем ее протяжении определялись множественные полиповидные дефекты наполнения до 3–4 мм в диаметре, с четкими контурами. Заключение: рентгенологическая картина ДУЛГ тонкой кишки (рис. 2).
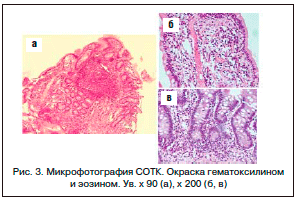
Диагностические трудности помогло разрешить морфологическое исследование биоптатов СОТК (рис. 3). Высота кишечных ворсин снижена, некоторые из них деформированы. Ворсины выстланы клетками высокого цилиндрического эпителия с небольшим количеством бокаловидных клеток. Число межэпителиальных лимфоцитов увеличено. Крипты неглубокие. Соотношение ворсина/крипт = 2/1. В эпителии дна крипт встречаются панетовские клетки. Собственная пластинка отечна и сильно инфильтрирована лимфоцитами с существенной примесью нейтрофилов и эозинофилов. Плазматические клетки в инфильтрате отсутствуют. В собственной пластинке располагаются крупные лимфатические фолликулы со светлыми центрами размножения и гиперплазированные сосуды капиллярного типа, просветы которых часто дилатированы. Заключение: гистологическая картина очагового субатрофического еюнита, вероятно, обусловленная патологией иммунной системы.
Больному выполнено иммунологическое исследование крови: IgG — 487 (норма — 751–1560 мг/дл), IgA — 6,67 (норма — 82–453 мг/дл), IgM — 17,7 (норма — 46–304 мг/дл). Общее количество иммуноглобулинов — 511 мг/дл (5,11 ). Антитела к тканевой трансглютаминазе (АтТГ) не определяются. Дыхательный водородный тест: концентрация Н2 в выдыхаемом воздухе — 237‰ (норма — 15–20‰).
Установлен диагноз: ОВГГГ, энтеропатия, ассоциированная с СИБР в тонкой кишке.
После выписки оставлен под наблюдение врача отделения патологии кишечника МКНЦ с рекомендацией продолжить повторные курсы антибактериальной терапии и лечение иммуномодуляторами в иммунологическом центре.
Позднее установление диагноза у больного (в возрасте 33 лет) обусловлено недостаточным информированием врачей, эндоскопистов, о данной патологии иммунной системы. Поэтому не были учтены многочисленные хронические инфекции, которым больной подвергался с самого раннего детства, не выполнялась биопсия СОТК при наличии ДУЛГ с целью исключения (или подтверждения) ОВГГГ.
Дальнейшая тактика ведения больного должна включать повторные курсы антибактериальной терапии с целью подавления СИБР в тонкой кишке, ежемесячные курсы лечения иммуноглобулином и иммунорегуляторами под наблюдением гастроэнтеролога и специалистов иммунологического центра.