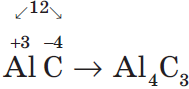Все что нужно знать о степенях окисления
Валентность и степень окисления
Валентность
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы
Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.
В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.
Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Степень окисления
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает «+», а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией 🙂 Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 😉
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Степень окисления
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями.
Степени окисления бывают высшие, низшие и промежуточные.
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Для нахождения степеней окисления используют следующие правила :
Примеры :
Задание: определите степени окисления элементов в молекуле дихромата калия: K2Cr2O7.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла. Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
Степени окисления элементов. Как найти степени окисления?
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
Несколько простых примеров на определение степеней окисления
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте «разделить» молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Не смешивайте понятия «валентность» и «степень окисления»!
Степень окисления часто путают с валентностью. Не совершайте подобной ошибки. Перечислю основные отличия:
Небольшой тест на тему «Степень окисления»
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Для желающих еще немного потренироваться рекомендую соответствующий тематический тест.
Все что нужно знать о степенях окисления
Ключевые слова конспекта: степень окисления химических элементов.
Атом в целом электронейтрален. Однако при образовании химических связей с атомами других элементов атом, как правило, приобретает частичный заряд. Например, при образовании ковалентной полярной связи между атомами водорода и хлора одноэлектронное s-облако атома водорода перекрывается одноэлектронным р-облаком атома хлора:
При этом общая электронная пара смещается в сторону более электроотрицательного атома хлора, но электрон атома водорода перейдет к атому хлора лишь частично, формируя тем самым частичные заряды атомов δ:
Если общую электронную пару в молекуле хлороводорода полностью «передать» атому хлора, то атом хлора «получит» назад собственный электрон и электрон от атома водорода, принимающий участие в ковалентной связи. Электрон атома водорода сформирует на атоме хлора отрицательный заряд, равный —1. А атом водорода, «потерявший» свой электрон, в этом случает приобретает заряд, равный +1. Эти заряды условны, их называют степенью окисления (СО).
Принято условно считать, что в соединениях с ковалентными полярными связями общие электронные пары полностью переходят к более электроотрицательному атому, а потому такие соединения состоят только из положительно и отрицательно заряженных ионов.
СО может иметь отрицательное, положительное или нулевое значения. Значения СО принято записывать сверху над символами элемента, при этом вначале указывается знак условного заряда, а затем его величина:
При определении СО элемента в химическом соединении необходимо учитывать, что:
При рассмотрении неорганических соединений, большинство из которых имеет ионное строение, обычно используют понятие степень окисления, а в органической химии, где большинство соединений имеют молекулярное строение, как правило, используют понятие валентность.
Пример Пример. Определить СО марганца в соединении K2MnO4.
Пользуясь правилом электронейтральности вещества, составляем уравнение:
(+1) • 2 + х + (–2) • 4 = 0;
х = 8 – 2 = 6.
Таким образом, СО марганца +6:
Конспект урока «Степень окисления химических элементов».
Темы, связанные с настоящим конспектом:
Электроотрицательность, степень окисления и валентность химических элементов
Теория к заданию 3 из ЕГЭ по химии
Электроотрицательность, степень окисления и валентность химических элементов
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО).
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью.
Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Существует шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
$F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs$. Наибольшее значение ЭО имеет фтор.
В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз).
В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два), или двухэлементными.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т.е. атомы более электроотрицательных элементов.
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т.е. атомы менее электроотрицательных элементов.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
Валентность
Очень важное значение в описании химического строения органических соединений имеет понятие валентности.
Валентность характеризует способность атомов химических элементов к образованию химических связей; она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле.
Валентность атома химического элемента определяется, в первую очередь, числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.