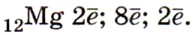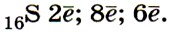Восстановительные свойства магния выражены сильнее чем у бериллия
§ 1. Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Как и литературным героям, химическим элементам — «героям» химических процессов дают характеристики. Только если для первых в качестве первоисточника используют литературное произведение, то для вторых — Периодическую систему химических элементов Д. И. Менделеева. Однако и в первом, и во втором случае необходим план.
Характеризуя химический элемент, будем придерживаться следующего плана.
1. Положение элемента в Периодической системе Д. И. Менделеева и строение его атомов.
2. Характер простого вещества (металл, неметалл).
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер (основный, кислотный, амфотерный).
6. Состав высшего гидроксида, его характер (кислородсодержащая кислота, основание, амфотерный гидроксид).
7. Состав летучего водородного соединения (для неметаллов).
В приведённом плане для вас незнакомыми являются следующие химические понятия: переходные металлы, амфотерные оксиды и гидроксиды. Их смысл будет раскрыт в следующем параграфе. Пока же рассмотрим характеристики металла и неметалла.
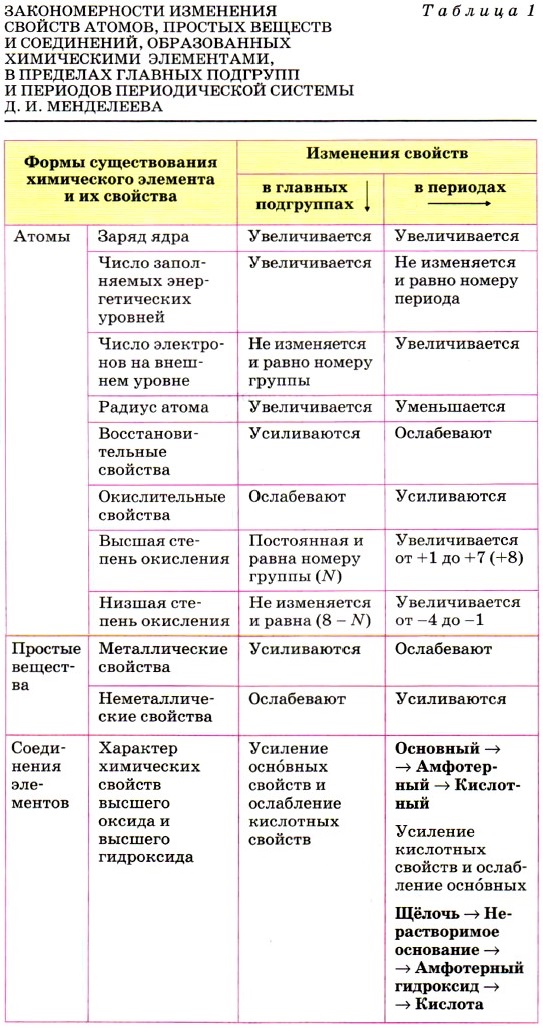
При этом будем руководствоваться уже известными вам из курса 9 класса основными закономерностями изменения свойств атомов, простых веществ и соединений, образованных химическими элементами главных подгрупп (А групп) и периодов Периодической системы Д. И. Менделеева (табл. 1).
Характеристика металла на примере магния.
Элемент магний находится в 3-м периоде Периодической системы, значит, все электроны атома располагаются на трёх энергетических уровнях. Строение электронной оболочки атома магния можно отразить с помощью следующей схемы:
Исходя из строения атома, можно предсказать и степень окисления магния в его соединениях. В химических реакциях атом магния отдаёт два внешних электрона, проявляя восстановительные свойства, следовательно, он получает степень окисления +2.
Восстановительные свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (элементы IIА группы), что связано с увеличением радиусов атомов при переходе от Be к Mg и Са. Соответственно в ряду Be — Mg — Са два внешних электрона всё более удаляются от ядра, ослабевает их связь с ядром, и они всё легче покидают атом, который при этом переходит в ион М2 + (М — металл).
2. Для магния — простого вещества — характерна металлическая кристаллическая решётка и металлическая химическая связь, а отсюда и все типичные для металлов свойства (вспомните какие).
3. Металлические свойства у магния выражены сильнее, чем у бериллия, но слабее, чем у кальция (объясните почему, учитывая, что металлические свойства определяются в первую очередь способностью атомов отдавать электроны).
4. Металлические свойства у магния выражены слабее, чем у натрия, но сильнее, чем у алюминия (соседние элементы 3-го периода) (объясните почему).
5. Оксид магния MgO является основным оксидом и проявляет все типичные свойства основных оксидов (iвспомните какие).
6. В качестве гидроксида магнию соответствует основание Mg(OH)2, которое проявляет все характерные свойства оснований (вспомните какие).
7. Летучего водородного соединения магний не образует.
Характеристика неметалла на примере серы.
1. Сера — элемент VIA группы и 3-го периода, Z = 16, А = 32. Соответственно атом серы содержит в ядре 16 протонов и 16 нейтронов и на электронной оболочке — 16 электронов. Строение его электронной оболочки можно отразить с помощью следующей схемы:
Сера — менее сильный окислитель, чем кислород, но более сильный, чем селен, что связано с увеличением радиусов атомов от кислорода к селену. По этой же причине восстановительные свойства элементов в главной подгруппе VI группы (VIA группы) при переходе от кислорода к селену усиливаются. (Дайте объяснения указанных изменений окислительных и восстановительных свойств.)
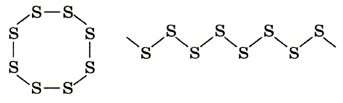
2. Сера — простое вещество, типичный неметалл. Сере свойственно явление аллотропии. Разные простые вещества, образованные химическим элементом серой, имеют различные свойства, так как кристаллическое строение их различно. Например, у ромбической серы молекулярная кристаллическая решётка состоит из циклических молекул состава S8, а у пластической серы молекулы представляют собой длинные открытые цепи атомов:
3. Неметаллические свойства у серы выражены слабее, чем у кислорода, но сильнее, чем у селена.
4. Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее, чем у хлора (соседние элементы в 3-м периоде).
5. Высший оксид серы имеет формулу SO3. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов какие?).
6. Высший гидроксид серы — хорошо известная вам серная кислота H2SO4, раствор которой проявляет все типичные свойства кислот (какие?).
7. Сера образует летучее водородное соединение — сероводород H2S.
Подобные характеристики можно привести для большинства элементов-металлов и элементов-неметаллов главных подгрупп. На их основе можно составить генетические ряды металла и неметалла.
1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
1. Дайте характеристику элементов: а) фосфора; б) калия.
2. Запишите уравнения химических реакций, характеризующие свойства: a) MgO и SO3; б) Mg(OH)2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
3. Дайте характеристику магния — простого вещества. Какой тип связи наблюдается в нём? Какие физические свойства имеет металл магний? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором Сl2; в) серой; г) азотом N2; д) соляной кислотой. Рассмотрите их с позиций процессов окисления-восстановления.
4. Что такое аллотропия? Какой тип химической связи реализуется в молекулах состава: a) S8; б) H2S? Какие физические свойства имеет наиболее устойчивая модификация серы — ромбическая сера? Запишите уравнения реакций серы со следующими веществами: а) натрием; б) кальцием;в) алюминием; г) кислородом; д) водородом; е) фтором F2. Рассмотрите их с позиций процессов окисления-восстановления.
5. Сравните свойства простого вещества кремния со свойствами простых веществ, образованных химическими элементами — соседями кремния по периоду.
6. У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора; б) фосфора или серы?
7. Вычислите объём воздуха (примите объёмную долю кислорода в нём равной 0,2), который потребуется для сжигания 120 мг образца магния, содержащего 2% негорючих примесей.
8. Вычислите объём оксида серы (IV) (н. у.), который может быть получен при сжигании 1,6 кг серы, если выход продукта составляет 80% от теоретически возможного. Указание. Сначала по уравнению реакции рассчитайте объём оксида серы (IV) — это теоретический объём Итеор, затем найдите практический объём Упракт, исходя из известного выхода продукта W:
Аналогично можно найти массу продукта реакции, используя формулу:
9. Можно ли утверждать, что высшему оксиду серы SO3 соответствует сернистая кислота H2SO3? Почему?
10. Используя метод электронного баланса, определите коэффициенты в схемах химических реакций:
Восстановительные свойства магния выражены сильнее чем у бериллия
Абросимова Елена Владимировна учитель химии и биологии
НАВИГАЦИЯ
Бериллий, магний и щелочноземельные металлы
К главной подгруппе второй группы относятся металлы: бериллий, магний, кальций, стронций, барий, радий.
НАХОЖДЕНИЕ В ПРИРОДЕ
MgCO3 – магнезит; CaCO3 • MgCO3 – доломит; KCl • MgSO4 • 3H2O – каинит; KCl • MgCl2 • 6H2O – карналлит
CaCO 3 – кальцит (известняк, мрамор и др.); Ca3(PO4)2 – апатит, фосфорит; CaSO4 • 2H2O – гипс; CaSO4 – ангидрит; CaF2 – плавиковый шпат (флюорит)
SrSO4 – целестин; SrCO3 – стронцианит; Ba BaSO 4 – барит; BaCO3 – витерит
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t ° пл. и t ° кип, плотностями и твердостью.
* 2 электрона на внешнем слое, Возможная степень окисления +2.
Очень реакционноспособны, сильные восстановители. Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
1. Взаимодействие с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде, но с горячей водой магний образует основание Mg(OH) 2.
В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
2. Взаимодействие с неметаллами
Все металлы образуют оксиды RO, барий образует пероксид – BaO2:
б). Взаимодействие с другими неметаллами:
Ca + 2 C → CaC 2 (карбиды)
3 Ba + 2 P → Ba 3 P 2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
3. Взаимодействие с кислотами:
4. Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
Катион Ba 2+ обычно открывают обменной реакцией с серной кислотой или ее солями:
Ba 2+ + SO 4 2- → BaSO 4↓ Сульфат бария – белый осадок, нерастворимый в минеральных кислотах.
Восстановительные свойства магния выражены сильнее чем у бериллия
Общая характеристика металлов главных подгрупп I – III групп в связи с их положением в периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа по их положению в периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов
1. В порядке увеличения восстановительной способности металлы расположены в ряду:
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
2. Щелочные металлы
1)являются сильными восстановителями
2) проявляют как окислительные, так и восстановительные свойства
3) легко образуют отрицательно заряженные ионы
4) легко присоединяют электроны в химических реакциях
2) восстановительная способность
3) химическая активность
4. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
5. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
6. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
7. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
8. Сила оснований возрастает в ряду:
9. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
10. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
11. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
12. Для растворения как меди, так и железа, следует использовать
1) концентрированную фосфорную кислоту
2) разбавленную азотную кислоту
3) разбавленную соляную кислоту
4) раствор гидроксида калия
13. К основным гидроксидам относится каждое из двух веществ:
14. При нагревании меди с концентрированной серной кислотой образуется
15. Медь может вступать во взаимодействие с водным раствором
1) гидроксида натрия
16. Основные свойства веществ ослабевают в ряду:
17. Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
3) верны оба суждения
4) оба суждения неверны
18. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
3) верны оба суждения
4) оба суждения неверны
19. Медь не взаимодействует с
1) разбавленной серной кислотой
2) концентрированной серной кислотой
3) разбавленной азотной кислотой
4) концентрированной азотной кислотой
20. Верны ли следующие суждения?
А. Магний взаимодействует с кислотами и щелочами.
Б. С концентрированными серной и азотной кислотами магний реагирует только при нагревании.
3) верны оба суждения
4) оба суждения неверны
21. Оксид хрома (VI) является
22. При обычных условиях практически осуществима реакция между железом и
2) серной кислотой (конц.)
3) нитратом меди (II) (р-р)
4) нитратом цинка (р-р)
23. Только при нагревании с водой реагируют
1) К и Hg 2) Zn и Fe 3) Cs и Ag 4) Sr и Сu
24. Только основные свойства проявляет
25. Сильные окислительные свойства характерны для
2) оксида железа (II)
3) оксида хрома (III)
26. Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
3) верны оба суждения
4) оба суждения неверны
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
28. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
3) верны оба суждения
4) оба суждения неверны
29. Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
3) верны оба суждения
4) оба суждения неверны
30. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
3) верны оба суждения
4) оба суждения неверны
Ответы: 1-4, 2-1, 3-4, 4-2, 5-1, 6-4, 7-3, 8-1, 9-3, 10-2, 11-3, 12-2, 13-3, 14-1, 15-4, 16-3, 17-3, 18-3, 19-1, 20-4, 21-2, 22-3, 23-2, 24-2, 25-4, 26-1, 27-4, 28-2, 29-1, 30-4