Вольтарен или нимесулид что лучше
Существуют ли различия между нестероидными противовоспалительными препаратами? В центре внимания нимесулид
В данной работе представлены различия нестероидных противовоспалительных препаратов, применяемых для лечения заболеваний, сопровождающихся острой болью.
This paper describes different non-steroid anti-inflammatory preparations used for treatment of diseases accompanied with acute pain.
Распространенность заболеваний, сопровождающихся острой болью и требующих применения обезболивающих препаратов, в современном мире постоянно растет. К ним относятся, в частности, ревматические болезни, воспалительные и дегенеративные заболевания опорно-двигательного аппарата, головная боль. Примерно 40% визитов к врачу общей практики обусловлены слабой и умеренной острой болью, а более 70% посещений отделений неотложной помощи происходит из-за наличия у пациента интенсивной острой боли [1]. В структуре общей заболеваемости населения Российской Федерации болезни костно-мышечной системы и соединительной ткани (БКМС) занимают 3-е место после болезней системы кровообращения и органов дыхания [2]. Агентство National Health Interview Survey демонстрирует следующие данные: в 2011 г. 28,4% взрослых американцев сообщали о боли в нижней части спины (БНС) в течение предыдущих опросу 3 месяцев [3].
Эффективность нестероидных противовоспалительных препаратов (НПВП) при острой боли не подвергается сомнению. НПВП обладают противовоспалительной, обезболивающей и жаропонижающей активностью. Входящие в состав НПВП вещества относятся к различным химическим классам, поэтому обладают разными фармакокинетическими и фармакодинамическими свойствами.
Обзор клинической эффективности НПВП показывает, что различные препараты данной группы обладают примерно схожей терапевтической активностью. В данной работе будут представлены различия НПВП и особое внимание будет уделено представителю НПВП нимесулиду.
Фармакологические свойства НПВП
Ингибирование синтеза простагландинов
В начале 70-х годов Vane высказал предположение, что в основе противовоспалительного действия Аспирина и аналогичных ему препаратов лежит способность ингибировать биосинтез простагладинов, путем ингибирования ответственного за их синтез фермента циклооксигеназы (ЦОГ). Лишь 20 лет спустя эта гипотеза получила свое подтверждение, и стало известно, что за синтез простагландинов отвечают две изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), а НПВП можно разделять с учетом селективности в отношении разных изоформ ЦОГ.
ЦОГ-1 отвечает в основном за синтез простагландинов, участвующих в процессах гомеостаза в жизненно важных органах. Именно с ингибированием ЦОГ-1 связывают хорошо известные желудочно-кишечные побочные эффекты традиционных неселективных НПВП.
Ингибирование ЦОГ-2 обеспечивает противовоспалительный эффект НПВП, так как она участвует в синтезе воспалительных простагландинов.
Неселективные НПВП ингибируют обратимо или необратимо как ЦОГ-1, так и ЦОГ-2. Большинство токсических эффектов этих препаратов связано с их способностью блокировать синтез физиологических простагландинов, необходимых для обеспечения гомеостаза в почках, желудке и тромбоцитах за счет ингибирования ЦОГ-1.
Появление на рынке в конце 90-х годов селективных ингибиторов ЦОГ-2 (коксибов) давало клиницистам надежду на то, что эта группа НПВП обеспечит высокую фармакологическую эффективность при более низком уровне желудочно-кишечных осложнений. Однако ожидания были оправданы не в полной мере, в частности, получены доказательства того, что применение коксибов сопровождается увеличением частоты тромбоэмболических осложнений, что привело к выводу с рынка во всем мире таких препаратов, как рпсиофекоксиб и валдекоксиб. Кроме того, применение валдекоксиба связывают с частым развитием нежелательных кожных реакций. Кардиотоксичность коксибов объясняют блокированием синтеза простациклинов, опосредованного ЦОГ-2, что нивелирует их защитные эффекты в отношении тромбогенеза, гипертензии и атерогенеза in vivo.
НПВП классифицируют по степени селективности в отношении изоформ ЦОГ (рис. 1). Селективность в отношении ЦОГ определяется химической структурой НПВП. Аминокислотная структура ЦОГ-1 и ЦОГ-2 является достаточно стабильной, однако рентгеновские кристаллографические исследования ЦОГ показали, что активная область связывания с НПВП у ЦОГ-2 позволяет связываться с большим количеством субстратов, чем центр связывания у ЦОГ-1. Этот активный канал является гидрофобным, у ЦОГ-2 возможно открытие бокового гидрофильного кармана, который у ЦОГ-1 закрыт изолейцином.
Так, флурбипрофен, который относят к неселективным НПВП, взаимодействует с ЦОГ-1 посредством связывания фенильной группы с гидрофобным каналом и карбоксильной группы с аргинином в 120-м положении. Взаимодействие флурбипрофена с ЦОГ-2 сходно с вышеописанным, однако, связываясь с аргинином в 120-м положении, карбоксильная группа блокирует активный центр ЦОГ-2, не позволяя ему взаимодействовать с субстратом. Напротив, селективные ингибиторы ЦОГ-2 не могут войти в активный канал ЦОГ-1 и не имеют карбоксильной группы для связывания с аргинином в 120-м положении.
Нимесулид — единственный представитель класса сульфонанилидов, преимущественно ингибирующим ЦОГ-2. Активность нимесулида в отношении ЦОГ-2 в 5–50 раз превосходит активность в отношении ЦОГ-1. В исследованиях in vivo использование нимесулида в терапевтической дозе (100 мг 2 раза в сутки) продемонстрировало значительное снижение концентрации простагландина E2 в плазме крови. Нимесулид не оказывает влияния на агрегацию тромбоцитов, что было доказано при оценке индуцированной активности ЦОГ-1, и не влияет на образование в желудке простагландина E2 и простагландина I2, а также ЦОГ-1 зависимых эффектов.
Фармакокинетический профиль
На основании периода полувыведения НПВП могут быть разделены на две большие группы: с коротким периодом полувыведения (менее 6 часов) и с длительным периодом полувыведения (более 10 часов). Группа НПВП с коротким периодом полувыведения включает Аспирин, диклофенак, ибупрофен, флурбипрофен, индометацин, лумиракоксиб* и нимесулид. Группа препаратов с длительным периодом полувыведения включает целекоксиб, напроксен, сулиндак, рофекоксиб, оксапрозин*, пироксикам. Достижение равновесной концентрации препарата в плазме крови происходит после его применения в течение периода, превосходящего период полувыведения в 3–5 раз, поэтому достижение пиковой концентрации в плазме крови и максимального клинического эффекта НПВП с коротким периодом полувыведения происходит быстрее, чем препаратов с длительным периодом полувыведения.
Нимесулид: фармакологический профиль
Нимесулид оказывает быстрое обезболивающее действие, что подтверждают следующие исследования. Применение нимесулида у пациентов с острым артритом характеризуется быстрым началом действия и ранним ингибированием образования простагландина E2 (маркера активности ЦОГ-2). В клинических исследованиях у пациентов с остеоартритом коленных суставов были получены доказательства быстрого начала действия нимесулида. У данной категории больных нимесулид вызывал достоверно более значимое облегчение боли, связанной с ходьбой, и эффект наступал быстрее, чем при применении целекоксиба и рофекоксиба. Начало обезболивающего действия нимесулида фиксировалось уже через 15 минут после приема. Согласно недавним исследованиям, эффективные концентрации нимесулида в плазме крови и синовиальной жидкости обнаруживаются уже через 30 минут после его приема.
НПВП могут обладать противовоспалительными свойствами, которые не зависят от ЦОГ. Было показано, что нимесулид, помимо периферического ингибирующего воздействия на ЦОГ, может ингибировать высвобождение фактора некроза опухолей (ФНО), гистамина, образования активных форм кислорода (АФК), высвобождения матриксных металлопротеаз (ММП) и гибели хондроцитов (рис. 2).
 Влияние нимесулида на медиаторы воспаления
Влияние нимесулида на медиаторы воспаления
ФНО-α играет ведущую роль в воспалительном процессе, что делает его идеальной целью при терапии ревматоидного артрита. В исследованиях на крысах, которым вводили липополисахариды для увеличения уровня ФНО-α, нимесулид эффективно ингибировал его высвобождение.
Выработка фагоцитами супероксида и высвобождение лактоферрина из нейтрофилов были исследованы у восьми добровольцев до и после приема нимесулида внутрь. В качестве активирующих стимулов были использованы фактор хемотаксиса N-формил-метионил-лейцил-фенилаланин и частицы опсонизированного зимозана. Нимесулид значимо ингибировал образование АФК N-формил-метионил-лейцил-фенилаланином и активированными за счет воздействия опсонизированных частиц зимозана фагоцитами (ингибирование до 67,6% и 36,8% соответственно) (рис. 3). Он не оказывал влияния на высвобождение лактоферрина нейтрофилами, что позволило авторам предположить, что нимесулид не оказывает влияния на механизмы, происходящие при экзоцитозе специфичных гранул.
В ходе воспалительной реакции для предупреждения повреждения тканей требуется поддержание баланса между протеиназами (преимущественно эластазами, выделяемыми мигрировавшими в очаг нейтрофилами) и антипротеазами (в основном эластаз-специфическим альфа-1-ингибитором протеиназ; A1PI). Нейтрофильные клетки способны инактивировать A1PI с помощью серии окислительных реакций с участием хлорноватистой кислоты, что позволяет эластазе свободно разрушать соединительную ткань. Возможным способом регулирования активности нейтрофильной эластазы является фармакологическая защита A1PI от окислительной инактивации под действием хлорноватистой кислоты нейтрофилов. В доклинических исследованиях было показано, что нимесулид предотвращал инактивацию A1PI под действием выделяемой нейтрофилами хлорноватистой кислоты, что позволяет осуществлять опосредованный A1PI контроль гистотоксической функции эластазы. Полученные данные позволяют предполагать, что защитное влияние нимесулида на A1PI может иметь значение в реализации его противовоспалительного действия.
В другом исследовании морским свинкам предварительно вводили нимесулид или индометацин, после чего ацетальдегидом провоцировали выброс гистамина и бронхоспазм (рис. 4). В контрольной группе, получавшей только ацетальдегид, концентрация гистамина в крови была равна 195 ± 12 мг/л, в группе, получавшей нимесулид, при использовании дозы 0,1 мг/кг она была равна 154 ± 10 мг/л (p
О. В. Котова, кандидат медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Нестероидные противовоспалительные препараты для наружного применения в лечении скелетно-мышечных болевых синдромов
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные средства (НПВС). В практической деятельности врача, занимающегося лечением болевых синдромов, определяющим критерием выбора лекарственного средства является его анальгетическая эффективность, индивидуальная непереносимость, вероятность возникновения осложнений или побочных эффектов [1, 3].
Применение НПВС внутрь или парентерально часто сопровождается у пациентов развитием побочных эффектов и осложнений, в первую очередь со стороны желудочно-кишечного тракта, почек, центральной нервной системы. Возможность применять лекарственные средства местно (наружно) позволяет доставлять активное вещество максимально близко к источнику болевого ощущения, не вызывая системного воздействия, что значительно уменьшает риск развития побочных эффектов и осложнений.
В настоящее время арсенал препаратов для местного применения, содержащих НПВС, при заболеваниях опорно-двигательного аппарата достаточно широк, в том числе в связи с выпуском одних и тех же препаратов разными производителями под разными (патентованными) названиями.
Все НПВС для местного применения можно разделить на следующие группы по основному действующему лекарственному веществу, входящему в состав многокомпонентных или комбинированных препаратов [2].
1. Действующее вещество — диклофенак.
2. Действующее вещество — ибупрофен.
- — Нурофен гель.
— Долгит.
— Долгит крем.
3. Действующее вещество — индометацин.
4. Действующее вещество — кетопрофен.
- — Артрозилен.
— Быструмгель.
— Кетонал.
— Кетопрофен Врамед.
— Фастум.
— Феброфид.
— Флексен.
5. Действующее вещество — нимесулид.
6. Действующее вещество — пироксикам.
Основным механизмом действия препаратов монокомпонентного состава с действующим веществом диклофенаком является неселективное ингибирование активности циклооксигеназы (ЦОГ): ЦОГ-1 и ЦОГ-2, что приводит к нарушению метаболизма арахидоновой кислоты и подавлению синтеза простагландинов в очаге воспаления. При наружном применении данных препаратов возникают ослабление болей в месте их нанесения, уменьшение отечности и увеличение объема движений в пораженных суставах.
Показаниями для применения служат болевой синдром при воспалительных и дегенеративных заболеваниях суставов и позвоночника, ревматических поражениях мягких тканей, посттравматическом болевом синдроме, невралгии.
Побочные действия могут наблюдаться в виде местных кожных проявлений, при длительном применении препаратов возможны резорбтивное действие и развитие системных реакций (крапивница, бронхоспазм, ангионевротический отек).
Противопоказаниями для применения являются язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, нарушение кроветворения, нарушение целостности кожных покровов, беременность, лактация, возраст до 6 лет, повышенная чувствительность к диклофенаку.
При сочетании диклофенака с ментолом в препарате Диклофенакол также дополнительно оказывается местное раздражающее и слабовыраженное анальгезирующее действие.
При сочетании диклофенака с метилсалицилатом, ментолом, льняным маслом в препарате Диклоран плюс противовоспалительное и анальгетическое действие диклофенака усиливается вторым препаратом из группы НПВС — метилсалицилатом, а также a-линоленовой кислотой, входящей в состав льняного масла; ментол оказывает местное раздражающее и слабовыраженное анальгезирующее действие.
Основным фармакологическим эффектом препаратов с действующим веществом ибупрофеном является местное анальгезирующее и противовоспалительное действие, механизм которого связан с торможением синтеза простагландинов за счет неселективного блокирования фермента ЦОГ.
Показаниями к применению являются миалгии, боли в спине, артриты, повреждения и растяжения связок, спортивные травмы, невралгии.
Побочные эффекты чаше всего отмечаются в виде небольшого покраснения кожи, жжения или покалывания. Системные реакции в виде аллергических реакций и бронхоспазма возникают чрезвычайно редко.
Противопоказанием к применению являются «аспириновая» астма, возраст до 12 лет, повышенная чувствительность к компонентам препарата. С осторожностью препарат применяют при сопутствующих заболеваниях печени и почек, желудочно-кишечного тракта, крапивнице, рините, беременности и лактации.
Основным фармакологическим эффектом препаратов монокомпонентного состава с действующим веществом индометацином является местное выраженное противовоспалительное и анальгетическое действие за счет неселективного блокирования фермента ЦОГ и подавления синтеза простагландинов. Показаниями к применению служат болевой синдром и местные воспалительные реакции при ревматоидных заболеваниях, острых скелетно-мышечных болях, подагре, невралгиях.
Побочные эффекты наблюдаются в виде местных кожных реакций (гиперемия, шелушение, крапивница и др.). Системные реакции в виде диспепсии, тошноты, головокружения, атаксии возможны при длительном, более 10 дней, применении либо при нанесении препарата на большой участок кожных покровов.
Препарат противопоказан при желудочно-кишечных заболеваниях, заболеваниях почек, центральной нервной системы, инфекционных заболеваниях, в период беременности и лактации, не назначается детям.
При сочетании индометацина с троксерутином в препарате Индовазин дополнительно оказывается местное противоотечное и ангиопротекторное действие.
Основным механизмом действия препаратов с действующим веществом кетопрофеном (производное пропионовой кислоты) является подавление активности ЦОГ-1 и ЦОГ-2, регулирующей синтез простагландинов. Противовоспалительная и анальгезирующая активность кетопрофена сходна с таковой индометацина и выше активности ибупрофена в 20 раз. Кетопрофен обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны, вызывает значительное торможение активности нейтрофилов у больных с ревматоидным артритом, подавляет агрегацию тромбоцитов.
Показаниями к применению являются острые и хронические воспалительные и дегенеративно-дистрофические заболевания опорно-двигательного аппарата, травмы.
Побочные действия наблюдаются в виде гиперемии кожи в месте нанесения препарата, фотосенсибилизации пурпуры. При длительном применении редко возможны системные реакции: боли в животе, рвота, астения, транзиторная дизурия.
Противопоказан к применению у пациентов с экземой, инфицированными ранами, у детей до 12 лет, при индивидуальной непереносимости препарата. С осторожностью возможно применение при беременности и в период лактации.
Основным механизмом действия препаратов с действующим веществом нимесулидом является селективное подавление активности ЦОГ-2, регулирующей синтез простагландинов. Нимесулид обратимо ингибирует синтез простагландина Е2 как в области воспаления, так и в восходящих путях ноцицептивой системы. Подавляет агрегацию тромбоцитов, высвобождение гистамина и фактора некроза опухоли a, обладает антиоксидантной активностью. Препарат хорошо переносится при длительной терапии. При местном применении вызывает уменьшение или исчезновение болей в месте нанесения геля, уменьшает отечность, утреннюю скованность суставов, способствует увеличению объема движений.
Показаниями к применению служат воспалительные заболевания с болевым синдромом умеренной интенсивности: заболевания опорно-двигательного аппарата, в том числе артриты, остеохондроз, остеоартроз, артралгии, миалгии, бурситы, травматические повреждения.
Побочные эффекты связаны с местными реакциями при нанесении геля — зуд, крапивница, шелушение, преходящее изменение цвета кожи — и не требуют отмены препарата.
Противопоказания: дерматозы, инфекции кожи в области применения геля, возраст до 2 лет, повышенная чувствительность к препарату, беременность и лактация.
Основным механизмом действия препаратов с действующим веществом пироксикамом является подавление синтеза простагландинов вследствие неселективного ингибирования ферментов ЦОГ-1 и ЦОГ-2. Применение препарата уменьшает отек, воспаление, мышечную и суставную боль, не вызывает сухости кожи.
Показаниями к применению является болевой синдром при спортивных травмах, анкилозирующем спондилоартрите, остеоартрозе, плечелопаточном периартрозе, тендините.
Побочные эффекты связаны с местными реакциями и проявляются в виде покраснения и шелушения, местного зуда, крапивницы.
Противопоказаниями для применения служат почечная недостаточность, возраст до 14 лет, беременность, индивидуальная непереносимость препарата.
Литература
Л. Е. Корнилова, кандидат медицинских наук
Е. Л. Соков, доктор медицинских наук, профессор
РУДН, Клиника лечения боли, ГКБ № 64, Москва
Разумный выбор НПВП при сочетанной патологии: заболеваниях суставов и гипертонической болезни
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением а
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением активности циклооксигеназы-2 (ЦОГ-2) в очаге воспаления — ключевого фермента синтеза простагландинов провоспалительной активности, а подавление изоформы ЦОГ-1 приводит к нарушению физиологических реакций: в частности, к нарушению синтеза простагландинов класса Е в слизистой оболочке желудка и развитию НПВП-гастропатии.
Большинство «стандартных» НПВП способно подавлять активность обеих изоформ ЦОГ, поэтому их применение часто ограничено из-за развития побочных эффектов, в первую очередь — со стороны желудочно-кишечного тракта (ЖКТ). Субъективные симптомы со стороны ЖКТ встречаются примерно у трети больных, а в 5% случаев представляют серьезную угрозу жизни пациентов. Именно поэтому в последние годы особо пристальное внимание привлекает проблема безопасного применения НПВП. Полагают, что препараты более селективные в отношении ЦОГ-2 реже вызывают развитие НПВП-гастропатии. Изучение механизмов действия НПВП послужило толчком к созданию новых препаратов, обладающих всеми положительными свойствами стандартных НПВП, но менее токсичных, — это специфические ингибиторы ЦОГ-2 [3, 4, 13].
В последние годы особую актуальность приобрела проблема взаимодействия НПВП и гипотензивных препаратов, а также связи между применением НПВП и развитием гипертонической болезни (ГБ). Неселективные НПВП могут привести к повышению АД (преимущественно диастолического) не только у больных артериальной гипертензией (АГ), но и у лиц с нормальным АД за счет ингибиции системного и локального, внутрипочечного синтеза простагландинов. Известно, что постоянный прием НПВП вызывает у пациентов увеличение АД в среднем на 5,0 мм рт. ст. Характерным свойством НПВП является также взаимодействие с гипотензивными препаратами, в основе гипотензивного действия которых лежат преимущественно простагландин-зависимые механизмы. Назначение НПВП пациентам, получающим по поводу АГ β-адреноблокаторы, ингибиторы АПФ и диуретики, приводит к снижению гипотензивного эффекта [8, 9].
Нимесулид был разработан еще в 1985 г. и является одним из первых НПВП, при изучении которого продемонстрирована более высокая селективность в отношении ЦОГ-2 и накоплен большой клинический опыт. В многочисленных исследованиях in vitro и in vivo было показано, что нимесулид примерно в 5–20 раз более селективно ингибирует ЦОГ-2, чем ЦОГ-1. Большой интерес представляет и тот факт, что нимесулид обладает широким спектром ЦОГ-независимых эффектов, которые могут определять его противовоспалительную, анальгетическую и хондропротективную активность [1, 2, 5, 7, 11, 12].
Нимесулид хорошо переносится больными и редко вызывает развитие серьезных побочных эффектов, требующих отмены препарата. По результатам ряда исследований, частота побочных эффектов, развивающихся на фоне приема нимесулида, достоверно не отличается от плацебо или ниже, чем при приеме других НПВП. Например, по данным мета-анализа, у больных, получавших нимесулид, общая частота побочных реакций со стороны ЖКТ была значительно ниже (8,7%), чем при назначении других НПВП (16,8%). Низкую частоту поражения ЖКТ на фоне лечения нимесулидом связывают не только с ЦОГ-2-селективностью препарата, но и с антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [6, 10, 13].
Таким образом, нимесулид относится к селективным ингибиторам ЦОГ-2, сравним по эффективности с «классическими» НПВП, но отличается более благоприятным профилем токсичности. Фармакоэкономический анализ свидетельствует о преимуществах нимесулида по сравнению с диклофенаком, в первую очередь в связи с более низкой частотой поражения ЖКТ.
Целью нашего исследования явилось изучение эффективности и переносимости найза (нимесулида) у больных РА в сравнении с ортофеном (диклофенаком).
Материалы и методы
Оба НПВП назначались случайным способом 40 больным с момента первого установления диагноза РА, согласно критериям Американской коллегии ревматологов. Найз применялся в виде таблеток по 100 мг дважды в день, ортофен — в виде таблеток по 25 мг в суточной дозе 150 мг. Одновременно всем больным проводилась базисная терапия, преимущественно метотрексатом или сульфасалазином. Эффективность и переносимость НПВП оценивались через 3 нед. от начала лечения, т. е. в те сроки, когда эффект базисных препаратов еще не имел клинической значимости.
В I группе из 20 пациентов, получавших найз, было 14 женщин и 6 мужчин, средний возраст пациентов составил 55,1 года, длительность суставного синдрома к моменту установления диагноза — от 3 до 14 мес., в среднем — 7,25 мес. Во II группе из 20 больных, получавших ортофен, было 18 женщин и 2 мужчин, средний возраст больных — 42,75 года, длительность суставного синдрома — от 2 до 14 мес., в среднем — 5,65 мес. Клиническая характеристика обеих групп представлена в таблице 1.
Результаты лечения оценивались по динамике показателей суставного синдрома (суставной индекс Ричи (СИ), счет болезненных суставов (СБС), счет припухших суставов (СПС), продолжительность утренней скованности (мин), выраженность боли по визуально-аналоговой шкале (ВАШ)) и на основании общей оценки эффективности лечения, по мнению врача и больного. Кроме того, у всех больных оценивалась динамика АД на фоне лечения НПВП.
Результаты
В I группе на фоне лечения найзом в суточной дозе 200 мг за 3 нед. лечения достигнута достоверная динамика показателей суставного синдрома. При этом эффективность терапии оценена 17 пациентами (85%) как хорошая и 3 (15%) — как удовлетворительная. По мнению врача, в 16 случаях (80%) наблюдалась хорошая эффективность препарата, в 4 случаях (20%) — удовлетворительная (рис. 1). Переносимость найза у 85% была хорошей, только у 2 больных (10%) отмечались изжога и гастралгии, у 1 больного (5%) — чувство тяжести в эпигастральной области. Однако при фиброгастроскопии у этих пациентов не выявлено эрозивного повреждения слизистой оболочки желудка. В группе больных, принимавших найз, не потребовалось отмены препарата ни у одного больного.
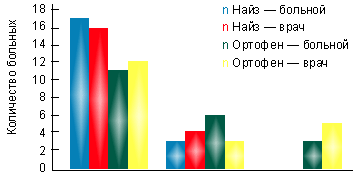 |
| Рисунок. Оценка эффективности препаратов на основании мнения больного и врача |
Во II группе на фоне терапии ортофеном в суточной дозе 150 мг через 3 нед. также отмечена существенная динамика показателей суставного синдрома. Однако оценка эффективности терапии показала, что только 11 пациентов (55%) оценили эффективность препарата как хорошую, 6 (30%) — как удовлетворительную и трое больных (15%) признали ее неудовлетворительной. По мнению лечащего врача, достаточная эффективность ортофена, соответствующая градации «хорошая», отмечалась в 12 случаях (60%), удовлетворительная — в 3 (15%) и неудовлетворительная — в 5 (25%) случаях (рис.).
Переносимость препарата ортофен была хуже, чем у найза: у 9 пациентов (45%) отмечались симптоматические побочные эффекты, причем у 3 больных (15%) потребовалась отмена препарата через 2 нед. от начала лечения в связи с выявленным при ФГДС эрозивным поражением слизистой оболочки антрального отдела желудка. В целом из побочных эффектов чаще отмечались изжога — у 7 (35%) пациентов, гастралгии — у 8 (40%), тошнота — у 4 (20%) и диарея — у 2 (10%) больных.
Особый интерес представляет влияние исследуемых НПВП на уровень АД, так как из 40 больных у 15 имелась сопутствующая ГБ, по поводу которой проводилась гипотензивная терапия. Динамика уровня АД в обеих группах на фоне лечения найзом и ортофеном представлена в таблице 2. Следует отметить, что терапия найзом не требовала усиления проводимой гипотензивной терапии (β-блокаторами, ингибиторами АПФ, диуретиками) и не вызывала повышения АД у ранее нормотензивных пациентов. В то же время лечение ортофеном потребовало коррекции доз гипотензивных препаратов у 4 (66,7%) из 6 больных ГБ и вызвало повышение АД у 5 (25%) женщин в постменопаузе с исходно высоконормальным АД. Данный эффект неселективного НПВП — ортофена — следует считать предсказуемым, особенно с учетом характера проводимой гипотензивной терапии. Все больные ГБ получали в разных комбинациях β-адреноблокаторы, ингибиторы АПФ и диуретики; при этом ни одному пациенту не был назначен дигидропиридиновый антагонист Са — амлодипин, который является препаратом выбора для лечения АГ в условиях терапии НПВП.
Таким образом, результаты открытого клинического исследования показали, что препарат найз у больных РА проявляет выраженную противовоспалительную активность, превосходящую диклофенак. При этом найз характеризуется хорошей переносимостью, малым числом симптоматических побочных эффектов и превосходит с этой точки зрения наиболее широко применяемый в клинической практике ортофен. Дополнительным преимуществом препарата найз можно считать менее выраженное влияние на уровень АД. При назначении найза не требовалось увеличения дозы гипотензивных препаратов. С учетом высокой распространенности эссенциальной гипертензии в популяции, взаимодействие НПВП с наиболее часто используемыми гипотензивными средствами представляется актуальной проблемой. Ревматические заболевания, требующие постоянной терапии НПВП, часто сочетаются с АГ. При этом у большинства больных ГБ коррекция АД может достигаться только благодаря комбинированной антигипертензивной терапии, а монотерапия дигидропиридиновыми антагонистами Са признается недостаточно эффективной. Следовательно, в большинстве случаев при лечении воспалительных ревматических заболеваний у лиц, страдающих ГБ, невозможно полностью нивелировать отрицательное взаимодействие «стандартных» НПВП с основными кардиологическими препаратами — β-адреноблокаторами, ингибиторами АПФ и диуретиками. В такой ситуации представляется рациональным выбор для проведения противовоспалительной терапии специфических ингибиторов ЦОГ-2, представителем которых является найз.
Литература
И. М. Марусенко, кандидат медицинских наук
Н. Н. Везикова, кандидат медицинских наук, доцент
В. К. Игнатьев, доктор медицинских наук, профессор
Петрозаводский университет, кафедра госпитальной терапии
.gif)
.gif)
.gif) Влияние нимесулида на медиаторы воспаления
Влияние нимесулида на медиаторы воспаления