Водный раствор нитрата и карбоната что это
Карбонат натрия: способы получения и химические свойства
Карбонат натрия Na2CO3 — соль щелочного металла натрия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 105,99; относительная плотность для тв. и ж. состояния d = 2,539; tпл = 851º C;
Способ получения
1. Карбонат натрия можно получить путем взаимодействия оксида натрия и углекислого газа:
2. В результате взаимодействия концентрированного раствора гидроксида натрия и углекислого газа образуется карбонат натрия и вода:
3. При взаимодействии гидрокарбоната натрия и концентрированного раствора гидроксида натрия образуется карбонат натрия и вода:
Качественная реакция
Качественная реакция на карбонат натрия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат натрия образует хлорид натрия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат натрия образует углекислый газ и воду, а также сульфат натрия:
Химические свойства
1. Карбонат натрия может реагировать с простыми веществами :
Na2CO3 + 2C(кокс) = Na + 3CO
1.2. С хлором концентрированный и горячий раствор карбоната натрия реагирует с образованием хлорида натрия, хлората натрия и углекислого газа:
2. Карбонат натрия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат натрия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната натрия:
2.2. Карбонат натрия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида натрия и карбоната кальция:
2.3. При взаимодействии с разбавленной хлороводородной кислотой карбонат натрия образует хлорид натрия, углекислый газ и воду:
Карбонат натрия, характеристика, свойства и получение, химические реакции
Карбонат натрия, характеристика, свойства и получение, химические реакции.
Карбонат натрия – неорганическое вещество, имеет химическую формулу Na2CO3.
Краткая характеристика карбоната натрия:
Карбонат натрия (кальцинированная сода) – неорганическое вещество белого цвета.
Химическая формула карбоната кальция Na2CO3.
Карбонат натрия (кальцинированная сода) – неорганическое соединение, натриевая соль угольной кислоты.
Карбонат натрия не следует путать с гидрокарбонатом натрия (пищевой содой) NaHCO3 и с гидроксидом натрия (каустической содой) NaOH.
Карбонат натрия – бесцветные кристаллы, в обычных условиях представляет собой порошок белого цвета, которые плавятся при температуре 854 °C без разложения и разлагаются при дальнейшем нагревании – при температуре свыше 1000 °C.
Карбонат натрия имеет три модификации:
– α-модификация. Имеет моноклинную кристаллическую решетку, образуется при температуре до 350 °C;
– β-модификация. Образуется при нагреве свыше 350 °C и до 479 °C. Также имеет моноклинную кристаллическую решетку;
– γ-модификация. Образуется при нагреве свыше 479 °C. Имеет гексагональную кристаллическую решетку.
В природе карбонат натрия встречается в виде минералов:
– нахколита, имеющего химическую формулу NaHCO3. Нахколит – минерал подкласса карбонатов, кристаллическая форма бикарбоната натрия. Название образовано по первым буквам символов химических элементов, входящих в его состав: Na, H, C и О;
– трона, имеющего химическую формулу Na2CO3·NaHCO3·2H2O. Название трон происходит от арабского названия природной соли. Другое название трона – египетская соль;
– натрита, имеющего химическую формулу Na2CO3·10H2O. Натрит – это декагидрат карбоната натрия. Другое название натрита – натрон, кристаллическая сода или сода;
– термонатрита, имеющего химическую формулу Na2CO3·Н2O. Термонатрит – моногидрат карбоната натрия. Образуется при дегидратации декагидрата карбоната натрия Na2CO3·10H2O. Другое название термонатрита – сода или кристаллическая сода.
Карбонат натрия также встречается в золе некоторых морских водорослей.
В пищевой промышленности используется 3 типа карбоната натрия:
– добавка Е500(i) – карбонат натрия (Sodium Carbonate) с химической формулой Na2CO3;
– добавка Е500(ii) – гидрокарбонат натрия (Sodium bicarbonate, Sodium hydrogen carbonate) с химической формулой NaHCO3. Гидрокарбонат натрия именуется также питьевой содой, пищевой содой, двууглекислой содой, натрием двууглекислым, бикарбонатом натрия.
– добавка Е500(iii) – смесь карбоната и гидрокарбоната натрия (Sodium Sesquicarbonate).
Физические свойства карбоната натрия:
Получение карбоната натрия:
В промышленности карбонат натрия получают несколькими способами:
Образовавшийся CO2 возвращают в производственный цикл.
Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Способ Хоу отличается от процесса Сольве тем, что не используется гидроксид кальция.
В лаборатории карбонат натрия получают:
Химические свойства карбоната натрия. Химические реакции карбоната натрия:
Карбонат натрия – это средняя соль, образованная слабой кислотой – угольной (H2CO3) и сильным основанием – гидроксидом натрия (NaOH).
Водные растворы Na2CO3 имеют щелочную реакцию.
Для карбоната натрия характерны следующие химические реакции:
1. реакция карбоната натрия и углерода:
Na2CO3 + 2C → 2Na + 3CO (t = 900-1000 o С).
В результате реакции образуются оксид углерода и натрий.
2. реакция карбоната натрия и брома:
В результате реакции образуются бромид натрия, бромат натрия и углекислый газ. В ходе реакции карбонат натрия используется в виде концентрированного горячего раствора.
3. реакция карбоната натрия и йода:
В результате реакции образуются йодид натрия, йодат натрия и углекислый газ. В ходе реакции карбонат натрия используется в виде концентрированного горячего раствора.
4. реакция карбоната натрия и хлора:
В результате реакции образуются хлорид натрия, хлорат натрия и углекислый газ. В ходе реакции карбонат натрия используется в виде концентрированного горячего раствора.
5. реакция карбоната натрия и азотной кислоты:
6. реакция карбоната натрия и угольной кислоты:
В результате реакции образуется гидрокарбонат натрия.
7. реакция карбоната натрия и ортофосфорной кислоты:
Аналогичные реакции протекают и с другими кислотами.
8. реакция карбоната натрия и фтороводорода:
9. реакция карбоната натрия и оксида кремния:
10. реакция карбоната натрия и оксида серы:
В первом случае в результате реакции образуются углекислый газ и дисульфит натрия. В ходе реакции карбонат натрия используется в виде концентрированного раствора. Реакция протекает при температуре 40-60 o С.
11. реакция карбоната натрия и оксида алюминия:
12. реакция карбоната натрия и оксида железа:
В результате реакции образуются углекислый газ и феррит натрия.
13. реакция карбоната натрия и воды (гидролиза карбоната натрия):
В результате реакции образуются гидрокарбонат натрия и гидроксид натрия. Реакция носит обратимый характер.
14. реакция карбоната натрия, оксида кальция и воды:
В результате реакции образуются карбонат кальция и гидроксид натрия.
15. реакция карбоната натрия, оксида углерода и воды:
В результате реакции образуется гидрокарбонат натрия. Данная реакция представляет собой способ получения питьевой соды путем пропускания оксида углерода через холодный раствор карбоната натрия.
16. реакция карбоната натрия и гидроксида кальция (каустификации соды):
17. реакция термического разложения карбоната натрия:
Применение и использование карбоната натрия:
Карбонат натрия используется во множестве отраслей промышленности и для бытовых нужд:
– в бытовой химии: в стиральных и чистящих порошках;
– в производстве эмалей для получения ультрамарина;
– для смягчения воды паровых котлов;
– для уменьшения жёсткости воды ;
– для обезжиривания металлов и десульфатизации доменного чугуна;
– в пищевой промышленности в качестве пищевой добавки E500 – регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию;
– в нефтяной промышленности в сочетании с поверхностно-активными веществами для снижения межфазного натяжения между водой и нефтью ;
– в химической промышленности как исходный продукт для получения NaOH, Na2B4O7, Na2HPO4;
– в табачной промышленности (в сигаретных фильтрах);
– в фотографии в составе проявителей как ускоряющее средство;
– в моторном масле для предотвращения полимеризации (концентрация 2 г на 1 л масла).
Применение и реакции взаимодействия карбоната натрия
Карбонат натрия производиться в виде белого порошкообразного вещества. В простонародье это вещество называют кальцинированной содой, в международном производстве применяют название Sodium carbonate.
Соду использовали еще в древних временах, первыми ее нашли египтяне. Они использовали ее для мытья посуды и для производства стекольных изделий. Зачастую ее находили в соляных пластах, которые находились под землей. Ее месторождением также считают содовые озера. Она находится в составе некоторых минералов и водорослей. Соду можно найти в нахколитах, термонатритах и натронах.
Формула карбоната натрия Na2CO3. Также это вещество можно назвать натриевой солью угольной кислоты. Свое наименование сода получила из-за того, что в процессе ее производства гидрокарбонат натрия подвергают высокому нагреву. Современные производители изготавливают это вещество разнообразными способами. Самыми популярными считаются метод Сольве и химическая переработка минералов.
Физические свойства
Молярная масса карбоната натрия 105,9 г/моль. Данное вещество обладает небольшой плотностью – 2,54 г/см³. Кальцинированная сода быстро растворяется в водной среде, начинает кипеть при температуре 1 600°C. Этот материал имеет высокую гигроскопичность, он легко впитывает в себя запахи и влагу. Если карбонат натрия Na2CO3 хранить в открытом виде, то он начинает слеживаться.
Реакции взаимодействия карбоната натрия
Это вещество способно реагировать с большим количеством химических соединений.
• Гидрокарбонат аммония и хлорид натрия в своей реакции образуют осадок в виде пищевой соды.
NH4HCO3 + NaCl = NaHCO3 + NH4C
• Карбонат натрия в реакции с соляной кислотой
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Раствор карбоната натрия и соляной кислоты в результате взаимодействия образовывают пищевую соль, воду и углекислый газ, который испаряется в воздух.
• Чтобы получить кальцинированную соду, соединяют гидроксид натрия с углекислым газом. В результате этой реакции, образуется кальцинированная сода и вода.
2NaOH + CO2 = Na2CO3 + H2O
• Реакция взаимодействия уксусной кислоты и карбоната натрия
2СН3СООН + Na2CO3 = H2O + CO2 + 2CH3COONa
• Для получения карбоната кальция, необходимо произвести реакцию, в которой будут участвовать карбонат натрия и хлорид кальция.
• Кальцинированная сода может вступать в реакцию с серной кислотой.
Na2CO3+H2SO4=NA2SO4 + H2O +CO2
• Обменная реакция сульфида натрия и карбоната кальция.
Na2S + СаСО3 → Na2CO3 + CaS
• Карбонат натрия быстро взаимодействует с водой. Водный раствор карбоната натрия разлагается следующим образом:
• Взаимодействие карбоната натрия с нитратом кальция
Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3↓
Представленные уравнения реакций карбоната натрия показывают, что это вещество можно получить разными способами. Оно способно качественно взаимодействовать с кислотами и водой.
Применение кальцинированной соды
Сфера применения этого вещества достаточно широкая. Раствор карбоната натрия используют в пищевой промышленности. Пищевая сода добавляется в составы многих продуктов питания для урегулирования кислотности, повышения воздушности теста, для эмульгирования.
Технический карбонат натрия находит свое применение в сфере стекольного производства. Также это вещество вводиться в состав бумаги, мыла, различных чистящих и моющих средств. В тяжелой промышленности его используют в процессе изготовления чугунных изделий.
Большой спрос на этот материал замечен в:
В химической сфере с помощью реакций с карбонатом натрия получают другие натриевые соли.
За счет кальцинированной соды проходит очистка водных труб, а также понижается жесткость воды.
В результате переработки угольной кислоты с солями калия и натрия получают карбонат калия-натрия. Этот материал не имеет характерного цвета, он быстро растворяется в водной среде. Его используют в процессе производства цемента. Он способствует быстрому затвердеванию.
Техническая сода имеет разное предназначение, ее выпускают двух марок:
Водный карбонат натрия марки Б используют для приготовления различных моющих средств. Его также применяют для очищения нефтяных продуктов. В химической промышленности он помогает получать натриевые, фосфорные и хромовые соли.
Обе марки карбоната натрия входят в составы разного стекла. Их добавляют в составы:
Марка А применяется в процессе изготовления электровакуумного стекла. Для этой цели карбонат натрия должен иметь высший сорт.
Производители и стоимость
Соединенные Штаты Америки, Канада, Мексика и ЮАР считаются мировыми лидерами по производству этого материала. На их территории сосредоточены большие природные залежи. В Российской Федерации содовые озера находятся на территории Забайкалья и Сибири.
Основными промышленными компаниями, которые изготавливают карбонат натрия в России, считаются:
Средняя цена карбоната натрия составляет 20-25 рублей за 1 кг. Фасуют кальцинированную соду в полиэтиленовые мешки и картонные упаковки.
Гидролиз
Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
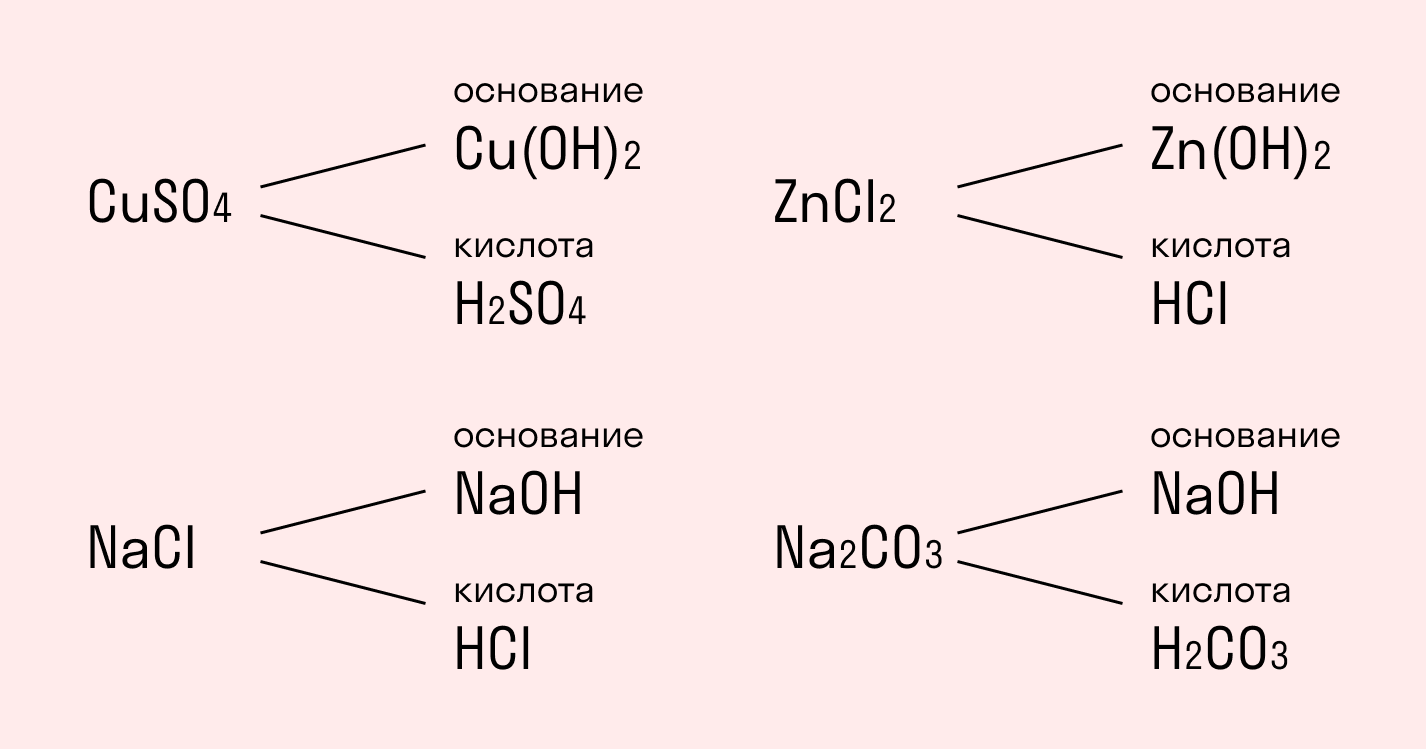
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
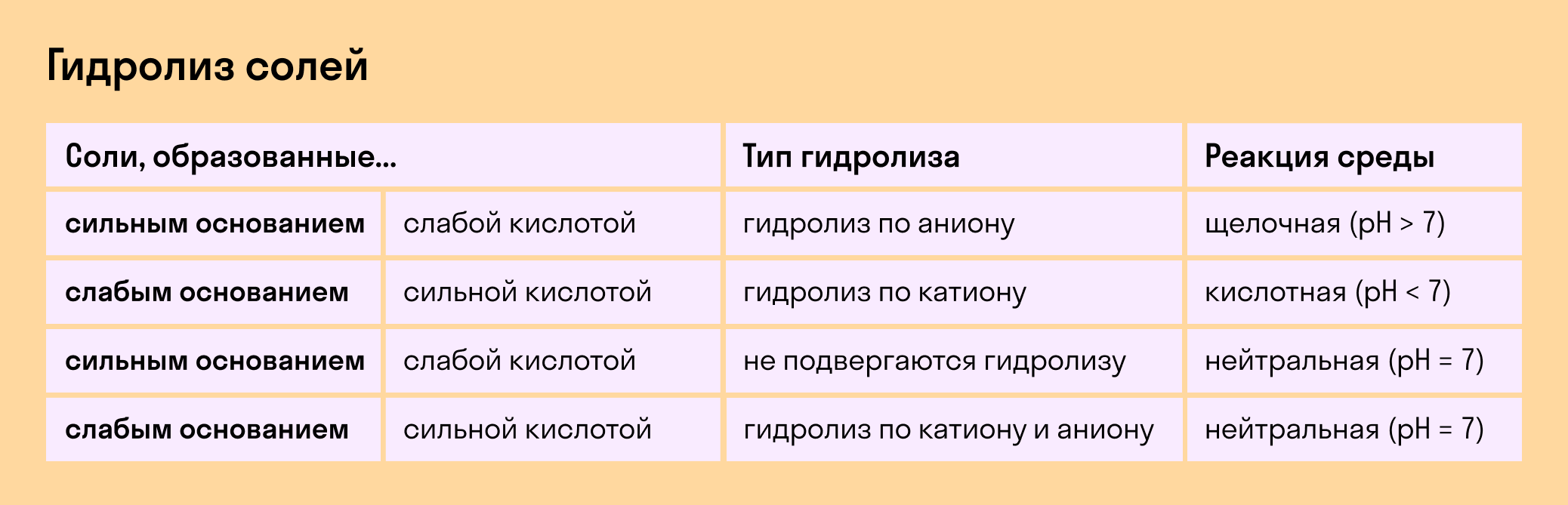
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
XH — кислотный остаток;
Индикаторы среды раствора
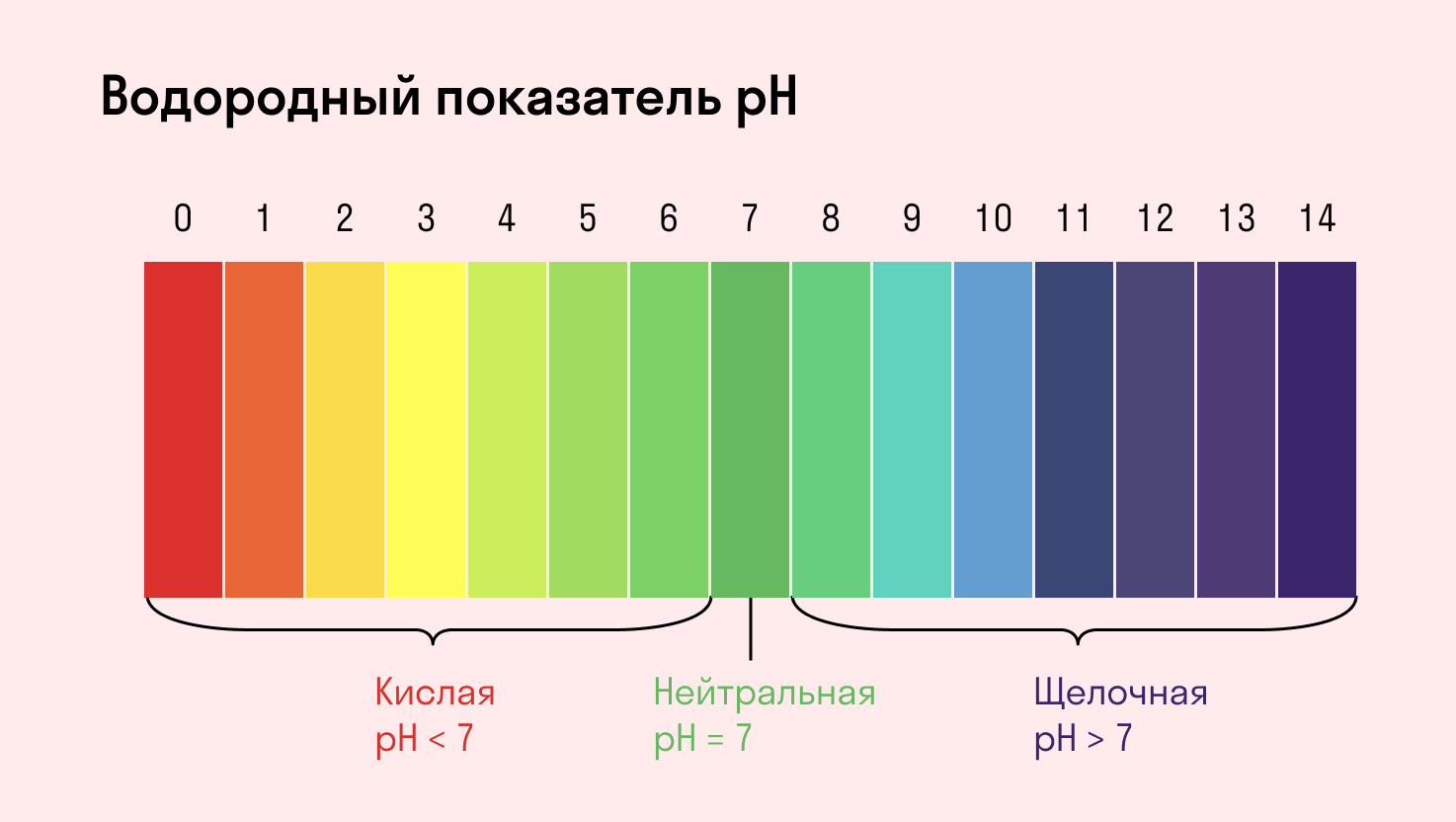
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Соль с сильным основанием и слабой кислотой
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
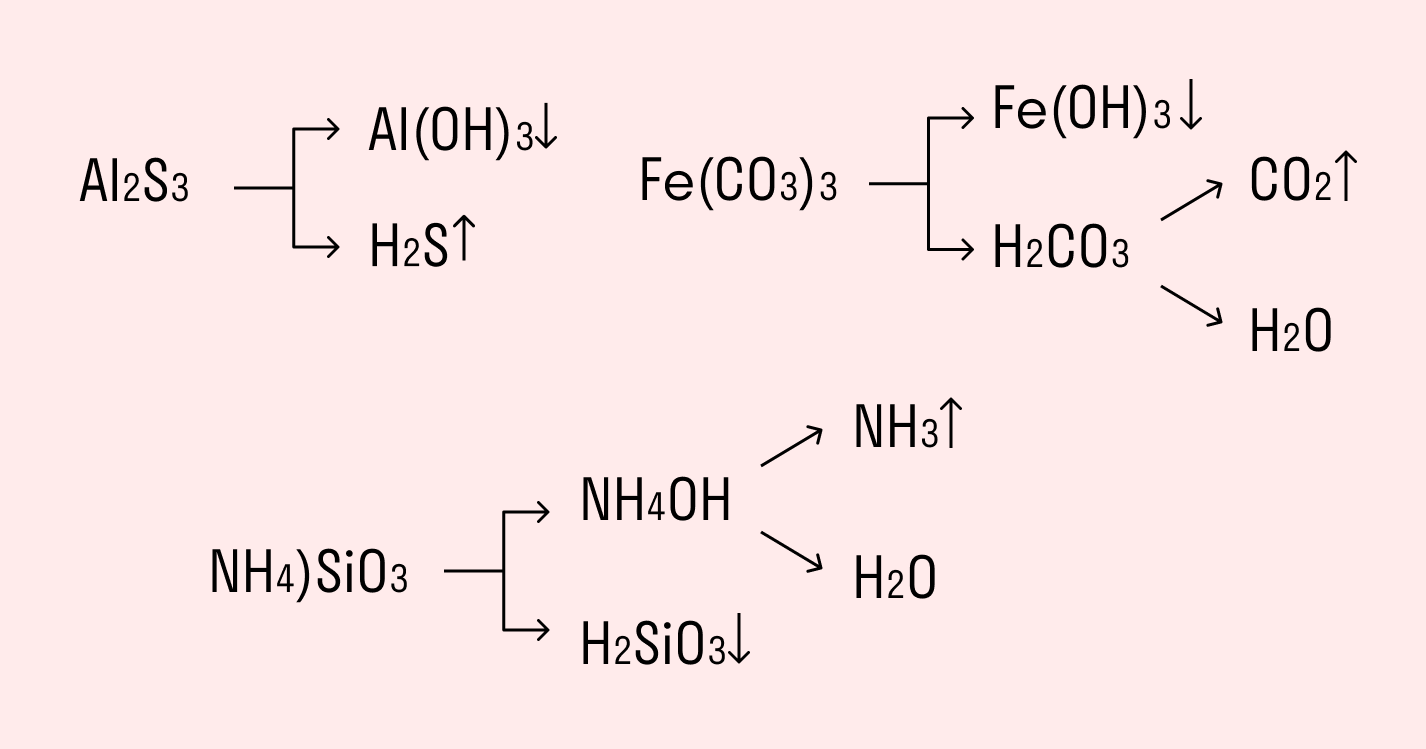
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?