цитотоксичность что это такое
Цитотоксичность что это такое
Цитотоксические вещества блокируют клеточный цикл. Все цитотоксические противоопухолевые лекарства препятствуют прохождению клетками клеточного цикла, приводя к синхронизации и замедлению пролиферации быстро размножающихся клеток. Результатом является снижение чувствительности к лекарствам в S-фазе.
Цитотоксичность пропорциональна общей лекарственной экспозиции. Фармакокинетика противоопухолевых лекарств — это сложный процесс, т.к. цитотоксичность для злокачественных клеток пропорциональна общей лекарственной экспозиции (площадь под кривой; ППК), а не концентрации препарата в плазме на пике. Сначала вещество должно проникнуть в отдельные злокачественные клетки, а затем взаимодействовать со своими молекулярными мишенями. Поскольку это взаимодействие часто обратимо, по крайней мере сначала, цитотоксическая концентрация должна сохраняться все это время.
Кроме того, число индивидуальных взаимодействий между лекарством и молекулами-мишенями, необходимое для киллинга одиночной клетки, может быть очень велико. Подсчитано, что для киллинга одной клетки с ее ДНК должен связаться как минимум 1 млн молекул цисплатина.
Комбинации противоопухолевых препаратов стали применять после того, как было обнаружено, что использование одного препарата не дает значительной ремиссии или не излечивает пациента (за исключением метотрексата при лечении хориокарциномы). Это явление объясняет гипотеза log-киллинга.
Лекарства, используемые для комбинированной терапии, должны обладать определенными свойствами:
• оказывать некоторый эффект при использовании в отдельности;
• вызывать преимущественно полный ответ (гибель всех клеток опухоли), а не частичный (гибель менее 50% клеток);
• биохимические механизмы действия препаратов должны быть разными для воздействия на опухоль, содержащую гетерогенную клеточную популяцию;
• препараты не должны обладать сходным побочным действием, т.к. в этом случае необходимо снижать их дозы, что приводит к утрате аддитивного эффекта комбинации.
По многим показателям различные опухоли являются гетерогенными, включая чувствительность к лекарственным веществам, в результате нестабильности их генетической конституции. Злокачественные клетки способны мутировать, что крайне важно для терапии, поскольку такие мутации могут привести к возникновению резистентности к лекарствам. В большинстве случаев такая резистентность определяется свойствами конкретного типа опухолей.
Клинически резистентность может стать очевидной, когда чувствительные клоны опухоли погибают, а резистентные выживают и становятся доминирующими. Излечимость пропорциональна числу злокачественных клеток, и, в соответствии с гипотезой Голди-Колдмана, существует более высокая вероятность мутации, приводящих к лекарственной резистентности, в более многочисленной клеточной популяции.
ЦИТОТОКСИНЫ
Цитотоксины (греческий kytos вместилище, здесь — клетка + токсины) — антитела, вызывающие повреждение клеток. Иногда в качестве синонима понятия «цитотоксины» употребляют термин «цитолизины», который имеет более широкое значение, так как применим к любым веществам, способным растворять клеточные элементы. Антитела, разрушающие эритроциты, обычно называют гемолизинами (см. Гемолиз), разрушающие лейкоциты — лейколизинами, инактивирующие сперматозоиды—сперматолизинами. К цитотоксинам относят также бактериолизины — антитела к бактериальным антигенам, способные в присутствии комплемента вызывать бактериолиз (см.).
Цитотоксины образуются при иммунизации животного антигенами клеточного происхождения, которые могут принадлежать к тканям животного другого вида (гетероцитотоксины), того же вида, но другой генетической линии (гомоцитотоксины), к тканям животного той же линии, что и иммунизируемое (изоцитотоксины), и к собственным тканям иммунизируемого животного (аутоцитотоксины). Чем больше антигены донора отличаются от антигенов реципиента, тем легче образуются антитела. Поэтому на практике цитотоксины получают, иммунизируя животное клеточной взвесью или антигенным материалом органов животного другого вида. Полученные при этом иммунные сыворотки содержат разные типы антицеллюлярных антител (антицеллюлярные сыворотки) или антиорганных антител (антиорганные сыворотки), как способствующих, так и не способствующих возникновению цитотоксического действия. В связи с этим термины «антицеллюлярная сыворотка» и «антиорганная сыворотка» являются более широкими, чем термин «цитотоксическая сыворотка», применяемый к тем сывороткам, цитотоксическое действие которых подтверждено.
Установлено, что при аллотрансплантации тканей в крови реципиента появляются гомоцитотоксины, которые, очевидно, играют определенную роль в механизме отторжения аллотрансплантата. При изотрансплантации, вероятно, образуется незначительное количество цитотоксинов, их значение в механизме отторжения трансплантата несущественно, и изотрансплантаты, как правило, приживают (см. Трансплантация).
В 1898 году Ж. Борде в лаборатории И. И. Мечникова показал, что иммунизация гетерогенными эритроцитами сопровождается образованием специфических антител — гемолизинов. Этим была доказана возможность получения антител не только против микроорганизмов, но и против клеточных элементов макроорганизма, что легло в основу учения о цитотоксинах. В 1900 году, иммунизируя морских свинок тканями кроличьего семенника, И. И. Мечников получил спермоцитотоксическую сыворотку, обездвиживающую сперматозоиды морской свинки. И. И. Мечников и А. М. Безредка изготовили лейкотоксическую и гемолитическую сыворотки. Лейкотоксическая сыворотка была получена при иммунизации морской свинки клетками лимфоидных органов кролика, гемолитическая сыворотка — при иммунизации эритроцитами. Обе сыворотки проявляли специфическое действие, избирательно направленное в первом случае на лейкоциты (иммобилизация и распад их), во втором — на эритроциты (гемолиз). Введение этих сывороток в больших дозах снижало соответственно число лейкоцитов и эритроцитов, инъекции малых доз, наоборот, приводили к увеличению их числа в крови. Таким образом, в лаборатории Мечникова было не только заложено учение о цитотоксинах, но и показано принципиальное различие в действии больших и малых доз цитотоксических сывороток: большие дозы проявляли токсическое действие, малые дозы действовали как активаторы.
После И. И. Мечникова спермоцитотоксины были получены С. И. Метальниковым (1900), Е. С. Лондоном (1901), М. П. Тушновым (1911) и др. В дальнейшем рядом исследователей были получены тестикулоцитотоксины, овариоцитотоксины и плацентоцитотоксины, применение которых в больших дозах приводило к дистрофическим процессам соответственно в семенниках, яичниках и плаценте. Были получены гепатоцитотоксины, вызывавшие в печени жировую дистрофию, развитие цирроза и некротические изменения; нефроцитотоксины, при введении которых развивались тяжелые изменения в почках. Вводимые в больших дозах нейротоксины вызывали тяжелые поражения головного мозга и периферических нервов. Аналогичные изменения в тканях глаза возникали под влиянием офтальмоцитотоксинов, приготовленных С. С. Головиным (1904) и др. Были получены цитотоксины, действующие на ткани сердца, желудка, селезенки, кожи, желез внутренней секреции и других органов.
В 1909 году А. А. Богомолец доказал возможность стимуляции функции надпочечников малыми дозами супрареноцитотоксинов. С помощью морфологических и физиологических методов исследования он установил, что введение кошке малых доз супрареноцитотоксической сыворотки вызывает повышение АД, учащение пульса и дыхания. Микроскопические изменения в надпочечниках свидетельствовали об усилении под влиянием цитотоксинов их гормональной активности. Эту работу А. А. Богомольца следует считать началом физиологического периода в изучении цитотоксинов в отличие от предшествовавшего, преимущественно морфологического. В 1925 году Л. А. Варшамовым и И. А. Леонтьевым в лаборатории А. А. Богомольца была впервые получена цитотоксическая сыворотка к активным элементам соединительной ткани, названная А. А. Богомольцем антиретикулярной цитотоксической сывороткой (см.).
В. К. Линдеман, H. Н. Нефедьев и П. А. Герцен показали, что при повреждении одной из почек в организме подопытного животного возникают аутоцитотоксины, оказывающие повреждающее действие на здоровую почку. Аутоцитотоксины в большем или меньшем количестве продуцируются при распаде любой ткани в организме в результате заболевания или экзогенного повреждения (лучевое воздействие, ожог и др.); при этом в кровь больного поступают аутоантигены. Аутоиммунизация, приводящая к возникновению аутоцитотоксинов (аутоантител), играет существенную роль в механизме дальнейшего развития патологического процесса. При воспалительных, дистрофических и других заболеваниях щитовидной железы установлено наличие в крови аутотиреоцитотоксинов.
Цитотоксины получают так же, как и другие высокоактивные и специфические препараты антител. Специфичность цитотоксинов достигается иммунизацией животных органоспецифическими очищенными антигенами или тщательной адсорбцией иммунной сыворотки органоспецифическими антигенами, присутствовавшими в использованном для иммунизации материале. Проблема получения узкоспецифических цитотоксинов, как и других высокоспецифических антител, решается в настоящее время на основе гибридомной техники (см. Гибридома), позволяющей получать моноклональные антитела.
Степень нарушения функции органа зависит от дозы, биологической активности цитотоксина и функциональной лабильности клеточного субстрата. Часть клеток гибнет под действием цитотоксинов у сохранившихся клеток нарушается функция.
Механизм действия малых доз цитотоксинов, стимулирующих функцию органа сложнее. В связи с образованием на мембране клетки комплекса антиген — антитело функция соответствующих клеток органа нарушается, часть тканевых элементов, очевидно, наименее стойких, погибает, но одновременно идет процесс восстановления, сопровождающийся выраженной функциональной активизацией органа. Такое объяснение действия малых доз цитотоксинов, в частности антиретикулярной цитотоксической сыворотки, дал А. А. Богомолец. В настоящее время оно является общепринятым.
Механизм действия цитотоксинов заключается в активации системы комплемента (см.) образующимся комплексом антиген—антитело (см. Антиген— антитело реакция). Цитотоксическим действием обладают антитела, принадлежащие к иммуноглобулинам (см.), с выраженной комплемент связывающей способностью. Цитотоксины принадлежат преимущественно к иммуноглобулину класса G. Изменение пространственной структуры молекулы антитела в результате связывания с антигеном приводит к обнажению на антителе участков, связывающих комплемент. Этапы последовательной активации компонентов комплемента, ведущие к цитолизу, наиболее полно изучены на эритроцитах на примере иммунного гемолиза (см.) и подтверждены на других клетках. Разрушение клеточных мембран при действии цитотоксинов и комплемента установлено с помощью электронной микроскопии. Повреждения, возникающие в мембранах эритроцитов, представляют собой круглые отверстия диаметром 8—10 нм. В ядросодержащих клетках происходит инвагинация клеточных мембран, набухание митохондрий и мембран эндоплазматической) ретикулума. Повышение проницаемости клеточной мембраны проявляется потерей внутриклеточных ионов калия, аминокислот и рибонуклеотидов. Клетки набухают, и в результате осмотического лизиса из них высвобождаются белки и нуклеиновые кислоты. Собственно лизис клеточной мембраны осуществляется на последнем этапе активации системы комплемента декамолекулярным комплексом с вовлечением компонентов комплемента C5 — C9. Декамолекулярный комплекс (по одной молекуле С5, С6, С7, С8 и 6 молекул С9) имеет молекулярный вес (массу) около 995 000. Возможно, что повреждение возникает в результате взаимодействий этого комплекса с липидами клеточной мембраны. Морфологические признаки повреждения клеточной мембраны становятся заметными после фиксации С5 вследствие детергентного действия активированной формы этого компонента (C5), который проявляет резко выраженные гидрофобные свойства по отношению к фосфолипидам мембраны. Взаимодействие других компонентов комплемента усиливает детергентное действие С5, что приводит к расплавлению участков клеточной мембраны.
Цитотоксины применяют в экспериментальных исследованиях для изучения функции отдельных органов и систем. Методы цитотоксической стимуляции и цитотоксического подавления функции различных органов и физиологических систем вошли в арсенал патофизиологических методов. Аналогичное действие цитотоксины оказывают in vitro при добавлении их в питательную среду. Так, малые дозы цитотоксинов усиливают пролиферацию соответствующих клеточных элементов, большие дозы подавляют размножение клеток.
Цитотоксины, специфичные к поверхностным антигенам определенных клеток, применяют для идентификации этих клеток в цитотоксическом тесте in vitro в присутствии комплемента. Примером может служить использование иммунных сывороток и моноклональных антител для идентификации популяций и субпопуляций лимфоидных клеток.
В клинической практике применяют в малых дозах антиретикулярную цитотоксическую сыворотку с целью повышения защитных функций организма при инфекционных и опухолевых процессах. Для усиления эритроцитопоэза, лейкоцитопоэза или тромбоцитопоэза вводят цитотоксические сыворотки, полученные при иммунизации животного соответственно эритроцитами, лейкоцитами или тромбоцитами. Для ускорения восстановления нормального состава крови у доноров, а также при гипорегенераторной анемии (см.) используют миелоцитотоксическую сыворотку.
цитотоксичность
Смотреть что такое «цитотоксичность» в других словарях:
цитотоксичность — Свойство химических веществ или иммунных агентов быть токсичными для клеток [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN cytotoxicity … Справочник технического переводчика
цитотоксичность — rus цитотоксичность (ж), цитотоксическое действие (с) eng cytotoxicity, cytotoxic action, cytotoxic effect fra cytotoxicité (f), action (f) cytopathogène, action (f) cytotoxique deu zellschädigende Wirkung (f), zytopathogene Wirkung (f),… … Безопасность и гигиена труда. Перевод на английский, французский, немецкий, испанский языки
цитотоксичность Т-киллеров — Клетки иммунной системы [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN cytotoxic killer lymphocyte … Справочник технического переводчика
Аллергия — I Аллергия (allergia; греч. allos другой + ergon действие) повышенная чувствительность организма к воздействию некоторых факторов окружающей среды (химических веществ, микроорганизмов и продуктов их жизнедеятельности, пищевых продуктов и др.),… … Медицинская энциклопедия
10993.5 — ГОСТ Р ИСО 10993.5 < 99>Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro. ОКС: 11.020 КГС: Р20 Классификация, номенклатура и общие нормы Действие: С 01.01.2002… … Справочник ГОСТов
Мабтера — Действующее вещество ›› Ритуксимаб* (Rituximab*) Латинское название Mabthera АТХ: ›› L03AX06 Моноклональные антитела 17 1а Фармакологические группы: Иммунодепрессанты ›› Противоопухолевые средства — моноклональные антитела Нозологическая… … Словарь медицинских препаратов
ГОСТ Р 53485-2009: Материалы текстильные. Метод определения токсичности — Терминология ГОСТ Р 53485 2009: Материалы текстильные. Метод определения токсичности оригинал документа: индекс токсичности : Величина, характеризующая степень цитотоксического действия. Определения термина из разных документов: индекс… … Словарь-справочник терминов нормативно-технической документации
Медиа́торы — (лат. mediator посредник: синоним нейромедиаторы) биологически активные вещества, секретируемые нервными окончаниями и обусловливающие передачу нервных импульсов в синапсах. В качестве М. могут выступать самые различные вещества. Всего… … Медицинская энциклопедия
Алка-Зельтцер — Действующее вещество ›› Ацетилсалициловая кислота + (Лимонная кислота + Натрия гидрокарбонат) (Acetylsalicylic acid + [Citric acid + Sodium hydrocarbonate]) Латинское название Alka Seltzer АТХ: ›› N02BA51 Ацетилсалициловая кислота в комбинации с… … Словарь медицинских препаратов
Цитотоксичность что это такое
Цитотоксические аллергические реакции (гиперчувствительность II типа)
Аллергические реакции II типа могут носить системный или локализованный характер. Цитолитические реакции имеют место при переливании несовместимых групп крови, резус-несовместимости матери и плода, лежат в основе развития ряда аутоиммунных заболеваний, в частности, аутоиммунной лейкопении, анемии, тромбоцитопении, а также трансплантационного иммунитета и других форм патологии.
При аллергических реакциях II типа индуктором аллергии является антиген клеточной мембраны.
Возможны два основных варианта подобных антигенов:
1. Антиген является структурным компонентом клеточной мембраны (антигены гистосовместимости – МНС I и МНС II, Rh-антигены эритроцитов, антигены эритроцитов системы АВО и др.);
2. Органоспецифические антигены, модифицированные под влиянием ксенобиотиков, инфекционных патогенных факторов, воздействий физической или химической природы на структуру клеток.
Антигены, индуцирующие развитие цитолитических реакций, могут иметь и внеклеточное происхождение (антигены миелина, коллагена, базальной мембраны клубочков почек).
В отличие от анафилактических реакций при ряде цитотоксических реакций антиген-аллерген персистирует в организме, выполняя роль сенсибилизирующей и разрешающей доз воздействия, т.е. вызывает выработку антител-агрессоров и вступает с ними в реакции взаимодействия на клеточном уровне. Подобный феномен имеет место при аутоиммунных заболеваниях, трансплантационном иммунитете. В тех случаях, когда аллерген является естественным компонентом мембраны клеток (групповые или Rh-антигены эритроцитов) реакции развиваются при введении в организм комплементарных антител.
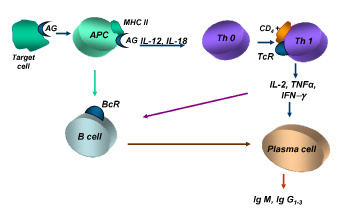
Антигенпрезентирующие клетки на фоне антигенной стимуляции обеспечивают не только экспрессию на цитоплазматических мембранах модифицированной части антигена в комплексе с белками гистосовместимости MHC II, но и интенсивную продукцию IL-12 и IL-18. Последние вызывают пролиферацию антигенчувствительного клона Th1. В свою очередь Th1 секретируют γ-интерферон, IL-2 и TNF-α, обеспечивающие переключение биосинтеза иммуноглобулинов в дифференцирующихся В-лимфоцитах с IgМ на IgG. Ответственными за развитие цитолитических реакций являются комплементсвязывающие цитолитические антитела классов IgG1, IgG2, IgG3 и IgM (рис. 1).
Рис. 1. Индукция иммунного ответа при цитотоксических реакциях
Различают три основных механизма цитолиза клеток в реакциях II типа:
• антителозависимая клеточная цитотоксичность;
• антителозависимый фагоцитоз опсонизированных клеток.
Комплементзависимый цитолиз обусловлен активацией комплемента комплексом антиген-антитело на мембране клеток по классическому пути, что приводит к формированию гидрофильного канала в мембране клетки с последующим развитием осмотического лизиса клетки.
Антителозависимая клеточная цитотоксичность возникает в том случае, если Fab-фрагменты аллергических антител связаны с антигеном клеточной мембраны, а к свободным Fc-фрагментам антител фиксируются макрофаги, эозинофилы, нейтрофилы с помощью соответствующих рецепторов. Нейтрофилы, макрофаги и NK-клетки обеспечивают цитолиз, взаимодействуя с Fc-фрагментом IgG, эозинофилы обеспечивают цитолиз при участии IgE и IgA.
В механизмах развития цитотоксичности при участии различных видов лейкоцитов важная роль отводится активации лизосомальных ферментов, освобождению катионных белков, лейкотриенов, лейкокининов, миелопероксидазы, свободных радикалов, вызывающих деструкцию клеток мишеней. Фагоцитоз опсонизированных клеток происходит в соответствии с общеизвестными закономерностями: разрушение клеток мишеней обеспечивается действием гидролитических ферментов в фаголизосомах, а также участием кислородзависимых и кислороднезависимых систем киллинга.
В последнее время выделяют четвертый механизм повреждающего действия на клетки-мишени, сопровождающийся развитием антителозависимой клеточной дисфункции (в ряде источников именуемые как рецепторно-опосредованные аллергические реакции, или V тип гиперчувствительности).
В роли антигенов при указанных реакциях выступают нейромедиаторы или гормоны (ацетилхолин, инсулин, тиреотропный гормон), индуцирующие синтез антител главным образом класса IgG.
Последние взаимодействуют со структурами, расположенными в рецепторном комплексе, вызывая стимулирующий или ингибирующий эффект на клетку-мишень.
Примером рецепторно-опосредованного стимулирующего типа аллергических реакций является развитие гипертиреоидного состояния при имитации антителами эффектов тиреотропного гормона. Описана возможность ингибирующего влияния антител на клетки и подавление ими эффектов инсулина.
Иммунокомплексные аллергические реакции (гиперчувствительность III типа)
Иммунокомплексная патология может носить локализованный и системный характер.
К местным проявлениям иммунокомплексной патологии относятся феномен Артюса, некоторые случаи лекарственной и пищевой аллергии. В ряде случаев иммунокомплексная патология приводит к развитию системных заболеваний (сывороточная болезнь, аутоиммунные заболевания, в частности гломерулонефрит, ревматоидный артрит, системная красная волчанка, артриты, эндокардит).
К числу аллергенов, вызывающих развитие иммунокомплексной патологии, относятся различные лекарственные препараты, антитоксические сыворотки, гамма-глобулины, пищевые, ингаляционные, вирусные и бактериальные аллергены.
К факторам риска развития иммунокомплексных реакций относится наследственная или приобретенная недостаточность системы элиминации иммунных комплексов, т.е. фагоцитоза, системы комплемента, недостаточность экспрессии CR1-рецепторов на мембранах эритроцитов, способных адсорбировать иммунные комплексы.
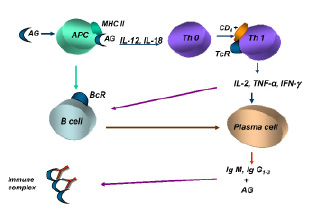
Механизмы развития иммунокомплексной патологии могут быть представлены следующим образом (рис. 2):
• презентация антигена макрофагами в комплексе с белками II класса МНС Тh1 и антигенчувствительным клонам В-лимфоцитов;
• секреция Тh1 гуморальных индукторов иммунопоэза ИЛ-2 и гамма-интерферона;
• стимуляция пролиферации и дифференцировки соответствующих антигенчувствительных клонов В-лимфоцитов, усиление продукции преципитирующих и комплементсвязывающих антител классов IgG1, IgG2, IgG3 и IgM.
Рис. 2. Индукция иммунного ответа при иммунокомплексных реакциях
При развитии иммунокомплексной патологии изначально ни антиген, ни антитело не связаны с клеточной мембраной. Образование высокотоксических растворимых комплексов происходит в системной циркуляции при условии взаимодействия антигена с антителом при небольшом избытке антигена; ММ токсических комплексов составляет 900`000 – 1`000`000. Они плохо фагоцитируются и долго находятся в организме.
Иммунные комплексы обладают способностью отслаивать эндотелий и фиксироваться на базальной мембране сосудов. При этом возникают обнажение коллагена, активация XII фактора Хагемана и связанного с ним каскада реакций освобождения медиаторов воспаления: активация калликреин-кининовой системы, коагуляционного и тромбоцитарного звеньев системы гемостаза, системы фибринолиза.
Для иммунокомплексных реакций характерно развитие выраженных расстройств микроциркуляции в различных органах и тканях, формирование циркуляторной гипоксии, снижение трофики органов и тканей, повышение проницаемости сосудистой стенки и другие нарушения.
Важная роль в патогенезе иммунокомплексной патологии отводится и медиаторам тучных клеток, тромбоцитов, нейтрофильных и базофильных лейкоцитов, активирующихся при участии антигена и системы комплемента.
Цитотоксичность что это такое
Производные аминоиндола и пирролохинолины как биологически активные вещества представляют большой интерес для исследования. Среди физиологически активных соединений как природного, так и синтетического происхождения азотистые гетероциклические системы занимают ведущее место. Наиболее интересными и перспективными являются производные хинолина и индола, а следовательно, пирролохинолина, в молекуле которого сочетаются указанные фармакофорные фрагменты. Самый молодой витамин, классифицированный как витамин группы В, по химической структуре представляет собой трициклический о-хинон-2,7,9-трикарбокси-1Н-пирроло[2,3-f]хинолин-4,5-дион, он обнаружен в живых системах как кофермент окислительно-восстановительных ферментов – PQQ (метоксатин). Он широко распространен в продуктах растительного происхождения: в плодах цитрусовых, киви, папайе, петрушке, перце, зеленом чае, а также в небольших количествах содержится в мясе, яичных желтках, женском молоке. Пирролохинолиновые аналоги PQQ представляют собой соединения, которые могут служить заменой природного вещества и могут быть использованы как антиоксиданты или как окислительно-восстановительные коферменты в ферментных системах [10]. Установлено, что биологическая активность PQQ зависит от характера заместителя в пирролохинолиновом кольце. Так, трициклический о-хинон-2,7,9-трикарбокси-1Н-пирроло[2,3-f]хинолин-4,5-дион в живых организмах является коферментом в окислительно-восстановительных системах, в то время как изученные трифторметилпроизводные PQQ обладают противомикробной и противогрибковой активностью. Нами проведена большая работа по исследованию антимикробной и противогрибковой активности данных соединений [3, 4, 5, 6]. Целью дальнейшего исследования стало изучение биологической безопасности данных соединений, так как в перспективе мы предполагаем их использование в составе лекарственных средств.
Цель исследования: изучить цитотоксичность производных аминоиндолов и пирролохинолинов с лабораторными шифрами 4Д (1,2,3,9-тетраметил-6-трифторметил-1,9-дигидро-8H-пирроло[3,2-h]хинолин-8-он), НД (6-гидрокси-2,3-диметил-6-трифторметил-1,6,7,9-тетрагидро-8H-пирроло[3,2-h]хинолин-8-он), 39Д (1,5-диметил-2-фенил-8-трифторметил-1,5-дигидро-6H-пирроло[3,2-g]хинолин-6-он), 66’ (4,4,4трифтор-N-(6-метокси-2,3-диметил-1H-индол-5-ил)-3-оксобутанамид), 64Д (4,4,4трифтор-3-оксо-N-(2,3,6-триметил-1H-индол-5-ил)бутанамид), 66Д (4,4,4трифтор-N-(6-метокси-1,2,3-триметил-1H-индол-5-ил)-3-оксобутанамид), 43Д (4,4,4трифтор-N-(6-метил-2-фенил-1H-индол-5-ил)-3-оксобутанамид) in vitro на линии опухолевых клеток HeLa (ATCC ® CCL-2TM).
Материалы и методы исследования
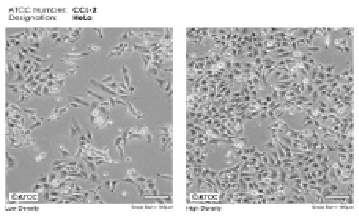
В работе была использована линия опухолевых клеток HeLa (ATCC ® CCL-2TM), полученная из коллекции банка глубокозамороженных клеточных культур ГУ НИИ вирусологии им. Д.И. Ивановского РАМН.
HeLa представляет собой эпителиальные клетки аденокарциномы шейки матки человека, прилипающие к подложке (рис. 1).
Эпителиальные клетки аденокарциномы шейки матки человека (HeLa ATCC ® CCL-2TM)
Опухолевые клетки культивировали в среде RPMI-1640 (Roswell Park Memorial Institute) (ПанЭко, Россия), содержащей 10 % эмбриональной телячьей сыворотки, 10 мМ буфера Hepes (4-(2-оксиэтил)1-пиперазинэтансульфоновой кислоты), 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина в пластиковых флаконах для культур клеток (Corning Costar, США) при 37 °С, 100 % влажности и 5 % содержании углекислого газа в окружающем воздухе. Пассирование клеточной культуры производили каждые 3 дня.
Во время пересева клетки снимали с поверхности пластикового флакона смесью раствора Версена (ПанЭко, Россия) и 0,25 % раствора трипсина (ПанЭко, Россия) (в соотношении 1:1) в течение 3–5 мин при 37 °С. После «ошпаривания» клеток и открепления их от дна флакона трипсин инактивировали добавлением питательной культуральной среды с 10 % эмбриональной телячьей сывороткой (ПанЭко, Россия).
В экспериментальных исследованиях широкое распространение для оценки лекарственной цитотоксичности получил МТТ-тест, (скрининговый метод измерения выживаемости клеток). Данный тест основан на способности митохондриальных дегидрогеназ живой метаболически активной клетки конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-етразолиум бромид (МТТ) в формазан, который выпадает в виде кристаллов внутри клетки. Растворение формазана с помощью диметилсульфоксида (ДМСО) и последующая фотометрия цветного (фиолетового) раствора позволяют сопоставить изменение оптической плотности раствора в опытных лунках по отношению к контрольным и, таким образом, косвенно оценить долю погибших клеток под влиянием изучаемого агента [7, 8].
В настоящей работе МТТ-тест проводили с использованием культуры клеток HeLa, по методике, описанной Mosmann Т. [9]. Клетки рассевали в лунки 96-луночного плоскодонного планшета для культур клеток в концентрации 104 – 2*104 кл/лунка и инкубировали при 37 °С, 100 % влажности и 5 % содержании углекислого газа в окружающем воздухе. После формирования монослоя производили замену полной культуральной среды, содержащей 10 % эмбриональную телячью сыворотку, на среду с низким содержанием сыворотки (1 % эмбриональной телячьей сыворотки) для стационирования культуры и вносили исследуемые соединения. Длительность инкубации с опытными веществами в концентрациях 2 мкг/мл, 20 мкг/мл, 200 мкг/мл составляла 48 ч. За 4 часа до окончания инкубации в каждую лунку вносили 20 мкл раствора МТТ (матричный раствор 5 мг/мл) (ПанЭко, Россия) и инкубировали на протяжении еще 4 ч. По окончании инкубации среду осторожно удаляли, а в каждую лунку добавляли по 200 мкл ДМСО (ПанЭко, Россия). Осадок ресуспензировали и растворяли в течение 15 мин, инкубируя в темноте при комнатной температуре. Показания оптической плотности считывали на планшетном ИФА-фотометре (Immunochem 2100, США) при 492 нм. Долю жизнеспособных клеток рассчитывали в процентах по отношению к контролю [1]. Цитотоксичность исследуемое вещество проявляет, если его процентный показатель оптической плотности меньше 70 %. Если показатель оптической плотности превышает 70 %, то данное вещество не проявляет выраженной цитотоксичности на культуру клеток [2].
Результаты исследования и их обсуждение
Для изучения прямой цитотоксичности исследуемых соединений использовался МТТ-тест, который получил широкое распространение в экспериментальных исследованиях. Исследуемые соединения 4Д, НД, 39Д, 66’, 64Д, 66Д, 43Д тестировали в диапазоне концентраций 2-200 мкг/мл в четырех параллельных сравнениях (для каждой концентрации) в 4 сериях экспериментов. Среднее значение для четырех измерений уровня оптической плотности (эквивалент доли метаболически активных/жизнеспособных клеток) выражали в процентах к контролю (таблица).
Определение цитотоксичности исследуемых соединений в МТТ-тесте