цитотоксический препарат что это
Цитостатическая противоопухолевая терапия
Призвана воздействовать на те клетки в организме, которые делятся наиболее быстро. Прежде всего это относится к опухолевым клеткам. Химиопрепараты могут назначаться по одному (монотерапия) или в комбинации (полихимиотерапия).
Наиболее часто противоопухолевые цитостатики назначаются внутривенно или внутрь, однако в ряде случаев может потребоваться введение лекарств в спинномозговой канал, либо в плевральную или брюшную полости. Иногда эффективность внутривенного введения повышает длительность введения химиопрепарата (до 48 и даже 96 часов).
Как проводится химиотерапия
Практически всегда химиотерапия проводится курсами (циклами), предполагая перерыв для восстановления нормальных тканей и функций организма (помимо опухолевых клеток, в процессе лечения могут повреждаться другие активно делящиеся клетки – в первую очередь клетки крови, волосяных фолликулов, клетки слизистых оболочек.
В последние годы успехи молекулярной биологии позволили для лечения ряда злокачественных новообразований создать препараты так называемой таргетной, или направленной терапии, с конкретной мишенью приложения, отличающей опухолевую клетку от нормальной.
Препараты таргетной терапии
В большинстве случаев препараты таргетной терапии сочетаются с обычными цитостатиками, повышая эффективность лечения, но иногда используются самостоятельно. Наиболее часто мишенью служат рецепторы на поверхности клеток опухоли или питающих ее сосудов (так действуют моноклональные антитела и ингибиторы тирозин-киназ), но мишенью могут быть и последующие этамы передачи пролиферативного сигнала).
Значительное число опухолевых заболеваний лечится не только химиопрепаратами, но и гормонами. Как правило, гормональные препараты принимаются внутрь и лечение осуществляется длительно. Иногда гормональное лечение требует хирургических вмешательств с целью исключить влияние тех или иных гормонов, вырабатывающихся в организме (удаление яичников или яичек).
Реже для лечения злокачественных новообразований используется иммунотерапия (как правило, цитокины интерферон альфа или интерлейкин-2). Обычно эти препараты используются в случаях, когда ограничены возможности химио- и гормонотерапии.
Бисфосфонаты
В арсенале онкологов существует также группа препаратов, избирательно действующих на костную ткань – бисфосфонаты. Предохраняя кость от разрушения опухолью, эти лекарства уменьшают боль и снижают частоту осложнений (прежде всего патологических переломов).
Кроме того, в арсенале онкологов существует целый ряд препаратов поддерживающей терапии для предотвращения либо лечения осложнений, связанных с химиотерапией. Как правило, такое лечение не носит «универсального» характера и присоединяется к противоопухолевой терапии по мере развития осложнений.
Исключение представляет, главным образом, противорвотная (антиэметическая) терапия, назначаемая перед химиотерапией, исходя из данных о возможности тошноты и рвоты при каждой конкретной схеме лечения.
По мере исчерпания возможностей противоопухолевого лечения (а на поздних стадиях болезни это обычно химиотерапия) возрастает значение паллиативной помощи и симптоматического лекарственного лечения как ее компонента.
В настоящее время медицина располагает большим количеством препаратов, позволяющих эффективно бороться с наиболее мучительными симптомами опухолевой болезни, включая болевой.
Цитотоксический препарат что это
Препарат был разработан Леонидом Федоровичем Ларионовым – руководителем лаборатории экспериментальной терапии рака, созданной в 1945 году при поддержке директора Института Николая Николаевича Петрова, и профессором Ленинградского технологического института Вульфом Григорьевичем Немецем.
Под руководством Л.Ф. Ларионова и В.Г.Немеца был синтезирован целый ряд производных азотистых ипритов (хлорэтиламинов), в числе которых был и метил-бис-(?-хлорэтил)-амин, названный авторами эмбихин. Доступных сведений ни о методике лечения хлорэтиламинами в клинике, ни о дозах и способах их введения в то время не было. Доклиническое изучение противоопухолевых и токсических свойств эмбихина проводила сотрудница лаборатории экспериментальной терапии рака врач Лидия Леонидовна Малюгина, которая в 1947 году по категорическому требованию самого пациента, специальному разрешению правительственных и партийных инстанций и по просьбе Николая Николаевича Петрова впервые ввела больному лимфопролиферативным заболеванием противоопухолевый препарат эмбихин.
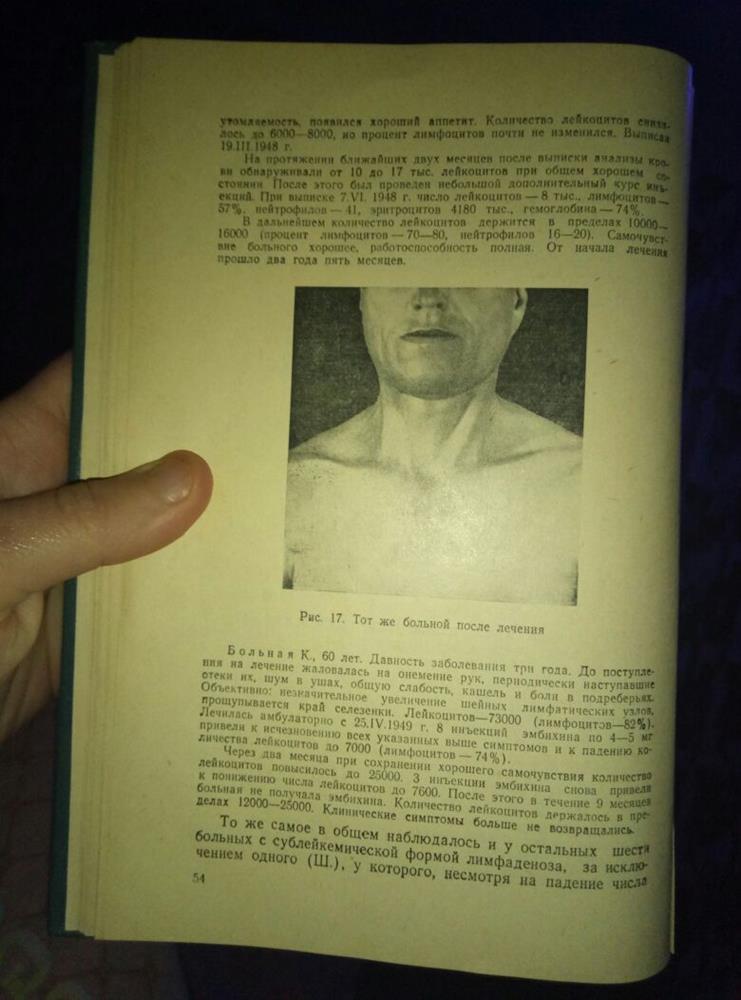
В монографии Л.Ф. Ларионова «Лечение белокровия и лимфогранулематоза эмбихином», вышедшей в 1951 году, описан этот случай:
Клиническое наблюдение: «Больной С., 49 лет, поступил в НИИ онкологии 08.12.1947 года с жалобами на слабость, быструю утомляемость, значительную потливость и похудание. Периферические лимфатические узлы во всех областях (шейные, подчелюстные, подбородочные, подмышечные, паховые) увеличены, некоторые до 4 см в диаметре. Лейкоцитоз – 35 тыс. при 78% лимфоцитов. Гистологическое исследование удаленного узла подтвердило диагноз лимфаденоза. Больному было сделано 30 введений эмбихина по 3 раза в неделю в дозе 4-5 мг. Все лимфатические узлы значительно уменьшились, некоторые почти перестали прощупываться. Полностью прекратились клинические симптомы. Выписан 19.03.1948г. Затем через 2 месяца последовал очередной цикл химиотерапии. При выписке 07.06.1948 г. клинический анализ нормализовался. В дальнейшем число лейкоцитов держится в пределах 10.000-16.000 тыс. (процент лимфоцитов 70-80, нейтрофилов 16-20). От начала лечения прошло два года и пять месяцев».

Монохимиотерапия эмбихином больных «белокровием», лимфогранулематозом и некоторыми опухолями была продолжена в НИИ онкологии АМН СССР. В 1950 году Л.Ф. Ларионову и В.Г. Немецу «За разработку нового метода лечения лимфогранулематоза и белокровия препаратом «Эмбихин» и внедрение его в практику здравоохранения» была присуждена Сталинская премия.
В 1951 году Л.Ф.Ларионов был переведен на работу в Москву в недавно созданный институт экспериментальной и клинической онкологии АМН СССР, где он также организовал лабораторию экспериментальной химиотерапии опухолей, которой руководил до последних дней. Талант экспериментатора, сила научного предвидения, аналитический ум и широкая эрудиция, а также слаженная работа единомышленников (В.Г. Немеца, И.Я. Постовского, З.В. Пушкарева, И.Л. Кнунянц, О.Ф. Гинзбург, Л.Б. Радиной) позволили академику АМН СССР, профессору Л.Ф. Ларионову заложить более полувека назад фундамент всей современной лекарственной терапии злокачественных опухолей.
Основные принципы, сформулированные в трудах Л.Ф. Ларионова:

На протяжении последующих десятилетий в рамках отечественных и международных исследований в НИИ Петрова было изучено более 150 различных противоопухолевых препаратов и средств сопроводительной терапии, вошедших в практику современной онкологии и гематологии. Сегодня, базируясь на результатах фундаментальных и клинико-экспериментальных исследований, успешно изучаются и внедряются все новые подходы в системном лечении злокачественных опухолей, включающие таргетную терапию и иммунотерапию. Как результат, с помощью системной терапии онкологи научились полностью излечивать одни опухоли и переводить некогда инкурабельные заболевания в хронические.
Т.Ю.Семиглазова, заведующая научным отделом инновационных методов терапевтической онкологии и реабилитации,
врач высшей категории, доктор медицинских наук.
ВЫ можете нам позвонить:
8 (8452) 98-84-68
и
+7-967-500-8468
или
Базисная терапия системных заболеваний соединительной ткани
Главным средством в лечении аутоимунных заболеваний являются, так называемые базисные препараты. Их название произошло от того, что они воздействуют на основание болезни, ее «базис». Эти препараты вызывают ремиссию и предотвращают или замедляют разрушение суставов, но не являются противовоспалительными препаратами. В настоящее время в качестве базисной терапии используют чаще всего: цитостатики, антималярийные препараты, сульфаниламиды, пеницилламин.
1. Цитостатики.
Цитостатические препараты: метотрексат, арава, азатиоприн (имуран), циклофосфан (эндоксан), циклоспорин (сандимун, экворал), проспидин и др.
Не стоит пугаться от названия «цитостатики», зная спектр их побочных эффектов: дозы этих препаратов при лечении артритов примерно в 5-20 раз меньше используемых при лечении опухолей! Использование цитостатиков помогает, как минимум, 70-80% больных, побочные явления возможны у 15-20% пациентов и редко бывают тяжелыми. Подбор доз под контролем ревматолога сводит возможность побочных эффектов к минимуму
В течение всего периода терапии цитостатиками необходимо, с помощью лабораторных методов исследования, контролировать показатели общего анализа крови,биохимических анализов и мочи у пациента. Если же пациент легко переносит цитостатическую терапию, можно ждать улучшения самочувствия уже через 2-4 недели после начала лечения.
Арава (элафра, лефлайд, лефлюнамид) рекомендуется больным, у которых артрит протекает очень активно, и тем, кто плохо переносит метотрексат. Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Ремикейд действует быстрее многих других базисных препаратов.
Однако применять ремикейд надо с очень большой осторожностью. До начала лечения ремикейдом необходимо выявить и пролечить все имеющиеся у пациента инфекции. Если этого не сделать, применение ремикейда может спровоцировать сильнейшее обострение недолеченных инфекционных процессов вплоть до развития сепсиса.
Также, во время лечения ремикейдом рекомендуется применять антиаллергические препараты, чтобы предотвратить возможные аллергические реакции. Стоимость препарата высокая. Лечение проводится только в стационарных условиях
Биологические препараты это одна из новейших групп препаратов для лечения артритов. Они инактивируют специальный белок (фактор некроза опухоли (ФНО)), который играет важную роль в воспалительной процессе. Эти препараты действуют быстро и эффективно уменьшают воспаление. К ним относится ингибитор ФНО этанерцепт (энбрел), анакинра (кинерет), хумира (адалимубаб), актемра (тоцилизумаб), ритуксимаб (ритуксан, мабтера), оренция (абатацепт).
Все эти препараты были разработаны в течение последнего десятилетия, а на мировом фармацевтическом рынке начали появляться не более пяти лет назад. В связи с этим они ещё весьма дороги. Ещё одним их недостатком является то, что они могут вводиться только в инъекционной форме (подкожно или внутривенно), причем в стационарных условиях, так как процедура проводится от получаса до нескольких часов под контролем специалиста. Поэтому данные препараты пока еще не получили широкого применения. Обычно их применяют в комбинации с метотрексатом или с другим базовым препаратом.
Также необходимо знать, что биологические препараты обычно не комбинируют друг с другом из-за высокой вероятности развития побочных эффектов!
Тофацитиниб – первый пероральный ингибитор янус-киназ в лечении ревматоидного артрита. Высокоэффективный и достаточно безопасный препарат. Однако высокая стоимость препарата не дает возможности говорить о его доступности для широкого круга больных.
Другие цитостатические препараты, такие как азатиоприн (имуран), циклофосфан (эндоксан) и циклоспорин (имуспорин, консупрен, сандимун, экворал) применяются только при неэффективности остальных базисных препаратов.
2. Антималярийные препараты
Антималярийные препараты делагил и плаквенил (иммард)
3. Сульфаниламиды.
4. Пеницилламин.
Пеницилламин (купренил ) при артритах обычно назначается в тех случаях, когда терапия цитостатиками не приносит больному облегчения. При системной скеродермии явяется препаратом выбора. Применение купренила при ССД основано в первую очередь на связывании препаратом альдегидных групп коллагена, что приводит к нарушению его биосинтеза и поперечного связывания отдельных молекул
Цитотоксический препарат что это
Доктор Питер
Химиотерапевты НМИЦ онкологии: Ковид не стал угрозой для жизни пациентов с диагнозом «рак»
Часто ли у пациентов с онкологическими заболеваниями выявляли коронавирус, как тяжело они болели и, главное, как это сказалось на развитии злокачественных новообразований, «Доктор Питер» спросил у химиотерапевтов НМИЦ онкологии им. Петрова.
Уже пережили страх за жизнь
Еще в начале пандемии онкологи НМИЦ им. Петрова говорили, что несмотря на ухудшение эпидобстановки их пациенты не хотят откладывать лечение – рака они боятся больше, чем коронавируса. По словам врачей, даже иногородние пациенты стремились во что бы то ни стало попасть на лечение — их не пугали ни риск заразиться в дороге, ни карантины, которые закрывали весной целые отделения. Остановить их могли только объективные причины – ограничения на перемещение или приостановка госпитализации.
— Наши пациенты уже пережили страх за свою жизнь из-за онкологического заболевания и для них лечение рака важнее, чем риск заразиться ковидом, — рассказала химиотерапевт отделения химиотерапии и инновационных технологий НМИЦ онкологии Анна Семенова. — Практически никто не отказывался от очередных циклов химиотерапии, в том числе из регионов – настаивают, просят. Когда были ограничения, некоторые просто не могли приехать, но не по собственному желанию. Сейчас все могут и без проблем приезжают.
Такое бесстрашие сочетается с особой дисциплинированностью. По словам Елены Ткаченко, заведующей отделением краткосрочной химиотерапии НМИЦ онкологии им. Петрова, практически все их пациенты строго соблюдают меры безопасности — носят маски, тщательно моют руки и стараются избегать многолюдных мест. Во время пандемии по возможности приезжали на химиотерапевтическое лечение из других городов на машине, старались во время курса химиотерапии жить в Петербурге.
Сегодня, говорят врачи, соотношение иногородних и местных пациентов полностью вернулось к обычному — примерно 70% и 30% соответственно, оба отделения химиотерапии работают, используют стандартные схемы лечения, – то есть возобновлены все режимы, включая агрессивные, если они показаны пациенту.
Заражались и болели, как все
Как говорят доктора, при любом инфекционном заболевании, будь то даже обычная ОРВИ, противоопухолевое лечение не проводится. С коронавирусом та же история – при выявлении COVID-19 химиотерапия переносится, пока человек не поправится. Напомним, с 5 мая НМИЦ онкологии начал тестировать своих пациентов на ковид в собственной лаборатории. Тест проводится накануне госпитализации, а в день поступления выполняется еще и компьютерная томография легких.
— Последние две недели стало спокойнее — почти никого не снимаем с госпитализации в отделение химиотерапии и инновационных технологий. А в мае-июне, бывало, у 4-6 человек в неделю либо тест давал положительный результат, либо КТ показывала характерные изменения в легких, — говорит Анна Семенова. — Некоторые наши пациенты даже серьезную пневмонию переносили бессимптомно. Так, у нас был пациент, который выписался и через неделю должен был снова проходить терапию. При поступлении на очередную процедуру КТ показало у него выраженную двустороннюю полисегментарную пневмонию с достаточно большой долей поражения легких – более 30-40%. При этом сам пациент ее совсем не чувствовал, у него не было ни температуры, ни кашля. И такое мы наблюдали не раз.
Как рассказала «Доктору Питеру» Елена Ткаченко, на отделении краткосрочной химиотерапии за почти 3 месяца тест на ковид при поступлении оказался положительным у немногих — всего у 14 человек, при том, что каждую неделю лечение на отделении проходят по 20-35 пациентов. По данным доктора, часть пациентов с подтвержденным ковидом болела с пневмонией, другие перенесли практически без симптомов.
— Чего мы боялись в начале пандемии? У наших пациентов причин для повышенной температуры, кроме ковида, и так много. Это побочная реакция на химиотерапию – так называемая фебрильная нейтропения, которую мы умеем лечить даже без госпитализации. Также сама по себе опухоль при распаде может давать температуру. Мы боялись, что наших пациентов без повода будут госпитализировать в ковидные стационары, где они могут подвергнуться еще большему риску заболеть, — рассказала Елена Ткаченко. — Боялись, что цитостатическая терапия, которая подавляет иммунитет, может оставить их без защиты и повысить риск заражения. Но среди наших пациентов критичных случаев не было, никто не погиб. Наблюдения показали, что рак не стал заболеванием, особо провоцирующим осложнения у инфицированных ковидом.
Ковид не «всколыхнул» опухоли
Как рассказали химиотерапевты, сезоны гриппа и ОРВИ не становятся большой проблемой для пациентов, проходящих противоопухолевое лечение. Даже несмотря на то, что многие в период прохождения курса отказываются от прививок против гриппа. В инструкциях к большинству цитостатиков (эти препараты влияют на процессы роста и деления всех клеток организма — Прим. ред.), использующихся в химиотерапии, отдельно оговаривается, что их применение может снижать иммунологический ответ на вакцинацию, а при одновременном введении с живой вакциной могут развиться тяжелые антигенные реакции.
Когда переболевшие ковидом начали возвращаться к профильному лечению, неприятных «сюрпризов» онкологи не зафиксировали — по словам врачей, все проходит в штатном режиме. К примеру, на отделении краткосрочной химиотерапии лечатся уже семеро.
«Химию» не связали с повышенным риском смерти от ковида
В конце мая в журнале The Lancet были опубликованы результаты исследования, проведенного в Великобритании при поддержке национальной сети по борьбе с раком. Его авторы проанализировали данные 800 пациентов с онкологическими заболеваниями, которые заразились коронавирусом. Исследователи хотели выяснить, как диагноз «рак» и получение противоопухолевой терапии повлияли на течение и исход у них COVID-19. Химиотерапию за 4 недели до положительного теста получил каждый третий участник (35% или 281 человек).
Как уточняется в исследовании, из 800 заболевших у 412 человек — более половины ковид протекал в легкой форме. Умерли 226 (28%) пациентов. По мнению авторов, риск смерти был значительно связан с их возрастом (средний возраст умерших 73 года) и полом (мужчины умирали чаще женщин), а также наличием сопутствующих сердечно-сосудистых заболеваний, в том числе гипертонии.
После анализа всех данных исследователи пришли к выводу:
«Смертность от COVID-19 у страдающих онкологическими заболеваниями, по-видимому, в основном определяется возрастом, полом и другими сопутствующими заболеваниями. Мы не нашли доказательств, что больные раком, получающие цитотоксическую химиотерапию или другое противоопухолевое лечение, имеют повышенный риск смертности от COVID-19 по сравнению с пациентами, не получающими активного лечения».
Основные результаты научно-исследовательской работы и перспективы химиопрофилактики рака
Достижения и перспективы химиопрофилактики рака
С середины 80-х годов 20 века в лаборатории предклинических испытаний, наряду с работами прикладного характера, определилось самостоятельное научное направление по разработке проблемы химиопрофилактики опухолей (В.Г. Беспалов, В.А. Александров), основываясь на современных принципах, которые практически не изменились до сих пор. Разработка средств для химиопрофилактики рака является сложным и длительным процессом, который должен проходить следующие этапы: доклиническое изучение антиканцерогенной активности на моделях опухолей различных органов и оценка возможных токсических свойств, предварительное клиническое изучение эффективности и безопасности у относительно небольшого числа пациентов из групп повышенного риска злокачественных опухолей, итоговое клиническое изучение на больших контингентах пациентов с оценкой онкологической заболеваемости и смертности. Перспективными для химиопрофилактики рака являются вещества, обладающие выраженным антиканцерогенным действием на широком спектре экспериментальных моделей опухолей, не имеющие токсических свойств, показавшие эффективность и безопасность в клинических исследованиях.
Цель химиопрофилактики – поиск эффективных средств (природных и синтетических), способных тормозить или препятствовать возникновению и развитию опухолей и внедрение наиболее активных препаратов в клиническую практику.
Средства для профилактики рака должны отвечать следующим основным требованиям:
Усилия в разработке этой проблемы были сосредоточены на поиске препаратов, способных ингибировать канцерогенез при их использовании, в основном, в период постинициации, т.е. в фазу промоции и прогрессии опухолей. Именно такой подход является наиболее перспективным для химиопрофилактики рака, поскольку показания к применению антипромоторных препаратов необычайно широки: среди популяции практически здоровых лиц, живущих в экологически неблагоприятных условиях; в группах с высоким риском развития рака; среди больных с преопухолевыми заболеваниями; у онкологических больных в период ремиссии после проведенного радикального лечения.
С первых шагов разработки проблемы химиопрофилактики рака решалась важная и трудоемкая задача по отработке моделей опухолей (как злокачественных, так и доброкачественных), вызываемых с достаточно высокой частотой в течение относительно непродолжительного времени (не более 1–1,5 лет), особенно тех локализаций, которые относятся к наиболее распространенным. В итоге в лаборатории были освоены, а также разработаны новые оригинальные экспериментальные модели всех основных опухолей, встречающихся у человека (табл. 1). Кроме того, в лаборатории была разработана модель опухолей молочной железы, эндокринной и репродуктивной систем и других органов, индуцированных гамма-облучением, у крыс; многоорганные модели канцерогенеза, вызываемого химическими канцерогенами.
Таблица 1. Экспериментальные модели предрака и рака, применяемые в лаборатории, для изучения антиканцерогенных средств
Локализация
Метод индукции
Гистологический тип
МНМ интраммамарно, МНМ или ДМБА в/в у крыс
Инициация МНМ в/в + промоция тестостероном в/б у крыс
Простатическая интраэпителиальная неоплазия, аденокарциномы
МХ интратрахеально у крыс, уретан в/б у мышей
АОМ п/к у крыс и мышей, МНМ интраректально у крыс
Очаги аберрантных крипт, аденокарциномы
Плоскоклеточные карциномы, папилломы
ДЭНА в/б у крыс и мышей
Пренеопластические очаги, гепатоцеллюлярные карциномы
ДМБА + ТПА или БП накожно
Плоскоклеточные карциномы, папилломы
Глиомы головного и спинного мозга, невриномы периферических нервов
Основные результаты научно-исследовательской работы
Доклиническое и клиническое изучение антиканцерогенной активности синтетических и природных веществ
К настоящему времени на различных моделях опухолей изучено более 80 веществ, и из них более 50 проявило антиканцерогенную активность, основные из которых представлены в табл. 2. В результате проведенной работы впервые выявлен ряд новых антиканцерогенных веществ, у известных ингибиторов установлена способность тормозить развитие опухолей ранее неизвестных локализаций.
Таблица 2. Ингибиторы канцерогенеза, изученные в лаборатории
Класс соединений
Препараты и вещества
Ретинол, альфа-токоферол, аскорбиновая кислота, тиамин, рибофлавин, витаминно-минеральные комплексы
Бета-каротин обычный и липосомальный
Селенит натрия, молибдат натрия, цинка сульфат
Нестероидные противовоспалительные средства
Диазепам, дифенин, карбонат лития
Тималин, тимоген, эпиталамин, кортексин
Органические кислоты и их соли
Фумаровая кислота, глюкарат кальция, глюкуронат калия
Биотехнологические растительные препараты
Экстракты лекарственных растений
Betula pendula, Eleutherococcus senticosus, Filipendula ulmaria, Glycyrrhiza glabra, Plantago major, Rhaponticum cartamoides, Urtica dioica
Пищевые вещества и природные комплексы
Концентрат ламинарии, масло зародышей пшеницы, пренолы из хвои, провитаминный концентрат из хвои, оксигумат торфяной, отруби пшеницы, рыбий жир, хвойный комплекс, экстракт фукусный
На основании полученных результатов по всем испытанным веществам на разных моделях были сделаны важные общие выводы:
В результате экспериментов были отобраны и предложены для дальнейшего клинического изучения наиболее эффективные и безопасные антиканцерогенные вещества. Разработан алгоритм клинических исследований химиопрофилактических препаратов у пациентов из групп повышенного риска рака молочной железы, желудка, легких, толстой кишки с использованием клинических, эндоскопических, гормональных, биохимических, иммунологических, эхографических, рентгенологических, гистологических, цитологических, цитоморфометрических исследований и оценкой влияния на промежуточные биомаркеры повышенного онкологического риска. В проведенных клинических испытаниях выявлены химиопрофилактические средства, оказывающие выраженное лечебное действие на патологические сдвиги у пациентов из групп повышенного онкологического риска. Кламин (БАД на основе концентрата ламинарии) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию кишечной метаплазии и дисплазии у больных атрофическим гастритом; улучшал клинико-рентгенологическую картину, вызывал регрессию дисплазии и метаплазии эпителия бронхов у больных хроническим бронхитом курильщика; вызывал регрессию предраковых очагов у больных красным плоским лишаем ротовой полости; нормализовал стул, подавлял повышенную пролиферацию эпителия слизистой оболочки и вызывал частичную регрессия полипов у пациентов с аденоматозными полипами толстой кишки. Лесмин (БАД на основе хвойного комплекса) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, подавлял инфекцию Helicobacter pylori, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию лимфоплазмоцитарной инфильтрации и кишечной метаплазии слизистой оболочки желудка у больных атрофическим гастритом. Результаты доклинического и клинического изучения пищевых веществ и разработанных в лаборатории на их основе БАД опубликованы в нескольких монографиях (в частности: Беспалов В.Г. Питание и профилактика онкологических заболеваний. – Великий Новгород, Полиграфическая компания «Позитив», 2015. – 242 с.).
На основе концентрата ламинарии в качестве фармацевтической субстанции был создан и внедрен в клиническую практику лекарственный препарат мамоклам, который применяется для лечения фиброзно-кистозной болезни молочных желез. В проведенных клинических испытаниях установлено, что мамоклам значительно уменьшает проявления масталгии, предменструального напряжения молочных желез и альгоменореи, ослабляет пальпаторные признаки фиброзно-кистозной болезни, нормализует менструальный цикл, баланс тиреоидных и половых гормонов; по данным маммографии и эхографии вызывает регрессию фиброаденоматозных уплотнений и кист в ткани молочных желез, приводит к уменьшению диаметра расширенных млечных протоков, снижает маммографическую плотность. Результаты клинического изучения мамоклама обобщены в монографии: Беспалов В.Г. Мастопатия и лекарственный препарат мамоклам. Методическое пособие для врачей. – СПб.: Издательство «Игра света», 2008. – 68 с.
Доклиническое и клиническое изучение противоопухолевой активности фармакологических веществ и препаратов
В последние годы нами были пересмотрены результаты изучения ранее синтезированных противоопухолевых препаратов, чтобы выявить наиболее перспективные для внедрения в клиническую практику после более углубленного и широкого экспериментального исследования. Наибольший интерес привлекли два препарата: диоксадэт и хлонизол.
Диоксадэт относится к группе алкилирующих соединений – этилениминов. В лаборатории были разработаны новая схема синтеза фармацевтической субстанции и новая лекарственная лиофилизированная форма препарата, которые обеспечивают большую безопасность в производстве; разработан новый проект ФСП на лекарственную форму; проведены доклинические исследования по оценке противоопухолевой активности диоксадэта на стандартных моделях трансплантированных опухолей в сравнении с цитостатиками, применяемыми в клинической практике.
В доклинических исследованиях была установлена выраженная противоопухолевая активность диоксадэта на широком спектре перевиваемых опухолей у лабораторных животных. Данные сравнительного изучения диоксадэта свидетельствуют о его более высокой противоопухолевой активности, чем у наиболее близкого к нему по структуре тиофосфамида. В эксперименте на крысах с перевиваемой асцитной опухолью яичника противоопухолевое действие диоксадэта при внутрибрюшинном введении сравнимо с действием цисплатина, являющегося стандартом в клинической интраперитонеальной химиотерапии рака яичника. С учетом того, что диоксадэт, в отличие от препаратов платины, обладает значительно более низкой токсичностью, не вызывает осложнений в виде спаечного процесса, перспективным является применение диоксадэта для интраперитонеальной химиотерапии рака яичника. В экспериментах с асцитной опухолью Эрлиха у мышей выявлен выраженный синергизм противоопухолевого действия диоксадэта в комбинации с гемцитабином при отсутствии повышения токсичности.
Клинические испытания диоксадэта по II фазе были проведены в 15 онкологических учреждениях у 229 больных распространенными формами злокачественных новообразований различных локализаций. Несмотря на то, что все больные были с далеко зашедшими формами злокачественных новообразований, практически при всех локализациях был доказан объективный противоопухолевый эффект диоксадэта. Особенно сильным противоопухолевый эффект диоксадэта оказался в лечении распространенных форм рака яичников и молочной железы, в том числе у больных с асцитом и ранее леченных другими алкилирующими агентами. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации при операбельных и распространенных формах рака почки. Химиоэмболизация с диоксадэтом повышала 2- и 3-летнюю выживаемость больных неоперабельным раком почки. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации печеночной артерии у больных с первичным раком печени и метастазами в печень колоректального рака. Была доказана эффективность химиоэмболизации с диоксадэтом в виде получения объективного противоопухолевого ответа и увеличения выживаемости больных.
Диосадэт обладает выраженным так называемым контактным противопухолевым действием. В настоящее время в лаборатории развивается направление использования диоксадэта в различных режимах интраперитонеальной химиотерапии канцероматоза брюшной полости. Доклинические исследования показали, что диоксадэт при интраперитонеальной химиотерапии превосходит по эффективности и безопасности другие применяемые с этой целью цитостатики: циспалатин, паклитаксел, митомицин С, мелфалан.
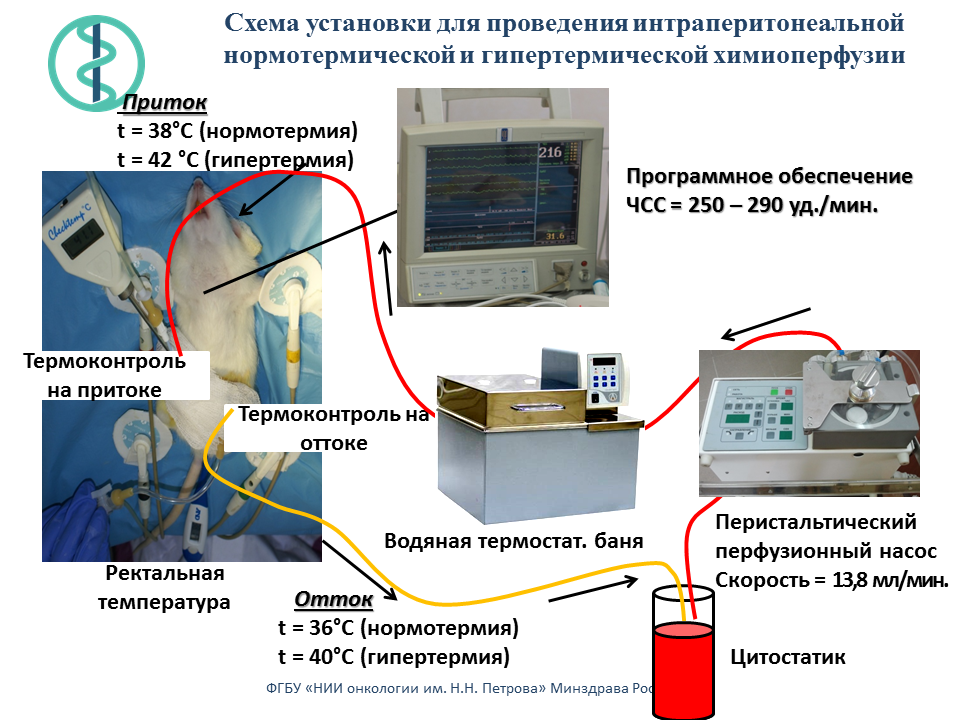
Создана экспериментальная установка для химиоперфузионного лечения канцероматоза брюшной полости на моделях у крупных и мелких лабораторных животных.
Результаты доклинического и клинического изучения химиоперфузионного лечения злокачественных опухолей обобщены в монографии: Беляева О. А., Беспалов В. Г., Сенчик К. Ю., Киреева Г. С., СтуковА. Н., Гафтон Г. И., Карачун А. М., Гусейнов К. Д. Беляев А. М. Химиоперфузионное лечение канцероматоза брюшной полости. – СПб., 2016. – 146 с.
Проведено сравнительное статистическое исследование результатов восьми независимых экспериментов по изучению эффективности интраперитонеальной химиотерапии. Изучены режимы инъекционной внутрибрюшинной (в/б) химиотерапии (ИВХ), нормо– и гипертермической химиоперфузии (НИПХ и ГИПХ) препаратом диоксадэт на модели перевиваемого асцитного рака яичника (РЯ) у 288 крыс самок Вистар. Перевивка РЯ осуществляли в/б в количестве 1?107 опухолевых клеток, интраперитонеальную химиотерапию проводили однократно через 48 часов после трансплантации опухоли. Диоксадэт вводили в максимально переносимых дозах в/б: при ИВХ с помощью шприца в дозе 1,5 мг/кг массы тела; при НИПХ и ГИПХ раствор с цитостатиком прокачивали через брюшную полость специальным насосом соответственно в дозе 30 мг/кг при температуре 36,5–37,5°С и 15 мг/кг при температуре 40,5–41,5°С. В контрольных группах крысам в/б аналогичными путями вводили физиологический раствор. Противоопухолевые эффекты лечения оценивали по увеличению средней продолжительности жизни крыс. Для статистического анализа использован принцип гармонизации статистических доказательств и предсказаний. В контрольной группе с инъекционным в/б введением физиологического раствора средняя продолжительность жизни составила 15 дней, 95% доверительный интервал (ДИ) от 12 до 19. По сравнению с данным контролем воздействие ИВХ, НИПХ и ГИПХ увеличивало среднюю продолжительность жизни соответственно на 85, 97 и 202% (p