цитомегаловирус и коронавирус что общего
Интервью с иммунологом: ответы на вопросы о вакцинации
Интервью с иммунологом: ответы на вопросы о вакцинации
Дорогие друзья, сегодня в нашей рубрике «Интервью с врачом» необычный гость. Наш директор, врач-генетик и к.м.н. Макеева Оксана Алексеевна побеседовала с Еленой Георгиевной Чуриной — д.м.н., профессором, врачом иммунологом-аллергологом. Тема — очень актуальная, будет посвящена вакцинации от новой коронавирусной инфекции.
О. А.: Елена Георгиевна, давайте сразу начнем с главного вопроса. Расскажите, пожалуйста, всех ли можно прививать, какие противопоказания, какие осложнения?
Е. Г.: Всех прививать, конечно, нельзя. Абсолютные противопоказания для вакцинации — беременность, аутоиммунные заболевания, онкологические заболевания, аллергические заболевания в стадии обострения, любые анафилактические реакции в анамнезе. Есть еще много относительных противопоказаний, в этом случае вопрос решается лечащим врачом пациента.
Вакцинация, которая сейчас активно предлагается и реализуется — в действительности продолжение третьей фазы испытаний — клинических исследований. Клинические исследования — это очень длительная и важная стадия и основными ее целями являются: получение объективных и полных данных о безопасности и эффективности вакцины, выявление побочных эффектов, в том числе отдаленных последствий, оценка соотношения риска и пользы при использовании изучаемой вакцины. И этот цикл обычно длится в течение 3-5 лет! Недавно появилась информация о тромбоэмболических осложнениях, в том числе развитии инсультов у людей после вакцинирования вакциной Astra Zeneca в ряде стран Европы. Напомню, что эта вакцина, по аналогии с вакциной Спутник V, также разработана на аденовирусной платформе.
Таким образом, вакцина Спутник V не прошла развернутую и полномасштабную третью фазу и поступила в гражданский оборот преждевременно, с ускоренной досрочной регистрацией и с мотивацией активной вакцинации населения, для создания коллективного иммунитета и защиты от вируса. На самом деле, все намного сложнее. Вакцинация никогда не защитит от проникновения вируса в организм. Она нужна для того, чтобы избежать тяжелого течения инфекции и фатальных осложнений. Антитела какое-то время находятся в кровотоке и, если они нейтрализующие, то могут связать определенные белки вируса, например, S-белок коронавируса. Но эта защита сработает только тогда, когда вирус минует первую линию защиты на слизистой ротоглотки и попадет в кровоток. У абсолютного большинства пациентов вся динамика ОРВИ, от проникновения вируса в организм до выздоровления разворачивается в верхних дыхательных путях.
О. А.: Давайте разграничим базовую вакцинацию ребенка по национальному календарю и вакцинацию взрослого населения от респираторных вирусных инфекций, то есть от гриппа и вот сейчас, от COVID-19.
Е. Г.: Особенности иммунного реагирования у каждого человека отличаются, в этом отношении мы все уникальны. С чего начинается иммунный ответ? Вирус внедряется в организм и сразу садится на слизистую оболочку носоглотки и ротоглотки — входные ворота для инфекции. Активируется врожденный иммунитет, его ключевые клетки — макрофаги — и сразу запускается воспаление. Для чего мы делаем прививку? Для того, чтобы в крови образовался пул протективных антител, которые будут блокировать вирусные белки и не давать вирусу размножаться и поражать другие клетки, уже в нижних отделах респираторного тракта. Они сработают только тогда, когда наступит генерализация инфекции, а не в первые 5-7 дней, когда весь процесс происходит на слизистых верхних дыхательных путей, для этого нужны эффективные механизмы местной защиты — секреторный IgА, макрофаги, местные Т-киллерные клетки и антимикробные белки. Таким образом, вакцина не защитит от заражения, она защитит от возможных осложнений, и только при условии выработки именно нейтрализующих антител к S-протеину.
Что касается вакцинации детей от особо опасных инфекций в соответствии с национальным календарем профилактических прививок, то здесь совсем другие механизмы реализации иммунного ответа на инфекцию изначально. Эти инфекции имеют раннюю и стойкую стадию вирусемии — присутствия вируса в крови и длительный инкубационный период, в отличие от респираторных вирусов. И после такой вакцинации формируется стойкий пожизненный иммунитет, образуются Т- и В-клетки памяти, которые всю жизнь живут вместе с нами.
О. А.: Чем отличается иммунитет после болезни, естественный, от искусственного иммунитета, достигаемого в ходе вакцинации? В первом случае слизистые защищены, а во втором нет?
Е. Г.: Не совсем так. Слизистые оболочки в полной мере никогда не могут быть защищены. Естественный или врожденный иммунитет — очень мощный и всеобъемлющий, основная масса живых существ на земле прекрасно обходится только врожденными механизмами. Высоко специфический адаптивный иммунитет — более позднее эволюционное приобретение млекопитающих, он связан с уникальной, избирательной специфичностью антигенраспознающих рецепторов на Т- и В-лимфоцитах. Если произошло хотя бы незначительное изменение генома у микроба, то иммунный ответ снова будет развиваться как в первый раз. А все респираторные вирусы, как правило, РНК-содержащие и очень быстро мутирующие. Вы уже читали про разные мутации COVID-19? Итальянская, бразильская, британская и т.д. мутации, и их будет очень много. У коронавируса есть пока несколько мутаций, но он высокомутирующий, и на каждую геномную последовательность будет разная специфичность рецепторов лимфоцитов. И что, против каждого штамма прививаться? Поэтому, довольно проблематично создать эффективную вакцину от любых респираторных вирусов.
Когда у человека уже реализовался естественный иммунный ответ на определенный вирус, даже если не было клинических признаков болезни, то выработались самые разнообразные защитные факторы, и это не только антитела! Неправильно оценивать противовирусный иммунный ответ, как антительный или гуморальный. Противовирусный ответ — это, прежде всего, Т-клеточный иммунный ответ, первая линия защиты на слизистых, макрофаги, многочисленные антимикробные белки, контактные взаимодействия между клетками, реакции, которые определяют дальнейший сценарий иммунного ответа в целом. Хорошо, если есть антитела, но они не смогут полностью защитить организм, и наоборот, если их нет — это вовсе не значит, что мы без защиты от коронавируса.
О. А.: Если мы вводим вакцину подкожно, то это только стимуляция антительного ответа и другого иммунитета не будет?
Е. Г.: Нет, разовьются разные иммунные ответы. Антиген в структуре вакцины попал в циркуляцию, необходимые процессы формирования Т-клеточного ответа обязательно будут запущены. Но абсолютно экстраполировать эту ситуацию на естественное проникновение вируса через слизистые верхних дыхательных путей нельзя. Почему мы постоянно говорим о том, что очень много «бессимптомных больных» и пациентов с легким течением инфекции? Да, как раз потому, что наши уникальные механизмы внутренней иммунной защиты срабатывают вовремя и блокируют размножение вируса. С вакциной немного другая ситуация — мы вводим в организм антиген в структуре аденовируса (Спутник V) и не можем точно утверждать, по какому механизму пойдет иммунный ответ. Если антитела уже есть, то могут возникнуть очень тяжелые побочные реакции, например, антителозависимое усиление инфекции (АЗУИ).
О. А.: Это реакция организма на вакцинацию или реакция на повторное инфицирование, когда в организме уже есть антитела, и произошло столкновение с вирусом?
Е. Г.: Может быть и та, и другая ситуация. Если человек переболел бессимптомно, хотя мне очень не нравится эта странная формулировка «бессимптомный больной», то есть просто он встретился где-то с вирусом, и у него уже есть активный защитный иммунитет, клетки памяти и антитела. При введении вакцины в этом случае возможно очень острое течение болезни, с осложнениями. Я бы рекомендовала обязательно провести исследование на наличие всех видов антител к COVID-19, прежде чем принять решение о вакцинации. АЗУИ возникает потому, что сразу образуется иммунный комплекс: антитела, которые уже есть в организме, плюс вирус и белки системы комплемента, запускается острое воспаление. Если много антител, то эти комплексы будет поглощаться клетками макрофагами, взаимодействовать с определенными рецепторами, но, вместо того, чтобы разрушиться и погибнуть, вирус продолжит размножаться в макрофагах. И в этой ситуации возможно развитие цитокинового шторма. Поэтому тем, кто уже переболел, я бы не рекомендовала вакцинироваться.
О. А.: Расскажите, пожалуйста, у всех ли после перенесенной коронавирусной инфекции появляются антитела? Можно ли переболеть и не иметь антител?
Е. Г.: Антитела всегда будут изначально, но их может быть мало, и, спустя какое-то время, они просто не будут фиксироваться методом иммуноферментного анализа, иначе говоря, останутся следовые количества антител. И в этом есть важный биологический смысл, что антитела подвергаются быстрой деградации. Это механизм иммунорегуляции, направленный на то, чтобы предотвратить потенциальные аутоиммунные процессы. Ничего хорошего нет в постоянной циркуляции по организму каких-либо антител, это канонические положения иммунологии, в любом учебнике их можно прочесть.
Кроме того, как правило, нет корреляции между клиническим течением заболевания и титром антител в крови при любых вирусных инфекциях. В моей практике есть пациенты с рецидивирующей герпетической инфекцией, но при этом с очень низким количеством антител к вирусам герпеса.
Установление клинического диагноза — это, в первую очередь — клиническое мышление врача. А сегодня мы наблюдаем такую картину, когда вся диагностика сводится лабораторным и инструментальным методам. Например, КТ. Удивляет, с какой легкостью назначается это серьезное, очень высокое по лучевой нагрузке обследование. И что мы видим? Например, 90% поражения легких по КТ? Это просто картина матового стекла, пневмонит, системное воспаление мелких сосудов и отек, это не поражение именно альвеол, если бы так было, то человек бы уже не жил. Мы должны ориентироваться на объективный статус и общее состояние пациента, на его настроение, самочувствие, активность. Если у человека все хорошо, и он прекрасно себя чувствует, а КТ показывает, например, 30% поражения легких, при этом ему все равно в ряде случаев рекомендовали срочную госпитализацию, в результате практически здоровый человек заболевал внутрибольничной бактериальной пневмонией, и все заканчивалось фатально.
О. А.: Чтобы возник цитокиновый шторм, человек должен одномоментно получить большое количество частиц коронавируса?
Е. Г.: Большое количество вирусных частиц, примерно 1000, надо получить для того, чтобы заболеть ковидом. Цитокиновый шторм развивается при синдроме активации макрофагов — самых главных клеток врожденного иммунитета, и это не такое частое осложнение, но его можно спровоцировать применением интерферонов и таких препаратов, как кагоцел и ингавирин. Что происходило год назад, с самого начала эпидемии? На первом этапе даже бессимптомных пациентов только с положительным ПЦР-тестом на коронавирус везли в госпитали, все лежали вместе. Таким образом формировались очаги инфекции внутри больниц, возрастала в геометрической прогрессии антигенная нагрузка на иммунную систему пациентов, а самое страшное — присоединялась внутрибольничная бактериальная суперинфекция, резистентная ко всем антибиотикам, которые на сегодня существуют.
Когда я увидела первые протоколы лечения COVID-19, то поняла, что, насколько это возможно, буду ограждать людей от госпитализации. Несколько видов антибиотиков, противомалярийные препараты и лекарства от ВИЧ-инфекции — от побочных эффектов такого лечения может умереть даже здоровый и молодой человек.
О. А.: Если человек получил небольшую долю коронавируса, то он легче справится с ней, чем если одномоментно получать много?
Е. Г.: Да, конечно. Когда вирусных частиц немного, скорее всего, вообще не будет никаких проявлений инфекции, гораздо опаснее высокая вирусная нагрузка.
О. А.: Полезно ли получить и пережить эту маленькую дозу?
Е. Г.: Очень полезно! Микробиота каждого человека уникальна, и чем она более разнообразна, тем лучше. Компоненты микробиома производят физиологическую микровакцинацию, постоянно стимулируют клетки врожденного иммунитета, держат их на низком старте для того, чтобы иммунитет оперативно сработал при необходимости. Нужно обязательно контактировать с антигенами. Дети, которые не посещают детский сад, все равно переболеют основными вирусными инфекциями, но уже в школе, пока не наработают адаптивный иммунный ответ.
О. А.: В гигиенической теории про вакцинацию так и говорят — она дает возможность иммунитету поработать. Это не так?
Е. Г.: Нет, это искусственная тренировка. Гигиеническая теория привела к резкому росту аллергических и аутоиммунных заболеваний! Невозможно вакцинацией воспроизвести все механизмы естественного иммунного ответа. Препараты микробных продуктов или аутовакцины в этом аспекте работают намного лучше — это вакцинация на уровне местного иммунитета. Таким способом мы помогаем клеткам иммунной системы активироваться, принимая лизаты бактерий. Может быть даже высокая температура, но это всегда хорошо, потому что, например, у часто болеющих людей хроническое воспаление протекает без температуры и затягивается, так как активного иммунного ответа нет.
О. А.: Итак, мы за базовую вакцинацию ребенка по национальному календарю, но против не до конца неизученной вакцины от респираторного вируса?
Е. Г.: Конечно. Мой ребенок — вакцинирован полностью от опасных инфекций по календарю, и даже дополнительно я его провакцинировала от менингококковой инфекции. Вакцинируем обязательно, потому что, как минимум, по туберкулезу у нас по-прежнему, не очень хорошая ситуация. Но когда мы говорим о массовой ежегодной вакцинации взрослого населения от ОРВИ, особенно о людях в возрасте 40+, с повышенными рисками аутоиммунных, сердечно-сосудистых, онкологических заболеваний, с уже накопленными соматическими мутациями в клетках, нужно быть крайне осторожными. Людей, работающих в группах профессионального риска, возможно, и надо провакцинировать, но только после тщательного сбора анамнеза и обследования.
Что такое инфекция цитомегаловирусная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Цитомегаловирусная болезнь (ЦМВИ, цитомегалия, вирусная болезнь слюнных желёз, болезнь с включениями) — это общее системное инфекционное заболевание, вызываемое вирусом семейства герпесов V типа — цитомегаловирусом, который специфически поражает лейкоциты и клетки различных органов (слюнных желёз, почек, лёгких, печени, головного мозга и другие).
Клинически характеризуется многообразием проявлений — от бессимптомного течения до генерализованных (распространённых) форм с поражением внутренних органов и центральной нервной системы, а также пожизненного пребывания в организме.
Этиология
Вид — Cytomegalovirus hominis (открыт в 1956 году)
Является древним человеческим вирусом (предположительно с Кембрийского периода), который в ассоциации с другими герпесвирусами оказал значительное влияние на формирование иммунитета современного человека.
Внутривидовая структура неоднородна. Известно о трёх штаммах вируса: Davis, АД 169, Kerr и Towne. Они могут иметь различия в тропизме к тканям человека, различаться по степени вирулентности и патогенности.
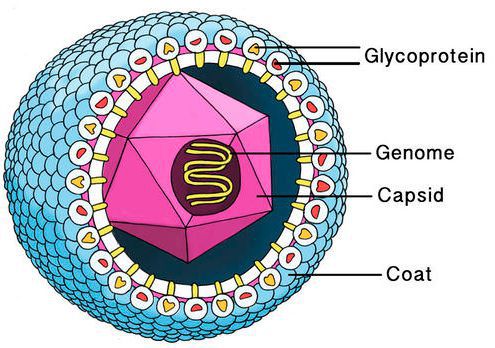
Цитомегаловирус имеет внешнюю гликопротеиновую оболочку, в составе которой есть B и H звенья — к ним формируются антитела. Представляет собой двухцепочечный ДНК-содержащий крупный вирус с диаметром нуклеокпсида до 180 нм.
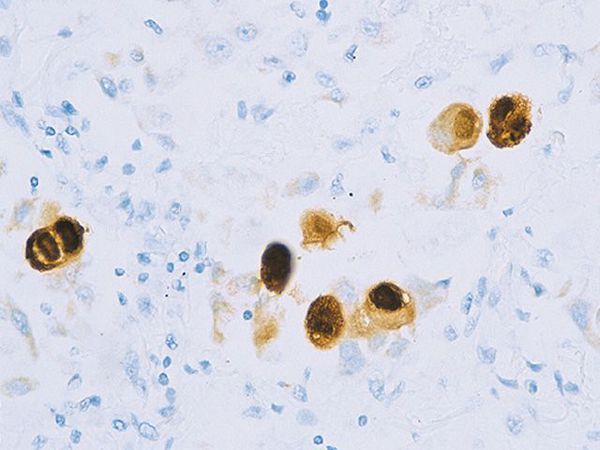
Вирус способен поражать практически любую ткань человеческого организма, т.е. обладает политропностью. При развитии в ядрах инфицированных клеток образует включения (незрелые вирионы), описываемые как «глаз совы».
Вызывает цитомегалию (увеличение) клеток, не приводя к их гибели. Способен при активном течении значительно снижать иммунитет. Возможна трансплацентарная передача вируса с развитием врождённой инфекции.
Культивируется на культуре фибробластов (клеток соединительной ткани) человека. Изменения хромосомного набора клеток не вызывает. Очень чувствительны к ЦМВ клетки плода и новорождённого.
Малоустойчив в окружающей среде, быстро погибает при повышении температуры до 56°С и действии дезинфицирующих средств, теряет заражающие свойства при замораживании. В условиях комнатной температуры способен сохраняться в течение нескольких дней. [1] [3] [4] [8]
Эпидемиология
Антропоноз. Источник инфекции — только человек (больной различными формами и носитель), причём выделение вируса возможно в течение всей жизни человека и зависит от его индивидуальных иммунологических особенностей. Возможно заражение различными штаммами ЦМВ, роль этого в изменении патологии и клинической картине пока не выяснена.
Как передаётся цитомегаловирус
Механизмы передачи вируса:
Факторами передачи вируса выступают слюна (преимущественно), моча, кровь, вагинальный секрет, слёзы, сперма, фекалии, грудное молоко.
Восприимчивость среди населения высокая, наибольшее количество заражённых выявляется в детском и подростковом возрасте, когда происходит повышение контактных взаимодействий между людьми. Во взрослом состоянии ЦМВ инфицировано до 95% населения планеты, которые являются пожизненными носителями вируса. [1] [2] [3] [8]
Симптомы цитомегаловирусной инфекции
Инкубационный период — от 15 дней до трёх месяцев (при манифестной, т. е. явно выраженной форме).
Врождённая форма цитомегаловирусной инфекции
Цитомегаловирусную инфекцию выявляют примерно у одного из 200 рождённых детей, каждый пятый из них имеет или будет иметь проблемы со здоровьем. Сразу после рождения выявляются низкая масса тела, увеличение печени и селезёнки, желтуха, увеличение всех групп лимфоузлов, высыпания геморрагического характера, различные органные поражения, резкие изменения гемограммы и функциональных тестов. В крови, слюне и моче выявляется вирусная ДНК (в ряде случаев выделение вируса продолжается на протяжении нескольких лет).
Прогноз серьёзен и зависит от тяжести поражения и объёма проводимых лечебных мероприятий. В более поздние сроки инфицирования беременной вероятность тяжёлых проявлений заболевания существенно ниже, и новорождённые, как правило, не имеют симптомов врождённой ЦМВ-инфекции на начальных этапах после родов, однако это не говорит о полном клиническом благополучии в будущем — возможно поражение нервной системы различной степени выраженности и нейросенсорная тугоухость. Поэтому такие дети нуждаются в обследовании и наблюдении профильных специалистов, а при необходимости — в лечении. [1] [2] [3] [5] [8] [10]
Приобретённая форма цитомегаловирусной инфекции
При приобретённых формах заболевание чаще всего протекает в детском или подростковом возрастах. В эти периоды отмечается наибольшая лабильность иммунной системы (имеет значение при группе «детских инфекций»).
Чаще всего первичное инфицирование протекает или бессимптомно, или по типу ОРЗ нетяжёлого течения. Наблюдаются лёгкая слабость, субфебрилитет (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение лимфатических узлов шеи, увеличение и болезненность слюнных желёз.
Зачастую такие проявления не вызывают настороженности в плане ЦМВ и самостоятельно купируются в течение 1-2 недель — болезнь переходит в стадию латентного течения (носительство).
При инфицировании в более позднем возрасте (взрослые люди), а также у некоторых детей (с нарушением иммунитета) и ослабленных больных заболевание, как правило, протекает с явными морфофункциональными нарушениями и гораздо тяжелее, чем у первой группы лиц. Наблюдается:
Синдром тонзиллита не характерен. Увеличивается печень и селезёнка, значимо изменяются показатели гемограммы и функциональных печёночных проб.
В зависимости от состояния иммунной системы и возможностей её коррекции клинически значимая первичная инфекция у данной группы людей продолжается в течение 1-3 месяцев и, как правило, завершается победой организма над вирусной экспансией с последующим формированием вирусоносительства без каких-либо явных клинических проявлений.
В некоторых случаях (ВИЧ-инфекция, онкологические заболевания, длительный приём цитостатических препаратов, генетические дефекты иммунной системы) может наблюдаться длительное волнообразное течение первичной инфекции или реактивация (обострение) имеющегося носительства вируса (латентной формы). В этом случае отмечается:
Мононуклеозоподобный синдром
При выраженной форме болезни может развиться мононуклеозоподобный синдром — слабость, субфебрильная температура (37,1—38,0 °C), увеличение и чувствительность лимфоузлов, увеличение печени и селезёнки, изменения крови вирусного характера.
Симптомы цитомегаловируса у мужчин и женщин
Цитомегаловирусная инфекция поражает людей всех возрастов и полов. Принципиальных отличий в симптомах у мужчин и женщин нет, за исключением поражения половых органов.
Цитомегаловирусная инфекция у беременных
У беременных первичная инфекция может протекать бессимптомно или с ограниченными клиническими проявлениями (чаще всего). При заражении ребёнка (плода) до родов в зависимости от сроков первичного инфицирования женщины (иногда истинной реактивации ЦМВ при СПИДе) возможно развитие врождённой цитомегаловирусной инфекции.
Риск внутриутробной передачи — до 90% от всех случаев инфицирования на любом сроке беременности.
При заражении в ранние сроки беременности высок риск самопроизвольного выкидыша, мертворождения или рождения детей с явными пороками развития (патологии лёгких, головного мозга, почек, сердца, сосудов, органа слуха, психоневрологическими нарушениями).
Интересной особенностью является влияние возраста беременной, на котором произошло первичное инфицирование, на частоту передачи инфекции: у женщин до 20 лет риск передачи в три раза выше и не зависит от сроков беременности, а после 20 лет риск внутриутробного инфицирования существенно ниже
Симптомы хронической цитомегаловирусной инфекции
Болезнь становится хронической, если вирус долго находится в организме и иммунная система не может ему противостоять. Характерны длительная субфебрильная температура (37,1—38,0 °C) и слабость. Может увеличиться печень, лимфоузлы (чаще нескольких разных групп), иногда селезёнка, возникает поражение глаз и миокардит.
Цитомегаловирусная инфекция у людей с нормальным иммунитетом
Заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека, т.е. иммунная система среднестатистического жителя планеты способна самостоятельно найти достойный выход из ситуации.
Цитомегаловирусная инфекция при СПИДе
При СПИДе болезнь протекает крайне тяжело — может развиться генерализованная форма инфекции, т. е. поражаются различные органы:
Прогноз часто неблагоприятен. Генерализованная форма цитомегаловирусной инфекции может также развиваться у пациентов с ослабленным иммунитетом и младенцев.
Патогенез цитомегаловирусной инфекции
Входные ворота — слизистая оболочка различных органов, преимущественно ротоглотки и верхних дыхательных путей (также желудочно-кишечного тракта, мочеполовой системы и других органов).
В месте внедрения никаких структурных и воспалительных изменений не наблюдается. После проникновения вируса в организм он атакует свои главные мишени — лимфо- и моноциты, эпителиальные клетки слюнных желёз, лёгких, почек и других органов.
Поражённые клетки увеличиваются в размерах в 3-4 раза (цитомегалия), в ядре клетки формируются включения (незрелые вирионы), в результате чего клетка приобретает вид «совиного глаза». При активном течении болезни развивается депрессия большинства звеньев иммунитета, в том чичле и белка ИНФ-α.
В дальнейшем в ответ на проникновение ЦМВ развивается защитная реакция в виде образования специфических антител различных классов, активации Т-киллеров и развития реакций гиперчувствительности замедленного типа, проявляющейся в поражённых органах образованием узелковых лимфомоноцитарных инфильтратов.
Однако инфицированные клетки не погибают, а продолжают функционировать и выделяют специальный слизисто-белковый секрет, который, обволакивая вирионы, обеспечивает маскировку вируса от иммунной системы человека. Это выражается в слабом иммунном ответе и переходу острого заболевания в длительный латентный процесс (носительство).
При слабой репликации и равновесных отношениях с иммунитетом вирус может длительно (пожизненно) сохранятся в организме в состоянии относительной стабильности, не вызывать никаких органных поражений и не причинять никаких неудобств человеку. Вирусную ДНК при таком состоянии в крови выявить не удаётся, однако в эпителии слюнных желёз и моче вирус можно обнаружить (обычно в незначительном количестве).
При значительном снижении иммунитета (ВИЧ, онкологические заболевания, пересадка органов, длительный приём цитостатиков) происходит активизация вирусной репликации, вирус попадает в кровь и вновь атакует различные органы. [1] [3] [10]
Классификация и стадии развития цитомегаловирусной инфекции
Общепринятой классификации не существует, она разнится в зависимости от особенностей медицинского подхода к проблематике заболевания.
Классификация по клинической форме:
1. Приобретённая ЦМВ:
○ генерализованная (мононуклеозоподобная, лёгочная, церебральная и почечная, печёночный гепатит, с поражением ЖКТ, комбинированного вида);
Отдельно выделяют цитомегаловирусную болезнь у ВИЧ-инфицированных.
Классификация по МКБ-10:
Классификация по степени тяжести:
Осложнения цитомегаловирусной инфекции
Осложнения при цитомегалии бывают специфическими неспецифическими.
Специфические осложнения:
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры. Это гнойные осложнения — повышение температуры тела до 41°С, соответствующие симптомы поражения определенных органов, нейтрофильный лейкоцитоз. [1] [3] [9] [10]
Диагностика цитомегаловирусной инфекции
Лабораторная диагностика:
Также проводится инструментальная диагностика:
Дифференциальная диагностика:
Лечение цитомегаловирусной инфекции
Лечение бессимптомной цитомегаловирусной инфекции
Бессимптомные носители цитомегаловирусной инфекции, как правило, не нуждаются в лечении. Исключением могут быть пациенты, которые получают сильную терапию, выраженно угнетающую иммунную систему. В таком случае может возникнуть опасное обострение инфекции, т. е. лечение проводится для профилактики.
Лечение цитомегаловирусной инфекции лёгкой степени тяжести
Лечения проводится в амбулаторных условиях. Важно отметить, что заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека. Это определяет основную лечебно-диагностическую тактику при выявлении активной (острой) ЦМВ-инфекции (при отсутствии тяжёлого течения и осложнений) — это здоровое питание, полноценный отдых и динамическое наблюдение. Лишь в случаях упорного течения и выраженных отклонений клинико-лабораторного характера следует подключать средства медикаментозного лечения.
Лечение средней и тяжёлой формы цитомегаловирусной инфекции
Больные средней тяжести, тяжёлые пациенты и дети неонатального возраста подлежат стационарному обследованию, наблюдению и лечению.
Принципы лечения цитомегаловируса должны отвечать следующим требованиям:
Медикаментозное лечение
С учётом индивидуальных особенностей проводится этиотропная терапия, направленная на ослабление вируса, прекращение его генерализованной циркуляции (персистенции) и патогенного потенциала.
В зависимости от условий могут применяться специфические цитомегаловирусные иммуноглобулины, специфические противовирусные препараты прямого противоцитомегаловирусного действия (в основном в условиях реанимации и интенсивной терапии).
В целях повышения сопротивляемости организма показано назначение средств иммунокоррекции и иммунотерапии, патогенетическое и симптоматическое лекарственное обеспечение.
Диета
Питание больных осуществляется согласно тяжести заболевания, проявлениям и возрастному фону. В общем показана диета №5 по Певзнеру с отказом от жирной, жареной, острой и раздражающей пищи, механически и химически щадящие питание.
Диспансерное наблюдение
После выписки за переболевшими устанавливается диспансерное наблюдение в течении 6-12 месяцев с периодическими осмотрами профильных специалистов и обследованием, объём и кратность которого определяется лечащим врачом. [1] [2] [5] [8] [10]
Прогноз. Профилактика
Прогноз, как правило, благоприятный (переход в неактивное носительство).
Специальной профилактики заражения не существует.
В очаге заболевания противоэпидемические мероприятия не проводятся, карантина нет.
После клинического выздоровления дети допускаются в коллективы без ограничительных мероприятий.
В целях выявления источников повышенной опасности ЦМВ проводятся обследования донорам крови, органов и тканей, а также беременным женщинам. Если беременная не имеет специфических антител IgG к ЦМВ, за ней следует установить более тщательное наблюдение с трёхкратным обследованием на ЦМВ за время беременности. В это время ей следует по возможности минимизировать общение с детьми, не пользоваться чужой посудой и не целоваться с новыми людьми.
Рекомендовано назначение профилактического лечения больным СПИДом и после трансплантации органов препаратами прямого противовирусного действия.
Вакцина для предотвращения врождённого ЦМВ находится в стадии разработки. [1] [2] [9]