цитогенная строма эндометрия что это
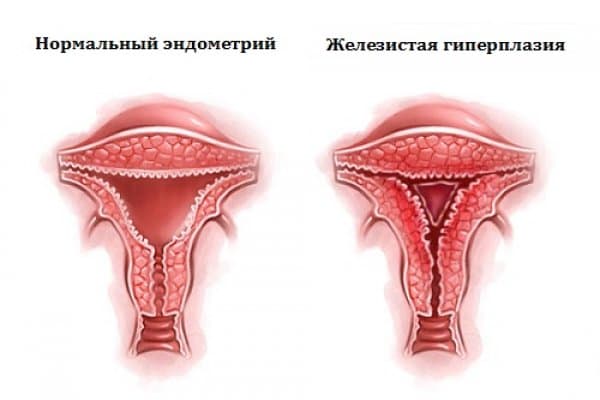
Гиперплазия эндометрия матки
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Эндометрий представляет собой нежную тонкую слизистую ткань, которая выстилает полость матки изнутри. Данная ткань каждый месяц быстро растет и утолщается под действием женских половых гормонов. В случае наступления беременности, эндометрий является «пуховой периной» на которую прикрепляется оплодотворенная яйцеклетка. При отсутствии беременности под действием гормонов эндометрий отторгается, выходит в виде менструальной крови.
Классификация гиперплазии эндометрия по локализации
Классификация гиперплазии эндометрия (по гистологической картине)
Причины гиперплазии эндометрия
В настоящее время основной причиной развития гиперплазии считается нарушение баланса женских половых гормонов, который чаще всего встречается в пубертатном периоде и перименопаузе.
Факторы риска развития гиперплазии эндометрия
Симптомы, которые встречаются при гиперплазии эндометрия
Основные из них при гиперплазии эндометрия могут быть:
Обследования, которые помогут выявить и поставить диагноз гиперплазии эндометрия
Лечение гиперплазии эндометрия
Практически в 100% случаев лечение гиперплазии эндометрия хирургическое.
Методами хирургического лечения гиперплазии эндометрия является гистероскопия и гистерорезектоскопия.
Данная операция проводится под общей анестезией. Продолжительность операции не превышает 30 минут, короткий период нахождения под общей анестезией позволяет врачам в тот же день отпустить пациентку домой.
Осложнения гиперплазии
При отсутствии должного и адекватного лечения гиперплазия эндометрия приводит к тяжелой анемии с значительным снижением уровня гемоглобина, появлению слабости, повышенной усталости, сонливости, что связано с большими потерями крови во время менструации. У молодых женщин гиперплазия эндометрия может быть причиной бесплодия и невынашивания беременности. Отдельные формы гиперплазии эндометрия (железистая и кистозная гиперплазии эндометрия) являются предраковым состоянием и в случае длительного наблюдения, при отсутствии лечения, могут переродиться в рак матки.
Профилактические мероприятия при данном заболевании необходимы для того, чтобы снизить риск развития рака эндометрия и предотвратить рецидив гиперплазии.
Гиперплазия эндометрия. Часто задаваемые вопросы
1. Что это такое? Доброкачественный процесс, который характеризуется чрезмерным разрастанием внутреннего слоя матки.
2. Из-за чего она возникает? Из-за постоянного воздействия полового гормона эстрогена на эндометрий, который вызывает его чрезмерное разрастание. Гиперэстрогения возникает из-за нарушения центральной регулиции менструального цикла, гормонопродуцирующих опухолей яичников, неправильного использования гормональных препаратов, дефицита прогестерона (гормон II фазы менструального цикла), обладающего антипролиферативным действием, так же в результате ановуляторных циклов.
3. Это распространенное заболевание? Частота встречаемости в структуре гинекологической заболеваемости 15-50%. По данным обращаемости пациенток частота встречаемости ГПЭ- 30%. В позднем репродуктивном возрасте и в перименопаузе встречается с частотой- 50%
4. Это заболевание очень опасно? Пристального внимания врачей заслуживают:
При отсутствии должного лечения гиперплазия эндометрия может приводить к серьезным маточным кровотечениям, со снижением гемоглобина крови и вытекающими отсюда последствиями.
5. Возможно ли забеременеть на фоне гиперплазии эндометрия? Ответ – нет. Гиперплазия эндометрия не возникает спонтанно, это следствие нарушений в репродуктивной системе женщины. Нарушение баланса между звеньями регуляции менструального цикла вызывает избыток эстрогенов в организме женщины, нехватку прогестерона, вследствие этого отсутствие овуляции (выхода яйцеклетки из фолликула для оплодотворения). Так же сам эндометрий структурно изменен, поэтому является неблагоприятным для имплантации (прикрепление плодного яйца к стенке матки).
7. Как диагностировать атипическую гиперплазию эндометрия? Большую информацию врач получает при опросе пациентки во время общения (возраст менархе или время наступления менопаузы, все особенности менструального цикла- его длительность, характер выделений и т.д.).
УЗ-исследование в зависимости от периода жизни женщины, а также фазы менструального цикла может дать информацию о состоянии эндометрия. По этим данным можно заподозрить проблему, однако подтвердить или опровергнуть атипию в клетках эндометрия нельзя. Только проведение гистероскопии с последующим гистологическим исследованием материала является золотым стандартом для диагностики этого состояния. Информативность метода более 90%.
8. Обязательно ли проводить выскабливание эндометрия при гиперплазии? Раздельное выскабливание цервикального канала и полости матки несет за собой лечебный и диагностический характер. Механическое удаление измененной патогенной ткани из полости матки предотвращает маточное кровотечение, что составляет лечебный эффект. Полученный соскоб отправляется на гистологическое исследование, после которого будет дано заключение о характере ткани, наличии или отсутствии признаков злокачественного поражения.
9. Возможен ли рецидив гиперплазии эндометрия? Да, возможен. Так как причиной гиперплазии эндометрия является нарушение гормонального баланса в организме женщины, то требуется обследование её гормонального фона. Для профилактики рецидива необходимо соответствующее лечение и исключение факторов риска.
Онкологические аспекты эндометриоза гениталий
Статья посвящена проблеме малигнизации эндометриоза, приведены особенности эндометриоза, сближающие его с опухолевым процессом, патогенетические факторы злокачественной трансформации эндометриоза. Отмечается, что при эндометриозе, особенно при эндометриои
The article is dedicated to the issue of endometriosis malignization, the features of endometriosis which bring it together with tumor process, were given, as well as pathogenic factors of malignant transformation of endometriosis. It was highlighted that, in endometriosis, especially, in endometrioid ovarian cysts, oncologic prudency is necessary. Approaches to endometriosis treatment were considered.
Эндометриоз — болезнь-загадка XX века, которая и по сей день вызывает множество вопросов и затруднений в диагностике и лечении. Разнообразие клинических признаков и топографии этого заболевания (от бессимптомных форм до весьма выраженных и тяжелых состояний) предопределяет широкий диапазон терапевтических алгоритмов у российской и зарубежных гинекологических школ и практическую значимость поиска общего, максимально эффективного подхода к ведению пациенток.
Эндометриоз в настоящее время рассматривают как доброкачественное гормонозависимое состояние, при котором за пределами границ нормального расположения слизистой оболочки матки происходит разрастание ткани, по морфологическим и функциональным свойствам идентичной эндометрию («эндометриоидные очаги», «эндометриоидные гетеротопии»), что индуцирует хроническую воспалительную реакцию и приводит к появлению клинических симптомов, которые могут оказывать влияние на физическое состояние, психологический статус и социальное благополучие пациенток [1].
Если заболевание обнаружено в молодом возрасте, то есть основания для прогнозирования его тяжелого течения в последующем [2].
Малигнизация эндометриоза остается нерешенной научной и клинической проблемой. По данным различных специалистов, это явление встречается в 0,6–11,4% случаев у пациенток с генитальной формой эндометриоза, и этот показатель превышает распространенность злокачественных опухолей внутренних половых органов у женщин в среднем в популяции [3–7]. Гистологически злокачественные опухоли, происходящие из генитального эндометриоза, отличаются от эпителиальных раков, формирующихся de novo, и выделяются в отдельную группу. С позиции гистологии такие опухоли соответствуют светлоклеточным (14,8%) и эндометриоидным (66,7%) карциномам [8]. При этом 75% опухолей происходит из эндометриоидных кист яичников и только 25% — из экстраовариальных локализаций процесса [9, 10].
Начало изучению вопроса малигнизации эндометриоза положил Sampson (1925), определив патологические критерии злокачественного процесса в эндометриоидном очаге: наличие раковой и доброкачественной эндометриоидной ткани в одном и том же органе, возникновение опухоли в эндометриоидной ткани, полное окружение клеток опухоли эндометриоидными клетками [11]. По его мнению, эктопический эндометрий должен рассматриваться как предрасположенность к злокачественным новообразованиям, так как периодически проявляющиеся цитолитические свойства стромы и кровоизлияния в эктопическом эндометрии на протяжении многих лет не могут оставаться безразличными для окружающих тканей. Поскольку очаги эндометриоза состоят из двух компонентов (железистый эпителий и строма), то злокачественное перерождение может происходить из железистого эпителия в карциному, из стромы — в саркому.
Концепция этиопатогенеза злокачественного перерождения эндометриоза до сих пор не ясна. В качестве основного провоцирующего фактора рассматривают гиперэстрогению, поэтому пристальному наблюдению должны подвергаться женщины репродуктивного возраста [12, 13].
Пик злокачественной трансформации эндометриоидных кист яичников приходится на возраст 35–55 лет, что на 10–20 лет меньше, чем у пострадавших от рака яичников без сопутствующего эндометриоза, и чаще соответствует репродуктивному периоду [3–5, 14].
По данным мировой литературы, прогноз при опухолях из эндометриоидных кист и очагов наружного генитального эндометриоза лучше, чем при обычных эпителиальных злокачественных опухолях яичников [9, 15, 16]. Пятилетняя выживаемость при недиссеминированных формах составляет 65%, при диссеминированных — 10%. При распространенном эндометриозе даже после удаления матки и придатков сохраняется риск гиперплазии эндометриоидной ткани и малигнизации экстраовариального эндометриоза [17].
Очевидно, что онкологические аспекты эндометриоза — одна из наиболее значимых, но, к сожалению, наименее изученных и дискутабельных проблем. По частоте малигнизации первое место занимает эндометриоидная киста яичника, второе — ретроцервикальный эндометриоз, третье принадлежит аденомиозу [18], однако онкологический аспект эндометриоза — «камень преткновения» и одновременно «гнездо раздора» многих исследователей [19]!
Причина разногласий в расхождении данных о частоте злокачественной трансформации эндометриоза, которые существенно противоречивы (от 0,4% до 11–24%) [20]. Я. В. Бохман (1989) высказывается категорично: частота малигнизации эндометриоза значительно превосходит представленные в литературе сведения в связи со сложностью диагностики поэтапных изменений малигнизированных очагов эндометриоза вследствие «поглощения» злокачественной опухолью предшествующих эндометриоидных тканевых структур [21].
Особенности эндометриоза, сближающие его с опухолевым процессом:
1) способность к инфильтративному росту в окружающие ткани и органы с деструкцией последних (в связи с отсутствием соединительнотканной капсулы и способностью эндометриодных очагов выделять липолитические и триполитические ферменты);
2) возможность paспространяться по кровеносным и лимфатическим сосудам, а также диссеминировать в результате нарушения целостности кистозных форм [22 [;
3) повышение уровня онкомаркера СА-125;
4) рак яичника и эндометриоз имеют общие законы наследования: повышение риска развития у близнецов и родственников первой линии [23].
Но в отличие от истинной опухоли для эндометриоза не специфична клеточная атипия и прогрессивный автономный рост.
В отличие от истинной опухоли при эндометриозе имеется связь с менструальной функцией и «содружественные» взаимоотношения с беременностью (физиологическое течение беременности является благоприятном фактором для эндометриоза).
Что касается раковой опухоли, то беременность стимулирует ее экспансивный рост [19].
При истинной опухоли яичника выражены катаболические нарушения (кахексия, анемия, нарушение основного обмена), не характерные для эндометриоза. Эндометриозу присущи тазовые боли, бесплодие, что ухудшает качество жизни [22].
Среди всех эндометриодных нарушений эндометриоз яичников имеет особое значение в связи с тем, что:
1) в числе всех эндометриодных гетеротопий эндометриоз яичников занимает стабильное первое место;
2) эндометриоз яичников играет ведущую роль в генерализации патологического процесса: очаги, расположенные в яичнике, распространяются на соседние органы и брюшину, способствуя развитию глубокого инфильтративного эндометриоза и спаечного процесса в малом тазу;
3) с позиций онкологической настороженности эндометриоз яичников представляет наибольшую потенциальную угрозу для малигнизации.
Сведения о частоте злокачественных трансформаций эндометриоидных кист чрезвычайно противоречивы. Существуют мнения известных исследователей о достаточно высоком риске малигнизации этих образований (3–4-кратное увеличение риска, на 37% чаще, чем в популяции, особенно если они были выявлены в молодом возрасте и имели длительное течение). Критической можно считать длительность заболевания 10–15 лет [24].
Существует проблема ложноположительного диагностирования рака яичника при эндометриозе, а F. E. van Lecumen считает, что наличие эндометриоза яичника является существенно менее опасным, чем процедура экстракорпорального оплодотворения с последующим переносом эмбриона, которая связана с увеличением риска агрессивного рака яичника в 3 раза [25].
В последние годы интенсивно изучаются патогенетические факторы, способствующие злокачественной трансформации эндометриоза в целом и эндометриоидных кист яичников в частности:
По-видимому, изучение экспрессии определенных генов поможет выявить факторы, объясняющие возможность прогрессирования и малигнизации эндометриоза у отдельных пациенток [29, 30].
В 60–80% эндометриоз-ассоциированный рак яичников (РЯ) возникает при наличии атипичного эндометриоза [22], который следует относить к предраковому состоянию. Гистохимически наличие атипичного эндометриоза подтверждается повышением экспрессии маркеров пролиферации.
Эндометриоз яичников коррелирует с определенными гистологическими типами РЯ, а именно эндометриоидными и светлоклеточными карциномами [31]. Эндометриомы, а также эндометриоидный и светлоклеточный РЯ чаще встречаются в левом яичнике, однако этот факт не нашел объяснения [8].
Профилактика злокачественной трансформации эндометриоидных кист:
1. Адекватная диагностика:
2. Рациональная лечебная тактика — оперативное вмешательство (основной этап в лечении эндометриодных кист).
К мерам профилактики эндометриоза и РЯ относят перевязку маточных труб, что снижает развитие как эндометриоза, так эндометриоидного и светлоклеточного РЯ [22].
Есть наблюдения, что консервативная хирургия, даже сопровождающаяся полным удалением эндометриоидных поражений, не предотвращает риска РЯ. Поэтому у пациенток с реализованной репродуктивной функцией есть основание рассмотреть вопрос о сальпингоовариэктомии ± гистерэктомии [32].
При полном удалении гистологически верифицированных эндометриоидных кист яичника можно ограничиться только хирургическим лечением, однако следует помнить о высокой частоте развития рецидивов и персистенции заболевания (через 1–2 года — 15–21%, спустя 5 лет — 36–47%, через 5–7 лет — 50–55%) [33].
Лечение эндометриоза гормональными препаратами также является одним из мощных факторов профилактики развития канцерогенеза. В большинстве случаев терапия эндометриоза осуществляется комплексно (хирургическое вмешательство и гормональная терапия в послеоперационном периоде).
Гормональная терапия осуществляется дифференцированно — с учетом репродуктивных планов пациентки, сопутствующей генитальной и экстрагенитальной патологии, наличия противопоказаний. При планировании беременности в ближайшее время препаратами выбора должны быть агонисты гонадотропин-релизинг-гормона (аГнРГ), в частности отечественный препарат Бусерелин-лонг (уровень доказательности А (литература в статье)).
Механизм действия аГнРГ связан с восстановлением нарушенных взаимосвязей в гипоталамо-гипофизарной системе у больных эндометриозом. В результате продолжительного воздействия аГнРГ на гипофиз происходят десенситизация клеток гипофиза и быстрое снижение интенсивности секреции и биосинтеза гонадотропинов [34]. Угнетение стероидогенеза, вызываемое аГнРГ, индуцирует атрофию как самого эндометрия, так и эктопических эндометриальных желез и стромы. Этот феномен называют медикаментозной кастрацией. Блокада обратима, и после отмены аГнРГ у женщин репродуктивного возраста восстанавливается чувствительность аденогипофиза к гипоталамической стимуляции [35].
Бусерелин-лонг при внутримышечном введении один раз в 28 дней в дозе 3,75 мг обеспечивает стойкий терапевтический эффект. Рекомендованная длительность лечения — до шести месяцев [20].
Активное вещество препарата Бусерелин-лонг заключено в микросферы размером от 30 до 150 мкм с разным временем рассасывания. Основу микросфер составляет биорастворимый сополимер DL молочной и гликолевой кислот. Микросферы в виде водной суспензии вводятся глубоко внутримышечно. После инъекции пролонгированной формы препарата начинается постепенное высвобождение аГнРГ с поверхности микросфер, что сначала — в течение первых суток — приводит к стимуляции синтеза гонадотропинов, а затем к десенситизации гипофиза и блокаде гипофизарно-гонадной оси. Впоследствии микросферы, подвергаясь биодеградации в тканях, медленно высвобождают содержащийся в них аГнРГ, длительно (до 28 дней) поддерживая необходимую для десенситизации гипофиза концентрацию препарата в крови. Сам сополимер метаболизируется в организме до мономеров молочной и гликолевой кислот. В репродуктивном возрасте нормальный менструальный цикл восстанавливается спустя два-три месяца после отмены препарата [34, 35].
Данные клинического исследования, проведенного на базе Московского областного научно-исследовательского института акушерства и гинекологии (С. Н. Буянова и соавт., 2014), показали высокую эффективность применения Бусерелина-лонг у группы пациенток, страдающих эндометриозом (n = 50), среди которых риск развития онкогинекологических заболеваний был выше, чем в популяции (возраст старше 35 лет, наличие сопутствующих заболеваний матки: миома, гиперплазия эндометрия; доброкачественные заболевания яичников и др.).
ФГБОУ ВО НижГМА МЗ РФ, Нижний Новгород
Онкологические аспекты гиперпластических процессов эндометрия
Гиперплазия — это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия — одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
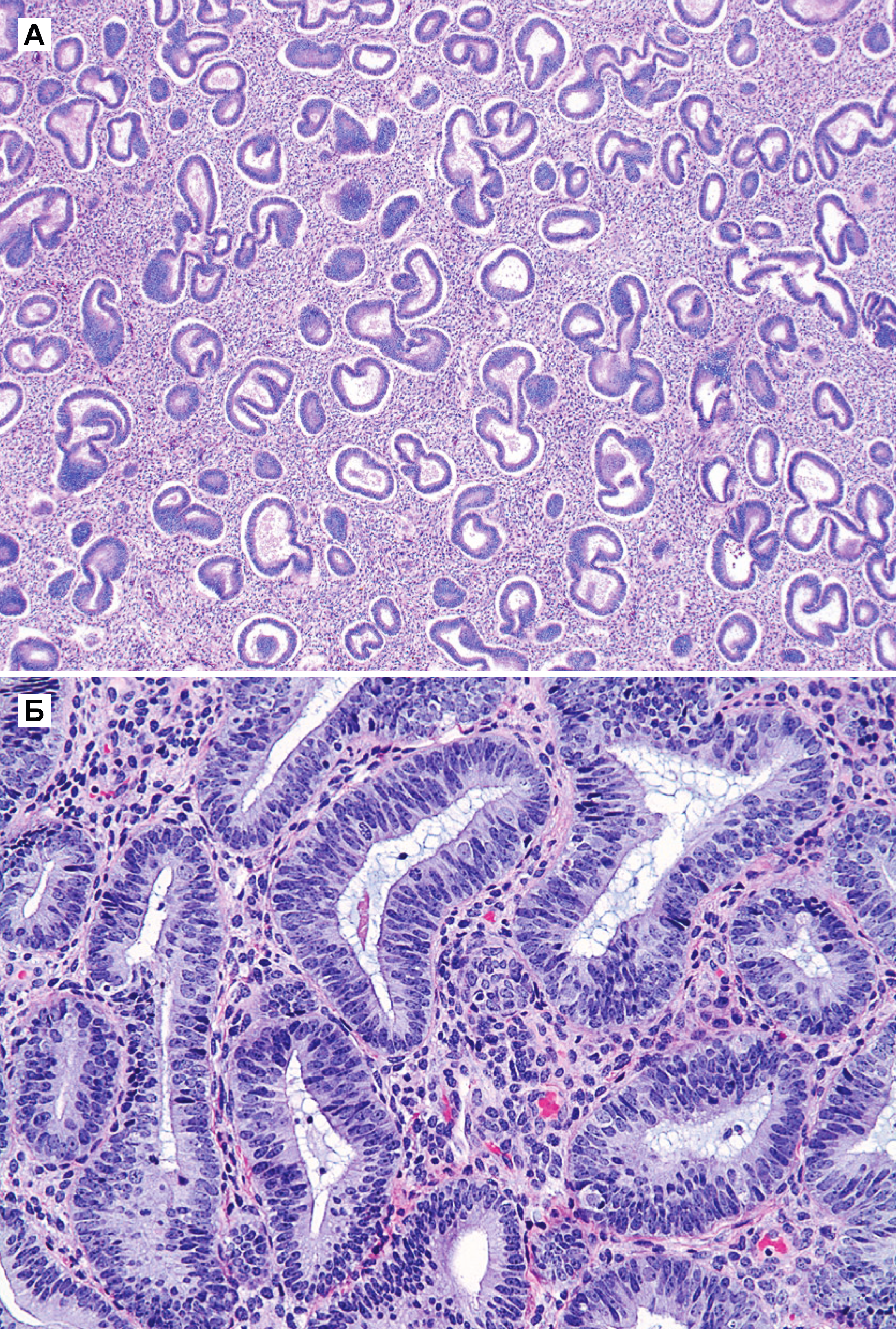
Гиперплазия эндометрия без атипии — это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации — это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].
К предраковым заболеваниям эндометрия относятся [2]:
Эндометрий — мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
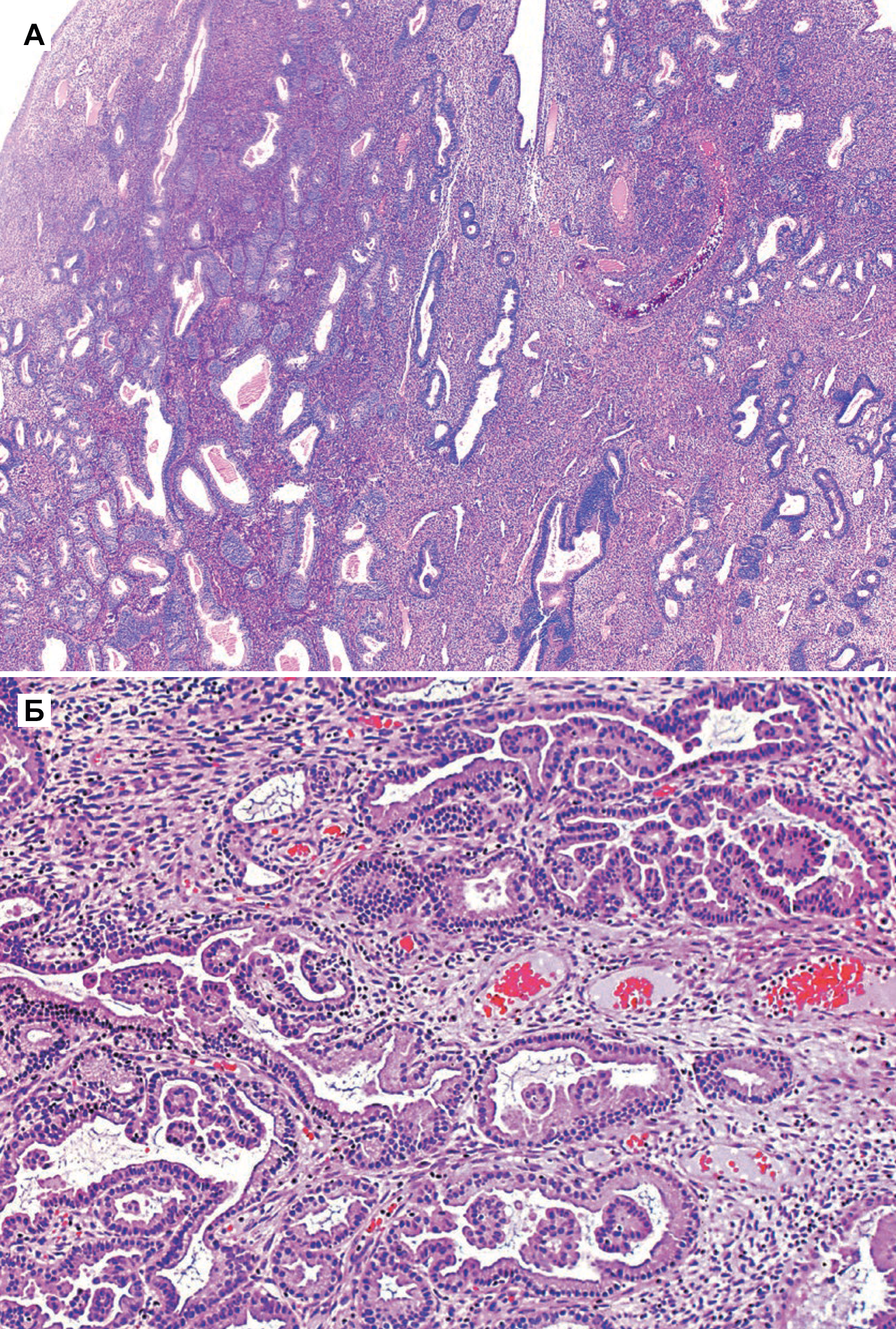
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2–4 слоя), и потеря ориентирования к базальной мембране [5].
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) — это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
РТМ — самая частая злокачественная опухоль женских половых органов в развитых странах и вторая по частоте после рака шейки матки злокачественная опухоль женских половых органов в мире. В США в 2015 г. зарегистрировано более 54800 новых случаев заболевания РТМ, и более 10150 смертей от этого заболевания. В России ежегодно регистрируется более 21 тысячи больных РТМ. В структуре заболеваемости женского населения в России в 2016 г. РТМ занимал 3-е ранговое место (7,7 %). Средний возраст заболевших РТМ в России составляет 62,6 года [3,4].
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
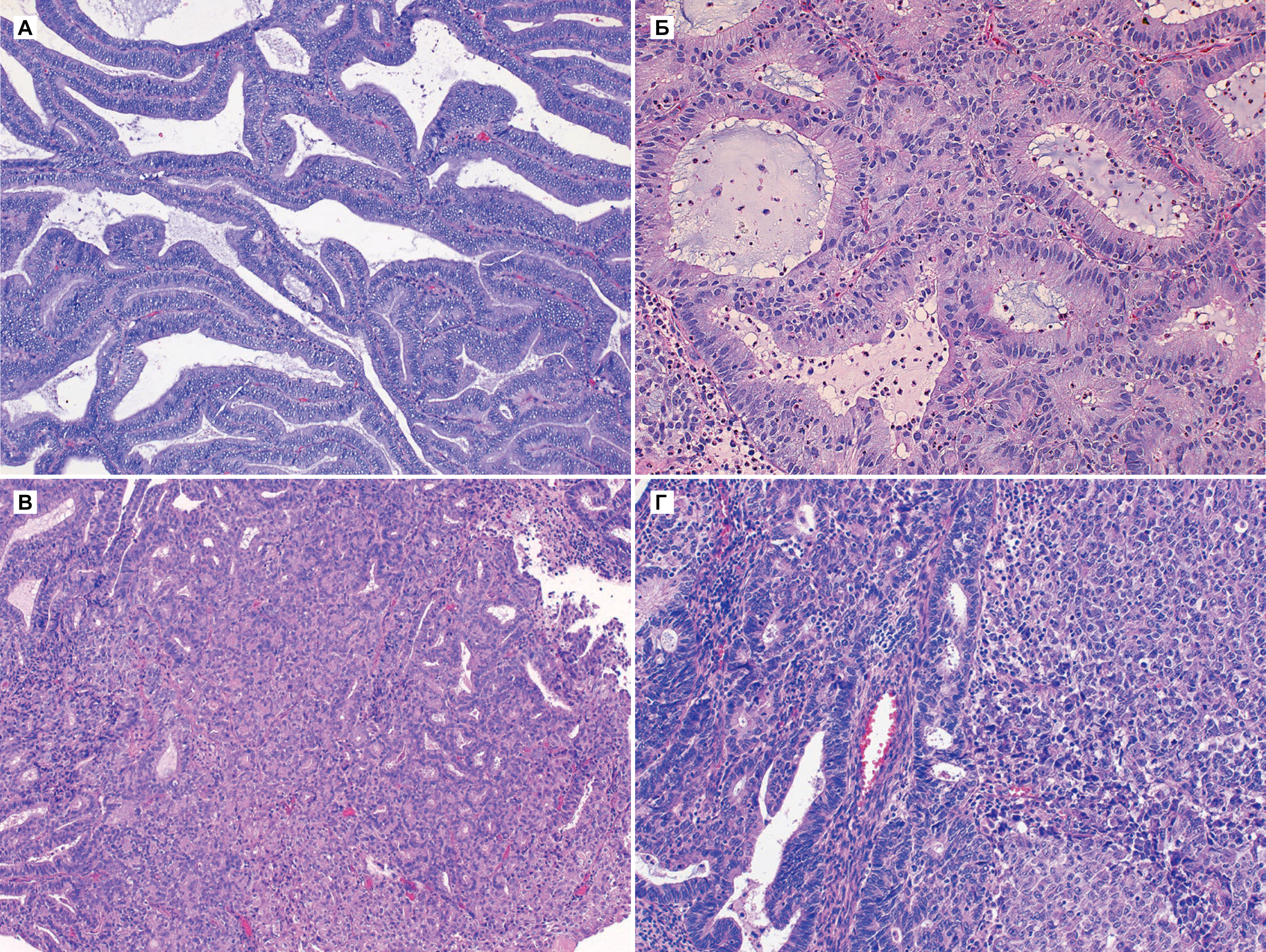
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 — высоко дифференцированная;
G2 — умеренно дифференцированная;
G3 — низко дифференцированная или недифференцированная.
Клиника
Ранний симптом прогрессирования рака эндометрия — появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки — гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Список литературы: