цикл кребса что дает
ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦИКЛ КРЕБСА)
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбо-новых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот.
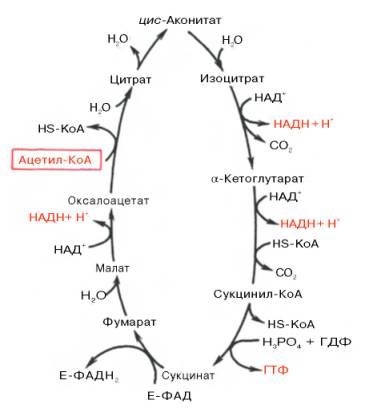
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.
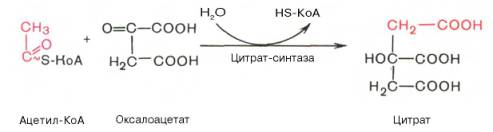
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
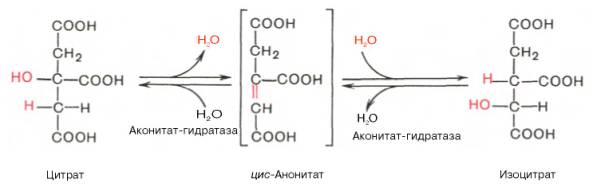
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
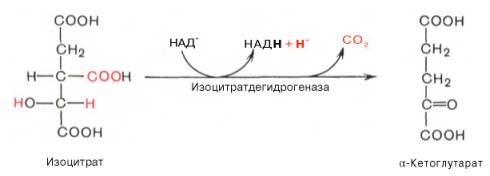
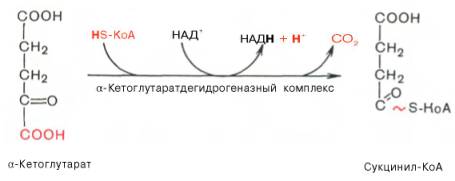
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
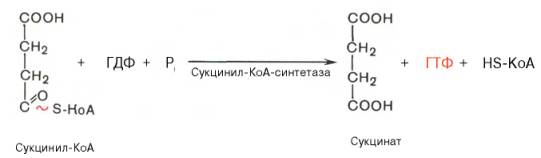
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
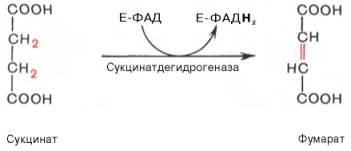
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
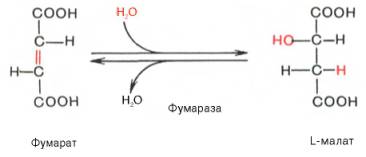
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
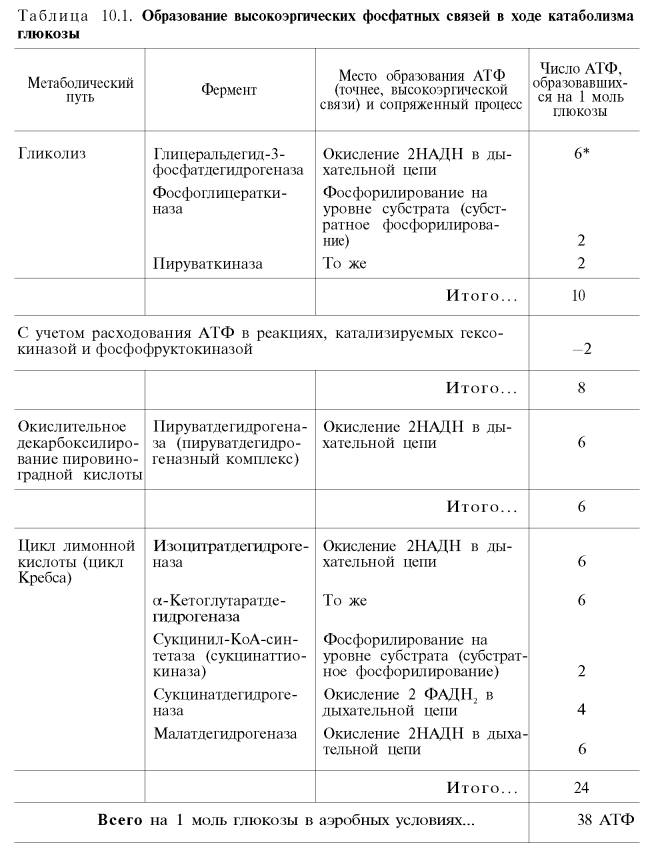
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД + и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
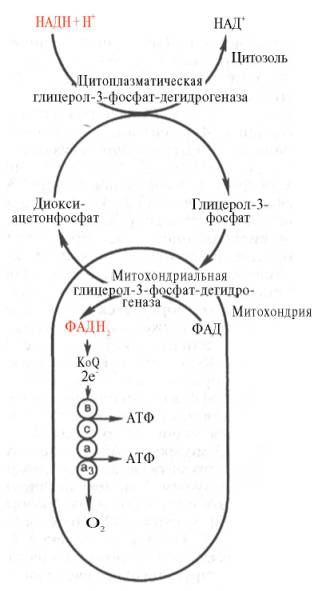
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулы НАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что сами молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Ци-топлазматический НАДН сначала реагирует с цитоплазматическим ди-гидроксиацетонфосфатом, образуя глицерол-3-фосфат. Реакция катализи-
Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
руется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутри митохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД Диоксиацетонфосфат + ФАДН2.
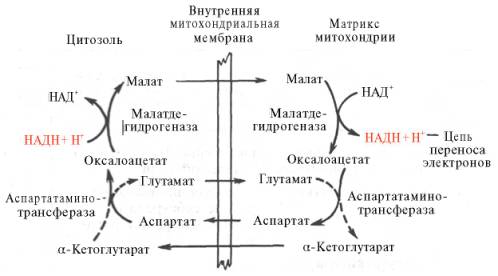
Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н + в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД + в цитозоле гли-церальдегид-3-фосфатом, образующимся при катаболизме глюкозы.
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.
★★★FITNESS LIVE★★★Спортивное питание
Корзина
Зарегистрируйтесь
Поиск
Fitness Live
Качественное спортивное питание доступное каждому! спортивное питание
Impakt.VPX
Купить спортивное питание.Протеин (белок, полипептиды) — органические вещества, состоящие из связанных в цепочку аминокислот, именно протеины составляют основу мышечной ткани. Мышечный рост предполагает положительный азотистый баланс. Кроме того под протеином …спортивное питание
Power Shock
Redline.VPX
Xtreme Thermogenic
MuscleMeds
Купить спортивное питание.Спортивное питание — это препараты и пищевые концентраты, разработанные для людей, энергично занимающихся спортом, и предназначенные для улучшения спортивных показателей: повышения силы и выносливости, увеличения мышечной массы и …спортивное питание
Syntha6
Купить спортивное питание.Протеин (белок, полипептиды) — органические вещества, состоящие из связанных в цепочку аминокислот, именно протеины составляют основу мышечной ткани. Мышечный рост предполагает положительный азотистый баланс. Кроме того под протеином …спортивное питание
Optimum Nutrition
Купить спортивное питание.Спортивное питание — это препараты и пищевые концентраты, разработанные для людей, энергично занимающихся спортом, и предназначенные для улучшения спортивных показателей: повышения силы и выносливости, увеличения мышечной массы и …спортивное питание
Anarchy VPX
Купить спортивное питание.Креатин или метил-гуанидо-уксусная кислота — азотсодержащая карбоновая кислота, которая участвует в энергетическом синтезе в мышечных и нервных клетках. В мире бодибилдинга, креатин широко применяется как спортивная добавка, для …спортивное питание
No Explode2
Nutrex Hemo Rage
Купить спортивное питание.Креатин или метил-гуанидо-уксусная кислота — азотсодержащая карбоновая кислота, которая участвует в энергетическом синтезе в мышечных и нервных клетках. В мире бодибилдинга, креатин широко применяется как спортивная добавка, для …спортивное питание
ALLMAX Nutrition
Купить спортивное питание.Спортивное питание — это препараты и пищевые концентраты, разработанные для людей, энергично занимающихся спортом, и предназначенные для улучшения спортивных показателей: повышения силы и выносливости, увеличения мышечной массы и …спортивное питание
All Max Nutrition Razor 8
Купить спортивное питание.Предтренировочные комплексы это разновидность спортивного питания применяемого в бодибилдинге, заключающее в своем составе ряд компонентов, которые делают тренировку более производительной, а также способствуют скорому восстановлению и мышечному росту. спортивное питание
Cellucor C4 Extreme
Купить спортивное питание.Креатин или метил-гуанидо-уксусная кислота — азотсодержащая карбоновая кислота, которая участвует в энергетическом синтезе в мышечных и нервных клетках. В мире бодибилдинга, креатин широко применяется как спортивная добавка, для …спортивное питание
Athletic Xtreme
Купить спортивное питание.Спортивное питание — это препараты и пищевые концентраты, разработанные для людей, энергично занимающихся спортом, и предназначенные для улучшения спортивных показателей: повышения силы и выносливости, увеличения мышечной массы и …спортивное питание
Заказ спортивного питания
Приглашаем к сотрудничеству оптовых покупателей для реализации продукции Fitness Live на очень выгодных условиях, высочайшее качество при очень низких ценах!
Цикл Кребса

Цикл Кребса — это ключевой этап дыхания всех клеток, т.е совокупность биохимических реакций, протекающих в клетках живых организмов, в ходе которых происходит окисление углеводов, липидов и аминокислот до углекислого газа и воды применяющих кислород, центр пересечения множества метаболических путей в организме. Кроме значительной энергетической роли циклу отводится также и основная пластическая функция, то есть это значительный источник молекул-предшественников, из которых в ходе других биохимических превращений синтезируются такие важные для жизнедеятельности клетки соединения как аминокислоты, углеводы, жирные кислоты и др.
Цикл превращения лимонной кислоты в живых клетках был открыт и изучен немецким биохимиком Хансом Кребсом, за эту работу он (совместно с Ф. Липманом) был удостоен Нобелевской премии (1953 год).
При работе цикла Кребса окисляются различные продукты обмена, в частности токсичные недоокисленные продукты распада алкоголя, поэтому стимуляцию цикла Кребса можно рассматривать как меру биохимической детоксикации.
Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса.
Функции
1. Интегративная функция — цикл является связующим звеном между реакциями анаболизма и катаболизма.
2. Катаболическая функция — превращение различных веществ в субстраты цикла:
o Жирные кислоты, пируват,Лей,Фен — Ацетил-КоА.
o Арг, Гис, Глу — α-кетоглутарат.
o Фен, тир — фумарат.
3. Анаболическая функция — использование субстратов цикла на синтез органических веществ:
o Оксалацетат — глюкоза, Асп, Асн.
o Сукцинил-КоА — синтез гема.
o CО2 — реакции карбоксилирования.
4. Водорододонорная функция — цикл Кребса поставляет на дыхательную цепь митохондрий протоны в виде трех НАДН.Н+ и одного ФАДН2.
5. Энергетическая функция — 3 НАДН.Н+ дает 7.5 моль АТФ, 1 ФАДН2 дает 1.5 моль АТФ на дыхательной цепи. Кроме того в цикле путем субстратного фосфорилирования синтезируется 1 ГТФ, а затем из него синтезируется АТФ посредствам трансфосфорилирования: ГТФ + АДФ = АТФ + ГДФ.
Вывод
Из всего выше сказанного следует что цикл Кребса является важным компонентом в производстве большого количества клеточной энергии. Использования цикла важно для обеспечения того, чтобы у вас было достаточное количество энергии в течение длительных тренировок. Потому что есть очень много шагов для повышения эффективности этого цикла, что выгодно спортсменов и бодибилдеров. Спортивные добавки могут способствовать аэробному производству энергии за счет увеличения скорости окислительного производства АТФ во время тренировки, и скорость восстановления после тренировки.
Цикл Кребса и бодибилдинг
Цикл Кребса является самой важной системой производства энергии в повседневной жизни. Он является основным производителем энергии в состоянии покоя и с низким уровнем умеренной интенсивности упражнений и большей продолжительностью упражнений. Повышения его эффективности в производстве большей энергии, может помочь вам, как культуристу получить больше, обеспечивая мышцам меньшую усталость и увеличение производительности. Сегодня производители спортивного питания предлагают большой выбор добавок на основе различных компонентов увеличивающих окислительные реакции в организме. Это различные виды креатинов, аргинина, и многое другое.
Купить спортивное питание Вы можете в интернет магазине спортивного питания Fitness Live
Регуляция гликолиза и цикл Кребса
Содержание
Регуляция гликолиза [ править | править код ]
В разных тканях гликолиз выполняет разные функции. В белых мышцах, сетчатке и эритроцитах в процессе гликолиза осуществляется анаэробный синтез АТФ, а в качестве побочного продукта образуется молочная кислота. При аэробном гликолизе в мышцах образуется пируват, который окисляется в цикле Кребса. Продукты цикла Кребса поступают в дыхательную цепь, и уже в ней синтезируется АТФ. В печени и жировой ткани в ходе аэробного гликолиза и пентозофосфатного пути образуется пируват, используемый для синтеза жирных кислот. Помните, что регуляция метаболических путей всегда имеет свою логику, именно функция процесса определяет способы его регуляции.
На стадии поступления глюкозы в клетку процесс гликолиза регулируется транспортерами глюкозы (ГЛЮТ), глюкокиназой или гексокиназой, фосфофруктокиназой-1, пируваткиназой и пируватдегидрогеназой.
Транспортеры глюкозы ГЛЮТ [ править | править код ]
Глюкоза поступает в клетку с помощью транспортеров глюкозы (ГЛЮТ). Существует несколько типов транспортеров глюкозы — ГЛЮТ1, ГЛЮТ2 и т.д. Все они расположены в плазматической мембране, кроме ГЛЮТ4, который регулирует поступление глюкозы в клетку и тем самым регулирует гликолиз в мышцах и жировой ткани. При голодании молекулы ГЛЮТ4 располагаются во внутриклеточных везикулах. После приема пищи под действием сигнала инсулина происходит перемещение ГЛЮТ4 в плазматическую мембрану, и клетка начинает интенсивно поглощать глюкозу.
Глюкокиназа и гексокиназа [ править | править код ]
Эти ферменты катализируют первую реакцию гликолиза — фосфорилирование глюкозы до глюкозо-6-фосфата. Гексокиназа содержится во многих тканях; у этого фермента низкое значение Km (т.е. высокое сродство к глюкозе). Гексокиназа по принципу обратной связи ингибируется продуктом реакции — глюкозо-6-фосфатом. Глюкокиназа содержится в печени и р-клетках поджелудочной железы. У глюкокиназы, напротив, высокое значение Km (т.е. низкое сродство к глюкозе). В печени она активна при высоких концентрациях глюкозы (до 15 ммоль/л), которая после приема углеводсодержащей пищи поступает из кишечника в печень по воротной вене печени. <Важно: глюкокиназа находится в печени.)
Фосфофруктокиназа-1 [ править | править код ]
Активация фосфофруктокиназы-1. Этот фермент активируется фруктозо-2,6-бисфосфатом (Ф-2,6-бисФ). Кроме того, АМФ также активирует фосфофруктокиназу-1. Высокие концентрации АМФ говорят о том, что клетка испытывает недостаток в энергии и требуется усилить синтез АТФ. Поэтому АМФ способствует интенсификации гликолиза.
(В печени образование фруктозо-2,6-бисфосфата активируется под действием инсулина и ингибируется под действием глюкагона. В скелетных мышцах образование этого вещества стимулируется высокой, а ингибируется низкой концентрацией фруктозо-6-фосфата.)
Ингибирование фосфофруктокиназы-1. Высокая концентрация АТФ ингибирует фосфофруктокиназу-1, и интенсивность гликолиза снижается. Кроме того, этот фермент ингибируется цитратом.
Пируваткиназа [ править | править код ]
Ингибирование пируваткиназы. В печени пируваткиназу ингибируют аланин и циклический АМФ. Эти вещества образуются при голодании. При голодании секретируется глюкагон, который стимулирует синтез циклического АМФ. Аланин же образуется при распаде мышечных белков при голодании и используется для синтеза глюкозы в процессе глюконеогенеза. При ингибировании пируваткиназы блокируется использование фосфоенолпирувата в гликолизе, и в клетке интенсифицируется глюконеогенез.
Активация пируваткиназы. В печени пируваткиназа активируется фруктозо-1,6-бисфосфатом (активация по принципу прямой связи). Этот процесс особенно важен при переходе от периода голодания к липогенезу. При голодании пируваткиназа неактивна, и в клетке интенсивно идет глюконеогенез, а при липогенезе пируваткиназа активируется.
Пируватдегидрогеназа [ править | править код ]
Пируватдегидрогеназа — комплекс из трех ферментов, который расположен в митохондриях. Он контролирует скорость поступления пирувата в цикл Кребса.
Активация пируватдегидрогеназы. После приема богатой углеводами пищи под действием инсулина происходит активация пируватдегидрогеназы в печени и жировой ткани, где пируват требуется для синтеза жирных кислот. Фермент также активируется своим субстратом (пируватом) и коферментами КоА и НАД+. Наконец, повышение концентрации АДФ также активирует пируватдегидрогеназу. Уровень АДФ повышается, когда клетка испытывает недостаток в энергии. Повышение концентрации АДФ свидетельствует о необходимости активации цикла Кребса и дыхательной цепи для синтеза АТФ.
Ингибирование пируватдегидрогеназы. Высокие концентрации АТФ ингибируют пируватдегидрогеназу, и окисление пирувата в цикле Кребса приостанавливается. Кроме того, активность фермента ингибируют продукты пируватдегидрогеназной реакции — ацетил-КоА и НАДН. Такая ситуация создается при голодании, когда в качестве источника энергии используются жирные кислоты, из которых образуется ацетил-КоА. В этом случае ингибирование пируватдегидрогеназы способствует сохранению пирувата для синтеза глюкозы. [Примечание: во время голодания пируват образуется из резервных запасов, т.е. из глюкозы, образующейся из гликогена и аминокислот, образующихся при распаде белков мышц.]
Регуляция цикла Кребса [ править | править код ]
В разных тканях цикл Кребса выполняет разные функции. Так, в мышцах и головном мозге в цикле Кребса ацетил-КоА окисляется с образованием НАДН и ФАДН2, которые используются для синтеза АТФ в дыхательной цепи. В печени при голодании ацетил-КоА не окисляется в цикле Кребса. Вместо этого цикл Кребса используется для синтеза малата из некоторых аминокислот, который превращается в оксалоацетат и вступает в глюконеогенез. После приема пищи ацетил-КоА в печени и жировой ткани поступает в цикл Кребса на очень короткий период. В первой реакции цикла он преобразуется в цитрат, затем экспортируется в цитозоль и используется для биосинтеза жирных кислот.
Изоцитратдегидрогеназа [ править | править код ]
Изоцитратдегидрогеназа ингибируется при высокой концентрации НАДН. Кофермент изоцитратдегидрогеназы — НАД+. Когда НАД+ восстанавливается до НАДН, изоцитратдегидрогеназа инактивируется, поскольку ее кофермент отсутствует.
Нарушения активности пируватдегидрогеназы [ править | править код ]
Недостаточность тиамина [ править | править код ]
В нервной ткани ведущую роль в синтезе АТФ играют гликолиз и дальнейший синтез ацетил-КоА в пируватдегидрогеназной реакции, который затем окисляется в цикле Кребса. Для нормального функционирования пируватдегидрогеназы необходим тиамин. При недостаточности тиамина активность фермента снижается, и нервная ткань испытывает недостаток в производимой энергии. Развиваются гиперлактатемия, заболевания нервной системы; в тяжелых случаях — болезнь Вернике, психоз Корсакова. Недостаточность тиамина наблюдается при хроническом алкоголизме, из-за плохого питания.
(Запомните, что, хотя ацетил-КоА может образовываться из жирных кислот независимо от пируватдегидрогеназной реакции, головной мозг не может использовать жирные кислоты в качестве источника энергии, поскольку они не проходят через гематоэнцефалический барьер.)
Болезнь Ли [ править | править код ]
Некоторые формы болезни Ли вызываются дисфункцией пируватдегидрогеназы.
Биологическое окисление. цикл Кребса, этапы, дыхательная цепь
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Биологическое окисление
Указанное выше уравнение для окислительно-восстановительной реакции представляет собой обобщенную форму, так как изображает процесс окисления субстратов как прямое дегидрирование, причем кислород выступает в роли непосредственного акцептора водорода. На самом деле кислород участвует в транспорте электронов иным образом. Существуют промежуточные переносчики при транспорте электронов от исходного донора электронов SH2 к терминальному акцептору – О2. Полный процесс представляет собой цепь последовательных окислительно-восстановительных реакций, в ходе которых происходит взаимодействие между переносчиками. Каждый промежуточный переносчик вначале выступает в роли акцептора электронов и протонов и из окисленного состояния переходит в восстановленную форму. Затем он передает электрон следующему переносчику и снова возвращается в окисленное состояние. На последней стадии переносчик передает электроны кислороду, который затем восстанавливается до воды. Совокупность последовательных окислительно-восстановительных реакций называется цепью переноса (транспорта) электронов, или дыхательной цепью:
Перенос электронов и протонов с участием промежуточных переносчиков. SH2 – исходный донор протонов и электронов; P – промежуточные переносчики; E1, E2, E3, E4 – ферменты окислительно-восстановительных реакций
Последовательность промежуточных переносчиков протонов и электронов в дыхательной цепи
Тип участвующей дегидрогеназы зависит от природы субстрата. Но каким бы ни был исходный субстрат, электроны и протоны от флавинов переносятся к коферменту Q, а дальше пути электронов и протонов расходятся. Электроны с помощью системы цитохромов достигают кислорода, который затем, присоединяя протоны, превращается в воду. Чтобы разобраться в системе транспорта электронов, необходимо познакомиться с отдельными ее участниками. NAD – зависимая дегидрогеназа катализирует реакции окисления непосредственно субстрата (первичная дегидрогеназа). NAD + является коферментом и выполняет роль акцептора водорода:
Символ 2Н + означает два электрона и два протона, обычно переносимые в виде гидрид иона. В этом случае вместо терминов «донор электронов» и «акцептор электронов» иногда используют термины «донор или акцептор водорода». FAD – зависимая дегидрогеназа также выполняет функцию первичной дегидрогеназы. Коферментом является FAD, который является акцептором водорода от субстрата. NADH – дегидрогеназа катализирует окисление NADH и восстановление убихинона (CoQ). Переносчиком водорода является кофермент – FMN (комплекс 1). В процессе реакции водород сначала присоединяется к FMN, соединенному с ферментом, а затем передается на убихинон. Флавиновые коферменты (FAD и FMN) прочно связаны с ферментом как простетические группы, поэтому ферменты, в состав которых они входят, называются флавопротеины. Флавинмононуклеотид (FMN), или рибофлавин фосфат, неразрывно связан с белковой частью фермента. Строго говоря, FMN не является нуклеотидом, так как флавиновая часть связана с рибитолом, а не с рибозой.
Убихинон (кофермент Q) – производное изопрена:
Название «убихинон» возникло из-за его повсеместной распространенности в природе. Кофермент Q действует как переносчик электронов на цитохромы.
Цитохромы – это гемопротеины – белки, содержащие в качестве прочно связанной простетической группы гем:
Простетическая группа гема в структуре цитохромов
Атом железа в геме может менять валентность, присоединяя или отдавая электроны.В дыхательной цепи цитохромы служат переносчиками электронов и располагаются соответственно величине окислительно-восстановительного потенциала следующим образом: B, С1, С, а, а3. Гемовые группы цитохромов связаны с белковой частью донорно-акцепторными связями между ионом железа и соответствующими аминокислотными остатками:
Связывание гема с белковой частью цитохрома С
В цитохромах С и С1 дополнительные ковалентные связи формируются между тиогруппами цистеина и боковыми винильными группами гема. QН2-дегидрогеназа (комплекс III) представляет собой комплекс цитохромов b и С1. Этот фермент катализирует окисление восстановленного кофермента Q и перенос электронов на цитохром С. Электроны последовательно переносятся атомами железа цитохромов b и С1, а затем поступают на цитохром С. Протоны после окисления QH2 освобождаются в раствор.
Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов.
Цитохромоксидаза переносит электроны с цитохрома С на кислород. В переносе электронов участвуют сначала ионы железа цитохромов а и а3, а затем ион меди цитохрома а3. Молекула кислорода связывается с железом в геме цитохрома а3. Следовательно, переход электронов на кислород с иона меди цитохрома а3, происходит на молекуле фермента. Каждый из атомов молекулы кислорода присоединяет по два электрона и протона, образуя при этом молекулу воды.
Белки, содержащие негеминовое железо. Некоторое количество атомов железа в митохондриях связано не в геме цитохромов, а образует комплексы с другими белками. Эти белки называют также железосерными, так как атомы железа связаны с атомами серы цистеиновых остатков. Белки, содержащие негеминовое железо, участвуют в переносе электронов на нескольких стадиях, однако, не совсем ясны их локализация и механизм действия.
Биологическое окисление. Синтез АТФ
Во внутренней мембране митохондрий расположен интегральный белковый комплекс – Н+-зависимая АТФ-синтаза seu Н+-зависимая АТФ-аза (два разных названия связаны с полной обратимостью катализируемой реакции), обладающий значительной молекулярной массой – более, чем 500кДа. Состоит из двух субъединиц: FO и F1.
F1 представляет из себя грибовидный вырост на матриксной поверхности внутренней митохондриальной мембраны, FO же пронизывает эту мембрану насквозь. В толще FO расположен протонный канал, позволяющий протонам возвращаться обратно в матрикс по градиенту их концентраций.
F1 способна связывать АДФ и фосфат на своей поверхности с образованием АТФ – без затраты энергии, но обязательно в комплексе с ферментом. Энергия необходима лишь для освобождения АТФ из этого комплекса. Эта энергия выделяется в результате тока протонов через протонный канал FO.
В дыхательной цепи сопряжение абсолютно: ни одно вещество не может окисляться без восстановления другого вещества.
Но при синтезе АТФ сопряжение одностороннее: окисление может идти без фосфорилирования, а фосфорилирование без окисления никогда не идёт. Это означает, что система МтО может работать без синтеза АТФ, но АТФ не может быть синтезирована, если не работает система МтО.
Биологическое окисление. Сопряжение работы дыхательной цепи с процессом синтеза АТФ
Существование такого сопряжения доказывается тем, что можно ингибировать образование АТФ, не нарушая процесса транспорта электронов. Это достигается добавлением химических веществ, названных разобщителями. После удаления разобщителей синтез АТФ восстанавливается.
Существует несколько гипотез, объясняющих механизм сопряжения. Одной из них является хемоосмотическая теория. Цепь транспорта электронов функционирует как протонная (Н + )помпа, осуществляя перенос протонов из матрикса через внутреннюю мембрану в межмембранное пространство. Эндоэргический процесс выброса протонов из матрикса возможен за счет экзоэргических окислительно-восстановительных реакций дыхательной цепи. Перенос протонов приводит к возникновению разности концентрации Н + с двух сторон митохондриальной мембраны: более высокая концентрация будет снаружи и более низкая – внутри. Митохондрия в результате переходит в «энергизованное» состояние, так как возникает градиент концентрации Н + и одновременно разность электрических потенциалов со знаком плюс на наружной поверхности.
С опряжение цепи транспорта электронов и фосфорилирования ADP посредством протонного градиента
С труктура компонентов комплекса I, обеспечивающего функционирование «протонной помпы» при окислении NADH
Биологическое окисление. ОСНОВНЫЕ ПРОЦЕССЫ, ДЛЯ КОТОРЫХ ИСПОЛЬЗУЕТСЯ ЭНЕРГИЯ АТФ:
1. Синтез различных веществ.
2. Активный транспорт (транспорт веществ через мембрану против градиента их концентраций). 30% от общего количества расходуемого АТФ приходится на Na+,К+-АТФазу.
3. Механическое движение (мышечная работа).
Биологическое окисление. Цикл Кребса
Основной функции Цикла Кребса является образование водородных эквивалентов, которые в цепи окислительного фосфорилирования обеспечивают синтез макроэргических соединений.
Кроме того, ЦТК выполняет ведущую роль в процессах глюконеогенеза, переаминирования, дезаминирования АК, липогенеза и синтеза гема. Интегрирует все виды обмена веществ.
Регуляция Цикла Кребса. Осуществляется с участием 4 регуляторных ферментов: цитратсинтазы, изоцитрат ДГ, α-КГ ДГ и СДГ. Цикл Кребса ингибируется в основном НАДН2 и АТФ, которые являются продуктами ЦТК и цепи окислительного фосфорилирования. Активируют цикл Кребса в основном НАД + и АДФ.
Биологическое окисление. Реакции цикла Кребса
1). Цитратсинтаза локализуется в матриксе митохондрий, ее активируют ЩУК, НАД + ; ингибируют АТФ, НАДН2, Сукцинил-КоА, цитрат.
2). Аконитаза локализуется в матриксе митохондрий.
3). Окислительно-восстановительная реакция, самая медленная в ЦТК.
4). Окислительно-восстановительная реакция.
5). Реакция субстратного фосфорилирования
6). Окислительно-восстановительная реакция.
Сукцинатдегидрогеназа, флавопротеин содержащий Fe2S2, связана с внутренней мембраной митохондрии. СДГ ингибирует ЩУК и Сукцинил-КоА,
7). Фумараза локализуется в матриксе митохондрий.
8). Окислительно-восстановительная реакция.
Малат ДГ локализуется в матриксе митохондрий.
Образовавшиеся молекулы ЩУК реагируют с новой молекулой Ацетил-КоА и цикл повторяется вновь.
Биологическое окисление. Энергетический баланс одного оборота ЦТК
В 4 окислительно-восстановительных реакциях ЦТК образуются 3 НАДН2 и 1 ФАДН2, которые направляются далее в дыхательную цепь окислительного фосфорилирования. В процессе окислительного фосфорилирования ДЦ из 1 НАДН2 образуется 3 АТФ, из 1 ФАДН2 – 2 АТФ. Из 1 ГТФ, образующейся в ЦТК за счет субстратного фосфорилирования, синтезируется 1 АТФ. Таким образом, за 1 цикл ЦТК из 3 НАДН2, 1 ФАДН2 и 1 ГТФ получается 12 АТФ.
Биологическое окисление. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ (ЦТК, лимоннокислый цикл, цикл Кребса)
ЦТК, как и реакции митохондриального окисления, протекает в митохондриях. Представляет собой серию реакций, замкнутых в цикл.
Образовавшиеся молекулы ЩУК реагируют с новой молекулой Ацетил-КоА и цикл повторяется вновь от образования цитрата до его превращения в ЩУК.
В реакциях этого цикла участвуют четыре из девяти субстратов МтО.
Происходит серия дегидрогеназных реакций. Из них 3-я, 4-я и 8-я происходят с участием НАД-зависимых дегидрогеназ, и каждая из этих реакций позволяет получить 3 молекулы АТФ. На 6-й стадии происходит ФАД-зависимая дегидрогеназная реакция, которая сопряжена с образованием 2-х молекул АТФ (Р/О = 2).
На 5-й стадии 1 молекула АТФ образуется путем субстратного фосфорилирования.
Итого за 1 оборот ЦТК образуется 12 молекул АТФ.
Смысл ЦТК заключается в том, чтобы остатки уксусной кислоты расщепились с образованием большого количества АТФ. Кроме того, из ацетатных остатков образуется СО2 и Н2О, как конечные продукты обмена веществ.
СО2 образуется в ходе ЦТК дважды:
1. на третьей стадии (окисление изоцитрата)
2. на четвертой стадии (окисление альфа-кетоглутарата).
Если прибавить еще 1 молекулу СО2, которая образуется до начала ЦТК – при превращении ПВК в Ацетил-КоА, то можно говорить о трех молекулах СО2, образующихся при распаде ПВК. Суммарно эти молекулы, образующиеся при распаде ПВК, составляют до 90% углекислоты, которая выводится из организма.
ИТОГОВОЕ УРАВНЕНИЕ ЦТК
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЦТК
ГЛАВНАЯ РОЛЬ ЦТК – ОБРАЗОВАНИЕ БОЛЬШОГО КОЛИЧЕСТВА АТФ.
1. ЦТК – главный источник АТФ. Энергию для образования большого количества АТФ дает полный распад Ацетил-КоА до СО2 и Н2О.
2. ЦТК – это универсальный терминальный этап катаболизма веществ всех классов.
3. ЦТК играет важную роль в процессах анаболизма (промежуточные продукты ЦТК):
АВТОНОМНАЯ САМОРЕГУЛЯЦИЯ ЦТК
В ЦТК два ключевых фермента:
Оба фермента аллостерически ингибируются избытком АТФ и НАДН2. Изоцитратдегидрогеназа сильно активируется АДФ. Если АДФ нет, то этот фермент неактивен. В условиях энергетического покоя концентрация АТФ увеличивается, и скорость реакций ЦТК мала – синтез АТФ уменьшается.
Изоцитратдегидрогеназа ингибируется АТФ намного сильнее, чем цитратсинтаза, поэтому в условиях энергетического покоя повышается концентрация цитрата, и он выходит в цитоплазму по градиенту концентраций путем облегченной диффузии. В цитоплазме цитрат превращается в Ацетил-КоА, который участвует в синтезе жирных кислот.
Биологическое окисление. ЭНЕРГЕТИЧЕСКИЙ ЗАРЯД КЛЕТКИ (ЭЗК)
Многие процессы метаболизма регулируются соотношением АТФ/АДФ. Это соотношение характеризует энергетический статус (состояние) клетки (Энергетический Заряд Клетки).
Теоретически ЭЗК может меняться от 0 до 1. Обычно в норме величина ЭЗК поддерживается в клетке в пределах 0.85-0.90.
ОБРАТИТЕ ВНИМАНИЕ! Метаболические пути, приводящие к образованию АТФ, ингибируются высоким ЭЗК; метаболические пути, ведущие к использованию АТФ, активируются высоким ЭЗК.
Биологическое окисление. ЧЕЛНОЧНЫЕ МЕХАНИЗМЫ ПЕРЕНОСА ВОДОРОДА
Никотинамидные дегидрогеназы находятся не только в матриксе митохондрий, но и в цитозоле. Митохондриальная мембрана непроницаема для НАД, поэтому НАДН2, который образуется в цитозоле, может передать свой водород в митохондрию только с помощью специальных субстратных ЧЕЛНОЧНЫХ МЕХАНИЗМОВ. В митохондрию из цитозоля передается не сам НАДН2, а только водород, отнятый от него. Переносимый водород включается в молекулу вещества-челнока, способного проникать через митохондриальную мембрану. В митохондрии вещество-челнок отдает водород на митохондриальный НАД или ФАД и возвращается обратно в цитозоль.

1. МАЛАТ-АСПАРТАТНЫЙ челнок (наиболее универсален для клеток организма). С высокой скоростью работает в миокарде, почечной ткани, печени.
В этой транспортной системе водород от цитоплазматического НАД передается на митохондриальный НАД(!), поэтому в митохондриях образуется 3 молекулы АТФ и не происходит потери энергии при переносе водорода. Для ткани печени малат-аспартатная система особенно важна, так как из митохондрии выводится Ацетил-КоА (в виде цитрата), а водород попадает в митохондрию (в составе малата).

ЩУК может вернуться в цитоплазму и другим способом: она может вступить в реакцию трансаминирования с глутаминовой кислотой (СМОТРИТЕ РИСУНОК)
2. ГЛИЦЕРОФОСФАТНЫЙ челнок (встречается реже).

В клетке существует не только челночный транспорт водорода от цитоплазматического НАД к митохондриальному. Происходит и обратный транспорт Ацетил-КоА из митохондрий в цитоплазму в виде цитрата. В цитоплазме Ацетил-КоА может быть использован для синтеза жирных кислот.
Биологическое окисление. Пути использования кислорода
Биологическое окисление. Историческая справка
Изучение окисления в организме было начато в 18 в. А. Лавуазье; в дальнейшем значительный вклад в исследование БО (его локализация в живых клетках, связь с др. процессами обмена веществ, механизмы ферментативных окислительно-восстановительных реакций, аккумуляция и превращение энергии и др.) внесли О. Варбург, Г. Виланд (Германия), Д. Кейлин, Х. Кребс, П. Митчелл (Великобритания), Д. Грин, А. Ленинджер, Б. Чанс, Э. Рэкер (США), а в СССР – А. Н. Бах, В. И. Палладин, В. А. Энгельгардт, С. Е. Северин, В. А. Белицер, В. П. Скулачев и др.
В 1777г французский химик Антуан Лоран Лавуазье (1743-1794), впервые правильно истолковал явление горения как процесс соединения веществ с О2. Так как горение и дыхание сопровождаются потреблением О2 и выделение СО2, он предположил что, в их основе лежит один процесс. Однако у дыхания были существенные отличия от горения: оно шло при низкой температуре, без пламени и в присутствии воды.
В конце XIX века русские исследователи А.Н. Бах и В.И. Палладин, работая независимо друг от друга, предложили 2 основные теории для объяснения процессов, протекающих в ходе биологического окисления.
В 1897г Алексей Николаевич Бах (1857-1946) сформулировал «перекисную теорию окисления», согласно которой молекула О2 сначала активируется. Активация О2 происходит в результате разрыва одной его связи (-О-О-) и присоединения к органическим веществам – оксидазам. Активированный О2 при взаимодействии с окисляемым веществом образует перекись.
Теория «перекисного окисления» Баха нашла свое подтверждение, однако главный механизм БО оказался иным.
Важнейшая заслуга в развитии учения о БО принадлежит русскому ученому ботанику и биохимику В.И. Палладину (1859-1922), который создал теорию «активации водорода». Он предположил, что окисление субстратов может происходить в 2 фазы:
1). Анаэробная фаза. В этой фазе особые вещества хромогены (R) отщепляют Н от субстратов и восстанавливаются (RH2).
2). Аэробная фаза. Восстановленные хромогены RH2 передают Н на О2.
В последствии теория В.И. Паладина подтвердилась для процессов митоходриального окисления, а хромогены, принимающие участие в отнятии водорода от субстратов, в настоящее время называются ферментами дегидрогеназами.
Биологическое окисление. Современные представления
Согласно современной теории БО:
Окислительно-восстановительные реакции (ОВР) – реакции, в которых меняется степень окисления субстрата за счет присоединения/отщепления: 1) 1 е – ; 2) 2е – и 2Н + ; 3) атомов кислорода.
Биологическое окисление (БО) совокупность окислительно-восстановительных реакций, которые протекают во всех живых клетках.
Субстрат БО – вещество, способное отдавать электрон. (Любые вещества, способные вступать в реакции окисления).
Тканевое дыхание – окисление органических веществ в клетках, сопровождающееся потреблением О2 и выделением воды.
Субстрат тканевого дыхания – это вещество, которое отдает электрон непосредственно в цепь окислительного фосфорилирования. (Например, НАДН2, ФАДН2).
Дыхательная цепь – цепь переноса электронов. В переносе электронов от субстратов БО к О2 принимают участие: 1) НАД и НАДФ зависимые ДГ; 2) ФАД и ФМН зависимые ДГ; 3) цитохромы; 4) коэнзим Q; 5) белки, содержащие негеминовое железо.
Свободная энергия. Каждое органическое вещество обладает определенным запасом внутренней энергии (Е). Часть этой внутренней энергии может быть использована для совершения полезной работы, такую энергию называют свободной (G). Направление химической реакции определяется значением ∆G. У катаболических реакций ∆G отрицательно, эти реакции протекают самопроизвольно (экзергонические реакции). У анаболических реакций ∆G положительно, они протекают только при поступлении свободной энергии извне (эндергонические реакции).
Редокс-потенциалы. В каждой окислительно-восстановительной системе участвует окисленная и восстановленная формы одного соединения, которые образуют сопряженную окислительно-восстановительную или редокс-пару. Разные редокс-пары обладают различным сродством к электрону. Мерой сродства редокс-пары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Ео‘), величина которого прямо пропорциональна изменению свободной энергии ∆G. Величину Ео‘ выражают в вольтах; чем она отрицательнее, тем меньше сродство вещества к электронам и наоборот.
Биологическое окисление. Этапы унифицирования энергии пищевых веществ и образования субстратов тканевого дыхания
Образование субстратов тканевого дыхания осуществляется в несколько этапов:
1. При переваривании в ЖКТ происходит гидролиз полимеров (белков, полисахаридов) и ТГ до мономеров, которые потом всасывающихся в кровь и включающихся в промежуточный обмен.
2. В ходе катаболизма мономеры (моносахара, жирные кислоты и аминокислоты) превращаются в универсальное вещество – Ацетил-КоА (исключение некоторые АК).
3. Ацетил-КоА поступает в ЦТК, где из него в последовательных реакциях образуются субстраты тканевого дыхания: изоцитрат, α-КГ, сукцинат и малат.
4. Окисление субстратов тканевого дыхания сопровождается восстановлением коферментов НАДН2 и ФАДН2, которые затем отдают протоны в редокс-цепь окислительного фосфорилирования.
Биологическое окисление. Пути использования кислорода в клетке
В настоящее время выделено 4 основные пути использования кислорода в организме:
1. Оксидазный путь – окислительное фосфорилирование. Протекает в митохондриях, является основным источником АТФ в аэробных тканях. Потребляет 90% кислорода.
2. Монооксигеназный путь. Обеспечивает включение 1 атома кислорода в молекулу субстрата. Используется для синтеза новых веществ (стероидные гормоны), обезвреживания ксенобиотиков и токсических продуктов обмена в митохондриях и ЭПР.
3. Диоксигеназный путь. Обеспечивает включение молекулы кислорода в молекулу субстрата. Используется для деградации АК и синтеза новых веществ.
4. Пероксидазный и радикальный пути. Кислород участвует в образовании перекисей и активных радикалов, которые необходимы в пероксисомах для внутриклеточного пищеварения, разрушения макрофагами бактерий, вирусов, регуляции метаболизма и т.д. Перекиси и активные кислородные радикалы оказывают также повреждающее воздействие на структуры клеток и тканей, активируя ПОЛ. Разрушение перекисей и инактивация свободных радикалов осуществляется с помощью ферментативной и неферментативной антиокидантной системы.
Биологическое окисление. Типы оксидоредуктаз
В соответствие с путями потребления кислорода и катализируемыми реакциями, все оксидоредуктазы разделены на 5 групп:
1). Оксидазы удаляют Н из субстрата (S), используя в качестве акцептора Н только О2, продуктом реакции является вода. Все оксидазы содержат медь. Например, цитохромоксидаза, последний фермент дыхательной цепи.
2). Аэробные дегидрогеназы, или ФАД зависимые оксидазы, относятся к металлофлавопротеинам (ФАД, ФМН, Fe, Cu, Mo), находятся в пероксисомах и наружной мембране митоходрий. Они отнимают Н от субстрата, и передают его на О2 с образованием перекиси. Дегидрогеназа L-аминокислот (оксидаза L-аминокислот) в почках осуществляет окислительное дезаминирование. Ксантиндегидрогеназа (ксантиноксидаза) превращает пурины в мочевую кислоту. Моноаминоксидазы (МАО) окисляют гормон адреналин и некоторые биогенные амины. Диаминоксидазы (ДАО) окисляют гистамин и другие диамины и полиамины. Образующаяся перекись бактерицидное действие.
3). Анаэробные дегидрогеназы многочисленная группа, содержат в качестве коферментов НАДН2, НАДФН2, ФАД, ФМН, цитохромы. Они удаляют Н из субстрата, не используя в качестве акцептора протона О2. Анаэробные дегидрогеназы выполняют две главные функции: перенос Н с одного субстрата на другой в сопряженной ОВР и транспорт электронов в дыхательной цепи. Примеры ферментов: изоцитрат ДГ (НАДН2), сукцинат ДГ (ФАДН2), цитохромы в, с1, с, а и а3.
4). Оксигеназы. Включают кислород в молекулу субстрата. Работают в составе мультиферментного комплекса, содержащего ФАД зависимую ДГ, Fe2S2-белок, цитохромы Р450 или В5. Этот комплекс встроен в мембрану ЭПР или внутреннюю мембрану митохондрий.
а) Монооксигеназы. Обеспечивают включение 1 атома кислорода в молекулу субстрата. В качестве восстановителей (R) используется НАДФН2, НАДН2 и аскорбат. Участвуют в синтезе стероидных гормонов, обезвреживании ксенобиотиков. Фен-4-монооксигеназа окисляет фен в тир. Пролингидроксилаза (аскорбат) гидроксилирует пролин в проколлагене.
б) Диоксигеназы. Обеспечивают включение молекулы кислорода в молекулу субстрата, окисляют циклические соединения с разрывом цикла. Например, триптофаноксигеназа, превращает триптофан в фенилкенуренин.
5). Гидроксипероксидазы разрушают перекиси водорода и органические перекиси. Ферменты пероксидаза и каталаза. Пероксидазы, содержат протогем, восстанавливают перекись до воды за счет хинонов, аскорбата или цитохрома с. Глутатионперосидаза, содержит селен, восстанавливает перекись до воды за счет глутатиона.
Биологическое окисление. Варианты дыхательной цепи
1. ПОЛНАЯ ДЫХАТЕЛЬНАЯ ЦЕПЬ
В этой цепи окисляется небольшое количество субстратов, из которых главными являются четыре. Коэффициент Р/О=3.
| СУБСТРАТЫ | НИКОТИНАМИДНЫЕ ФЕРМЕНТЫ, ИХ ОКИСЛЯЮЩИЕ |
| изолимонная кислота (изоцитрат) | Изоцитратдегидрогеназа |
| Яблочная кислота (малат) | Малатдегидрогеназа |
| Глутаминовая кислота (глутамат) | Глутаматдегидрогеназа |
| бета-гидроксиацил-КоА | бета-гидроксиацил-КоА-дегидрогеназа |
Все ферменты полной цепи являются НАД-зависимыми дегидрогеназами.
2. СОКРАЩЕННАЯ (УКОРОЧЕННАЯ) ДЫХАТЕЛЬНАЯ ЦЕПЬ
Известны два субстрата. Главным из них является сукцинат (янтарная кислота).
Сукцинатдегидрогеназа – это комплекс II, который в укороченном варианте цепи является начальным звеном окисления. В составе комплекса – простетическая группа ФАД и FeSII. От ФАД.Н2 два атома водорода переносятся на KoQ. Значит, первое звено, которое имеется в полной цепи – исключается. Перепад окислительно-восстановительного потенциала между ФАД и KoQ невелик. Поэтому переноса H+ в межмембранное пространство в этой точке не происходит. DmH+ также создается, но меньший, чем в полной цепи. Значит, меньше и эффективность фосфорилирования – коэффициент Р/О=2.
Аналогичным образом окисляется и второй субстрат – ацил-КоА (активная форма любой жирной кислоты):
3. МАКСИМАЛЬНО СОКРАЩЕННАЯ (МАКСИМАЛЬНО УКОРОЧЕННАЯ) ДЫХАТЕЛЬНАЯ ЦЕПЬ.
Она представлена только цитохромной частью. Эксперименты показали, что здесь может быть окислен только один субстрат – аскорбиновая кислота, с участием фермента, восстановленные эквиваленты включаются в цепь на уровне цитохрома С цитохромоксидазы (цитохром аа3), но в реальных условиях такого окисления практически не происходит. Образуется вода и 1 молекула АТФ. Коэффициент Р/О=1.
Возможность такого окисления доказана в эксперименте in vitro. А в живой клетке аскорбиновая кислота обычно используется как донор водорода в системе окисления оксигеназного типа (реакции, катализируемые монооксигеназами: смотрите лекцию «Внемитохондриальное окисление»). Такие реакции с участием витамина «С» особенно важны для формирования белка коллагена, в котором за счет монооксигеназной реакции образуется гидроксипролин.
Биологическое окисление. ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРОВИНОГРАДНОЙ И a-КЕТОГЛУТАРОВОЙ КИСЛОТ В МИТОХОНДРИЯХ
Этот вариант дыхательной цепи удлинен по сравнению с полной цепью за счет того, что первое звено катализируется не никотинамидным ферментом, а мультиферментным комплексом. Это единая надмолекулярная структура. В состав этого комплекса входят 3 фермента и 5 коферментов. Такой комплекс называется мультиферментным комплексом окислительного декарбоксилирования a-кетокислот, и он окисляет два субстрата:
1. Пировиноградную кислоту (пируват, ПВК)
Окисляется с помощью ферментов пируватдегидрогеназного комплекса;
2. a-кетоглутаровую кислоту (a-КГ)
Окисляется с помощью ферментов a-кетоглутаратдегидрогеназного комплекса.
Оба комплекса ферментов работают одинаково. Они катализируют реакции окислительного декарбоксилирования соответствующей a-кетокислоты.
Биологическое окисление. ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРУВАТА
1-ю реакцию катализирует фермент ПИРУВАТДЕКАРБОКСИЛАЗА (Е1).
Простетической группой пируватдекарбоксилазы является тиаминдифосфат (ТПФ, тиаминпирофосфат, ТДФ) – это активная форма витамина В1. Активная часть ТПФ – тиазоловое кольцо и атом водорода в нем. Для краткости записывают: НС-ТПФ.
Пируватдекарбоксилаза отщепляет CO2, а оставшаяся оксиэтильная группа присоединяется к ТПФ.
2-ю и 3-ю реакцию процесса катализирует фермент АЦИЛТРАНСФЕРАЗА (Е2). Простетическая группа ацетилтрансферазы – амид липоевой кислоты. Катализирует перенос оксиэтильного остатка на свой собственный кофермент (строение ЛК знать описательно по учебнику). В ее составе есть дисульфидная связь.
На этом этапе уже произошло окисление оксиэтильного остатка до остатка уксусной кислоты, одновременно с этим началось восстановление липоевой кислоты.
3 этап – продолжает работать фермент ацилтрансфераза.
Выяснено, что этот фермент переносит не только остатки уксусной кислоты, но и остатки других кислот (нециклических). Поэтому его еще называют коферментом ацилирования.
Второй фермент данного комплекса является не только ацетилтрансферазой, но и окислительным ферментом одновременно (дегидрогенизирующая ацетилтрансфераза).
Энергия этого окисления аккумулируется в виде макроэргической связи активной формы уксусной кислоты (ацетил-КоА).
4 этап катализируется ферментом ДИГИДРОЛИПОИЛДЕГИДРОГЕНАЗОЙ.
Кофермент этого этапа – особый ФАД с низким окислительно-восстановительным потенциалом (обозначается как ФАД’). Переносит протоны и электроны с дигидролипоата на НАД – последний кофермент в описанном комплексе.
В итоге можем записать суммарное уравнение:
Аналогично действует ферментный комплекс для окислительного декарбоксилирования a-кетоглутарата. Но названия двух из трех ферментов другие:
1-й фермент – декарбоксилаза a-кетоглутаровой кислоты
2-й фермент – сукцинилтрансфераза (переносит остаток янтарной кислоты)
Суммарное уравнение для этого комплекса:
В результате действия этих двух комплексов, каждый из двух приведенных субстратов (ПВК и a-КГ) – теряют СО2, два протона и два электрона, которые передаются на кислород с образованием Н2О и параллельно происходит фосфорилирование трех молекул АТФ. Сами субстраты превращаются в итоге в активную форму соответствующей кислоты.
Макроэргическая связь в молекулах этих активных форм может легко трансформироваться в макроэргическую связь молекулы АТФ. Например, для молекулы сукцинил-КоА:
Такой способ образования АТФ, когда нет сопряжения с процессами окисления, называется СУБСТРАТНЫМ ФОСФОРИЛИРОВАНИЕМ (при этом используется макроэргическая связь в молекуле какого-нибудь субстрата). В организмах высших животных и человека этот путь получения АТФ не является главным. Благодаря такому механизму окислительное декарбоксилирование a-кетокислот может считаться энергетически более выгодной, потому что образуется вещество с макроэргической связью – ацетил-КоА. Некоторые синтетазы используют макроэргические связи из Ацетил-КоА или Сукцинил-КоА для реакций биосинтеза.
Например, при синтезе гема гемоглобина используется часть молекул сукцинил-КоА:
Большая часть будет все же использоваться для синтеза ГТФ.
Другой продукт окислительного декарбоксилирования (Ацетил-КоА) может расходоваться в реакциях синтеза жирных кислот, холестерина, стероидов. А самая большая часть этого вещества используется при синтезе лимонной кислоты в реакциях Цикла Трикарбоновых Кислот.
Биологическое окисление. ЭНЕРГЕТИЧЕСКИЙ ИТОГ УДЛИНЕННОЙ ЦЕПИ.
Образуются 3 молекулы АТФ путем окислительного фосфорилирования. Продукты окислительного декарбоксилирования (ацетил-КоА и сукцинил-КоА) содержат макроэргическую связь. Энергия макроэргической связи сукцинил-КоА используется двумя способами.
Энергия макроэргической связи Ацетил-КоА используется только в реакциях синтеза:
Среди субстратов МтО почти нет веществ, которые организм получает с пищей – только глутаминовая кислота.
Субстраты МтО – в основном органические кислоты, которые образуются в организме в процессе катаболизма. В процессе катаболизма из большого количества разнообразных пищевых веществ образуется всего 2 вида общих метаболитов: Ацетил-КоА и ПВК.
Биологическое окисление. Пути использования кислорода
Биологическое окисление. ОКСИГЕНАЗНЫЙ ПУТЬ
Оксигеназы это ферменты, которые катализируют включение кислорода в молекулу субстрата. Оксигеназы работают в составе мультиферментных комплексов, встроенных в мембрану и участвуют в синтезе и деградации многих типов метаболитов. По способу включения кислорода их делят на: монооксигеназы и диоксигеназы.
Монооксигеназные реакции
Монооксигеназы это ферменты, которые включают в субстрат только один атом молекулы кислорода. Другой атом кислорода восстанавливается до воды с участием электронов и протонов НАДФН2, НАДН2, реже витамин С:
Монооксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР, их называют микросомальным окислением, и на внутренней поверхности внутренней мембраны митохондрии.
1. Микросомальные монооксигеназные системы
Катализируют низкоспецифичные реакции. Эти монооксигеназы функционируют в комплексе с различными ЦПЭ:
А. Цепь НАДФН2-Р450 редуктаза – Цитохром Р450
Донорами протонов и электронов для этой цепи являются НАДФН2.
Субстратами являются гидрофобные вещества экзогенного (лекарства, ксенобиотики) и эндогенного (стероиды, жирные кислоты и т.д.) происхождения.
Регуляция активности осуществляется индукцией синтеза ферментов. Открыто более 250 веществ-индукторов (барбитураты, спирты, кетоны, стероиды, ароматические углеводороды).
.НАДФН2-Р450 редуктаза. Цитозольный домен содержит 2 кофермента ФАД и ФМН, гидрофобный домен фиксирует фермент в мембране. НАДФН2-Р450 редуктаза переносит электроны с НАДФН2 на цитохром Р450.
Цитохром Р450 – интегральный гемопротеин, содержит простетическую группу гем, имеет участки связывания для О2 и субстрата. Открыто 150 генов, кодирующих различные изоформы цитохрома Р450. Каждая из изоформ Р450 имеет много субстратов и отличается от других изоформ Р450 только белковой частью.
Б. Цепь НАДН2-цитохром b5 редуктаза – Цитохром b5 – стеароил-КоА-десатураза
Донорами протонов и электронов для этой цепи являются НАДН2.
НАДН2-цитохром b5 редуктаза – двухдоменный белок, цитозольный домен содержит ФАД, гидрофобный домен фиксирует фермент в мембране. НАДН2-b5 редуктаза переносит электроны с НАДН2 на цитохром b5.
Цитохром b5. Цитозольный домен содержит гем, гидрофобный домен фиксирует фермент в мембране. Цитохром b5 может передавать свои электроны на различные ферменты (цитохром Р450, Стеароил-КоА-десатуразу и т.д.), образуя различные ЦПЭ, при этом он участвует в десатурации и элонгации жирных кислот, в синтезе холестерина, плазминогенов и церамида.
Стеароил-КоА-десатураза – интегральный фермент, содержит негеминовое железо. Катализирует образование 1 двойной связи между 9 и 10 атомами углерода в жирных кислотах. Стеароил-КоА-десатураза переносит электроны с цитохрома b5 на 1 атом кислород, при участии протонов этот кислород образует воду. Второй атом кислорода включается стеариновую кислоту с образованием её оксиацила, который дегидрируется до олеиновой кислоты.
Биологическое окисление. Митохондриальные монооксигеназные системы
Митохондриальные монооксигеназные системы локализованы на внутренней поверхности внутренней мембране митохондрий и катализируют высокоспецифичные реакции.
Компонентами этих систем могут быть: НАДН2-зависимые ФАД-содержащее редуктазы, Fe2S2-белки (адренодоксин), цитохромы Р450, b5, элонгазы и т.д.
Митохондриальные монооксигеназные системы:
· в коре надпочечников, семенниках, яичниках и плаценте участвуют в синтезе стероидных гормонов из холестерина (гидроксилирование по С22 и С20 при отщеплении боковой цепи и по положениям 11β и 18);
· в почках участвуют в синтезе 1,25-диоксихолекальциферола (Витамин Д3) из 25-гидроксихолекальциферола;
· в печени участвуют в синтезе желчных кислот из холестерина;
· в соединительной ткани участвуют в гидроксилировании пролина в оксипролин в молекуле коллагена (пролингидроксилазы). Донором протонов и электронов является витамин С. С оксипролином зрелый коллаген приобретает механическую прочность.
Биологическое окисление. Диоксигеназные реакции
Диоксигеназы это ферменты, которые включают в субстрат оба атома молекулы кислорода:
Таким путем окисляются циклические трудноокисляемые структуры, реакции идут с разрывом цикла. Диоксигеназные реакции протекают на цитоплазматической поверхности гладкого ЭПР.
L-триптофандиоксигеназа печени, содержит гем, участвует в катаболизме триптофана:
Биологическое окисление. ПЕРОКСИДАЗНЫЙ И РАДИКАЛЬНЫЙ ПУТИ ИСПОЛЬЗОВАНИЯ КИСЛОРОДА
Кислород – потенциально опасное вещество. Молекулярный О2 является бирадикалом (˙О::О˙), но он стабилен так как, 2 неспаренных е – внешней орбиты имеют параллельные спины, (подавляют радикальную активность друг друга).
Кислород в составе молекулы Н2О стабилен, потому что его внешняя электронная орбита укомплектована е – (Н:О:Н). Химические соединения, в составе которых кислород имеет промежуточную степень окисления, имеют высокую реакционную способность и называются активными формами кислорода (АФК). К активным формам кислорода относятся свободные радикалы кислорода и перекиси. Свободный радикал – свободный атом или частица с неспаренным электроном.
Образование активных форм кислорода
АФК во многих клетках образуются в основном в ферментативных и неферментативных реакциях в результате последовательного присоединения е – к кислороду:
1) О2 + 1е – → О ∙ 2 супероксидный анион-радикал (˙О::О:).
2) О ∙ 2 +1е – → О 2- 2 пероксидный анион (:О::О:), он быстро протонируется с образованием перекиси водорода О 2- 2 + 2Н + → Н2О2 (Н:О::О:Н)
3) Н2О2 + 1е – → НО ∙ + ОН – гидроксильный радикал, ОН – протонируется с образованием воды ОН – + Н + → Н2О
4) ОН ∙ + 1е – → Н2О (Н:О:Н)
В организме донорами электронов являются:
1). ЦПЭ. Утечка электронов из ЦПЭ на кислород является основным путем образования активных форм кислорода в большинстве клеток:
b) в монооксигеназных реакциях электрон с цитохрома Р450 переходит на кислород с образованием супероксидного анион-радикала, который иногда теряется с активного центра.
c) Аэробные дегидрогназы (ФАД-зависимые оксидазы) переносят электроны и протоны с субстрата на кислород с образованием перекиси водорода. Примеры таких оксидаз — оксидазы аминокислот, супероксид дисмутаза, оксидазы, локализованные в пероксисомах.
2). Металлы переменной валентности. Наличие в клетках Fe 2+ или ионов других переходных металлов катализирует образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного анион-радикала.
Hb(Fe 2+ ) + O2 → MetHb(Fe 3+ ) + О ∙ 2
H2O2 + Fe 2+ → Fe 3+ + HO – + HO· (реакция Фентона)
HOCl + Fe 2+ → Fe 3+ + Cl – + HO· (реакция Осипова)
3). Радикалы. Активные формы кислорода, обмениваясь электроном, легко переходят друг в друга: О ∙ 2 + Н2О2 → О2 + НО ∙ + ОН –
Биологическое окисление. Ферментативные реакции образования АФК
Электроны, необходимые для образования АФК могут давать ЦПЭ. Утечка е – из ЦПЭ на кислород является основным путем образования АФК в большинстве клеток:
Неферментативные реакции образования АФК
Электроны, необходимые для образования АФК могут давать:
1). Металлы переменной валентности. Наличие в клетках Fe 2+ или ионов других переходных металлов катализирует образования АФК. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного анион-радикала.
Hb(Fe 2+ ) + O2 → MetHb(Fe 3+ ) + О ∙ 2
H2O2 + Fe 2+ → Fe 3+ + HO – + HO· (реакция Фентона)
HOCl + Fe 2+ → Fe 3+ + Cl – + HO· (реакция Осипова)
2). Радикалы. АФК, обмениваясь электроном, легко переходят друг в друга: О ∙ 2 + Н2О2 → О2 + НО ∙ + ОН –
Биологическое окисление. Свойства активных форм кислорода
Кислородные радикалы, обладая высокой активностью, разрушают органические молекулы в реакциях свободно-радикального окисления (СРО). Большая часть этих реакций протекает с полиненасыщенными жирными кислотами липидов, и называется перекисным окислением липидов (ПОЛ). Реакции ПОЛ являются цепными.
Наиболее химически активным соединением является гидроксильный радикал – сильнейший окислитель. Время его жизни очень короткое (1 миллиардная доля секунды), но за это время он мгновенно вступает в цепные окислительные реакции в месте своего образования.
Супероксидный анион-радикал и перекись водорода более стабильные вещества, могут диффундировать от места образования, проникать через мембраны клеток. Однако, перекись водорода способствует образованию гидроксильного радикала по следующей реакции:
Fe 2+ + Н2О2 → Fe 3+ + НО ∙ + ОН –
Биологическое окисление. Использование активных форм кислорода в организме
1. Иммунная система. АФК используются фагоцитарными клетками – тканевыми макрофагами, моноцитами и гранулоцитами крови для разрушения бактерий, вирусов и онкоклеток.
В условиях патологии могут произойти нарушения либо системы защитных ферментов (в частности, снижение активности СОД), либо ферментных систем, связывающих ионы железа в плазме крови (церулоплазмин и трансферрин) и в клетках (ферритин). В этом случае супероксидные радикалы и перекись водорода вступают в альтернативные реакции: Образование двухвалентного железа из трехвалентного: Fe 3+ + O •- → Fe 2+ + O2
Реакция перекиси водорода и гипохлорита с ионами двухвалентного железа:
При дефиците в клетках СОД, ферритина, а в плазме церулоплазмина, трансферрина активируются альтернативные реакции:
Фактор некроза опухоли
2. Поддержание гомеостаза.
Эйказаноиды – медиаторы воспаления
3. Внутриклеточное пищеварение. В пероксисомах образуются АФК. Когда пероксисомы сливаются с фагосомами, АФК обеспечивают внутриклеточное пищеварение.
Биологическое окисление. Повреждающее действие активных форм кислорода в организме
Радикалы гидроксила химически исключительно активны и вызывают повреждение белков, нуклеиновых кислот и липидов биологических мембран. В белках происходит неферментативное окисление аминокислотных остатков гистидина, цистеина, триптофана. Таким образом, инактивируют многие ферменты. Особенно тяжелые последствия имеют повреждение ДНК и липидов. Радикалы НО ∙ вызывают разрыв нитей ДНК, обладая, в зависимости от ситуации, мутагенным, канцерогенным или цитостатическим действием. Радикалы гидроксила инициируют цепную реакцию ПОЛ, при этом нарушаются физико-химические свойства мембран – проницаемость, рецепторная функция и работа мембранных белков. Повреждение барьера приводит к нарушению регуляции внутриклеточных процессов и тяжелым расстройствам клеточных функций. Свободно-радикальные реакции часто вызывают гибель клеток и целом ускоряют процесс старения организма.
Биологическое окисление. Антиоксидантные клетки
Антиоксидантная система
В нормальных условиях процесс СРО находится под строгим контролем ферментативных и неферментативных систем клетки, от чего скорость его невелика. Химические соединения и физические воздействия, влияющие на скорость СРО, делят на прооксиданты и антиоксиданты.
Прооксиданты усиливают процессы СРО. Это высокие концентрации кислорода (например, при длительной гипербарической оксигенации больного), ферментные системы, генерирующие супероксидные радикалы (например, ксантиноксидаза, ферменты плазматической мембраны фагоцитов и др.), ионы двухвалентного железа.
Антиоксиданты тормозят СРО. Антиоксиданты, находящиеся в организме, образуют его ферментативную и неферментативную антиоксидантную систему.
1. Ферментативная антиоксидантная система
К ферментам, защищающим клетки от действия активных форм кислорода, относят супе-роксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико.
Супероксиддисмутаза (СОД) превращает супероксидные анионы в перекись водорода:
Изоферменты СОД находятся и в цитозоле (Cu 2+ и Zn 2+ ) и в митохондриях (Mn 2+ ) и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода. СОД — индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется СРО.
Каталаза – геминовый фермент, катализирует реакцию разрушения перекиси водорода. При этом образуется вода и молекулярный кислород:
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество перекиси водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» и в эритроцитах, где она защищает гем гемоглобина от окисления.
Глутатионпероксидаза — обеспечивает разрушение перекиси водорода и гидропероксидов липидов при окислении глутатиона (у-глутамилцистеинилглицин): Н2О2 + 2 GSH → 2 Н2О + G-S-S-G. Глутатионпероксидаза в качестве кофермента содержит селен.
Глутатионредуктаза восстанавливает окисленный глутатион с участием НАДФН2:
Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий.
Фосфолипаза в мембране отщепляет от фосфолипидов окисленные жирные кислоты, содержащие гидроперекисную группу (LOOH), тем самым разрушаются гидроперекиси липидов, предотвращается разветвление цепей окисления липидов в мембранах.
2. Неферментативная антиоксидантная система
“Липидные антиоксиданты” – производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран и предотвращать развитие ПОЛ. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол).
Регенерацию α-токоферола осуществляет витамин С.
Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму — токоферолхинон.
Витамин С ингибирует СРО с помощью двух различных механизмов:
1). восстанавливает в мембранах токоферолхинон до витамина Е:
НО-аскорбат-ОН + α-ТФ-О· → α-ТФ-ОН + НО-аскорбат-О· (семидегидроаскорбиновая к-та)
НО-аскорбат-О· + α-ТФ-О· → α-ТФ-ОН + О=аскорбат=О (дегидроаскорбиновая к-та)
Регенерация аскорбиновой кислоты идет с участием ферментативных систем:
а). В микросомах, с участием комплекса НАДН2-редуктаза-цитохром b5:
2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД +
б). В митохондриях, с участием НАДН2-семидегидроаскорбатредуктазы:
2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД +
в). В цитозоле, с участием НАДФН2-дегидроаскорбатредуктазы:
О=аскорбат=О + 2НАДФН2 → НО-аскорбат-ОН + 2НАДФ +
г). В цитозоле, с участием GSH-дегидроаскорбатредуктазы:
О=аскорбат=О + 2GSH → НО-аскорбат-ОН + GS-SG
2). взаимодействует с активными формами кислорода — О ∙ 2, Н2О2, НО ∙ и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ин-гибирует ПОЛ.
Соединения, связывающие железо. Большинство из них, включая такие природные соединения как дипептид карнозин, не просто связывают железо, но, самое главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы, в силу своей полярности, не проникают в гидрофобную зону.
Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe 2+ до Fe 3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина.