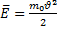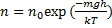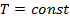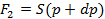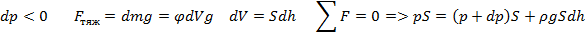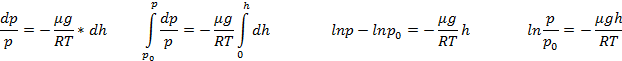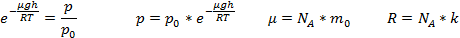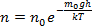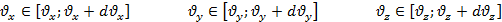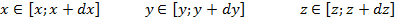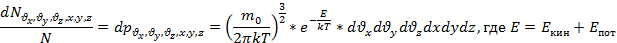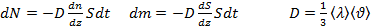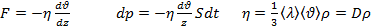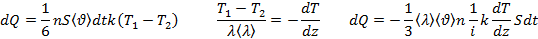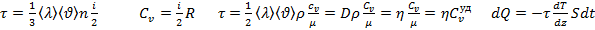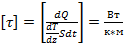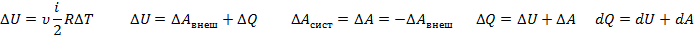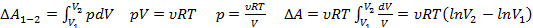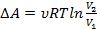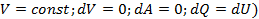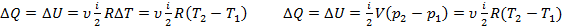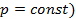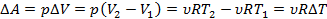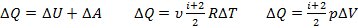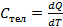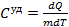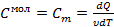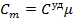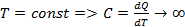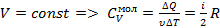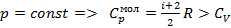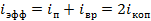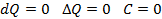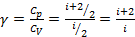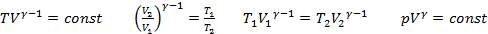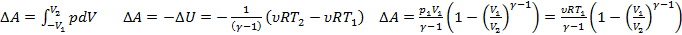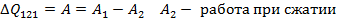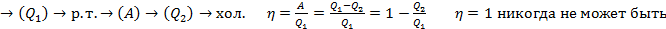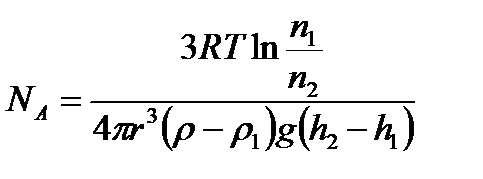молекулы газа находящиеся в поле тяготения
Идеальный газ в поле силы тяжести. Барометрическая формула.Распределение Больцмана.
Макроскопическая система, макроскопические параметры. Идеальный газ, уравнение состояния идеального газа.
Макроскопические параметры – параметры значения, которых можно определить с помощью приборов, ничего не зная об атомно-молекулярном строении вещества (давление, объем, температура).
Идеальным называют газ, взаимодействием, между молекулами которого можно пренебречь.
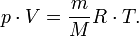
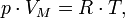
Законы идеальных газов: Бойля-Мариотта, Гей-Люссака, Авогадро, Дальтона.
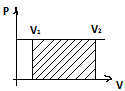
Закон Бойля-Мариотта: При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно. Формула: pV = const
Закон Гей-Люссака:при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Формула: V/T=const
Закон Авогадро: в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
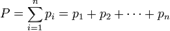
Внутренняя энергия идеального газа. Степени свободы. Теорема о равномерном распределении кинетической энергии по степеням свободы.
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Формула:
Степени свободы — характеристики движения механической системы. Число степеней свободы определяет минимальное количество независимых переменных, необходимых для полного описания движения механической системы.
В состоянии термодинамического равновесия на каждую степень свободы движения частиц вещества приходится кинетическая энергия в среднем, равная kT/2.
Основное уравнение молекулярно-кинетической теории. Средняя кинетическая энергия молекул, молекулярно-кинетический смысл температуры.
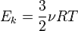
Средняя кинетическая энергия молекул:
Температура определяется через микроскопические характеристики системы и служит мерой энергии неупорядоченного движения частиц.
5. 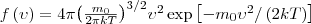
Идеальный газ в поле силы тяжести. Барометрическая формула.Распределение Больцмана.
В идеальном газе, находящемся во внешнем поле сил, каждая отдельная частица приобретает импульс в направлении силы, а также соответствующую потенциальную энергию. Однако в газе наряду с упорядоченным движением в направлении действия силы существует хаотическое тепловое движение. В результате конкуренции между этими двумя типами движений возникает неравномерное распределение макроскопических параметров: плотности частиц, давления, температуры по объему, занимаемому газом.
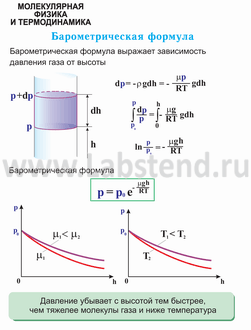
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с законом распределения Больцмана:
2.1.4. Идеальный газ в поле силы тяжести
Каково поведение идеального газа в поле внешней силы? Для определенности в качестве внешней силы возьмем хорошо известную силу тяжести mg. Под действием внешней силы механическая система частиц приобретает импульс и перемещается как целое поступательно в направлении силы. В идеальном газе, находящемся во внешнем поле сил, каждая отдельная частица приобретает импульс в направлении силы, а также соответствующую потенциальную энергию. Однако в газе наряду с упорядоченным движением в направлении действия силы существует хаотическое тепловое движение. В результате конкуренции между этими двумя типами движений возникает неравномерное распределение макроскопических параметров: плотности частиц, давления, температуры по объему, занимаемому газом.
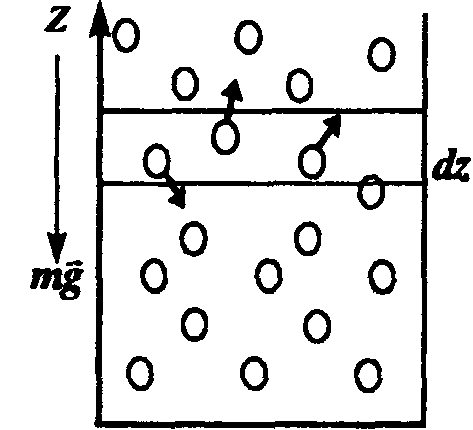
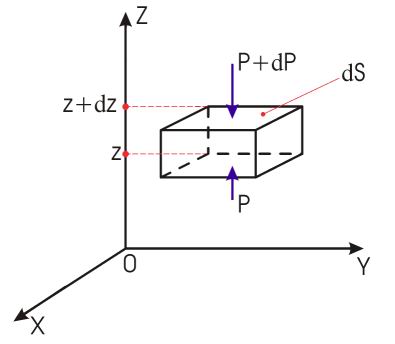
Пусть разность давлений есть dP. Давление газа с ростом высоты уменьшается, поэтомуdP равно весу слоя со знаком минус. Вес газа в объеме слояdV =dz·S равен ρ·g·dV, где ρ — плотность газа,g — ускорение силы тяжести. Таким образом,
По определению 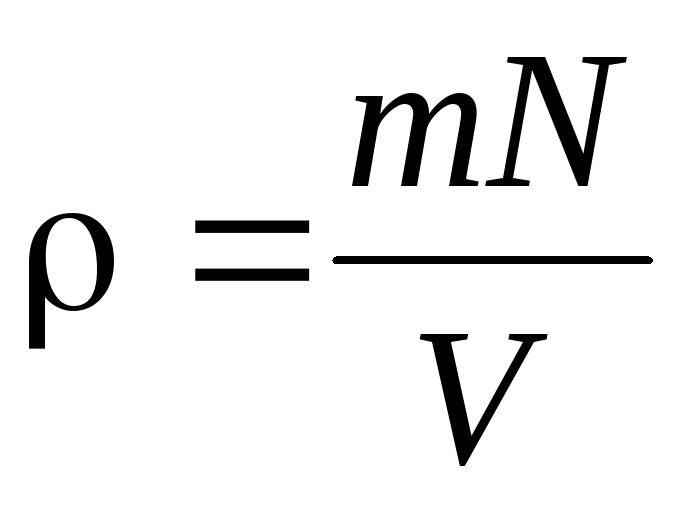
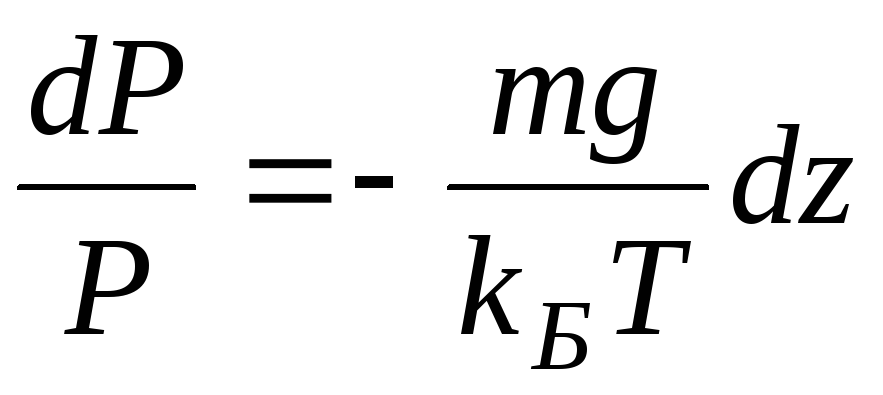
Интегрируя это соотношение, получим 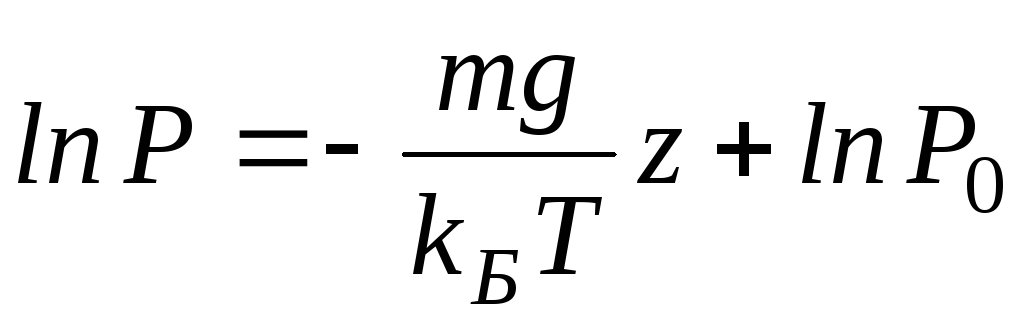
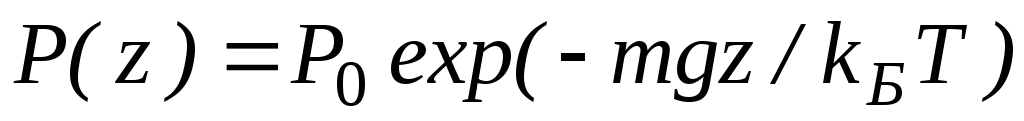
Здесь P0 — давление приz = 0. т. е. у основания столба. Аналогично с высотой изменяется и плотность частиц
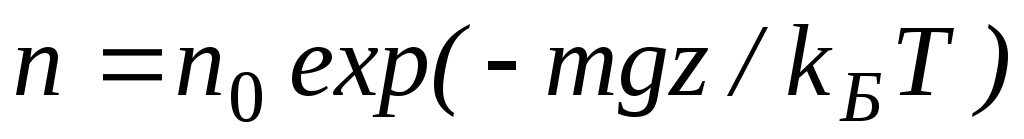
Давление и плотность газа распределены по объему газа неоднородно, они принимают максимальные значения у основания столба и убывают с высотой.
Величина, входящая в показатель экспоненты в формулах (2.9) и (2.10), есть потенциальная энергия частицы в поле тяжести U =mgz-Таким образом, распределение молекул в произвольном потенциальном внешнем поле, в котором частицы обладают потенциальной энергиейU(r), может быть описано формулой:
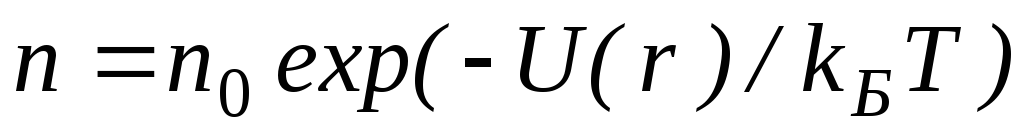
Эта формула называется распределением Больцмана. Здесь n0 — плотность частиц в точках пространства, для которых потенциальная энергия принята равной нулю.
Согласно распределению Больцмана число частиц, обладающих определенными значениями потенциальной энергии определяется отношением величины потенциальной энергии U к тепловой энергии частицыkБT. Чем больше энергия теплового движения, тем более разупорядочена система частиц, значит, тем более однородно распределены частицы в пространстве. В самом деле, еслиkБT >>U,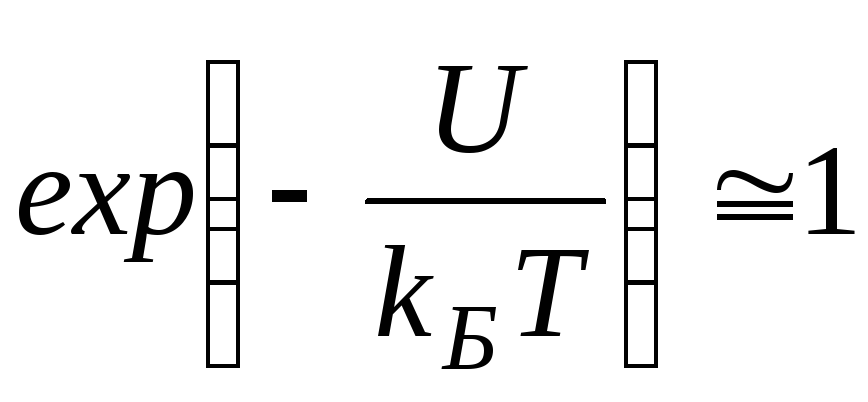
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Газ в поле тяготения. Барометрическая формула. Распределение Больцмана.
1)поле однородно
3)
Равновестное распределение молекул устанавливается в результате одновременного действия двух конкурирующих факторов:
1.Газ стремится занять весь предоставленый ему объем.
2.Молекулы притягиваются к земле.
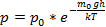
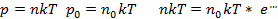
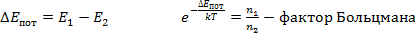
25. Столкновения молекул. Средняя длина свободного пробега. Эффективный диаметр молекул.
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулыd. Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
Эффективный диаметр молекулы- это min расстояние до которого могут свдвинутся две молекулы.
Эффективное сечение – это сечение шара, который описан вокруг молекулы.

Вакуум- это такое состояние газа, когда длина свободного пробега соизмеряется длиной сосуда.
26. Диффузия, внутреннее трение, теплопроводность. Коэффициенты диффузии, вязкости и теплопроводности.
Диффузия:
Внутреннее трение в твёрдых телах, свойство твёрдых тел необратимо превращать теплоту в механическую энергию, сообщенную телу в процессе его деформирования. В. т. связано с двумя различными группами явлений — неупругостью и пластической деформацией.
Вязкость:
Теплопроводность:
27. Термодинамика. Первое начало термодинамики. Теплоемкости газа. Работа и теплоемкость при изопроцессах. Зависимость теплоемкости от температуры.
Термодинамика- наука о наиболее общих св-вах макросистем о находящихся в состоянии термодинамического равновесия и о процессах перехода между этими состояниями.
Вн. энергия- суммарная энергия
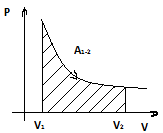
Теплота, сообщенная системе идет на работу системы против внешних сил и на приращение внутренней энергии системы.
2)изохора (
3)изобара (
Газовая постоянная численна равна работе одного моля идеального газа, при изобарном нагреве на 1К.
1)Теплоемкость- кол-во теплоты, которое нужно собщить всему телу на повышение температуры на 1К.
2)Теплоемкость удельная- кол-во теплоты, которое нужно сообщить единице массы на повышение температуры на 1К.
3)Теплоемкость молярная- кол-во теплоты, которое нужно сообщить 1 молю в-ва чтобы нагреть его на 1 К.
1)
2)
3)
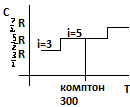
28. Адиабатический процесс. Работа при адиабатическом процессе. Уравнение Пуассона.
Адиабата- процесс без теплообмена с окр. средой.
Показатель Пуассона
Уравнение Пуассона
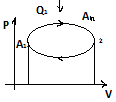
29. Круговой процесс (цикл). КПД цикла. Обратимые и необратимые процессы. Второе начало термодинамики по Кельвину и Клаузиусу
Цикл – это процесс, в котором система, пройдя ряд последовательных состояний возвращается в исходное.
Наг.
Обратимые и не обратимые процессы.
Процесс называется обратимым, если он может идти как в прямом, так и в обратном направлении, при этом, если система возвращается в исх. состоянии, то ни в самой системе, ни в окр.среде не происходит никаких изменений. Все равновесные процессы обратимы. Равновесный процесс – это процесс, любая точка которого это состояние равновесия. Только равновесные процессы изображают на графиках.
Все реальные процессы необратимы. Необратимые: теплопроводность, диффузия, вязкость, трение.
КПД выше если процесс наиболее близок к идеальному.
Второе начало термодинамики.
Карно доказал, что невозможно построить вечный двигатель второго рода( 
По Клаузиусу: невозможно без совершения дополнительной работы передавать теплоту от холодного к горячему.
Дата добавления: 2018-02-18 ; просмотров: 666 ; Мы поможем в написании вашей работы!
Идеальный газ во внешнем гравитационном поле
Пусть ИГ находится во внешнем гравитационном поле (в поле силы тяжести Земли). При нахождении концентрации молекул газа n(x, y, z) в этом поле будем исходить из предположения, что любой бесконечно малый объем газа находится в состоянии механического равновесия, а температура газа T во всех точках одинакова. Только при выполнении этих условий состояние газа можно считать равновесным, так как иначе в газе возникли бы потоки вещества и теплоты, что сделало бы состояние газа неравновесным.
Поле силы тяжести Земли будем считать однородным. Ось OZ направлена вертикально вверх. Тогда концентрация молекул газа будет зависеть только от координаты z (высоты h): n=n(z)или n=n(h). На рис. (1) схематически изображен бесконечно малый выделенный объем газа dV=dSdz, находящийся в равновесии.

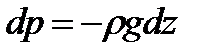
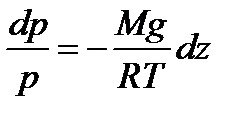
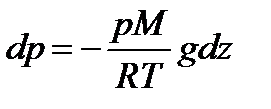
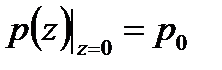
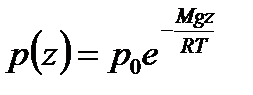
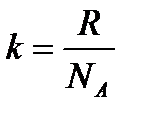
С учетом формулы для постоянной Больцмана:
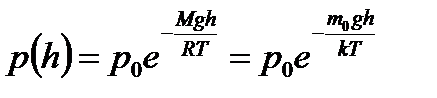
270 К на высоте около 55 км. На этой высоте давление атмосферы становится уже меньше 0,001 от атмосферного давления на уровне моря.
Несмотря на указанную зависимость температуры атмосферы Земли от высоты, барометрическая формула позволяет достаточно точно определять высоту по результатам измерения давления, что нашло применение в приборах, предназначенных для определения высоты полета самолетов.
Распределение Больцмана было получено в 1866 году Л. Больцманом. Это распределение позволяет рассчитывать концентрацию газа, находящегося в равновесном состоянии во внешнем силовом поле. Причем это поле не должно быть обязательно гравитационным, а может иметь любое происхождение, в частности, быть электростатическим или полем сил инерции.
Анализ распределения Больцмана показывает, что концентрация молекул газа тем выше, чем меньше их потенциальная энергия. Кроме этого, с понижением температуры увеличивается отличие концентраций в точках с различными значениями потенциальной энергии молекул. А при стремлении температуры к абсолютному нулю, молекулы начинают скапливаться в месте, где их потенциальная энергия принимает наименьшее значение. Указанные особенности распределения Больцмана являются следствием теплового движения молекул, так как кинетическая энергия их поступательного движения в среднем равна Wк=(3/2)kT и уменьшается пропорционально уменьшению температуры. А уменьшение кинетической энергии приводит к уменьшению количества молекул, способных преодолеть потенциальный порог, высота которого характеризуется величиной потенциальной энергии высотой Wp.
Опыт Перрена.
Распределение Больцмана было использовано французским физиком Жаном Батистом Перреном (1870–1942) при экспериментальном определения постоянной Больцмана k и постоянной Авогадро NA.
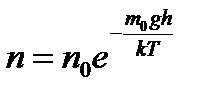
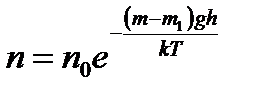
где m – масса частицы,
m1– масса вытесненной ею жидкости;
m=4/3πr 3 ρ, m1= 4/3πr 3 ρ1
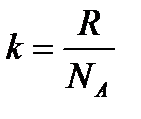
Значение NA, получаемое из работ Ж. Перрена, соответствовало значениям, полученным в других опытах. Это подтверждает применимость к броуновским частицам распределения Больцмана.