Кто в госпитале погружает пациентов глубокий сон перед операцией
Кто в госпитале погружает пациентов глубокий сон перед операцией
Проблема поражения легких при вирусной инфекции, вызванной COVID-19 является вызовом для всего медицинского сообщества, и особенно для врачей анестезиологов-реаниматологов. Связано это с тем, что больные, нуждающиеся в реанимационной помощи, по поводу развивающейся дыхательной недостаточности обладают целым рядом специфических особенностей. Больные, поступающие в ОРИТ с тяжелой дыхательной недостаточностью, как правило, старше 65 лет, страдают сопутствующей соматической патологией (диабет, ишемическая болезнь сердца, цереброваскулярная болезнь, неврологическая патология, гипертоническая болезнь, онкологические заболевания, гематологические заболевания, хронические вирусные заболевания, нарушения в системе свертывания крови). Все эти факторы говорят о том, что больные поступающие в отделение реанимации по показаниям относятся к категории тяжелых или крайне тяжелых пациентов. Фактически такие пациенты имеют ОРДС от легкой степени тяжести до тяжелой.
В терапии классического ОРДС принято использовать ступенчатый подход к выбору респираторной терапии. Простая схема выглядит следующим образом: низкопоточная кислородотерапия – высокопоточная кислородотерапия или НИМВЛ – инвазивная ИВЛ. Выбор того или иного метода респираторной терапии основан на степени тяжести ОРДС. Существует много утвержденных шкал для оценки тяжести ОРДС. На наш взгляд в клинической практике можно считать удобной и применимой «Берлинскую дефиницую ОРДС».
Общемировая практика свидетельствует о крайне большом проценте летальных исходов связанных с вирусной инфекцией вызванной COVID-19 при использовании инвазивной ИВЛ (до 85-90%). На наш взгляд данный факт связан не с самим методом искусственной вентиляции легких, а с крайне тяжелым состоянием пациентов и особенностями течения заболевания COVID-19.
Тяжесть пациентов, которым проводится инвазивная ИВЛ обусловлена большим объемом поражения легочной ткани (как правило более 75%), а также возникающей суперинфекцией при проведении длительной искусственной вентиляции.
Собственный опыт показывает, что процесс репарации легочной ткани при COVID происходит к 10-14 дню заболевания. С этим связана необходимость длительной искусственной вентиляции легких. В анестезиологии-реаниматологии одним из критериев перевода на спонтанное дыхание и экстубации служит стойкое сохранение индекса оксигенации более 200 мм рт. ст. при условии, что используются невысокие значения ПДКВ (не более 5-6 см. вод. ст.), низкие значения поддерживающего инспираторного давления (не более 15 см. вод. ст.), сохраняются стабильные показатели податливости легочной ткани (статический комплайнс более 50 мл/мбар), имеется достаточное инспираторное усилие пациента ( p 0.1 более 2.)
Достижение адекватных параметров газообмена, легочной механики и адекватного спонтанного дыхания является сложной задачей, при условии ограниченной дыхательной поверхности легких.
При этом задача поддержания адекватных параметров вентиляции усугубляется присоединением вторичной бактериальной инфекции легких, что увеличивает объем поражения легочной ткани. Известно, что при проведении инвазинвой ИВЛ более 2 суток возникает крайне высокий риск возникновения нозокомиальной пневмонии. Кроме того, у больных с COVID и «цитокиновым штормом» применяются ингибиторы интерлейкина, которые являются выраженными иммунодепрессантами, что в несколько раз увеличивает риск возникновения вторичной бактериальной пневмонии.
В условиях субтотального или тотального поражения дыхательной поверхности легких процент успеха терапии дыхательной недостаточности является крайне низким.
Собственный опыт показывает, что выживаемость пациентов на инвазивной ИВЛ составляет 15.3 % на текущий момент времени.
Алгоритм безопасности и успешности ИВЛ включает:
В связи с тем, что процент выживаемости пациентов при использовании инвазивной ИВЛ остается крайне низким возрастает интерес к использованию неинвазивной искусственной вентиляции легких. Неинвазивную ИВЛ по современным представлениям целесообразно использовать при ОРДС легкой степени тяжести. В условиях пандемии и дефицита реанимационных коек процент пациентов с тяжелой формой ОРДС преобладает над легкой формой.
Тем не менее, в нашей клинической практике у 23% пациентов ОРИТ в качестве стартовой терапии ДН и ОРДС применялась неинвазивная масочная вентиляция (НИМВЛ). К применению НИМВЛ есть ряд ограничений: больной должен быть в ясном сознании, должен сотрудничать с персоналом. Допустимо использовать легкую седацию с целью обеспечения максимального комфорта пациента.
Критериями неэффективности НИМВЛ являются сохранение индекса оксигенации ниже 100 мм рт.ст., отсутствие герметичности дыхательного контура, возбуждение и дезориентация пациента, невозможность синхронизации пациента с респиратором, травмы головы и шеи, отсутствие сознания, отсутствие собственного дыхания. ЧДД более 35/мин.
В нашей практике успешность НИМВЛ составила 11.1 %. Зав. ОАИР: к.м.н. Груздев К.А.
Что вы знаете об операционной медсестре?
15 февраля отмечается День операционной медсестры. Что же входит в профессиональные обязанности этого специалиста? Сегодня мы расскажем о рабочих буднях операционных сестер в НМИЦ онкологии им. Н. Н. Петрова.
О своей работе нам рассказала Марина Молчанова – операционная сестра НМИЦ онкологии им. Н. Н. Петрова.
– Что важно в работе операционной медсестры?
– Внимательность, скорость, знание хода операций и логическое мышление. ЛЮБОВЬ к своей профессии, человеколюбие. К примеру, бывают моменты, когда мне плохо видно, что делает врач в операционной ране. Но при этом я должна продолжать свою работу. Во-первых, здесь важно знание хода операций, во-вторых, умение выстраивать логическую цепочку действий. Если хирург взял два зажима, дальше он возьмет ножницы, а дальше будет вязать.
– Вы специально изучаете ход всех операций?
– Знание хода всех операций приходит с опытом. Выпускнику колледжа сложно сразу приступить к работе, не смотря на полученные теоретические знания. На практике существует множество тонкостей, о которых не расскажут на лекциях. Многое зависит от операции, ее сложности, развития событий. Важно отрабатывать действия на скорость. Например, первое время я брала после операции иглодержатель, иглу и тренировалась быстро вдевать нитку. Или, скажем, раньше подготовка операционной занимала у меня примерно час, а теперь около получаса.
– А как происходит обучение на практике?
– По началу после каждой операции я проводила работу над ошибками, анализировала свои действия, спрашивала совета у более опытных коллег. На ошибки могут указать и хирурги в ходе операции, они же показывают, как делать те или иные манипуляции правильно.
– Бывают ли непредсказуемые сценарии на операционном столе?
– Да. Иногда исследование показывает, что опухоль только прилежит к органу, а на операционном столе оказывается, что новообразование уже проросло в соседние ткани, сосуды, органы и так далее. Хирурги во время операции обсуждают сложившуюся ситуацию, а медсестра уже должна среагировать и подготовить необходимые инструменты.
Если, к примеру, в списке на завтрашний день значится операция по удалению рецидивного узла, то медсестра должна быть готова вообще к любому развитию событий. То есть может возникнуть сосудистый, кишечный и любой иной этап операции.
– В чем особенность работы хирургических бригад в НМИЦ онкологии им. Н. Н. Петрова?
– Здесь делают то, что кажется невозможным. Первое время для меня было шоком то, что здесь делают сложные операции лапароскопическим способом, например, резекцию почки или тромбэктомию из нижней полой вены. Здесь очень высокий уровень профессионалов. Они оперируют красиво.
– Что значит «красиво оперировать»?
– Аккуратно, щепетильно, педантично, чисто. Т.е. когда оперирует Игорь Викторович Берлев, он всегда делает операции с малыми потерями крови. Это действительно красиво, видна вся анатомия. Наблюдение за работой профессионала вызывает эстетическое удовольствие. Поэтому я люблю свою работу.
Нарушения сна в периоперационном периоде

Перевод из Frontiers in medicine. В обзоре рассмотрены факторы риска, способствующие нарушениям ритма сна в периоперационном периоде, их влияние на прогноз заболевания и современные методы лечения.
Dandan Lin, Xiao Huang, Yi Sun, Changwei Wei, Anshi Wu. Department of Anesthesiology, Beijing Chao-Yang Hospital, Capital Medical University, Beijing, China
Введение
Сон является одной из важнейших физиологических потребностей человека. Расстройства сна, возникающие в периоперационном периоде, могут носить кратковременный или длительный характер и оказывать существенное влияние на процесс реабилитации, повышая риск неврологических осложнений и боли. Несмотря на широкую распространенность расстройств сна в общей популяции, механизмы, лежащие в основе этих нарушений, до сих пор мало изучены, что затрудняет своевременную диагностику и разработку новых терапевтических подходов.
В обзоре представлены данные последних исследований о распространенности, классификации, факторах риска и современных подходах к диагностике и лечению нарушений сна в периоперационном периоде, а также их влиянии на исход заболевания и эффективность хирургического вмешательства (Рисунок 1).
Рисунок 1. Графическая иллюстрация разделов обзора
Распространенность
Расстройства сна широко распространены среди пациентов в период госпитализации. В частности, нарушения сна выявляются у 8.8–79.1% больных в предоперационном периоде (1–3) и могут сохраняться в течение длительного времени после операции. Так, после хирургического удаления злокачественного новообразования легкого у 49.7% пациентов нарушения сна сохраняются в течение 1 года после операции (3). После операции на грудной стенке и органах грудной клетки у 62% больных снижение качества сна наблюдается спустя 6 месяцев после хирургического вмешательства, а у 12% – на протяжении более длительного периода (4).
Распространенность расстройств сна различается в зависимости от характера заболевания и типа операции. Так, с нарушениями сна часто сталкиваются пациенты, перенесшие операцию по восстановлению функций вращательной манжеты (5). С другой стороны, 8.8% пациентов, которым назначена артроскопия тазобедренного сустава, страдают бессонницей до проведения операции, а у 17.8% расстройства сна сохраняются в послеоперационном периоде (6).
Причиной развития бессонницы у пациентов, перенесших операцию, может служить хроническая боль, применение опиоидных анальгетиков и т.д. Однако в большинстве случаев расстройства сна остаются недиагностированными. Так, у четверти кардиохирургических больных развивается синдром обструктивного апноэ во сне; в 80% случаев патология не выявляется до операции, а гипоксическое повреждение органов часто рассматривается как индикатор сердечного приступа (7). Своевременное выявление расстройств сна и назначение соответствующей терапии позволяют в значительной степени улучшить исход операции и прогноз заболевания.
Клиническая оценка
Диагностика нарушений сна основана на объективной оценке клинических проявлений – трудностей засыпания, внезапного пробуждения, ночных кошмаров и парасомнии (Таблица 1). Субъективная оценка качества сна проводится с использованием стандартизированных шкал, среди которых наиболее распространены Питтсбургский индекс качества сна (Pittsburgh Sleep Quality Index questionnaire, PSQI), индекс выраженности бессонницы (Insomnia Severity Index, ISI), афинская шкала бессонницы (Athens Insomnia Scale, AIS), шкала сонливости Эпворта (Epworth Sleepiness Scale, ESS) и общая шкала нарушений сна (General Sleep Disturbance Scale, GSDS). Шкала PSQI обладает высокой степенью достоверности и валидности и наиболее широко применяется в клинических исследованиях. Кроме того, индекс PSQI позволяет количественно оценить структуру сна за последний месяц на основании семи показателей, включая субъективную оценку качества сна, латентный период, длительность и эффективность сна, характер нарушений сна, использование снотворных и самочувствие в течение дня. Более высокий балл по шкале PSQI соответствует худшему качеству сна. Альтернативным методом диагностики расстройств сна является индекс выраженности бессонницы ISI, основанный на субъективной оценке выраженности симптомов бессонницы и связанных нарушений, включая трудности с засыпанием или прерывистый сон (затруднение поддержания сна), удовлетворенность качеством сна, влияние депривации сна на дневную активность и обеспокоенность пациента имеющимися нарушениями (8). Шкала сонливости Эпворта ESS позволяет оценить сонливость в течение дня (9).
Таблица 1. Методы оценки нарушений сна
Питтсбургский индекс качества сна ( Pittsburgh Sleep Quality Index questionnaire , PSQI )
Субъективная оценка качества сна, латентный период и длительность сна, самочувствие в течение дня, эффективность сна, использование снотворных лекарственных средств в течение последнего месяца
Индекс выраженности бессонницы ( Insomnia Severity Index , ISI )
Трудности с засыпанием и поддержанием сна, удовлетворенность качеством сна, самочувствие в течение дня, уровень стресса и обеспокоенности снижением качества сна
Афинская шкала бессонницы ( Athens Insomnia Scale , AIS )
Трудности с засыпанием, пробуждение по ночам, длительность сна, качество сна, общее самочувствие, сонливость в течение дня
Шкала сонливости Эпворта ( Epworth Sleepiness Scale, ESS)
Сонливость в течение дня
Общую шкала нарушений сна (General Sleep Disturbance Scale, GSDS)
Латентный период засыпания, количество пробуждений за ночь, длительность пробуждения, качество и длительность сна, сонливость в течение дня, использование снотворных лекарственных средств
Общая длительность сна, латентный период засыпания, длительность пробуждения, количество пробуждений за ночь, длительность фаз медленного и быстрого сна
Общее время сна, латентный период засыпания и время пробуждения
Субъективная оценка качества сна с использованием стандартизированных шкал отличается от методов клинической оценки (9). Согласно традиционной классификации, сон подразделяется на фазы медленного (non-rapid eye movement sleep, NREM) и быстрого (rapid eye movement sleep, REM) сна. Фаза медленного сна делится на три стадии – N1, N2 и N3. Исследование качества и структуры сна проводится с использованием метода полисомнографии, включающего регистрацию электроэнцефалограммы (ЭЭГ), электромиограммы (ЭМГ), электрокардиограммы (ЭКГ) и других диагностически важных физиологических показателей. Актиграфия является экономически эффективным и надежным методом диагностики наиболее распространенных нарушений сна и позволяет оценить общее время сна, латентный период засыпания и время пробуждения (10). Дополнительные критерии оценки качества сна включают учет коморбидных патологий, применение опросников и ведение дневников.
Классификация нарушений сна
Нарушения сна в периоперационном периоде традиционно разделяют на две категории: синдром недостаточного сна и нарушения сна во время госпитализации. На основании клинических проявлений, согласно Международной классификации (International Classification of Sleep Disorders, version 3, ICSD-3) (11, 12) среди нарушений сна выделяют бессонницу (инсомнию), гиперсомнолентность, нарушения дыхания и движений во сне, расстройства циркадного ритма сна, парасомнии, физиологические (органические) расстройства сна и другие расстройства, не связанные с приёмом лекарственных препаратов или известными физиологическими факторами и т.д. (13–16).
Бессонница (инсомния)
Бессонница является наиболее распространенной формой нарушений сна, в том числе периоперационном периоде, которая сопровождается трудностями с инициацией и поддержанием сна, а также снижением его качества. Бессонница может быть хронической (>3 месяцев) и кратковременной ( 0.2 мкг/кг/ч) (87).
Золпидем – снотворное средство из группы имидазопиридинов, которое обладает высокой эффективностью в терапии послеоперационных расстройств сна, в частности бессонницы, на фоне отсутствия выраженных побочных эффектов. Действие препарата основано на нормализации соотношения фаз быстрого и медленного сна. Использование золпидема за 2 дня до и в течение 5 дней после операции позволяет улучшить качество сна и самочувствие пациента, снизить уровень тревожности и риск депрессии (88). Однако известно, что препарат может вызывать психические нарушения и суицидальное поведение, хотя результаты национального популяционного исследования, проведенного в Южной Корее, опровергают эти данные: применение золпидема было связано со снижением риска суицида с 70.6% за 2 дня до назначения препарата до 63.35% спустя 1 день после начала терапии (89).
Мелатонин является основным гормоном эпифиза и играет ключевую роль в регуляции циркадных ритмов. Пероральное введение мелатонина (6 мг) за 1 час до сна позволяет добиться выраженного улучшения качества сна и снизить время пробуждения у пациентов, перенесших операцию по удалению злокачественной опухоли молочной железы (90). По данным рандомизированного клинического исследования, мелатонин снижает длительность латентного периода сна, дневную сонливость и частоту ночных пробуждений, а также выраженность болевого синдрома на 1-й и 2-й день после операции (91).
Хотя точный механизм действия мелатонина неизвестен, показано, что введение мелатонина анестезированным мышам вызывает увеличение δ-активности в темноте (92) и приводит к восстановлению нормального цикла сна после лапаротомии. Инфузия мелатонина в перифорникальную область латерального гипоталамуса ночью вызывает увеличение длительности фазы медленного сна и снижению уровня бодрствования (93).
Кроме того, мелатонин демонстрирует высокую эффективность в снижении риска послеоперационного делирия. По данным мета-анализа, применение мелатонина в периоперационном периоде снижает вероятность делирия у пожилых пациентов (94), а у пациентов, перенесших бариатрическую операцию, – улучшает процесс реабилитации (95).
Использование мелатонина в течение 12 недель после хирургического вмешательства приводит к снижению риска развития симптомов депрессии и выраженности тревожности (96). Таким образом, участвуя в регуляции циркадных ритмов, мелатонин играет важную роль в поддержании нормального ритма сна.
Заключение
Качество сна пациента в периоперационном периоде зависит от множества физиологических факторов и факторов внешней среды, включая возраст, психическое состояние пациента, сложность и длительность операции, использование анестезии, болевой синдром, больничная среда, а также общее недомогание и депрессия. Учитывая высокую распространенность расстройств сна в периоперационном периоде, своевременная диагностика этих нарушений играет важную роль в определении прогноза заболевания и исхода лечения. Использование различных терапевтических инструментов, в частности предоперационное консультирование, медикаментозная терапия и постоперационная терапия позволяют улучшить качество сна пациентов и избежать негативных последствий бессонницы. Проведение клинических исследований в больших популяциях пациентов позволит приблизиться к пониманию биологических механизмов, лежащих в основе нарушений сна в периоперационном периоде, и способствовать разработке эффективных методов диагностики и терапии.
Паллиативная седация: регуляторные, этические и клинические аспекты
Статья авторов Д.В. Невзоровой и Т.А. Гремяковой, опубликованная в журнале «Pallium: паллиативная и хосписная помощь» (№1 (2), 2019). Текст публикуется с разрешения редакции журнала.
Аннотация
Паллиативная седация применима, когда неизлечимо больные пациенты в конце жизни страдают физически и невосприимчивы к усилению стандартных методов лечения. Адекватная практика ее применения не приводит к уменьшению продолжительности жизни. Паллиативная седация показана как исключение из правил после обсуждения с пациентом и его представителями и принятия решения мультидисциплинарной командой медиков. Что касается необходимой степени седации, сознание пациента следует снижать до уровня, требуемого для облегчения страданий. Этот принцип помогает определиться с моментом начала процедуры и титрованием дозы седативных средств. Бензодиазепины остаются основными препаратами паллиативной седации, дозы зависят от массы тела больного, состояния почек и печени, статуса гидратации, наличия сопутствующих симптомов.
Паллиативная седация – контролируемое введение седативных препаратов с целью уменьшения сознания пациента до уровня переносимости рефрактерных и невыносимых симптомов. Она применима в тех случаях, когда неизлечимо больные пациенты в конце жизни страдают от физических симптомов, невосприимчивых (рефрактерных, резистентных) к стандартным методам лечения. Цель паллиативной седации – избавление от боли и страданий, но не приближение смерти. Результаты клинических исследований показывают, что паллиативная седация применяется в основном у онкологических больных при делирии, одышке, болях, рвоте и тошноте. Адекватная практика ее применения не приводит к уменьшению продолжительности жизни. Паллиативная седация показана на терминальных стадиях заболеваний как исключение из правил после обсуждения данного вопроса с пациентом и его представителем и принятия решения мультидисциплинарной командой медиков. Что касается необходимой степени седации для данного пациента, сознание пациента следует снижать до уровня, который требуется для облегчения страданий от резистентных к лечению симптомов. Этот принцип помогает определиться с моментом начала процедуры и титрованием дозы седативных средств. Бензодиазепины, особенно мидазолам, остаются основными элементами процедуры паллиативной седации. Индивидуальные дозы седативных препаратов могут варьироваться, поскольку они зависят от массы тела больного, функционального состояния почек и печени, статуса гидратации и наличия сопутствующих симптомов. Можно и нужно продолжать лечение любыми другими препаратами, которые ранее использовались для купирования симптомов, однако с началом паллиативной седации следует прекратить повышать их дозу во избежание возникновения возможных побочных эффектов.
Терминология
Купирование мучительных симптомов неизлечимых болезней в конце жизни подчас становится для медиков трудновыполнимой задачей, несмотря на интенсивный паллиативный уход за больными. В случае невосприимчивости симптомов к стандартным лечебным мерам может быть показана паллиативная седация, цель которой избавление от боли и страданий, но ни в коем случае не приближение смерти [1].
Во избежание путаницы необходимо определиться с терминологией. В мировой практике существует несколько процедур, связанных с уходом больного пациента из жизни:
эвтаназия – введение пациенту летального препарата с целью избавления его от неизлечимых и невыносимых страданий;
ассистируемое врачом самоубийство – предоставление врачом пациенту необходимой информации/и/или препаратов, позволяющих больному совершить акт самоубийства;
паллиативная седация – контролируемое введение седативных препаратов с целью уменьшения сознания пациента до уровня переносимости рефрактерных и невыносимых симптомов (одобрено American Medical Association (AMA) в 2008 г.)
В данном обзоре речь пойдет только о паллиативной седации, но даже это определение не является однозначным, и смысл, который вкладывают в него клиницисты, существенным образом различается. Так, в литературе наряду с паллиативной седацией можно найти терминальную, общую, контролируемую, глубокую, непрерывную глубокую седацию (Сontinuous deep sedation (CDS)), седационную терапию и седацию умирающих пациентов. Многочисленность синонимов объясняет, почему только 40% опрошенных врачей соглашаются дать определение паллиативной седации без оговорок [6].
Анализ данных литературы выявил большой разброс в распространенности применения паллиативной седации среди неизлечимо больных пациентов – от 2 до 52%. От 10 до 50% пациентов в программах паллиативной помощи по-прежнему отмечают наличие значительной боли за неделю до смерти. Наиболее распространенные симптомы, наблюдаемые у этих пациентов, – одышка, боль, бред, рвота. Большинство симптомов физические по природе. В ретроспективном анализе 54% пациентов имели больше чем один неподконтрольный симптом [6].
Международный опыт
В США паллиативные отделения могут сообщить, что 23% из 186 пациентов после паллиативной седации выписаны из госпиталя [3].
В Европе нет единых стандартов проведения паллиативной седации:
Бельгия и Нидерланды – эвтаназия легализована, применение продолжительной глубокой седации считается нормой и очень похожа на эвтаназию, семья обычно прощается перед тем, как пациента переведут в бессознательное состояние. В той же Бельгии уровень применения CDS в одной из клиник за 6 лет сократился с 7 до 3% в результате оптимизации управления симптомами и использования командного подхода при принятии решения [3].
Великобритания следует директивам Европейской ассоциации паллиативной помощи (European Association for Palliative Care), которая подчеркивает необходимость титрования дозы пропорционально симптомам, сохраняя, по возможности, сознание пациента [3].
Франция в 2016 г. приняла закон, разрешающий терминальную седацию для неизлечимо больных пациентов [1].
Швейцария – доля терминальной седации в смертности паллиативных больных в Цюрихе, по данным 2013 г., составила 17,5%. Для сравнения в 2001 г. этот показатель равнялся всего 4,7%. Эксперты всерьез обеспокоены таким существенным ростом, так как в стране запрещена эвтаназия подобного рода. Одной из причин роста случаев искусственного сна эксперты называют чрезмерное искусственное продление жизни бессмысленной терапией [1].
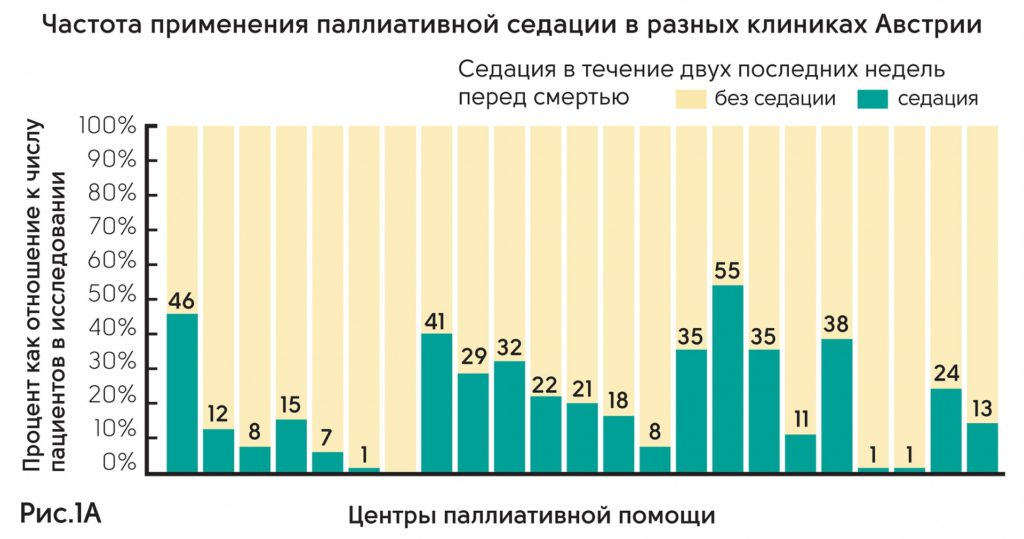
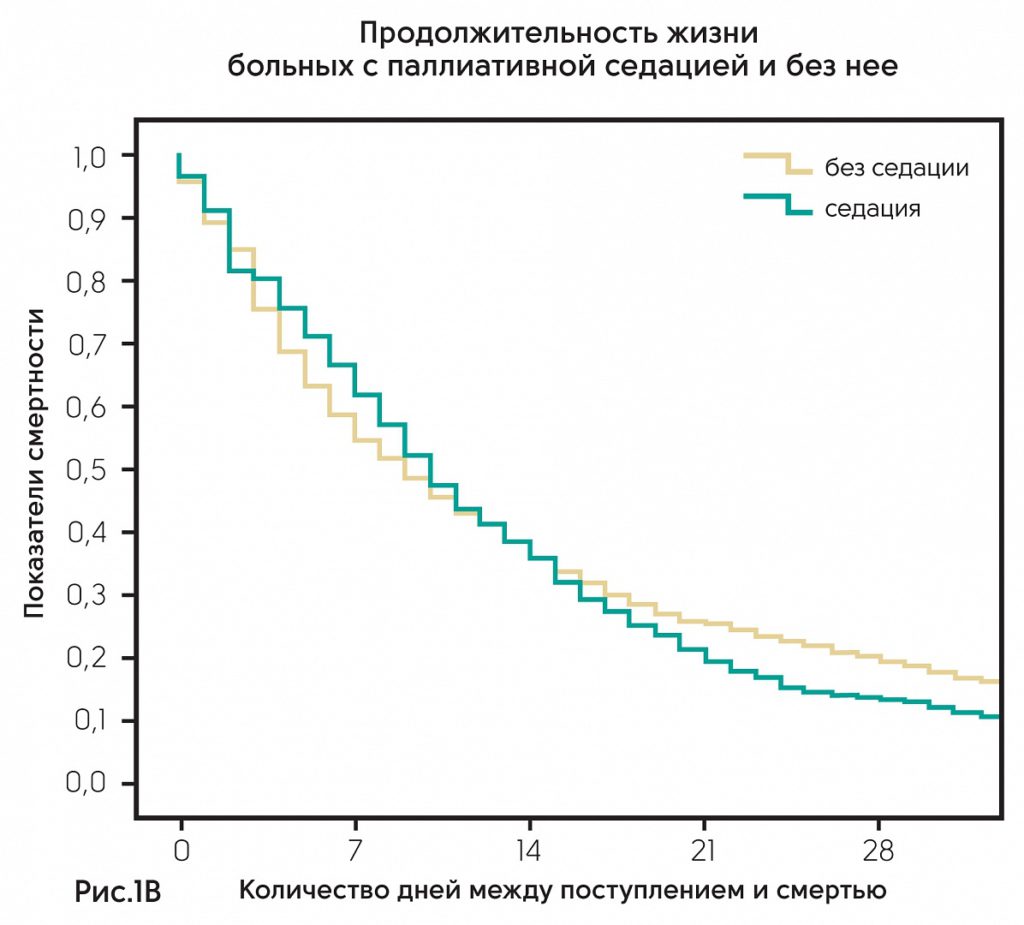
Австрия – проанализированы клинические данные по 2414 пациентам в 23 из 31 отделения паллиативной помощи Австрии. Результаты показали, что частота применения паллиативной седации в разных клиниках колеблется от 0 до 55% (рис. 1А). Из 2414 только 502 получали седацию. Из них 356 (71%) получали непрерывную седацию до момента смерти, 119 (24%) – прерывистую седацию. Среднее время седации составляло 48 ч (IQR 10–72h); 168 пациентов (34%) получали седативные препараты менее 24 ч. Показания для седации – делирий (51%), экзистенциальный дистресс (32%), нарушение дыхания (30%), боль (20%). Основное заболевание – онкология (92%). Среднее количество дней жизни между госпитализацией и смертью у пациентов с седацией статистически не различалось и составляло 10 против 9 дней (p = 0,491) (рис. 1В).
Япония – рассчитанное применение продолжительной глубокой седации у больных с экзистенциальным дистрессом – 1% (90 случаев/8,661 общего числа смертей пациентов). Прогнозируемое время жизни в 94% случаев составляло не более 3 недель. Показания для продолжительной глубокой седации – ощущение бессмысленности/бесполезности (61%), нагрузка на других/зависимость/неспособность к самообслуживанию (48%), боязнь смерти/тревожность/страх/паника (33%), желание самостоятельно контролировать время смерти (24%), изоляция/отсутствие социальной поддержки (22%) [7].
Отсутствие единообразия в терминологии сказывается на представляемых результатах клинических исследований, где под паллиативной седацией имеется в виду и рутинная седация, и другие практики, не имеющие отношения к паллиативной седации [3].
Предлагаются другие дефиниции для замены неоднозначно трактуемой медикаментозной процедуры паллиативной седации. Так, Твайкросс в 2017 г. [3] предложил ввести термин непрерывной глубокой седации (Сontinuous deep sedation – CDS) как основную цель терминального лечения, применяемую только в исключительных случаях.
Но пока это не рассмотрено на законодательном уровне, следует руководствоваться установленными нормами и определениями паллиативной седации, принятой многими международными организациями, действующими в области паллиативной медицины:
Данные организации единогласны в том, что паллиативная седация показана в случае невыносимых физических страданий пациентов в конце их жизни, но не может применяться при экзистенциальном дистрессе, требующем других способов коррекции [6, 9, 10, 11, 12].
Показания для использования паллиативной седации
Паллиативная седация применяется в тех случаях, когда неизлечимо больные пациенты в конце жизни страдают от неконтролируемых симптомов, невосприимчивых (рефрактерных, резистентных) к стандартным методам лечения. В обзоре литературы о применении паллиативной седации у пациентов с неизлечимыми онкологическими заболеваниями за 2012 год по результатам 30‑летних клинических исследований паллиативная седация применялась при делирии у 54% из 774 пациентов, при одышке – у 30%, при болях – у 17% и при тошноте – у 5% [4].
Атрибуты рефрактерных симптомов [5]:
Когда следует принимать решение о паллиативной седации? В наличии должны быть следующие факторы [6]:
Отказ от реанимации в данном случае не противоречит законодательству РФ. Согласно статье 66 ФЗ № 323 РФ, «в некоторых случаях реанимационные мероприятия не проводятся (пункт 7) – «на фоне достоверно установленных неизлечимых заболеваний».
Перед началом паллиативной седации стандартной процедурой является получение информированного согласия пациента и прикрепление этого документа к медицинской карте. Необходимо в любой ситуации уважать автономность пациента, а если он не может или не хочет участвовать в принятии решения, то следует организовать процесс принятия решения вместо пациента его родственником или назначенным законным представителем. Лучше всего, если информированное согласие будет получено у пациента до того, как возникнет необходимость начать паллиативную седацию, предпочтительно в присутствии члена его семьи или его назначенного представителя и с разрешения пациента. В таком случае пожелания пациента будут должным образом учтены, даже если в момент, когда показана паллиативная седация, у пациента уже отсутствует ясная речь.
В процессе получения согласия на встрече с членами семьи необходимо разъяснить основные моменты, в том числе рассказать о текущем состоянии пациента, прогнозе, этиологии резистентных симптомов. Кроме того, необходимо объяснить, почему есть основания полагать, что адекватное купирование симптомов невозможно обеспечить стандартными методами лечения, представить риски и преимущества паллиативной седации и подробно описать процесс седации с заранее установленными целями этого процесса.
Ведение паллиативной седации
Паллиативной седации можно достичь различными методами. Чтобы понять, какой из них будет наиболее эффективным, лечащему врачу, возможно, придется принять во внимание несколько факторов, таких как характер, начало проявления и тяжесть симптомов пациента, общий прогноз, а также цели и желания пациента/семьи.
Что касается необходимой степени седации для данного пациента, сознание пациента, согласно принципу пропорциональности, нужно снижать до уровня, который требуется для облегчения страданий от резистентных симптомов. Этот принцип помогает определиться также с моментом начала процедуры и титрованием дозы седативных средств [1].
Целью паллиативной седации является максимально возможное сохранение способности пациента взаимодействовать с близкими и в то же время обеспечение адекватного купирования его симптомов и комфортного состояния за счет поддержания минимального уровня необходимой седации.
Пожелания пациента к паллиативной седации:
Такая седация может быть обеспечена за счет успокоительных или обезболивающих препаратов, вводимых для седативного воздействия, а не просто с помощью увеличения дозы лекарств, применяемых ранее для контроля симптомов (например, опиоидов), до уровня, когда седативный побочный эффект приведет к гиперседации, поскольку это может вызвать нежелательные побочные эффекты (например, миоклонию, тошноту).
Под рукой также должен быть план лечения стационарных и амбулаторных пациентов на случай чрезвычайной ситуации. Может понадобиться купирование внезапных и тяжелых симптомов в конце жизни, таких как сильное кровотечение, терминальное кислородное голодание, мучительный болевой кризис. В этом случае, чтобы облегчить страдания неизбежно умирающего пациента, может быть показано быстрое проведение агрессивной, глубокой и непрерывной седации [1].
Фармакология паллиативной седации
В медицинском сообществе нет консенсуса или научных доказательств, касающихся наиболее подходящих препаратов для осуществления паллиативной седации. Лекарственный препарат следует выбирать, основываясь на безопасности, эффективности и доступности [6]. В таблице 1 перечислены препараты и дозировки, которые обычно используются для паллиативной седации.
Лоразепам – это бензодиазепин, действующий дольше, чем мидазолам. В жидкой форме его можно применять орально или сублингвально. Печеночная или почечная недостаточность не влияют на его выведение. Таким образом, он незаменим для хосписной помощи на дому и часто входит в хосписный набор медикаментов для облегчения симптомов, особенно в концентрированной форме [1, 6].
Среди других препаратов, широко используемых для паллиативной седации, – антипсихотический хлорпромазин, барбитураты (фенобарбитал или первоначально пентобарбитал) и анестетический пропофол.
Лекарственные препараты для проведения паллиативной седации начинают давать с минимальной дозы и постепенно титруют вверх до минимально необходимой дозы, обеспечивающей облегчение или управление рефрактерными симптомами. Дополнительные дозы могут быть введены при необходимости [6].
Важно помнить, что индивидуальные дозы могут варьироваться, поскольку они зависят от массы тела больного, функционального состояния почек и печени, статуса гидратации и наличия сопутствующих симптомов.
Краткий перечень препаратов, наиболее часто используемых для паллиативной седации, и диапазон начальных доз [1]:
Мидазолам – 0,5 до 1 мг/час внутривенно/подкожно начальная внутривенная доза, от 0,5 до 5 мг по необходимости или нагрузочная доза;
Лоразепам – 0,5 до 5 мг орально/внутривенно/сублингвально, каждые 1–2 часа по необходимости, каждые 4–6 часов по расписанию;
Хлорпромазин – 12,5 до 25 мг внутривенно/внутримышечно каждые 2–4 часа, от 25 до 100 мг ректально каждые 4–12 часов;
Фенобарбитал – 1 до 3 мг/кг нагрузочная доза внутривенно, подкожно, затем – инфузия 0,5 мг/кг/час;
Пропофол – 20 мг нагрузочная доза внутривенно, затем длительная инфузия 10 мг/ч или 2,5 до 5 мг/кг/мин и увеличивать до 10–20 мг/час каждые 10 мин по необходимости;
Галоперидол – орально/внутримышечно/внутривенно, разовая доза – 0,5 мг, суточная – 0,5–15 мг [12].
Постепенное и прогнозируемое нарушение дыхания у терминальных больных не должно использоваться в качестве основания для уменьшения седативного эффекта. Оценка пациента должна включать тяжесть страданий, уровень сознания и неблагоприятные побочные эффекты [6].
Этические вопросы
Паллиативная седация поднимает этические вопросы в тех случаях, когда сознание больного медикаментозно снижается до такой степени, что пациент не в состоянии взаимодействовать с другими людьми, не имеет возможности скорректировать или изменить свое мнение и не в состоянии принимать пищу и воду.
С целью снятия и облегчения эмоциональных нагрузок и ответственности, связанных с уходом за такими больными в конце жизни, очень важно для медицинской команды проводить периодические конференции с разбором данных случаев и оказанием психологической поддержки персоналу [6].
Литература:
Bobb. B. Nurs Clin North Am. 2016, Sep.; 51 (3): 449–57.
Понкин И. В., Понкина А. А.. Паллиативная медицинская помощь. Понятие и правовые основы. 2014.
Twycross R. Regarding Palliative Sedation. Journal of Pain and Symptom Management. 2017. https://www.clinicalkey.com/#!/content/journal/1‑s2.
Maltoni M., Scarpi E., Rosat M. et al. Palliative sedation in end-of-life care and survival: a systematic review. J. Clin. Oncol. 2012; 30 (12: 1378–83. 456.
Cherney N. I., Portenoy R. K. Sedation in the management of refractory symptoms: guidelines for evaluation and treatment. J. Palliat. Care. 1994; 11 (2): 31–38.
Bruce S. D. Palliative Sedation in End-of-Life Care. Journal of Hospice and Palliative Nursing. 2006; 8 (6): 320–327.
Morita T. Palliative sedation to relieve psycho-existential suffering of terminally ill cancer patients. J Pain Symptom Manage. 2004, Nov.; 28 (5): 445–50.
Schur S., Weixler D., Gabl C., Kreye G., Likar R., Masel E. K., Mayrhofer M., Reiner F., Schmidmayr B., Kirchheiner K., Watzke H. H. Sedation at the end of life – a nation-wide study in palliative care units in Austria. BMC Palliative Care (2016) 15:50.
Statement on Palliative Sedation. December 5, 2014. http://aahpm.org/positions/palliative-sedation.
Danis M., Bellavance E., Silverman H. Ethical considerations in managing critically ill patients. Critical Care Medicine: Principles of Diagnosis and Management in the Adult, Fourth Edition Published January 1, 2014.
Kirk T. W. National Hospice and Palliative Care Organization (NHPCO) Position Statement and Commentary on the Use of Palliative Sedation in Imminently Dying Terminally Ill Patients. Journal of Pain and Symptom Management. Vol. 39. No. 5. May 2010. P. 914–923.
Хронический болевой синдром (ХБС) у взрослых пациентов в паллиативной медицинской помощи. МКБ‑10: R52.1, R52.2, 2016.
- Кто в главе вожатый видит сон про комнату с телами мертвецов
- Кто в комедии горе от ума рассказывает о своем сне
.jpg)