кислород плохо растворяется в воде какое явление
Кислород как химический элемент
Кислород – химический элемент, свойства которого будут рассмотрены в следующих нескольких параграфах. Обратимся к Периодической Системе химических элементов Д.И. Менделеева. Элемент кислород расположен во 2 периоде, VI группе, главной подгруппе.
Там же указано, что относительная атомная масса кислорода равна 16. По порядковому номеру кислорода в Периодической Системе можно легко определить количество электронов, содержащихся в его атоме, заряд ядра атома кислорода, количество протонов. Валентность кислорода в большинстве соединений равна II. Атом кислорода может присоединять два электрона и превращаться в ион:
Стоит отметить, что кислород – самый распространенный элемент на нашей планете. Кислород входит в состав воды. Морские и пресные воды на 89% по массе состоят из кислорода. Кислород входит в состав множества минералов и горных пород. Массовая доля кислорода в земной коре составляет около 47%. В воздухе кислорода содержится около 23% по массе.
Физические свойства кислорода
При взаимодействии двух атомов кислорода образуется устойчивая молекула простого вещества кислорода O2. Данное простое вещество, как и элемент, называется кислородом. Не путайте кислород-элемент, и кислород – простое вещество!
По физическим свойствам кислород – бесцветный газ без запаха и вкуса. Практически нерастворим в воде (при комнатной температуре и нормальном атмосферном давлении растворимость кислорода составляет около 8 мг на один литр воды). Кислород растворим в воде – в 1 л воды при температуре 20°С растворяется 31 мл кислорода (0,004% по массе). Однако этого количества достаточно для дыхания рыб, живущих в водоемах. Газообразный кислород немного тяжелее воздуха:
1 л воздуха при температуре 0°С и обычном давлении весит 1,29 г, а 1 л кислорода – 1,43 г.
Кислород проявляет интересные свойства при сильном охлаждении. Так, при температуре –183°С кислород конденсируется в прозрачную подвижную жидкость бледно- голубого цвета. Если жидкий кислород охладить еще сильнее, то при температуре –218°С кислород «замерзает» в виде синих кристаллов. Если температуру постепенно повышать, то при –218°С, твердый кислород начнет плавится, а при –183°С – закипит. Следовательно, температуры кипения и конденсации, а также температуры замерзания и плавления для веществ являются одинаковыми.
Для хранения и транспортировки жидкого кислорода используют так называемые сосуды Дьюара. Сосуды Дьюара используют для хранения и транспортировки жидкостей, температура которых должна длительное время оставаться постоянной. Сосуд Дьюара носит имя его изобретателя, шотландского физика и химика Джеймса Дьюара. Простейшим сосудом Дьюара является бытовой термос. Устройство сосуда довольно простое: это колба, помещенная в большую колбу. Из герметичного пространства между колбами откачивается воздух. Благодаря отсутствию воздуха между стенками колб, жидкость, налитая во внутреннюю колбу, долгое время не остывает или не нагревается.
Кислород — парамагнитное вещество, то есть в жидком и твердом состояниях он притягивается магнитом
В природе существует еще одно простое вещество, состоящее из атомов кислорода. Это озон. Химическая формула озона О3.
Озон, так же как и кислород, в обычных условиях – газ. Озон образуется в атмосфере во время грозовых разрядов. Характерный запах свежести после грозы является запахом озона. Если озон получить в лаборатории и собрать значительное количество его, то в больших концентрациях озон будет иметь резкий неприятный запах. Получают озон в лаборатории в специальных приборах – озонаторах.
Озонатор – это стеклянная трубка, в которую подают ток кислорода, и создают электрический разряд. Электрический разряд превращает кислород в озон: В отличие от бесцветного кислорода, озон – газ голубого цвета. Растворимость озона в воде составляет около 0,5 л газа на 1 литр воды, что значительно больше, чем у кислорода. С учетом этого свойства озон применяется для обеззараживания питьевой воды, так как оказывает губительное действие на болезнетворные микроорганизмы.
При низких температурах, озон ведет себя аналогично кислороду. При температуре –112°С он конденсируется в жидкость фиолетового цвета, а при температуре –197°С кристаллизуется в виде темно-фиолетовых, почти черных кристаллов Таким образом, можно сделать вывод, что атомы одного и того же химического элемента могут образовывать разные простые вещества.
Аллотропия — это явление существования химического элемента в виде нескольких простых веществ
Простые вещества, образованные одним и тем же элементом, называют аллотропными модификациями
Значит, кислород и озон – аллотропные модификации химического элемента кислорода. Существуют данные, что при сверхнизких температурах, в жидком или твердом состоянии кислород может существовать в виде молекул О4 и О8.
Круговорот кислорода в природе
Количество кислорода в атмосфере постоянно. Следовательно, расходующийся кислород постоянно пополняется новым. Важнейшими источниками кислорода в природе является углекислый газ и вода. Кислород попадает в атмосферу главным образом в результате процесса фотосинтеза, протекающего в растениях, согласно схеме реакции:
Кислород может образовываться и в верхних слоях атмосферы Земли: вследствие воздействия солнечного излучения, водяные пары частично разлагаются с образованием кислорода. Кислород расходуется при дыхании, сжигании топлива, окислении различных веществ в живых организмах, окислении неорганических веществ, содержащихся в природе. Большое количество кислорода расходуется в технологических процессах, таких как, например, выплавка стали.
Итог статьи:
Кислород плохо растворяется в воде какое явление
1. ВВЕДЕНИЕ
Аэрацией воды называется процесс насыщения воды кислородом воздуха. Аэрация воды производится:
Аэрация обычно характеризуется следующими параметрами:
По принципу действия аэрационные установки подразделяют на:
Более подробно работу установок безнапорной и напорной аэрации воды мы рассмотрим ниже. А для того, чтобы понять, какие факторы могут повлиять на процесс аэрации воды, нам необходим анализ, как самого процесса, так и процесса растворения кислорода воздуха в воде.
2. РАСТВОРИМОСТЬ КИСЛОРОДА В ВОДЕ
Растворенный в воде кислород находится в виде гидратированных молекул О2. Содержание растворенного кислорода (в дальнейшем по тексту РК) зависит от температуры, атмосферного давления, степени турбулизации воды, количества осадков, минерализации воды др.
На содержание РК в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее.
К числу первых относят:
С = k×Р
где С – массовая концентрация газа в насыщенном растворе (моль/л); Р – парциальное давление; k – коэффициент пропорциональности, называемый константой Генри (или коэффициентом Генри).
Однако коэффициент Генри зависит от давления, хотя и в небольшой степени. Зависимость растворимости кислорода от температуры или зависимость k (Р°,Т) проявляется в уменьшении растворимости с повышением температуры.
Растворение кислорода и других газов в воде вызывает нарушение ближнего порядка, поскольку требует затраты энергии. Процесс растворения является самопроизвольным. Растворение кислорода в воде следует рассматривать как совокупность физических и химических явлений, выделяя при этом три его основных стадии:
3. МЕТОДЫ КОНТРОЛЯ СОДЕРЖАНИЯ КИСЛОРОДА В ВОДЕ
dC/dT=KL (A/V)(Cs – C), (Ф. Уитон, 1985)
Различные системы обычно сравнивают при стандартных условиях, а именно:
Поправка для перехода от стандартных условий к реальным условиям.
Чтобы перейти от стандартных условий к реальным, применяют поправочный фактор Т:
реальные условия = стандартные условия * Т
где Т – произведение трех коэффициентов: Тр, Тd, Тt.
Коэффициент Тр оценивает перенос кислорода к реальной воде по отношению к чистой (дистиллированной) воде; он зависит от состава воды (в частности от содержания ПАВ, жиров, нефтепродуктов, взвешенных веществ и пр.)
Кислород в воде
Кислород вместе с другими газами, входящими в состав воздуха, легко растворяется в воде.
Сколько же воздуха может раствориться в воде? Говорить о растворимости воздуха в целом нельзя, нужно говорить о растворимости каждой составной части воздуха в отдельности.
Кислород, азот, аргон, двуокись углерода и другие газы обладают различной растворимостью. При одинаковых температуре и давлении чистого кислорода в воде растворится почти в 2 раза больше, чем азота, а углекислого газа — в 35 раз больше, чем кислорода.
Однако существуют общие закономерности для всех газов. Чем выше температура жидкости, тем меньше растворимость газов. В литре чистой воды при нормальном атмосферном давлении, равном 760 миллиметрам ртутного столба, и при температуре 0° растворяется около 50 кубических сантиметров чистого кислорода. А при температуре 30° — примерно в 2 раза меньше. Чистого азота при температуре 0° и нормальном атмосферном давлении растворится 24 кубических сантиметра, а при температуре 30° — 14 кубических сантиметров.
Чем выше давление газа над жидкостью, тем больше его растворимость.
Если в закрытом сосуде, наполненном на одну треть водой, создать давление в 2 атмосферы, то газа растворится вдвое больше, чем при 1 атмосфере. И, наоборот: при пониженном давлении газа растворится во столько же раз меньше, во сколько ниже давление.
Два равных объема различных газов, смешанных при давлении в 1 атмосферу, растворяясь в воде, будут вести себя как два самостоятельно существующих газа, находящихся под давлением в 1/2 атмосферы. Растворимость каждого из них будет в 2 раза меньше их растворимости при нормальном атмосферном давлении.
Воздух — это смесь газов. Так как в воздухе содержится 21 процент кислорода, то его парциальное давление, то есть та часть давления, которая падает только на кислород, будет в 5 раз меньше давления воздуха. Поэтому кислорода воздуха при нормальном атмосферном давлении растворится в воде в 5 раз меньше, чем чистого кислорода при том же давлении.
В самом деле, если при нормальном давлении и при температуре 0° насытить воду не чистым кислородом, а воздухом, то в литре воды растворится только 10 кубических сантиметров кислорода вместо 50, а азота из воздуха растворится 19 кубических сантиметров вместо 24.
В воде, содержащей различные соли, растворимость газов снижается. В речной воде кислорода растворяется меньше, чем в чистой (дистиллированной), а в морской меньше, чем в речной.
Чтобы растворить газ в воде, его нужно привести в соприкосновение или перемешать с водой; чтобы вытеснить газ из воды, воду нужно подогреть. Доведя температуру воды до 100°, можно почти полностью вытеснить из нее газ.
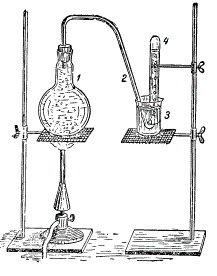
Вытеснение воздуха из воды кипячением: 1 — колба с водой; 2 — загнутая стеклянная трубка; 3 — стакан с водой; 4 — пробирка, в которую собирается вытесненный воздух
Возьмите колбу, наполненную доверху водой, закройте ее пробкой, в которую вставлена загнутая стеклянная трубка. Второй конец этой трубки вставьте в стакан с водой и наденьте на этот конец трубки наполненную водой пробирку. Доведите воду в колбе до кипения. В опрокинутой пробирке появится газ, тот самый газ, который был растворен в воде до ее кипячения.
Хотя до кипячения вода соприкасалась только с воздухом, но в силу различной растворимости кислорода и азота состав вытесненного газа будет существенно отличаться от состава обычного воздуха. В него входит 1 объем кислорода и 2 объема азота. А это означает, что в полученном газе кислорода уже не 21, как в воздухе, а 33 процента.
В обыкновенной, неочищенной воде, кроме растворенного газообразного кислорода, имеется еще кислород, входящий в состав растворенных в ней солей. Этот кислород вытеснить кипячением нельзя, так как он прочно связан с каким-нибудь другим элементом.
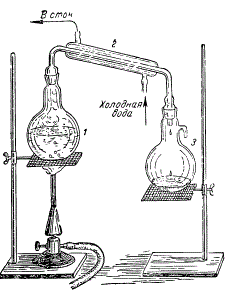
Чтобы освободить воду от солей, ее нужно перегнать.
Прибор для перегонки состоит из колбы для кипячения воды, холодильника, где конденсируются пары, и приемника, куда стекает дистиллированная вода.
Полученная таким образом вода содержит только растворенные газы, которые можно вытеснить кипячением.
Что же содержится в воде, в которой нет ни солей, ни растворенных газов?
Вода, как и всякое химическое соединение, состоит из однородных молекул.
В состав молекулы воды (Н2O) входит 2 атома водорода и 1 атом кислорода, тесно связанные между собой.
Лабораторная установка для получения дистиллированной воды: 1 — колба для кипячения воды; 2 — холодильник; 3 — приемник
Разделить, разорвать молекулу воды на ее составные части нелегко, на это нужно затратить энергию.
Молекулярный вес воды равен 18. Он состоит из 2 атомных весов водорода, равных 2 единицам, и атомного веса кислорода — 16. Следовательно, в молекуле воды содержится около 89 процентов кислорода и около 11 процентов водорода. В килограмме воды насчитывается 890 граммов кислорода.
Это означает, что все реки, моря и океаны состоят главным образом из кислорода.
Вода занимает три четверти земной поверхности.
Но в природе вода встречается не только в жидком виде. В полярных странах и на высоких горах круглый год сохраняются огромные толщи льда и снега. Большие количества воды мы встречаем в воздухе в виде пара.
Животные и растения больше чем наполовину состоят из воды. В человеческом организме, при среднем весе тела 65—70 килограммов, содержится до 40 килограммов воды.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Концентрация кислорода в воде: растворим ли он и как определяется?
Концентрация растворенного кислорода в воды — характеристика полезности и качества субстанции. В жидкости химический элемент содержится в виде молекул О2. Их объем определяет биолого-химическое и экологическое состояние субстанции. Низкая концентрация кислорода указывает на сильное биологическое или (и) химическое загрязнение воды. 
Растворимость и концентрация
ВОЗ не устанавливает особых требований к содержанию кислорода в питьевой воде. Его концентрация более важна для природных источников, ведь кислородный режим определяет экологическую чистоту и качество жизни пруда, водоема, речки и пр. А они в свою очередь влияют на окружающую обстановку. Поэтому регулярное и грамотное определение растворенного кислорода в воде играет основополагающую роль в поддержании санитарно-эпидемиологической обстановки.
Основной источник поступления молекул О2 — атмосферные воздушные массы. Поверхностные воды абсорбируют их из воздуха. Фотосинтез — второй источник. Зеленые организмы в водоемах в результате воздействия на них света активно продуцируют кислород. Незначительное его количество поступает в водоемы и подземные источники с талыми и дождевыми водами. Но несмотря на стабильное поступление О2, концентрация растворенного кислорода в воде непостоянна и изменяема:
Согласно ГОСТ, растворенный кислород в воде водоемов и прудов должен находиться в пределах 75-80% (4.5-6.5 мг/дм3). Состояние поверхностных вод в этом случае считается нормальным. Жизнедеятельность водоема и экологическая обстановка считаются допустимыми. В таблице ниже показано, при какой температуре кислород растворим в воде лучше всего.
| Растворимость, мг/дм3 | Температурная зависимость, 0С |
| 14.6 | 0 |
| 11.3 | 10 |
| 9.1 | 20 |
| 7.5 | 30 |
| 6.5 | 40 |
| 5.6 | 50 |
| 4.8 | 60 |
| 2.9 | 80 |
| 0.0 | 100 |
Влияние содержания О2 на характеристики питьевой воды
Несмотря на то, что ПДК растворенного кислорода в воде установлен только для природных источников, известно, что его низкая концентрация способствует резкому снижению качества жидкости. Малый объем О2 приводит к:
Без достаточного объема молекул О2 питьевая субстанция становится непригодной для употребления. Процессы микробиологического восстановления ухудшают ее качественный состав. Специалисты рекомендуют проводить измерения растворенного в воде кислорода, что даст возможность контролировать воздействие некачественной жидкости на организм. Устраняют проблему установкой систем фильтрации, озонирования и минерализации.
Как провести измерения объема О2 в воде?
Определить насыщенность субстанции кислородом можно в домашних условиях. Сдавать пробы в лабораторию не обязательно. Производители техники предлагают портативные приборы для определения растворенного кислорода в воде с точностью до ± 1.2-3 мг/дм3. Их используют при профессиональной оценке параметра в полевых условиях. Оборудование можно приобрести в специализированных магазинах.
Особенности портативного оборудования:
Применяют анализатор растворенного кислорода в воде для вычисления массовой концентрации О2 и температуры в поверхностных субстанциях, питьевой жидкости, водоемах и иных рыбоводческих объектах, технологических процессах. После замера, полученные данные нужно сравнить с нормами растворенного кислорода в воде из различных источников. Некоторые модели приборов проводят эту операцию автоматически. Более детальный анализ проводят, если класс качества низкий.
| Класс качества, уровень токсичности | Содержание О2 | ||
| Летний период, мг/дм3 | Зимний период, мг/дм3 | Насыщенность, % | |
| I класс, очень чистые | 9 | 13-14 | 95 |
| II класс, чистые | 8 | 11-12 | 80 |
| III класс, умеренно загрязненные | 6-7 | 9-10 | 70 |
| IV класс, загрязненные | 4-5 | 4-5 | 60 |
| V класс, грязные | 3-2 | 1-4 | 30 |
| VI класс, очень грязные | 0 | 0 | 0 |
На экологическую обстановку окружающей среды оказывают влияние и сбрасываемые в нее загрязненные воды. Они также подлежат анализу на уровень токсичности. Портативные анализаторы способны выявлять растворенный в воде кислород в сточных водах и подсчитывать его концентрацию. Результаты и более глубокие методы оценки насыщенности О2 описаны в природоохранных нормативных документах. Они доступны в сети.
1. Водоемы и показатели качества воды
А.Н. Петин, М.Г. Лебедева, О.В. Крымская
Анализ и оценка качества поверхностных вод
Учебное пособие. – Белгород: Изд-во БелГУ, 2006. – 252 с.
1. Водоемы и показатели качества воды
1.3. Растворенный в воде кислород
Растворенный кислород находится в природной воде в виде молекул O2. На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
· процесс абсорбции кислорода из атмосферы;
· выделение кислорода водной растительностью в процессе фотосинтеза;
· поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации. При каждом значении температуры существует равновесная концентрация кислорода, которую можно определить по специальным справочным таблицам, составленным для нормального атмосферного давления. Аэрация – обогащение глубинных слоев воды кислородом – происходит в результате перемешивания водных масс, в том числе ветрового, вертикальной температурной циркуляции и т.д.
Фотосинтетическое выделение кислорода происходит при ассимиляции диоксида углерода водной растительностью (прикрепленными, плавающими растениями и фитопланктоном). Процесс фотосинтеза протекает тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше биогенных (питательных) веществ (P, N и др.) в воде. Продуцирование кислорода происходит в поверхностном слое водоема, глубина которого зависит от прозрачности воды (для каждого водоема и сезона может быть различной, от нескольких сантиметров до нескольких десятков метров).
В поверхностных водах содержание растворенного кислорода варьирует в широких пределах – от 0 до 14 мг/дм 3 – и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать
2,5 мг/дм 3 растворенного кислорода. В зимний и летний периоды распределение кислорода носит характер стратификации. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в эвтрофированных водоемах, содержащих большое количество биогенных и гумусовых веществ.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/дм 3 в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже
4 мг/дм 3 в зимний период (при ледоставе) и 6 мг/дм 3 – в летний.
Определение кислорода в поверхностных водах включено в программы наблюдений с целью оценки условий обитания гидробионтов, в том числе рыб, а также как косвенная характеристика оценки качества поверхностных вод и регулирования процесса очистки стоков (табл. 15). Содержание растворенного кислорода существенно для аэробного дыхания и является индикатором биологической активности (т.е. фотосинтеза) в водоеме.
Содержание кислорода в водоемах с различной степенью загрязненности
Уровень загрязненности воды и класс качества