кальций окрашивает пламя в какой цвет
Цветное пламя: проба на окрашивание пламени
Для химика пламя не только источник тепла, но и инструмент химического анализа. Давно известно, что некоторые химические соединения, введенные в пламя, придают ему характерную окраску. В этом можно убедиться, если в любое пламя внести кусочек поваренной соли.
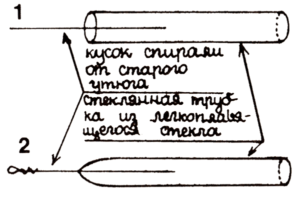
Возьмите кусок нихромовой проволоки (например, из старого утюга) длиной 10 см и выпрямите. Для опыта понадобится еще стеклянная трубка из легкоплавкого стекла. Надо заплавить проволоку в стеклянную трубку при помощи газовой горелки. Потом на конце проволоки сделайте маленькую петельку, как показано на рисунке.
Можно поступить не совсем спортивно и заменить стеклянную трубку корковой пробкой из винной бутылки.
При подведении определенного количества воздуха пламя газовой горелки становиться голубым и не коптит. Отчетливо видны в нем две части. Внутренняя часть называется восстанавливающей. Она голубого цвета и имеет сравнительно низкую температуру. Внешняя часть бесцветная — окисляющая. Температура этой части пламени равно около 1300 °С.
Растворите в нескольких миллилитрах воды, налитых в пробирку щепотку хлористого натрия. Очищенную проволоку погрузите в раствор, а потом введите в окисляющую часть пламени.
Какой великолепный эффект! Пламя в одно мгновение меняет окраску на интенсивно желтую. А теперь проверьте, содержит ли натрии вода, которую вы пьете (этот металл придает пламени желтый цвет). Результат анализа будет положительным. Можете проверить, содержат ли натрий другие вещества. Окажется, что натрий «пронырливый» металл, везде он есть, пламя всегда будет более или менее желтым.
Если вы уже знаете, как меняет окраску пламени натрий, проверьте «поведение» других металлов. Возьмите образцы солей кальция, стронция, бария, калия и меди. Лучше всего взять хлориды или нитраты. Если у вас их нет, возьмите другие соли, но помните, что сначала проволоку нужно очистить в пламени и соляной кислоте. После такой очистки опять опускайте проволоку в раствор анализируемого вещества, а затем вводите в окисляющую часть пламени.
При анализе твердых субстанций раскаленную проволоку опускают в анализируемое вещество, которое прилипает к ней и затем сплавляется в пламени горелки, образуя перл. Перл на мгновение опускают в соляную кислоту. Образующиеся при этом хлористоводородные соединения летучие и быстро испаряются с проволоки в пламени, окрашивая его в характерный цвет.
Вероятно вы удивитесь, когда начнете исследовать калий, так как цвет пламени будет такой же как в ходе анализа натрия, и лишь время от времени через желтое пламя будут проскакивать розовые отблески калия. Это потому, что натрий, содержащийся в воде, употребляемой для растворения образца, не позволяет калию показать себя в полной красоте. В пламени идет „борьба” между натрием и калием, в которой натрий побеждает. Если хотите, можете помочь победить калию. Наблюдайте через так называемое синее кобальтовое стекло. Это стекло представляет собой фильтр, который задерживает цвет натрия, пропуская цвет калия. Вы, наверное, огорчитесь, что в вашей лаборатории нет кобальтового стекла. Но не падайте духом, вместо него можно взять раствор метилового фиолетового. А если его тоже нет, растворите в воде несколько капель синих чернил. Если будете наблюдать пламя через этот раствор, увидите фиолетовую вспышку, свидетельствующую о наличии калия.
А теперь сопоставьте результаты работы:
Металл Цвет пламени
Медный факел
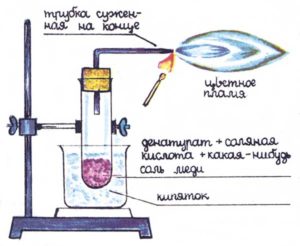
Зная, что некоторые металлы окрашивают пламя, сделайте медный «факел». Это необыкновенно интересный опыт. Соберите аппаратуру, показанную на рисунке.
Всыпьте в пробирку несколько криеталликов какой-либо соли меди, например, CuSO4 (медный купорос), и добавьте до 1/3 высоты пробирки денатурат и несколько капель разбавленной соляной кислоты Закупорьте пробирку пробкой, через которую проходит трубка, изогнутая под прямым углом и суженая на конце. Поместите пробирку в химический стакан с горячей водой, денатурат начнет испаряться, увлекая с собой соль меди. Приставьте к выходу трубки горящую спичку: пары денатурата зажгутся, а пламя приобретет зелено-синий цвет. Эффект опыта необыкновенно красив, если его наблюдать в темной комнате.
А теперь модифицируйте опыт, взяв вместо соли меди ранее употреблявшиеся химические соединения, окрашивающие пламя. А если у вас есть бура или борная кислота, проверьте, как окрашивает пламя бор. Борную кислоту можно купите в аптеке. И еще одно: не заливайте пробирку более чем на 1/3 высоты. И ни в коем случае не нагревайте пробирку горелкой!
Цветные свечи
Чтобы получить свечи с разноцветным пламенем надо добавить в расплавленный парафин соль металла, окрашивающего пламя в той или иной цвет.
Синяя свеча. Покрасить парафин в синий цвет можно стеаратом меди. Эту соль получают смешивая растворы сульфата меди и хозяйственного мыла. Пламя свечи тоже будет синим, благодаря ионам меди.
Зеленая свеча. В качестве пигмента используется зеленый оксид хрома (III). Он получается при термическом разложении бихромата аммония (опыт с вулканом). Цвет пламени тоже будет зеленым.
Желтая свеча. Желтый хромат натрия окрасит парафин и пламя свечи в желтый цвет.
Красная свеча. Парафин подкрашивают любым красным пигментом, например гуашью. Чтобы пламя было красным надо добавитькакую-либо соль стронция или лития.
Кальций окрашивает пламя в какой цвет
Ряд элементов окрашивает пламя в характерный цвет, если под воздействием тепла в пламени появляются отдельные атомы этих элементов. У некоторых элементов атомы отделяются уже при первом погружении в пламя, у иных для этого требуется обработка кислотой. Если в определителе нет других специальных указаний, то обломок минерала надо смочить каплей разбавленной соляной кислоты, которая наносится с помощью стеклянной палочки или пипетки, а затем прокалить.
Исследования в пламени проводятся двояким способом. Если в нашем распоряжении имеется газовая горелка, то на ней надо получить окислительное (несветящееся) пламя, затем взять обломок минерала пинцетом и поместить его в краевую часть пламени, примерно в 1 см от основания последнего. При этом необходимо следить, чтобы пламя не касалось пинцета, так как от этого оно бы загрязнилось и приобрело неверную окраску. По той же причине нельзя брать обломок минерала перед его прокаливанием пальцами, чтобы не вызывать загрязнения минерала и окрашивания пламени в желтый цвет (поскольку пот содержит следы поваренной соли). в той своей части, которая находится выше облом минерала (рис. 8,а).
Особенно сложно установить фиолетовую окраску калием в присутствии натрия, что характерно для полевых шпатов. В этом случае в качестве фильтра используется кобальтовое стекло, которое поглощает желтый цвет. Через него мы можем наблюдать чистый фиолетовый цвет пламени, вызванный калием (табл. 1). Таблица 1
Проба на окрашивание пламени
Присутствие металлов можно идентифицировать по цвету пламени, образующегося при их горении.
При совершении электроном квантового скачка с одной разрешенной орбитали на другую (см. Атом Бора) атом испускает свет. А поскольку энергетические уровни атомов двух элементов различны, свет, испускаемый атомом одного элемента, будет отличаться от света, испускаемого атомом другого. Это положение лежит в основе науки, которую мы называем спектроскопией (см. Открытие Кирхгофа—Бунзена).
На этом же положении (что атомы разных элементов испускают свет разной длины волны) основана проба на окрашивание пламени в химии. При нагревании в пламени газовой горелки раствора, содержащего ионы одного из щелочных металлов (то есть одного из элементов первой колонки периодической системы Менделеева), пламя окрасится в определенный цвет в зависимости от того, какой металл присутствует в растворе. К примеру, ярко-желтый цвет пламени выдает присутствие натрия, фиолетовый — калия, а карминно-красный — лития. Происходит это окрашивание пламени так: столкновение с горячими газами пламени переводит электроны в возбужденное состояние, из которого они возвращаются в исходное, одновременно испуская свет характерной длины волны.
Это свойство атомов объясняет, почему лес, прибитый к океанскому берегу, так высоко ценится для топки каминов. Долгое время находясь в море, бревна адсорбируют большое количество разных веществ, и при горении бревен эти вещества окрашивают пламя во множество разных цветов.
Химические и физические свойства кальция, его взаимодействие с водой
Пламя бывает разного цвета. Посмотрите в камин. На поленьях пляшут желтые, оранжевые, красные, белые и синие языки пламени. Его цвет зависит от температуры горения и от горючего материала. Чтобы наглядно себе это представить, вообразите спираль электрической плитки. Если плитка выключена — витки спирали холодные и черные. Допустим, вы решили подогреть суп и включили плитку. Сначала спираль становится темно-красной. Чем выше поднимается температура, тем ярче красный цвет спирали. Когда плитка разогревается до максимальной температуры, спираль становится оранжево-красной.
Естественно, спираль не горит. Вы же не видите пламени. Она просто очень горячая. Если нагревать ее дальше, то будет меняться и цвет. Сначала цвет спирали станет желтым, затем белым, а когда она раскалится еще больше, от нее будет исходить голубое сияние.
Нечто подобное происходит и с пламенем. Возьмем для примера свечу. Различные участки пламени свечи имеют разную температуру. Огню нужен кислород. Если свечу накрыть стеклянной банкой, огонь погаснет. Центральный, прилегающий к фитилю участок пламени свечи, потребляет мало кислорода, и выглядит темным. Верхушке и боковым участкам пламени достается больше кислорода, поэтому эти участки ярче. По мере того как пламя продвигается по фитилю, воск тает и потрескивает, рассыпаясь на мельчайшие частички углерода. (Каменный уголь тоже состоит из углерода.) Эти частички увлекаются пламенем кверху и сгорают. Они очень горячие и светятся, как спираль вашей плитки. Но частички углерода намного горячее, чем спираль самой жаркой плитки (температура сгорания углерода примерно 1 400 градусов Цельсия). Поэтому свечение их имеет желтый цвет. Около горящего фитиля пламя еще горячее и светится синим цветом.
От чего зависит цвет пламени
Нечто подобное происходит и с пламенем. Возьмем для примера свечу. Различные участки пламени свечи имеют разную температуру. Огню нужен кислород. Если свечу накрыть стеклянной банкой, огонь погаснет. Центральный, прилегающий к фитилю участок пламени свечи, потребляет мало кислорода, и выглядит темным. Верхушке и боковым участкам пламени достается больше кислорода, поэтому эти участки ярче.
По мере того как пламя продвигается по фитилю, воск тает и потрескивает, рассыпаясь на мельчайшие частички углерода. (Каменный уголь тоже состоит из углерода.) Эти частички увлекаются пламенем кверху и сгорают. Они очень горячие и светятся, как спираль вашей плитки. Но частички углерода намного горячее, чем спираль самой жаркой плитки (температура сгорания углерода примерно 1 400 градусов Цельсия). Поэтому свечение их имеет желтый цвет. Около горящего фитиля пламя еще горячее и светится синим цветом.
Интересно: Почему, когда темнеет, красный и синий цвета чернеют?

Температура огня на примере свечи

Зависимость цвета пламени от температуры
Как получить ровный цвет пламени?
Для исследования минералов и определения их состава используется бунзеновская горелка, дающая ровный бесцветный цвет пламени, не мешающий ходу эксперимента, изобретенная Бунзеном в середине XIX века.

Бунзеновская горелка
Бунзен был ярым поклонником огненной стихии, часто возился с пламенем. Его увлечением было стеклодувное дело. Выдувая из стекла различные хитрые конструкции и механизмы, Бунзен мог не замечать боли. Бывали, что его заскорузлые пальцы начинали дымиться от горячего еще мягкого стекла, но он не обращал на это внимания. Если боль уже выходила за грань порога чувствительности, то он спасался своим методом – сильно прижимал пальцами мочку уха, перебивая одну боль другой.
Именно он и был родоначальником метода определения состава вещества по цвету пламени. Конечно, и до него ученые пытались ставить такие эксперименты, но у них не было бунзеновской горелки с бесцветным пламенем, не мешающим эксперименту. Он вводил в пламя горелки различные элементы на платиновой проволоке, так как платина не влияет на цвет пламени и не окрашивает его.
Казалось бы, метод хороший, не нужен сложный химический анализ, поднес элемент к пламени – и сразу виден его состав. Но не тут то было. Очень редко вещества встречаются в природе в чистом виде, обычно они содержат большой набор различных примесей, изменяющих окраску.
Бунзен пробовал различные методы вычленения цветов и их оттенков. Например, пытался смотреть через цветные стекла. Скажем, синее стекло гасит желтый цвет, который дают наиболее распространенные соли натрия, и можно было различить малиновый или лиловый оттенок родного элемента. Но и с помощью этих ухищрений определить состав сложного минерала удавалось лишь раз из ста.
Это интересно! Благодаря свойству атомов и молекул испускать свет определенного цвета был разработан метод определения состава веществ, который называется спектральным анализом
. Ученые исследуют спектр, который испускает вещество, например, при горении, сравнивают его со спектрами известных элементов, и, таким образом, определяют его состав.
Видео
Цвет пламени и химический состав
Цвет пламени может меняться в зависимости от химических примесей, содержащихся в поленьях или другом горючем веществе. В пламени может находиться, например, примесь натрия. Натрий — это составная часть поваренной соли. Если натрий раскалить, он окрашивается в ярко – желтый цвет. В огонь может попасть кальций.

Цвет пламени и химический состав
Мы все знаем, что кальция много в молоке. Это металл. Раскаленный кальций окрашивается в яркий красный цвет. Если в огне горит фосфор, то пламя окрасится в зеленоватый цвет. Все эти элементы или содержатся в дереве, или попадают в огонь с другими веществами. Смешение цветов пламени, как и смешение цветов радуги, может дать белый цвет, поэтому в пламени костра или камина видны белые участки.
Смачивая медную пластинку в соляной кислоте и поднося к пламени горелки, замечаем интересный эффект – окрашивание пламени. Огонь переливается красивыми сине-зелеными оттенками. Зрелище довольно впечатляющее и завораживающее.
Медь придает пламени зеленый оттенок. При высоком содержании меди в сгораемом веществе пламя имело бы яркий зеленый цвет. Окислы же меди дают изумрудно-зеленое окрашивание. Например, как видно из ролика, при смачивании меди соляной кислотой пламя окрашивается в голубой цвет с зеленоватым оттенком. А прокаленные медьсодержащие соединения, смоченные в кислоте, окрашивают пламя в лазурно-голубой цвет.
Для справки: Зеленый цвет и его оттенки огню придают также барий, молибден, фосфор, сурьма.
Объяснение:
Почему пламя видимое? Или чем определяется его яркость?
Некоторое пламя почти не видно, а другое наоборот светит очень ярко. Например, водород горит почти совершенно бесцветным пламенем; пламя чистого спирта тоже светит весьма слабо, а свеча и керосиновая лампа горят ярким светящимся пламенем.
Дело в том, что большая или меньшая яркость всякого пламени зависит от присутствия в нем раскаленных твердых частичек.
В топливе в большем или меньшем количестве содержится углерод. Частички углерода, раньше чем сгореть, накаливаются, — оттого-то пламя газовой горелки, керосиновой лампы и свечи светит – т.к. его подсвечивают раскаленные частицы углерода.
Таким образом, можно и несветящееся или слабо светящееся пламя сделать ярким, обогащая его углеродом или раскаляя им негорючие вещества.
Как получить разноцветное пламя?
Для получения цветного пламени к горящему веществу прибавляют не углерод, а соли металлов, окрашивающих пламя в тот или иной цвет.
Стандартный способ окрашивания слабосветящегося газового пламени — введение в него соединений металлов в форме легколетучих солей — обычно, нитратов (соли азотной кислоты) или хлоридов (соли соляной кислоты):
желтое – соли натрия,
красное – соли стронция, кальция,
зеленое – соли цезия (или бора, в виде борноэтилового или борнометилового эфира),
голубое – соли меди (в виде хлорида).
В синий окрашивает пламя селен, а в сине-зеленый — бор.
Этой способностью горящих металлов и их летучих солей придавать определенную окраску бесцветному пламени пользуются для получения цветных огней (например, в пиротехнике).
Чем определяется цвет пламени (научным языком)
Цвет огня определяется температурой пламени и тем, какие химические вещества в нём сгорают. Высокая температура пламени дает возможность атомам перескакивать на некоторое время в более высокое энергетическое состояние. Когда атомы возвращаются в исходное состояние, они излучают свет с определённой длиной волны. Она соответствует структуре электронных оболочек данного элемента.
Химические свойства кальция
Кальций — активный металл, вступающий во многие взаимодействия. При нормальных условиях он легко реагирует, образуя соответствующие бинарные соединения: с кислородом, галогенами. Нажмите здесь, чтобы узнать больше о соединениях кальция. При нагревании кальций реагирует с азотом, водородом, углеродом, кремнием, бором, фосфором, серой и другими веществами. На открытом воздухе мгновенно взаимодействует с кислородом и углекислым газом, поэтому покрывается серым налетом.
Бурно реагирует с кислотами, при этом иногда воспламеняется. В солях кальций проявляет интересные свойства. Например, пещерные сталактиты и сталагмиты — это карбонат кальция, постепенно образовавшийся из воды, углекислого газа и гидрокарбоната в итоге процессов внутри подземных вод.
Из-за высокой активности в обычном состоянии кальций хранится в лабораториях в темной герметичной стеклянной посуде под слоем парафина или керосина. Качественная реакция на ион кальция — окрашивание пламени в насыщенный кирпично-красный цвет.
Какая часть пламени самая горячая?
Ученые предполагают, что люди научились использовать огонь более миллиона лет назад – когда, собственно, они еще не были homo
sapiens
. За прошедшее с тех пор время процессы горения были изучены досконально. Давайте и мы разберемся.
Горение – это ни что иное, как очень интенсивный процесс окисления. Этот процесс сопровождается излучением и выделением большого количество тепла. В природе и нашей повседневной жизни окислителем является кислород, который содержится в воздухе. Он окисляет горючее, которое чаще всего содержит углерод. В результате этой окислительной реакции образуются углекислый газ.
Если в химическом составе сгорающего вещества присутствует водород, то в процессе горения образуется вода, которая имеет высокую теплоемкость. Выделяющееся тепло частично затрачивается на то, чтобы эту воду испарить, поэтому температура горения всегда выше у тех веществ, в составе которых водород отсутствует.
Температура воспламенения большинства твердых материалов (например, дерева) составляет около 300 градусов. После возгорания температура значительно повышается. Так, например, температура горения спички может доходить до 800 и даже 1000 градусов. Одной из самых высоких температур горения обладает ацетилендинитрил: до 5000 градусов.
Конус пламени можно разделить на три основных зоны.
Самая нижняя зона – темная, горение там отсутствует, так как в эту зону кислород практически не поступает. Температура этой зоны наиболее низкая – 300-350 градусов.
Следующая зона – светящаяся, она находится чуть ниже середины конуса пламени. Это часть пламени называется восстановительной; кислород в этой зоне присутствует, но его мало, а самого топлива – много. Тут происходит его температурное разложение и неполное сгорание. Температура в этой зоне держится на уровне 600-800 градусов.
Самая верхняя зона пламени едва светится и называется окислительным пламенем. В этой зоне наблюдается избыток кислорода, поэтому окислительные процессы в продуктах сгорания идут наиболее интенсивно. Эта зона характеризуется наиболее высокой температурой, которая может достигать 1500 градусов. Таким образом, температура пламени растет от нижней части к верхней
Любопытно, что пламя в условиях невесомости кардинально меняется. На Земле наличие гравитации обуславливает конвекционные потоки, которые поднимают вверх раскаленные частички вещества и образуют характерную конусообразную форму пламени. В невесомости этого нет, поэтому процесс горения происходит у самой поверхности вещества, а пламя приобретает сферическую форму без характерных зон.
Если тебе понравится статья, жми палец вверх! Тебе не сложно, а нам приятно!
Подписывайся на канал, расскажи о нем в соцсетях, а уж мы постараемся не ударить в грязь лицом )
Кальций окрашивает пламя в какой цвет
Щелочно-земельные металлы и их соединения можно обнаружить по характерной окраске пламени: кальций окрашивает пламя в кирпично-красный цвет; стронций – в карминово-красный; барий – в желто-зеленый (яблочный).
3.12. Применение бериллия, магния и щелочно-земельных металлов и их соединений
Бериллий и сплавы на его основе используются в самолето- и ракетостроении, ядерной энергетике и при производстве рентгеновских трубок.
Оксид бериллия применяется в качестве химически стойкого и огнеупорного материала для изготовления тиглей и специальной керамики, входит в состав стеклообразующих смесей.
Магнийалюминевые сплавы (магналий, электрон) используются для изготовления деталей в самолето- и автомобилестроении.
Оксид магния применяется в сигнальных ракетах, в производстве магния, при производстве резины, для очистки нефтепродуктов, в производстве строительных и огнеупорных материалов, используется в медицине.
Горькая соль – гептагидрат сульфата магния – применяется в медицине.
Кальций служит восстановителей в металлотермии, раскислителем при выплавке стали.
Оксид и гидроксид кальция широко используются в строительстве, металлургии, при производстве стекла, сахара, бумаги и др.
Фторид кальция служит сырьем для получения плавиковой кислоты и фтора.
Стронций используется в качестве легирующей добавки при производстве сталей.
Оксид стронция применяется для поглощения рентгеновского излучения, стекла на его основе идут на производство кинескопов.
Барий используется в качестве газопоглотителя в вакуумных трубках.
Сульфат бария применяется в качестве белого пигмента, используется в медицине.