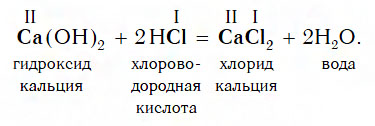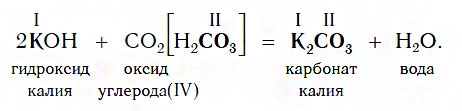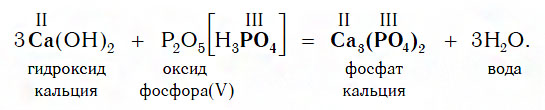какую общую формулу имеет основание
Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
ОСНОВАНИЯ
NaOH – гидроксид натрия,
KOH – гидроксид калия,
Ca(OH) 2 – гидроксид кальция,
Fe(OH) 3 – гидроксид железа (III),
Ba(OH) 2 – гидроксид бария.
Классификация оснований
Щёлочи – это основания растворимые в воде.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью как кислоты.
Классификация оснований по числу групп ОН:
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н 2 ↑
2Na + 2H 2 O = 2NaOH + H 2
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na 2 O + H 2 O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra, Sr)
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
Ме х А у + Ме * (OH) n = Me(OH) у ↓+Ме * х А n
CuSO 4 + 2 NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Классифицируйте формулы:
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P 2 O 5 , Ca(OH) 2 , CO, Al(OH) 3 , BeO, Mg(OH) 2 , K 2 O, ZnO, KOH, CrO 3
№3. Приведите по два уравнения реакций получения следующих оснований:
Урок 37. Основания
В уроке 37 «Основания» из курса «Химия для чайников» узнаем о составе оснований, выясним на какие виды они подразделяются, а также рассмотрим с чем эти сложные веществ взаимодействуют.
Существует целый класс сложных неорганических веществ, в состав которых входят атомы металлов и группы ОН. Все вещества этого класса реагируют с кислотами с образованием солей, т. е. являются как бы «основой» солей. Поэтому класс таких веществ получил название основания.
Состав оснований
Вы уже знаете, что общая формула оснований — Me(OH)x, где Me — символ какого-либо металла, а индекс х — число групп OH, соединенных с одним его атомом. Обычно это число изменяется от 1 до 3.
Напомним, что основания NaOH, KOH, Mg(OH)2, Ca(OH)2, Fe(OH)2, Cu(OH)2 относятся к основным гидроксидам.
Классификация оснований
По растворимости в воде основания делятся на растворимые и нерастворимые. К растворимым основаниям относятся NaOH, KOH, Ba(OH)2, Ca(OH)2. Они имеют общее название — щёлочи. При обычных условиях это твердые вещества белого цвета. Нерастворимыми являются основания Mg(OH)2, Al(OH)3, Zn(OH)2, Fe(OH)2, Fe(OH)3 и некоторые другие. Они также представляют собой твердые вещества, многие из которых окрашены в разные цвета (рис. 120).
На заметку: Термин «щёлочь» происходит от старорусского слова «щёлок», обозначавшего отвар чего-либо в воде. Этим словом называли, например, жидкость, которая получается при кипячении смеси воды с золой растений. Вещество, содержащееся в золе, реагирует с водой и превращается в гидроксид калия KOH. Это соединение, содержащееся в щёлоке, назвали «щёлочь». Впоследствии данный термин стали использовать для всех растворимых оснований.
Химические свойства оснований
Для оснований характерны реакции обмена с кислотами и солями, реакции соединения с кислотными оксидами и реакции термического разложения.
Изменение окраски индикаторов
Вы уже знаете, что такое индикаторы и для чего они используются. Вспомните, в какие цвета окрашиваются лакмус, метилоранж и фенолфталеин в растворах щелочей.
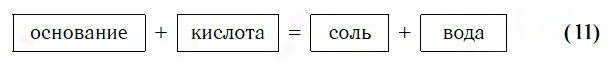
Взаимодействие с кислотами
Практически все основания реагируют с кислотами с образованием солей по общей схеме:
Пример реакции, протекающей в соответствии с указанной схемой:
В результате реакции между щелочью и кислотой образуется раствор соли, в котором уже нет ни щелочи, ни кислоты. Такой раствор называется нейтральным. Слово «нейтральный» происходит от греческого «нейтер», что в переводе на русский язык означает «ни тот ни другой».
Напомним, что реакция между щелочью и кислотой, в результате которой образуется нейтральный раствор, называется реакцией нейтрализации.
Взаимодействие с кислотными оксидами
Все щелочи реагируют с кислотными оксидами по общей схеме:
Например, если в реакцию вступает кислотный оксид CO2, которому соответствует кислота H2CO3 (указана в квадратных скобках), то в состав соли будет входить остаток этой кислоты — CO3, валентность которого, как вы уже знаете, равна II:
Если же в реакцию вступает кислотный оксид P2О5, которому соответствует кислота H3PO4 (указана в квадратных cкобках), то в составе образующейся соли будет остаток этой кислоты — PO4 с валентностью, равной III:
Взаимодействие с солями
Все щелочи реагируют с солями по общей схеме:
Реакции этого типа относятся к реакциям обмена, поскольку в процессе взаимодействия исходные вещества — щелочь и соль — обмениваются своими составными частями. При этом валентность атомов металлов и кислотных остатков не изменяется.
Термическое разложение
Все нерастворимые основания при нагревании разлагаются по общей схеме:
Краткие выводы урока:
Надеюсь урок 37 «Основания» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
2K 0 + 2 H2 + O → 2 K + OH + H2 0
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Химические свойства щелочей
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Основания — классификация, получение и свойства
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
Получение оснований
Взаимодействие активных металлов с водой (только щелочи)
Взаимодействие основных оксидов с водой (только щелочи)
Взаимодействие солей со щелочами (малорастворимые основания)
Электролиз водных растворов солей (промышленный способ)
Химические свойства оснований

В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
Многоосновные основания диссоциируют ступенчато:
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
4) Взаимодействие с солями
2Fe 3+ + 6OH — = 2Fe(OH)3.
5) Термическое разложение
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
6)Взаимодействие с неметаллами
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
Какую общую формулу имеет основание
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
Гидроксид
Основный
Амфотерный
Кислотный
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7»
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Возьмём любой амфотерный гидроксид: Al(OH)3;
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
Расставим степени окисления:
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
H2
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
Основания
Однокислотные
Двукислотные
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na + + OH ‒ + H + + Cl ‒ = Na + + Cl ‒ + H2O
Сокращенное ионное уравнение (СИУ): OH ‒ + H + = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH + + OH ‒ (первая ступень)
FeOH + ↔ Fe 2+ + OH ‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
Основания
Сильные (щелочи)
Слабые
Нерастворимы (искл. NH4OH)
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария