какую функцию выполняет миозин
Миозин
Миозин — фибриллярный белок, один из главных компонентов сократительных волокон мышц — миофибрилл. Составляет 40—60 % общего количества мышечных белков. При соединении миозина с другим белком миофибрилл (актином) образуется актомиозин — основной структурный элемент сократительной системы мышц. Другое важное свойство миозина — способность расщеплять аденозинтрифосфорную кислоту (АТФ) (В. А. Энгельгардт и М. Н. Любимова, 1939). Благодаря АТФ-азной активности миозина, химическая энергия макроэргических связей АТФ превращается в механическую энергию мышечного сокращения. Молекулярная масса миозина около 500 000. При действии протеолитических ферментов миозин распадается на фрагменты — тяжёлый меромиозин и лёгкий меромиозин (молекулярная масса около 350 000 и около 150 000). С помощью меченного тяжёлого меромиозиона при цитологических исследованиях выявляется местоположение актиновых микрофиламентов в клетке.
Содержание
Структура
Миозины — семейство белков, являющихся моторами цитоскелета системы микрофиламентов. Миозины состоят из тяжёлых цепей (H) и лёгких (L) в разном количестве в зависимости от типа миозина. H-цепь имеет 2 участка — «головку» и «хвостик». Головка тяжёлой цепи миозина имеет сайт связывания с актином и сайт связывания АТФ. По количеству «головок» миозины делятся на «традиционные» (convention myosin) — 2 головки, и нетрадиционные (unconvention myosin) — одна «головка». Традиционные миозины могут связываться между собой в протофибриллы, а нетрадиционные — не могут.
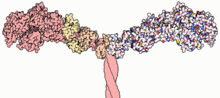
На электронных микрофотографиях молекулы миозина имеют вид палочек (1600´25) с двумя глобулярными образованиями на одном из концов. Полагают, что 2 полипептидные цепи, образующие миозина, скручены в спираль. Белки, аналогичные миозину, обнаружены в жгутиках, ресничках и других двигательных структурах у многих простейших и бактерий, сперматозоидов животных и некоторых растений.
Виды миозина
Мышечный миозин
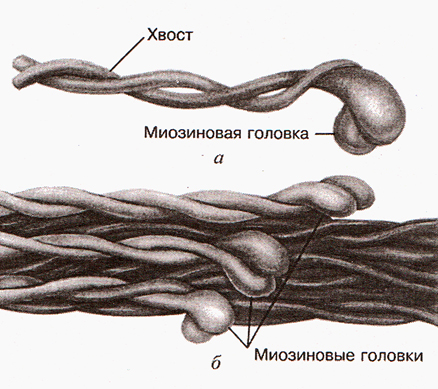
Мышечный миозин (т. н. Миозин II) — традиционного типа. Обнаруживается в поперечно-полосатой мускулатуре позвоночных и беспозвоночных животных, в гладкомышечных клетках беспозвоночных. Мышечный миозин всегда состоит из двух H-цепей, по 200 кДа каждая, образующих две «головки» молекулы и скрученный из двух хвостиков тяжёлой цепи хвост. Две лёгкие L-цепи по 18 кДа ассоциированы с тяжёлыми цепями в районе перехода от головки к хвосту. Связываясь с микрофиламентами головками попеременно, миозины как бы «шагают» по нему за счёт гидролиза макроэргической связи молекулы АТФ. При этом к хвосту молекулы может быть присоединена соседняя микрофибрилла, и тогда происходит мышечное сокращение.
Немышечный миозин
Немышечные миозины встречаются в разных клетках, в том числе в гладко-мышечных клетках позвоночных. Немышечные миозины могут быть 2-х-головые и одно-головые, то есть традиционные и нетрадиционные. Нетрадиционные миозины найдены во всех клетках. Они не могут образовывать протофиламенты. Одноголовый миозин тащит груз от (-) конца микрофиламента к (+)-концу. Миозин I — в фоторецепторах, миозин VII — в органах слуха.
См. также
Полезное
Смотреть что такое «Миозин» в других словарях:
МИОЗИН — белок мышечных волокон; образует с актином основной сократительный элемент мышц актомиозин. Обладает каталитической активностью: расщепляет аденозинтрифосфорную кислоту (АТФ) с освобождением энергии, которая используется при мышечном сокращении … Большой Энциклопедический словарь
МИОЗИН — МИОЗИН, плотный волокнистый белок, содержащийся в мышечных клетках. В процессе сокращения мышц взаимодействует с АКТИНОМ … Научно-технический энциклопедический словарь
МИОЗИН — белок сократительных волокон мышц. Молекула М. состоит из двух полипептидных цепей, скрученных в спираль. Мол. м. 47 000. Составляет 40 60% всех мышечных белков. При соединении с актином образует актомиозин осн. белок сократит, системы мышц.… … Биологический энциклопедический словарь
миозин — сущ., кол во синонимов: 1 • белок (99) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
миозин — Белок сократительных волокон мышц (содержит 2 полипептидные цепи), составляющий до 60 % всех мышечных белков, обладает АТФазной активностью; взаимодействуя с актином, М. преобразует химическую энергию АТФ в двигательную энергию мышц. [Арефьев В.А … Справочник технического переводчика
МИОЗИН — (от греч. mys, род. падеж myos мышца), белок сократит. волокон мышц. Его содержание в мышцах ок. 40% от массы всех белков (в др. тканях и клетках 1 2%). Молекула М. представляет собой длинный фибриллярный стержень (хвост), несущий на одном конце… … Химическая энциклопедия
миозин — белок мышечных волокон; образует с актином основной сократительный элемент мышц актомиозин. Обладает каталитической активностью: расщепляет аденозинтрифосфорную кислоту (АТФ) с освобождением энергии, которая используется при мышечном сокращении … Энциклопедический словарь
миозин — miozinas statusas T sritis chemija apibrėžtis Raumenų baltymas. atitikmenys: angl. myosin rus. миозин … Chemijos terminų aiškinamasis žodynas
Какую функцию выполняет миозин
• Миозиновые белки являются преобразователями энергии, которые используют АТФ для обеспечения подвижности и генерации силы, направленных вдоль актиновых филаментов
• Миозиновая подгруппа молекулярных моторов на основе актина включает в себя по меньшей мере 18 классов, причем для многих белков существует несколько изоформ
• Одни миозины обеспечивают сокращение мышц и клеток, в то время как другие обеспечивают поддержку формы мембран и везикулярный транспорт
• Миозины играют ключевую роль в регуляции формы и полярности клеток
• Миозины участвуют в процессах передачи сигнала и реализации сенсорных ощущений
Миозины представляют собой белковые моторы, использующие энергию гидролиза связанного АТФ для генерации силы, обеспечивающей подвижность вдоль актиновых филаментов. Миозины хорошо известны из-за своей роли в мышечном сокращении. Однако экспрессия миозина не ограничивается только мышцами. Эта большая группа белков, которые экспрессируются практически во всех клетках эукариот.
Различные ее представители характеризуются структурными и биохимическими особенностями, которые предназначаются для специфических клеточных нужд.
Миозиновая группа молекулярных моторов на основе актина состоит по меньшей мере из 18 классов (или семейств), причем во многих классах белки имеют несколько изоформ. Классы различаются по результатам филогенетического анализа аминокислотных последовательностей. Все миозины, за исключением миозина VI, движутся по направлению к оперенному концу актиновых филаментов. Типы и количество миозинов, которые экспрессируются в данной клетке или организме, существенно различаются.
Например, в клетках дрожжей Saccharomyces cerevisiae экспрессируются пять миозинов, принадлежащих к трем разным классам, а у человека присутствуют сорок генов из двенадцати семейств.
Представители семейства миозинов участвуют в выполнении существенных и разнообразных клеточных функций. Для них характерно наличие трех общих доменов (головной или моторный домен, регуляторный и хвостовой домены), которые эволюционировали таким образом, что приобрели характеристики, позволяющие им выполнять в клетке различные специфические механические и регуляторные функции. Моторный и регуляторный домены управляют подвижностью, хвостовой домен участвует в полимеризации миозина и в связывании с другими клеточными компонентами, необходимыми для транспорта.
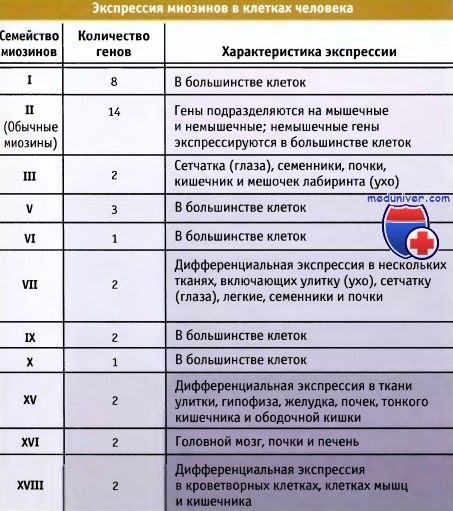
Достигнут большой прогресс в выяснении клеточных функций миозинов и их регуляции с участием моторных и хвостовых доменов. В таблице ниже представлены функции различных семейств миозина, другая таблица ниже суммирует свойства миозиновых доменов, а последняя таблица ниже содержит сведения об экспрессии миозинов человека. Все известные миозины можно подразделить на четыре больших функциональных группы.
Миозины, обеспечивающие мышечное и клеточное сокращение. Изоформы семейства миозин II генерируют усилия, вызывающие сокращение скелетных, сердечных и гладких мышц. Они также обеспечивают функционирование сократительного кольца при цитокинезе, миграцию клеток и прочие процессы, связанные с сократительной способностью клетки.
Миозины необходимы для образования и функционирования богатых актином специализированных поверхностных образований, таких как филоподии, стереоцилии и псевдоподии. Например, некоторые изоформы миозина-I связывают липиды мембраны с актиновым цитоскелетом и обеспечивают сокращение мембранных протрузий, богатых актином; изоформы миозина-П обеспечивают сокращение стресс-фибрилл и актиновых филаментов кортикального слоя клеток, участвующих в поддержании формы клетки; миозин-VII обеспечивает сокращаемую связь между актиновым цитоскелетом и внеклеточными матриксами.
В последующих статьях на сайте мы рассмотрим структуру миозина, основные механизмы генерации усилий для всех охарактеризованных миозинов, и связь этих свойств с биологической ролью содержащих их клеток.

Перечислены организмы, в которых они экспрессируются, и функции этих белков.
Для некоторых миозинов функции неизвестны. 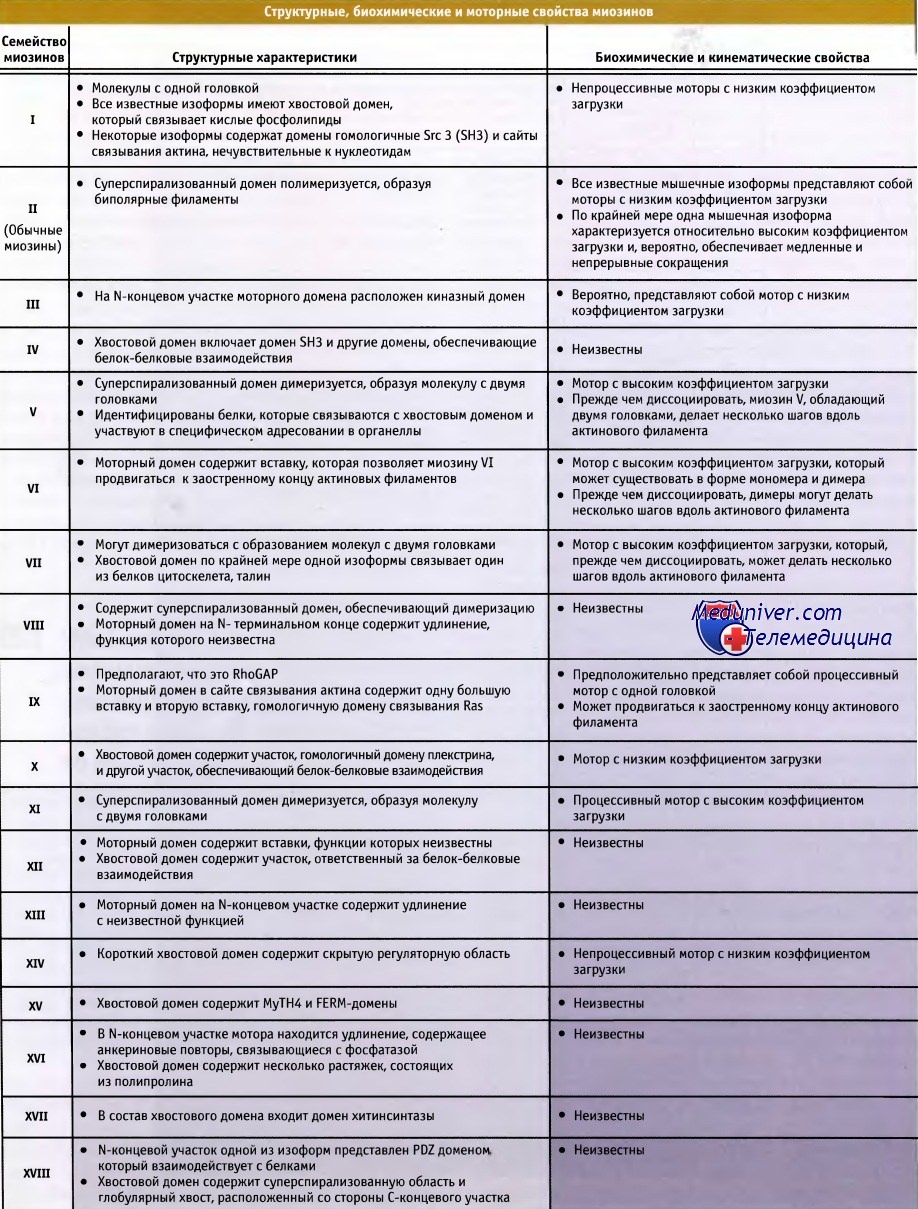
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Белки — состав, свойства и роль в диете
» data-image-caption=»» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/belki-sostav-svojstva-i-rol-v-diete-900×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/belki-sostav-svojstva-i-rol-v-diete.jpg» title=»Белки — состав, свойства и роль в диете»>
Александр Попандопуло, студент медицинского института УЛГУ. Редактор А. Герасимова
Пища человека состоит из многих ингредиентов. Они делятся на макроэлементы — белки, жиры и углеводы и микронутриенты — витамины, микроэлементы и т. д. Белок обеспечивает около 10-15%. дневной энергии. 1 грамм белка высвобождает 4 ккал.
Белок — это основной строительный блок тела. Белки расщепляются на аминокислоты, которые важны для регенерации мышц, костей, кожи, крови и других жизненно важных систем. Кроме того, они используются в синтезе нуклеиновых кислот, несущих генетическую информацию.
Функции белков
У взрослых белок составляет около 16% массы тела. Из них 43% содержатся в мышцах,15% – в коже, 16% в крови и др.
Функции белков в организме человека :
Функции белков в организме человека
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/funkcii-belkov-v-organizme-cheloveka-800×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/funkcii-belkov-v-organizme-cheloveka-800×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/08/funkcii-belkov-v-organizme-cheloveka-800×600.jpg» alt=»Функции белков в организме человека» width=»800″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2020/08/funkcii-belkov-v-organizme-cheloveka-800×600.jpg 800w, https://unclinic.ru/wp-content/uploads/2020/08/funkcii-belkov-v-organizme-cheloveka-768×576.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/funkcii-belkov-v-organizme-cheloveka.jpg 900w» sizes=»(max-width: 800px) 100vw, 800px» title=»Белки — состав, свойства и роль в диете»> Функции белков в организме человека
По питательной ценности белок делится на полезный и менее ценный. Значение зависит от набора аминокислот, которые лучше всего усваиваются человеческим организмом. Этот «набор» меняется в зависимости от физиологического развития человека.
Коллаген
Коллаген — это основной белок соединительной ткани у животных. Коллаген содержится в костях, хрящах, сухожилиях, зубах, коже, роговице, легких, печени, кровеносных сосудах и других органах и тканях. На его долю приходится около 25-30% белка млекопитающих.
У человека и позвоночных было идентифицировано двенадцать типов коллагена, состоящего из более чем 24 различных полипептидных α-спиралей. Комбинаци и этих спиралей определяют типы коллагена. Например, наиболее распространенный коллаген I типа (90% общей массы коллагена) состоит из 2 спиралей α-1 и 1 α-2.
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/struktura-kollagena-800×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/struktura-kollagena-800×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/08/struktura-kollagena-800×600.jpg» alt=»Структура коллагена» width=»800″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2020/08/struktura-kollagena-800×600.jpg 800w, https://unclinic.ru/wp-content/uploads/2020/08/struktura-kollagena-768×576.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/struktura-kollagena.jpg 900w» sizes=»(max-width: 800px) 100vw, 800px» title=»Белки — состав, свойства и роль в диете»> Структура коллагена
Коллаген отличается от других белков организма своим уникальным аминокислотным составом: 33%. из всех аминокислот составляют Gly, 10% – про, 10% – гидрокси-Pro и 1% – гидрокси-Lys. Основная структурная единица коллагена — тропоколаген, состоит из трех левовращающихся α-спиралей, скрученных в одну правовращающуюся суперспираль. Такие суперспирали связываются поперечными ковалентными связями с образованием фибрилл.
Миозин
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/molekula-miozina-801×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/molekula-miozina-801×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/08/molekula-miozina-801×600.jpg» alt=»Молекула миозина» width=»801″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2020/08/molekula-miozina-801×600.jpg 801w, https://unclinic.ru/wp-content/uploads/2020/08/molekula-miozina-768×575.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/molekula-miozina.jpg 900w» sizes=»(max-width: 801px) 100vw, 801px» title=»Белки — состав, свойства и роль в диете»> Молекула миозина
Инсулин
Это полипептидный гормон, секретируемый В-клетками поджелудочной железы. Инсулин регулирует уровень глюкозы в крови, увеличивая проницаемость клеток мышечной и жировой ткани для глюкозы.
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/insulin-749×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/insulin-749×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/08/insulin-749×600.jpg» alt=»Инсулин» width=»749″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2020/08/insulin-749×600.jpg 749w, https://unclinic.ru/wp-content/uploads/2020/08/insulin-768×615.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/insulin.jpg 900w» sizes=»(max-width: 749px) 100vw, 749px» title=»Белки — состав, свойства и роль в диете»> Инсулин
Гликоген синтезируется из глюкозы в печени и мышцах, а инсулин подавляет синтез глюкозы из других веществ (молочной кислоты, аминокислот, глицерина) в печени. При нехватке инсулина (из-за недостаточной выработки рукой или нарушения транспорта глюкозы из крови в клетки) начинается заболевание, называемое диабетом (сахарный диабет).
Аминокислоты
Белки состоят из аминокислотной цепи. Аминокислоты связываются между собой с образованием пептидных цепей, более 10 аминокислот — полипептиды.
Общая формула аминокислот H 2 N – CHR – COOH. Строение отдельных аминокислот кардинально отличается. Согласно им выделяют три основные группы аминокислот:
Алифатические кислоты делятся на моноаминомонокарбоновые и моноаминодикарбоновые кислоты. В молекуле трех аминокислот — цистеина, цистина и метионина содержится атом серы.
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/stroenie-aminokislot-842×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/stroenie-aminokislot-842×600.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/08/stroenie-aminokislot-842×600.jpg» alt=»Строение аминокислот» width=»842″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2020/08/stroenie-aminokislot-842×600.jpg 842w, https://unclinic.ru/wp-content/uploads/2020/08/stroenie-aminokislot-768×547.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/stroenie-aminokislot.jpg 900w» sizes=»(max-width: 842px) 100vw, 842px» title=»Белки — состав, свойства и роль в диете»> Строение аминокислот
Аминокислоты — бесцветные кристаллические вещества. За исключением глицина, все они имеют асимметричный атом углерода и оптически активны. Человеческий белок содержит 20 отдельных аминокислот. Некоторые из них незаменимы (существенны), другие — заменяемы, потому что их можно синтезировать.
Во время катаболизма всех аминокислот образуются шесть веществ, которые участвуют в общем катаболическом процессе. Эти вещества представляют собой пируват, ацетил-КоА, кетоглутарат, сукцинил-КоА, фумарат и оксалоацетат.
Аминокислоты, из которых промежуточные продукты цикла Кребса (α-кетоглутарат, сукцинил-КоА, фумарат) образуются во время катаболизма и впоследствии превращаются в конечный продукт оксалоацетат и могут использоваться для гликогенеза, называются гликогенными аминокислотами.
Некоторые аминокислоты превращаются в ацетоацетат или ацетил-CoA во время катаболизма и могут использоваться для синтеза ацетоновых материалов. Их называют кетогенными. Многие аминокислоты используются в синтезе веществ глюкозы и ацетона, потому что катаболизм производит два продукта, соответствующий метаболит цикла Кребса и ацетоацетат (Tyr, Phe, Trp) или ацетил-КоА (Ile). Такие аминокислоты называют смешанными или гликокетогенными.
Почти все природные аминокислоты (за исключением метионина) реагируют с α-кетоглутаровой кислотой. Эта катализируемая трансаминазой реакция дает глутаминовую кислоту и соответствующую α-кетоновую кислоту. Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию под действием каталитической глутаматдегидрогеназы.
Незаменимые аминокислоты
Некоторые аминокислоты могут вырабатываться в организме, другие необходимо получать с пищей. Есть восемь незаменимых аминокислот.
Продукты, содержащие незаменимые аминокислоты
Продукты, содержащие незаменимые аминокислоты
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/produkty-soderzhashhie-nezamenimye-aminokisloty.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/produkty-soderzhashhie-nezamenimye-aminokisloty.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/08/produkty-soderzhashhie-nezamenimye-aminokisloty.jpg» alt=»Продукты, содержащие незаменимые аминокислоты» width=»900″ height=»474″ srcset=»https://unclinic.ru/wp-content/uploads/2020/08/produkty-soderzhashhie-nezamenimye-aminokisloty.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/08/produkty-soderzhashhie-nezamenimye-aminokisloty-768×404.jpg 768w» sizes=»(max-width: 900px) 100vw, 900px» title=»Белки — состав, свойства и роль в диете»> Продукты, содержащие незаменимые аминокислоты
Важность некоторых аминокислот зависит от стадии физиологического развития человека. Например, в детстве очень важна одна аминокислота, а для взрослых она уже не важна. Пример: аргинин, гистидин, цистеин, глицин, тирозин, глутамин, пролин. Эти аминокислоты очень важны для детей, потому что детский организм не может их синтезировать из-за повышенной потребности. Во время метаболического стресса синтез глутамина может быть недостаточным, что делает его в таких случаях незаменимым.
Тирозин
Тирозин — ароматическая аминокислота, одна из двадцати аминокислот, необходимых для синтеза белка. Он образован из фенилаланина и других аминокислот. Тирозин участвует в синтезе адреналина, норадреналина, серотонина и дофамина.
Для правильного метаболизма тирозина в мозге необходимы витамин B 6 (пиридоксин) и фолиевая кислота. Тирозин используется для синтеза белков, катехоламинов, гормонов щитовидной железы, меланинов и может расщепляться на конечные метаболиты CO 2, H 2 O, NH + и энергию.
Между тирозином и α-кетоновой кислотой происходит реакция пераминирования, в результате чего п-гидроксифенилпируват вступает в реакцию с O 2.образуется гомогентизат. Ароматическое кольцо гомогентизата далее разрушается молекулярным кислородом с образованием малеилацетата. Он изомеризуется в фумарилацетоацетат, который гидролизуется до фумарата и ацетоацетата.
Недостаток тирозина снижает синтез белка, отмечается повышенная утомляемость, признаки депрессии, нарушение функции печени, снижение активности щитовидной железы. Очень серьезный дефицит тирозина может возникнуть при генетическом заболевании — фенилкетонурии, при котором организм не может метаболизировать аминокислоту фенилаланин, поэтому ее необходимо исключить из рациона. В отсутствие фенилаланина тирозин не может образовываться.
Недостаток тирозина снижает активность щитовидной железы
Недостаток тирозина снижает активность щитовидной железы
» data-medium-file=»https://unclinic.ru/wp-content/uploads/2020/08/nedostatok-tirozina-snizhaet-aktivnost-shhitovidnoj-zhelezy-900×600.jpg» data-large-file=»https://unclinic.ru/wp-content/uploads/2020/08/nedostatok-tirozina-snizhaet-aktivnost-shhitovidnoj-zhelezy.jpg» loading=»lazy» src=»https://unclinic.ru/wp-content/uploads/2020/08/nedostatok-tirozina-snizhaet-aktivnost-shhitovidnoj-zhelezy-900×600.jpg» alt=»Недостаток тирозина снижает активность щитовидной железы» width=»900″ height=»600″ srcset=»https://unclinic.ru/wp-content/uploads/2020/08/nedostatok-tirozina-snizhaet-aktivnost-shhitovidnoj-zhelezy.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/08/nedostatok-tirozina-snizhaet-aktivnost-shhitovidnoj-zhelezy-768×512.jpg 768w» sizes=»(max-width: 900px) 100vw, 900px» title=»Белки — состав, свойства и роль в диете»> Недостаток тирозина снижает активность щитовидной железы
Биологическая ценность белков
Биологическую ценность белков определяют аминокислоты. Белки со всеми незаменимыми аминокислотами в достаточном количестве, имеют высокую биологическую ценность. Белки с высокой биологической ценностью содержатся в источниках животного происхождения: мясе, яйцах, молочных продуктах, рыбе.
Если в белке нет одной или нескольких незаменимых аминокислот, его биологическая ценность низкая. Как правило, белки растительного происхождения имеют низкую биологическую ценность. Если питательная ценность ежедневного рациона слишком низкая, для выработки энергии используются белки организма.
Дефицит белка часто встречается у пациентов, перенесших операцию, и у пожилых людей. Дефицит белка возникает при заболеваниях почек, серьезных травмах, ожогах, сепсисе, мальабсорбции. Дефицит белка вызывает потерю мышечной массы, плохое заживление ран, восприимчивость к инфекциям, отек и ожирение печени.
Миозин в мышечных волокнах
Дана характеристика молекулы миозина: длина, толщина и молекулярная масса. Описана также структура молекулы миозина: головок и хвоста. Подробно описано формирование толстого филамента путем самосборки и факторы, отрицательно влияющие на этот процесс.
Миозин в мышечных волокнах
Основу толстого филамента саркомера (миофибриллы) составляет белок миозин. Впервые белок миозин был выделен из скелетных мышц в начале XX века.
Характеристика молекулы миозина
Молекула белка миозина (миозина II типа), который участвует в сокращении саркомера, имеет молекулярную массу 500 кДа. Длина молекулы равна 150 нм, а толщина – 2 нм. Молекула миозина образована четырьмя полипептидными цепями, две из которых (тяжелые) имеют молекулярную массу по 200 кДа, а две – легкие 20 и 17 кДа.
Рис. 1. Состав и структура молекулы миозина
Состав и структура молекулы миозина
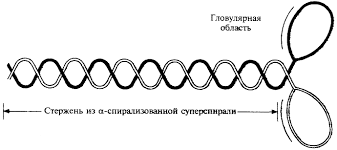
Молекула миозина состоит из «хвоста» или «стержня» и двух «головок» (рис.1). Хвост миозина состоит из двух цепей, каждая из которых свернута в α-спираль. Две α-спирали дополнительно скручены в суперспираль. Эта суперспираль является стержнем (хвостом) миозиновой молекулы. Ее длина равна 135 нм.
Соединение между головкой и стержнем молекулы миозина подобно шарниру. Это позволяет головкам наклоняться и прикрепляться к молекулам актина.
АТФ-азная активность миозина
В 1939 году советскими учеными В.А. Энгельгардом и М.Н. Любимовой было установлено, что молекула миозина обладает АТФ-азной активностью, то есть участвует в реакции гидролиза АТФ – основной реакции энергообеспечения мышечной деятельности энергией. Позже было установлено, что на каждой миозиновой головке имеются центры. В одном из них находится фермент АТФ-аза. Другой центр предназначен для связывания головки миозина с тонким филаментом (рис.2).
Рис.2. Молекула миозина состоит из двух длинных полипептидов (тяжелых цепей), формирующих две глобулярные головки и стержнеобразный хвост, участвующий в образовании толстого филамента. Головки содержат актин-связывающие участки (А) и моторные области (М), где происходит связывание и расщепление АТФ. Вблизи головок с тяжелыми цепями ассоциированы две пары легких цепей, одна из которых содержит участок фосфорилирования (Ф).
В настоящее время на основе степени активности фермента АТФ-азы производится разделение мышечных волокон на типы.
Формирование толстого филамента
Несколько сотен миозиновых молекул способны самопроизвольно собираться в пучок. При таком объединении молекулы миозина располагаясь параллельно друг другу с некоторым сдвигом образуют своеобразный «ствол» (рис.2). Толщина «ствола» составляет 11-14 нм. В середине «ствола» переплетаются хвосты молекул миозина, а с двух концов «ствола» торчат головки. Это и есть толстый филамент (рис. 3 и рис.4).
Рис.3. Молекула миозина и толстый филамент
Установлено, что агрегация (самосборка) толстого филамента очень чуствительна к рН саркоплазмы. Если рН саркоплазмы находится вне физиологических значений (рН = 7,2-7,5), самосборка толстых филаментов происходит нерегулярно и возникают очень длинные разветвляющиеся структуры (Дж. Бендолл, 1970). Из этого следует, что синтез белков, пока в мышечных волокнах много молочной кислоты (лактата) отставлен, так как могут синтезироваться «неправильные» толстые филаменты, саркомеры и миофибриллы.