хрустальные дети что это
Что такое несовершенный остеогенез?
Несовершенный остеогенез, в народе «хрустальная болезнь» – генетически обусловленное заболевание, для которого характерен дефект структурного белка костной ткани, приводящий к ее неправильному формированию.
Несовершенный остеогенез – наследственная болезнь, характеризующаяся нарушением костеобразования (остеогенеза). В результате возникает генерализованный остеопороз и повышенная ломкость костей.
Заболевание имеет множество названий: несовершенный остеогенез, врожденная хрупкость костей, внутриутробный рахит, периостальная дистрофия, болезнь Лобштейна (Вролика), врожденная остеомаляция и др. Заболевание неизлечимо, но возможно существенно облегчить и нормализовать жизнь больных детей.
Болезнь Лобштейна возникает в результате врожденного нарушения обмена белка соединительной ткани коллагена 1-го типа, вызванного мутациями генов, кодирующих коллагеновые цепи.
Патология может наследоваться по аутосомно-доминантному или аутосомно-рецессивному типу. У половины всех больных недуг развивается из-за случайных мутаций. Периостальная дистрофия характеризуется нарушением структуры коллагена или недостаточного его синтеза.
Нехватка коллагена приводит к нарушению периостального и эндостального окостенения при нормальном элифизаторном росте костей.
Классификация Сайленса является общепризнанной во всем мире для несовершенного остеогенеза.
| Тип болезни Вролика-Лобштейна | Механизм наследования | Дентинообразование | Структурное изменение костей | Возникновение деформации костных структур | Цвет склер | Возникновение деформации позвоночника | Возникновение изменения структуры черепа |
| I A | Аутосомно-доминантный | Обычное | Умеренно выражено | Средней степени тяжести | Голубой | В 21 % случаев происходит возникновение кифоза или кифосколиоза | Есть вставочные (вормиевы) костные структуры |
| I B | Аутосомно-доминантный | Является несовершенным | Не изучено | Нет данных | Нет сведений | Не изучена | Нет данных |
| II | Аутосомно-доминантный, спонтанными мутациями, семейного мозаицизма | Нет сведений | Сильно выражено | Множество переломов | Голубой | Не изучена | Есть вормиевы кости и отсутствует оссификация |
| III | Аутосомно-доминантный, редко аутосомно-рецесссивный путь, семейного мозаицизма | Является несовершенным | Сильное | Прогрессирующая деформация позвоночника и длинных костей | Голубой при рождении и белого цвета во взрослом возрасте | В виде кифосколиоза | Формируется гипоплазия вставочных костных структур |
| IV A | Аутосомно-доминантный | Обычное | Умеренно выражено | Умеренно выражены | Белый | В виде кифосколиоза | Формируется гипоплазия вставочных костных структур |
| IV B | Аутосомно-доминантный, семейного мозаицизма | Является несовершенным | Нет данных | Нет сведений | Не изучен | Нет сведений | Сведения отсутствуют |
Для определения стадии, течения и прогноза несовершенного остеогенеза, специалисты применяют дополнительную классификацию.
Стадии болезни Лобштейна развиваются:
В зависимости от времени возникновения недуга, он бывает:
Типы костных трансформаций у ребенка:
Некоторые врачи выделяют девятый тип данного недуга. Для него характерно крайне тяжелое течение, существенная задержка роста, выраженные искривления и высокая смертность.
Несовершенный остеогенез
Несовершенный остеогенез – генетически обусловленная патология опорно-двигательного аппарата, характеризующаяся хрупкостью костной ткани и подверженностью ребенка частым переломам при минимальном воздействии или в отсутствие травмы. Кроме патологических переломов, при несовершенном остеогенезе у детей отмечаются деформации костей, аномалии зубов, атрофия мышц, гипермобильность суставов, прогрессирующая тугоухость. Диагноз несовершенного остеогенеза устанавливается с учетом анамнестических, клинических, рентгенологических данных, генетического тестирования. Лечение несовершенного остеогенеза включает профилактику переломов, бальнеотерапию, массаж, гимнастику, УФО, прием витамина D, препаратов кальция, фосфора, применение бисфосфонатов; при переломах – репозицию и гипсовую фиксацию отломков.
Общие сведения
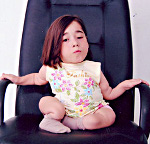
Несовершенный остеогенез – наследственная патология, в основе которой лежит нарушение костеобразования (остеогенеза), приводящее к генерализованному остеопорозу и повышенной ломкости костей. Несовершенный остеогенез известен в литературе под различными названиями: врожденная хрупкость костей, внутриутробный рахит, периостальная дистрофия, болезнь Лобштейна (Фролика), врожденная остеомаляция и др. Из-за повышенной хрупкости костей и склонности к множественным переломам детей, страдающих несовершенным остеогенезом, часто называют «хрустальными детьми». Несовершенный остеогенез встречается с частотой 1 случай на 10 000-20 000 новорожденных. Несмотря на то, что как любое генетическое заболевание, несовершенный остеогенез неизлечим, сегодня существует возможность значительно облегчить и даже нормализовать жизнь «хрупких детей».
Причины несовершенного остеогенеза
Развитие несовершенного остеогенеза связано с врожденным нарушением обмена белка соединительной ткани коллагена 1-го типа, обусловленным мутациями генов, кодирующих коллагеновые цепи. В зависимости от формы заболевание может наследоваться по аутосомно-доминантному или аутосомно-рецессивному типу (менее 5%). Примерно в половине случаев патология возникает вследствие спонтанных мутаций. При несовершенном остеогенезе нарушается структура коллагена, входящего в состав костей и других соединительных тканей, либо синтезируется его недостаточное количество.
Нарушение синтеза коллагена остеобластами приводит к тому, что, несмотря на нормальный эпифизарный рост кости, нарушается периостальное и эндостальное окостенение. Костная ткань имеет пористое строение, состоит из костных островков и многочисленных пазух, заполненных рыхлой соединительной тканью; кортикальный слой истончен. Это обусловливает снижение механических свойств и патологическую ломкость костей при несовершенном остеогенезе.
Классификация несовершенного остеогенеза
Согласно классификации Д.О. Сайлленса, 1979 г., выделяют 4 генетических типа несовершенного остеогенеза:
IV тип – наследуется аутосомно-доминантным путем. Характеризуется маленьким ростом, деформацией скелета, часто переломами костей, несовершенным дентиногенезом, нормальными склерами.
В течении несовершенного остеогенеза выделяют четыре стадии: латентную стадию, стадию патологических переломов, стадию глухоты и стадию остеопороза.
Как составная часть различных наследственных синдромов, несовершенный остеогенез может сочетаться с микроцефалией и катарактой; врожденными контрактурами суставов (синдром Брука) и др.
Симптомы несовершенного остеогенеза
Манифестация и тяжесть клинических проявлений несовершенного остеогенеза зависит от генетического типа заболевания.
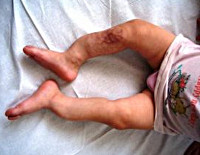
Поздняя форма несовершенного остеогенеза характеризуется типичной триадой симптомов: повышенной ломкостью костей, главным образом, нижних конечностей, синевой склер и прогрессирующей тугоухостью (глухотой). В раннем возрасте отмечается позднее закрытие родничков, отставание ребенка в физическом развитии, разболтанность суставов, атрофия мышц, подвывихи или вывихи. Переломы костей у ребенка с несовершенным остеогенезом могут возникать во время пеленания, купания, одевания ребенка, во время игр. Неправильное сращение патологических переломов часто приводит к деформации и укорочению костей конечностей. Переломы костей таза и позвоночника случаются реже. В старшем возрасте развиваются деформации грудной клетки и искривление позвоночника.
Несовершенный дентиногенез проявляется поздним прорезыванием зубов (после 1,5 лет), аномалиями прикуса; желтой окраской зубов («янтарные зубы»), их патологическим стиранием и легким разрушением, множественным кариесом. Вследствие выраженного отосклероза к 20-30 годам развиваются тугоухость и глухота. В постпубертатном периоде склонность к переломам костей уменьшается.
Сопутствующие проявления несовершенного остеогенеза могут включать пролапс митрального клапана, митральную недостаточность, чрезмерную потливость, камни в почках, пупочные и паховые грыжи, носовые кровотечения и др. Умственное и половое развитие детей при несовершенном остеогенезе не страдает.
Диагностика
Пренатальная диагностика позволяет выявить тяжелые формы несовершенного остеогенеза у плода с помощью акушерского УЗИ, начиная с 16 недели беременности. Иногда для подтверждения предположений проводится биопсия ворсин хориона и ДНК-диагностика.
В типичных случаях диагноз несовершенного остеогенеза ставится на основании клинико-анамнестических и рентгенологических данных. Обычно грубые морфологические и функциональные изменения выявляются на рентгенограммах трубчатых костей: выраженный остеопороз, истончение кортикального слоя, множественные патологические переломы с образованием костных мозолей и т. д.
Достоверность диагноза подтверждается гистоморфометрическим исследованием костной ткани, полученной во время пункции подвздошной кости, и структуры коллагена 1 типа в биоптате кожи. С целью выявления характерных для несовершенного остеогенеза мутаций выполняется молекулярно-генетический анализ.
В рамках дифференциальной диагностики несовершенного остеогенеза необходимо исключение рахита, хондродистрофии, синдрома Элерса-Данлоса.
Больные с несовершенным остеогенезом нуждаются в наблюдении детского травматолога-ортопеда, педиатра, стоматолога, детского отоларинголога, генетика.
Лечение несовершенного остеогенеза
Терапия несовершенного остеогенеза, главным образом, паллиативная, направленная на улучшение минерализации костной ткани; предотвращение переломов; физическую, психологическую и социальную реабилитацию.
Реабилитация детей, страдающих несовершенным остеогенезом, проводится группой специалистов: педиатром, детским ортопедом, физиотерапевтом, специалистом ЛФК, детским психологом и др. Детям может потребоваться ношение специальной ортопедической обуви, ортезов, стелек, корсетов.
Прогноз и профилактика
Дети с врожденной формой несовершенного остеогенеза погибают в первые месяцы и годы жизни от последствий множественных переломов и септических осложнений (пневмонии, отита, сепсиса). Поздняя форма несовершенного остеогенеза протекает более благоприятно, хотя и ограничивает качество жизни.
Профилактика сводится в основном к правильному уходу за ребенком, проведению лечебно-реабилитационных курсов, предупреждению бытовых травм. Наличие в семье больных с несовершенным остеогенезом служит прямым показанием к медико-генетическому консультированию.
Хрустальная болезнь, или 8 генетических типов несовершенного остеогенеза
Болезнь хрустальная относится к редким генетическим патологиям, при которых происходят нарушения в строении и развитии опорно-двигательной системы, что приводит к высокой ломкости костей. В медицине это заболевание называют несовершенным остеогенезом. Что собой представляет эта болезнь? Каковы признаки и симптомы недуга, какие методы лечения существуют? Попробуем ответить на все эти вопросы.
Что собой представляет несовершенный остеогенез?
Хрустальная болезнь костей – наследственное заболевание. При этой патологии костные ткани становятся очень хрупкими, из-за чего у больного человека часто случаются переломы, которые возникают при малейшем воздействии и даже при отсутствии каких-либо травм. У пациентов с таким диагнозом нередко отмечают другие патологические проявления в виде:
В различных источниках болезнь несовершенный остеогенез имеет несколько названий:
Причины появления такой патологии кроются в генетических изменениях, приводящих к нарушению образования костных тканей. У человека возникает генерализированный остеопороз, а кости становятся хрупкими.
Заболевание довольно редкое. Согласно статистическим данным, оно встречается у 1 ребенка из 10-20 тысяч рожденных детей. Болезнь считается неизлечимой, хотя в современной медицине есть множество способов улучшить состояние больного и облегчить жизнь детям с такой генетической патологией.








Лечение «хрустальных детей»
Вследствие того, что синдром Вролика является генетической патологией, терапия будет только симптоматической. То есть будет нацелена на то, чтобы улучшить минерализацию костей, предотвратить возникновение переломов и на реабилитационные мероприятия.
Малышу с «хрустальной болезнью» нужен щадящий режим, а также необходимо проведение лечебно- гимнастических упражнений, массажей, гидротерапии, физиотерапевтических процедур. Из лекарств ребёнку с данной патологией производится назначение поливитаминов, витамина D, гормональных препаратов (содержащих соматотропный гормон).
Для повышения синтезирования коллагена производится назначение соматотропина.
Улучшения клинической картины можно достичь путём назначения биофосфатов, так как они тормозят деструкцию костных структур.
При переломах нужна тщательная репозиция костей и гипсовая иммобилизация. Если у ребёнка выраженная деформация костных структур, то он нуждается в хирургическом лечении. Таким детям проводится корригирующая остеотомия и интрамедуллярный или надкостный остеосинтез.
Почему возникает болезнь
Медики отмечают две основных причины появления заболевания:
Болезнь «хрустальная кость» является генетической патологией, поэтому в большинстве случаев она встречается у детей, родственники которых имеют такое же заболевание. Но бывают редкие случаи, когда у ребенка обнаруживают несовершенный остеогенез, тогда как родители абсолютно здоровы. Появление такой патологии связано с возникновением спонтанной мутации.
Существует несколько типов заболевания, которые характеризуются различной симптоматикой и развитием структуры костных тканей. Подробно рассмотрим каждую стадию болезни.
Профилактика заболевания
Любую болезнь лучше предупредить, чем потом лечить. Но как же поступить в отношении заболевания, которое на начальных стадиях себя никак не проявляет? Существует специальный метод диагностики, благодаря которому можно с максимальной точностью выявить изменения плотности костных тканей.
Ультразвуковая методика, называемая денситометрия, выявляет снижение плотности даже при таких показателях, как на 3-5%. Другие аппаратные методики, к сожалению, неэффективны для раннего реагирования. Так, например, рентгенограмма укажет на проблему, когда снижение плотности достигнет 25-30%.
Выделяют еще несколько признаков, которые могут косвенно указать на протекание патологического процесса в костях:
В качестве профилактических мер рекомендовано вести здоровый, физически активный образ жизни:
правильное питание: капуста, орехи, злаковые и бобовые, кисломолочные продукты, сухофрукты, все виды зелени, садово-огородные культуры в большом количестве;
На предмет комплекса упражнений лучше проконсультироваться с врачом или фитнес-инструктором. Улучшение состояния отмечается уже после первого месяца профилактических мероприятий – увеличение косной массы на пару-тройку процентов.
Слабая форма
Около 50 % всех больных несовершенным остеогенезом имеют первый тип этой патологии. Хрустальная болезнь у детей (фото в статье) сопровождается частыми переломами, но по достижении 10-летнего возраста риск травмирования костных тканей снижается. Людям после 40 лет стоит быть осторожнее, так как угроза ломкости костей вновь возрастает.
При слабой форме заболевания нередко наблюдаются кровотечения из носовой полости, это связано с некоторыми изменениями, происходящими в аорте.
Остеопороз разрушение костной ткани, причины симптомы и лечение заболевания
Остеопороз — это патология, которая вызывается разрушением костной ткани. Специалисты не зря считают её «безмолвной эпидемией», ведь заболевание годами протекает совершенно бессимптомно, а кости в это время постоянно теряют плотность и приобретают чрезмерную хрупкость. Не сложно догадаться, к каким последствиям это приводит. Даже от простого неловкого выполненного движения, или просто уронив на ногу увесистый предмет можно «заработать» перелом конечности. По статистике половина женщин, возраст которых перевалил за 50 лет, и 20% зрелых мужчин имеют явные признаки остеопороза, Женщин эта болезнь поражает намного чаще, в связи с тем, у них в организме в период менопаузы прекращается выработка эстрогенов, поддерживающих прочность костей. Помимо принадлежности к слабому полу в группу риска по развитию патологии могут попасть следующие категории людей:
Стоит вспомнить и о тех, кто имеет отягощённую наследственность, является приверженцем пагубных привычек, включая и злоупотребление кофе, а также ведёт малоподвижный образ жизни. Всем этим людям остеопороз грозит в первую очередь. Нередко можно услышать вопрос о том, почему же возникает эта болезнь и каков механизм её развития. Основным фактором, провоцирующим её возникновение, является излишнее выведение из организма кальция, в результате чего возникает его дефицит. Когда нехватка этого необходимого химического элемента становится заметной, он начинает вымываться в кровь из скелета. Если его не восполнять извне, это становится очень опасным, так как кальциевые депо, имеющиеся в костях, постепенно полностью истощаются, что непосредственно и приводит к началу развитию остеопороза.
Перинатально-летальная форма
В большинстве случаев второй тип несовершенного остеогенеза приводит к смерти ребенка еще в утробе матери. Заболевание может стать причиной преждевременных родов на ранних сроках вынашивания.
Эту форму болезни разделяют на три группы, каждой из которых свойственны определенные характеристики:
Деструктивные изменения позвоночника
Деструкция кости – это опасный процесс, дальнейшее развитие которого необходимо предупредить при первых признаках патологии. Деструктивные изменения затрагивают не только костную ткань зуба, без соответствующего лечения они могут распространяться и на другие кости в организме. Например, в результате развития спондилита, гемангиомы деструктивные изменения затрагивают позвоночник в целом или позвонковые тела в отдельности. Патология позвоночника может привести к нежелательным последствиям, осложнениям, частичной или полной потере подвижности.
Спондилит – заболевание, хронически воспалительного характера, является разновидностью спондилопатии. В процессе развития болезни отмечается патология тел позвонков, их разрушение, что грозит деформацией позвоночника.
Встречается специфический и неспецифический спондилит. Специфический спондилит вызывают разные инфекции, которые попадают в кровь и с ее помощью разносятся по всему организму, поражая на своем пути кости и суставы. К инфекционным возбудителям относятся микробактерии:
Иногда недуг могут спровоцировать грибковые клетки или ревматизм. Неспецифический спондилит встречается в виде гематогенного гнойного спондилита, болезни Бехтерева или анкилозирующего спондилоартроза.
Независимо от причины развития заболевания, к лечению необходимо приступать сразу после диагностики.
Рост костей нарушен
Третий тип имеет характерную особенность – рост костей нарушен. Такой вид патологии встречается очень редко. Притом что новорождённый маленького роста, его вес может соответствовать норме. У больных несовершенным остеогенезом такого типа часто диагностируют проблемы с кровеносной системой. Именно эта проблема становится причиной летального исхода. У новорожденных с нарушенным ростом костей часто случаются переломы в процессе родов.
Методы диагностики
Хрустальная болезнь (фото представлены в статье) может быть диагностирована у плода еще в утробе матери. Узнать об имеющейся патологии можно при прохождении УЗИ. Если есть подозрения на нарушения в синтезе коллагена, понадобятся дополнительные исследования. Для этого у беременной женщины берут на анализ амниотическую жидкость и ткани эпителия.
Как только малыш появился на свет, необходимо провести комплексное обследование, которое включает в себя:
Полученные результаты дают возможность врачам подобрать эффективную схему терапии.
Болезнь Стилла взрослых: особенности клинического течения и трудности диагностики
Болезнь Стилла взрослых – это мультисистемное воспалительное заболевание неизвестной природы, ведущими симптомами которого являются поражение суставов, лихорадка, кожная сыпь и нейтрофильный лейкоцитоз при отсутствии ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду в сыворотке крови и синовиальной жидкости. Помимо описанных проявлений болезни могут развиваться лимфаденопатия, серозиты, поражение органов ретикулоэндотелиальной системы. Стоит отметить, что заболевание не имеет патогномоничных симптомов или специфических изменений при лабораторном и инструментальном обследовании, поэтому болезнь Стилла является диагнозом исключения [1]. Первое упоминание о симптомокомплексе, включающем лихорадку, сыпь и артралгии, появилось в журнале Lancet в 1896 г. [2]. Тогда он был расценен как проявление ревматоидного артрита у взрослого человека. В 1897 г. английский педиатр Джордж Стилл выпустил монографию под названием «Одна из форм поражения суставов у детей», где описал 12 случаев с подобной клинической картиной среди 22 детей с ювенильным ревматоидным артритом. Впоследствии этот симптомокомплекс был назван в честь него «болезнью Стилла» [3]. В дальнейшем подобные случаи, описанные у взрослых, относили к лихорадке неясного генеза. В 1966 г. Эрик Байвотерс впервые использовал термин «болезнь Стилла взрослых» в выступлении на Геберденовских чтениях, отметив, что признаки болезни Стилла у взрослых он считает самостоятельной нозологией, а в 1971 г. Э. Байвотерсом были опубликованы многочисленные наблюдения этого заболевания у взрослых [4].
Болезнь Стилла взрослых – это относительно редкое заболевание. Частота заболеваемости, по различным данным, составляет около 0,16–1,5 случаев на 100 тыс. населения. Мужчины и женщины болеют приблизительно с одинаковой частотой. Болезнь Стилла взрослых поражает лиц любого возраста, однако пик заболеваемости приходится на молодой (15–25 лет) и средний (35–46 лет) возраст [5]. В настоящее время этиология болезни Стилла неизвестна. Существует несколько теорий появления заболевания. Инфекционная теория подразумевает возникновение болезни Стилла как реактивного синдрома в ответ на инфицирование либо бактериальными микроорганизмами (Yersinia enterocolitica, Mycoplasma pneumonia), либо вирусами (вирус краснухи, вирус Эпштейна–Барр, цитомегаловирус, вирус парагриппа). Генетическая теория предполагает связь заболевания с изменениями в структуре главного комплекса гистосовместимости. К сожалению, в настоящее время не получено данных, подтверждающих какую-либо из этих версий. В основе патогенеза болезни Стилла взрослых лежит преобладание ответа Т-хелперов 1-го типа (Th-1) над ответом Т-хелперов 2-го типа (Th-2). Тh-1 в свою очередь приводят к синтезу провоспалительных цитокинов, в частности фактора некроза опухоли-альфа (ФНО–), который стимулирует выработку интерлейкина-1 (ИЛ-1), интерлейкина-6 (ИЛ-6). ИЛ-1 действует на центры терморегуляции в гипоталамусе, приводя к перестройке терморегуляции и повышению температуры тела. Также ИЛ-1 способствует активации кроветворения, продукции белков острой фазы воспаления в печени и пролиферации эндотелия. Выработка ИЛ-6 усиливается под влиянием ИЛ-1. ИЛ-6 вызывает схожие с ИЛ–1 эффекты. Кроме того, ИЛ-6 приводит к активации остеокластов. Основу клинической картины болезни Стилла представляет собой триада симптомов в виде ежедневной лихорадки, артралгий или артритов и характерной сыпи Стилла. Также симптомами данного заболевания могут быть боль в горле, лимфаденопатия, спленомегалия, серозиты, абдоминальная боль. Стоит отметить, что при всем многообразии клинических проявлений при болезни Стилла не существует определенной модели появления симптомов [6]. Нами представлен достаточно редкий клинический случай, ярко демонстрирующий широкий дифференциально-диагностический поиск, необходимый при постановке диагноза «болезнь Стилла взрослых».
Клинический случай Пациентка К., 53 лет, поступила в терапевтическое отделение клиники факультетской терапии им. В.Н. Виноградова в январе 2014 г. с жалобами на ежедневное повышение температуры тела до 40°С, как правило, в вечернее время (температура снижалась после приема нестероидных противовоспалительных препаратов (НПВП), что сопровождалось обильным потоотделением); зудящие высыпания на всей поверхности туловища, рук и ног, на лице с максимумом выраженности в вечернее время на высоте лихорадки, проходящие самостоятельно в утренние часы; боль в плечевых, проксимальных межфаланговых суставах, обоих лучезапястных суставах. Из анамнеза известно (рис. 1), что пациентка с 17 лет страдала язвенной болезнью двенадцатиперстной кишки с обострениями около 2–3 раз в год. Впервые эпизод лихорадки отмечался в феврале 2012 г., когда пациентка находилась на лечении по поводу обострения язвенной болезни двенадцатиперстной кишки. Во время пребывания в стационаре она отметила внезапное появление боли и припухания в левой половине шеи, повышение температуры тела до 39°С. Консультирована оториноларингологом: состояние было расценено как острый фарингит, шейный лимфаденит. Больной проводилась терапия цефтриаксоном 2 г/сут. На 5-й день антибактериальной терапии припухлость и боль в области шеи исчезли, однако сохранялось ежедневное повышение температуры до 39°С. Для уточнения причины лихорадки больной в амбулаторных условиях были проведены: компьютерная томография (КТ) шеи, ультразвуковое исследование (УЗИ) органов брюшной полости и магнитно-резонансная томография (МРТ) почек; патологии не выявлено. Повышенная температура держалась в течение 3 нед., после чего снизилась самостоятельно. В феврале 2013 г. у пациентки возник эпизод острой опоясывающей боли в верхней половине живота, которая сопровождалась рвотой, диареей, повышением температуры тела, в связи с чем она была госпитализирована в ЦРБ г. Мытищи (Московская область). Состояние было расценено как обострение хронического панкреатита, проводилась терапия панкреатином, платифиллином с умеренным положительным эффектом. Повторный эпизод боли в животе случился 16 ноября 2013 г., в связи с чем пациентка вновь была госпитализирована в ЦРБ г. Мытищи. 22 ноября 2013 г. во время пребывания в стационаре больная отметила появление ежедневного повышения температуры тела до 40,5°С в вечернее время.
Консультирована оториноларингологом: при осмотре ЛОР-органов выявлен белесоватый налет в области левого грушевидного синуса. Для исключения рака грушевидного синуса проведена биопсия слизистой оболочки гортани: данных, говорящих об онкологическом заболевании, не получено. Пациентке проводилась терапия цефтриаксоном, ципрофлоксацином, амикацином в течение 10 дней без эффекта. При выписке лихорадка сохранялась, в связи с чем пациентка самостоятельно принимала клиндамицин, тилорон, кетоконазол, орнидазол, цетиризин без эффекта. При повышении температуры тела принимала НПВП (ибупрофен, нимесулид) с положительным эффектом. 5 декабря 2013 г. на фоне ежедневного повышения температуры пациентка впервые отметила появление зудящей сыпи на коже туловища, рук, лица. В дальнейшем сыпь распространилась на кожу нижних конечностей, спонтанно появлялась и исчезала бесследно. В то же время впервые отметила появление боли в мелких суставах кистей, лучезапястных суставах. Тогда при амбулаторном обследовании было выявлено повышение СОЭ до 30 мм/ч, С-реактивного белка (СРБ) – до 48 мг/л, РФ – до 16 МЕ/мл, титры антинуклеарных антител (ANA) были отрицательные, ANCA – отр. Пациентка консультирована оториноларингологом, гематологом, инфекционистом: патологии не выявлено.
14 января 2014 г. больная госпитализирована в Факультетскую терапевтическую клинику им. В.Н. Виноградова Первого МГМУ им. И.М. Сеченова. При поступлении состояние пациентки оценивалось как относительно удовлетворительное. Температура тела 37°С. На коже туловища, верхних и нижних конечностей определялась пятнисто-папуллезная и уртикарная сыпь ярко-розового цвета, без шелушения, умеренно зудящая (рис. 2). Отеков не наблюдалось. Отмечались болезненность при пальпации в межфаланговых суставах III пальца левой кисти, ограничение активных движений в мелких суставах кисти, боль и ограничение активных движений в обоих лучезапястных суставах. Доступные пальпации лимфоузлы не были увеличены. В остальном по органам и системам – без отклонений; гемодинамические показатели оставались стабильными. В клинике у пациентки отмечалось ежедневное вечернее повышение температуры тела до 38,5–39°С, сопровождавшееся появлением зудящих высыпаний на коже туловища, верхних и нижних конечностей (рис. 2). На фоне применения НПВП к утру температура тела снижалась до нормальных цифр, сыпь на коже бледнела, а в течение дня исчезала. Дифференциально-диагностический поиск был основан на сочетании синдрома лихорадки неясного генеза с кожными высыпаниями, лимфаденопатией (на основании данных анамнеза), артралгиями. При этом безусловным представлялось проведение онкопоиска и исключение инфекционной природы заболевания. Результаты рутинных лабораторных тестов не внесли ясности в диагноз. Обращали на себя внимание лишь увеличение СОЭ до 25 мм/ч, СРБ до 3,12 мг/дл (N до 0,8), некоторое повышение уровня АЛТ и АСТ до 49 и 72 ед/л соответственно. На высоте лихорадки пациентке проводился трехкратный посев крови, роста флоры не получено. Больная была консультирована инфекционистом, выполнены лабораторные исследования для исключения вирусных и паразитарных инфекций как причины лихорадки. Пациентке было проведено развернутое инструментальное обследование: ЭхоКГ, КТ органов грудной клетки и брюшной полости, эзофагогастродуоденоскопия, колоноскопия, УЗИ органов малого таза, щитовидной железы, рентгенологическое исследование придаточных пазух носа, пациентка консультирована ЛОР-врачом – патологии не выявлено. Таким образом, данных, свидетельствующих об онкологическом заболевании или инфекционном процессе, не получено.
Поражение кожных покровов предполагало возможность наличия диффузного заболевания соединительной ткани (ДЗСТ), в частности, нельзя было исключить васкулит и системную красную волчанку. Однако лабораторные маркеры системных заболеваний у данной пациентки отсутствовали (ANA, AMA, pANCA, cANCA, Ro, La, ASMA, anti-RNP/Sm, anti-Scl-70, anti-Jo-1 – отрицательно). Пациентка была консультирована гематологом: признаков лимфопролиферативного заболевания не обнаружено. Больная была тщательно обследована фтизиатрами, проведены диаскинтест и реакция Манту, получены отрицательные результаты. Нельзя было не принимать во внимание жалобы пациентки на периодически возникающую боль в области шеи, увеличение шейных лимфатических узлов в анамнезе, в связи с чем были последовательно осуществлены УЗИ и МРТ мягких тканей шеи: выявлена МР-картина лимфаденопатии шейных лимфатических узлов, дополнительных образований в мягких тканях шеи и ротоглотки не выявлено. Таким образом, у пациентки исключены очаговая и генерализованная инфекция, не подтверждены неоплазия и гемобластоз, отсутствовали характерные диагностические критерии и необходимые лабораторные маркеры ДЗСТ. Однако наличие у больной лабораторных маркеров неспецифического воспаления, лихорадки в сочетании с сыпью, артралгиями и лимфаденопатией не позволяло полностью исключить наличие ревматологической патологии, в частности болезни Стилла взрослых. В качестве дополнительного лабораторного маркера для диагностики этого заболевания нами был исследован уровень ферритина сыворотки крови. Было отмечено почти трехкратное повышение данного показателя – 334 мкг/л (N до 120 мкг/л), что могло, при исключении других причин гиперферритинемии, также явиться подтверждением диагноза «болезнь Стилла взрослых». Таким образом, у пациентки имелись 6 диагностических критериев заболевания: большие – лихорадка более 39°С, артралгии более 2 нед., сыпь Стилла; малые – лимфаденопатия, боли в горле, отрицательные РФ и ANA. Диагноз болезни Стилла взрослых является достоверным при наличии более 5 критериев, включая 2 больших (табл. 1). Пациентка была консультирована ревматологом клиники внутренних и профессиональных заболеваний им. Е.М. Тареева к.м.н. С.В. Гуляевым. Наиболее вероятным диагнозом представлялась болезнь Стилла взрослых, подтверждением чему могло служить необходимое сочетание диагностических критериев. Было принято решение о проведении терапии глюкокортикостероидами: метилпреднизолон 4 мг – 4 таблетки утром и 3 таблетки днем. В связи с наличием у пациентки в анамнезе язвенной болезни двенадцатиперстной кишки дополнительно назначен омепразол 20 мг/сут. На фоне терапии метилпреднизолоном состояние больной значительно улучшилось: температура тела нормализовалась, сыпь исчезла, боли в суставах уменьшились. Пациентке планировалось начать терапию метотрексатом, от которой она отказалась. В течение года наблюдения удалось уменьшить дозу метилпреднизолона до 4 мг/сут, лихорадка и кожные высыпания не рецидивировали. Вместе с тем, попытка отмены метилпреднизолона привела к возобновлению болей в суставах кисти, в обоих лучезапястных суставах.
Таким образом, болезнь Стилла представляет собой редкое системное заболевание, не имеющее достаточного количества патогномоничных признаков. Однако имеющиеся клинические симптомы, встречающиеся при большом количестве заболеваний, – лихорадка, артралгии и кожные высыпания, обладают определенными особенностями, позволяющими предположить, а впоследствии и подтвердить диагноз «болезнь Стилла взрослых». Лихорадка при болезни Стилла взрослых достигает фебрильных цифр, появляется внезапно и исчезает также внезапно, иногда без приема жаропонижающих средств. Лихорадка возникает ежедневно в вечернее время, иногда наблюдаются двойные пики повышения температуры тела (днем и вечером) [7]. Зачастую повышение температуры тела, как и в приведенном клиническом случае, сопровождается появлением характерной для заболевания сыпи. Сыпь появляется и исчезает так же внезапно и самостоятельно, как и лихорадка. Сыпь, как правило, пятнисто-папуллезная, характерного «лососевого» (salmon-colored) цвета. Для сыпи Стилла характерен феномен Кебнера: сыпь быстро появляется вдоль расчесов, в местах тесного соприкосновения с одеждой. Типичная локализация сыпи – кожа конечностей, туловища, шея. Артралгии и артриты обнаруживаются у большинства пациентов с болезнью Стилла взрослых. Чаще всего поражаются мелкие суставы кистей, лучезапястные суставы. Характерным для болезни Стилла взрослых, хотя и не вполне изученным, феноменом является развитие анкилоза лучезапястных суставов. Также у некоторых пациентов встречаются анкилозы в области стоп и шейного отдела позвоночника [8]. Общие симптомы могут в части случаев выступать на первый план и значительно беспокоить больных. Более чем у 70% пациентов процесс дебютирует с воспаления в горле, напоминающего ангину. Лимфаденопатия, гепатомегалия и спленомегалия – очень частые симптомы на ранних стадиях заболевания, отражающие инфильтрацию тканей клетками, участвующими в воспалении, а также повышение иммунной активности самой ретикулоэндотелиальной системы. Часто данные симптомы сопровождаются болями в животе, причина которых также не ясна в полной мере. Лимфаденопатия выявляется у 65% больных. Несмотря на частое присутствие, она редко доминирует в клинической картине [9].