хромпик что это такое применение
Дихромат калия: получение, применение, волшебные реакции с участием реагента
Химические элементы, из которых состоит всё сущее, могут образовывать невероятные соединения. Они обладают уникальными свойствами и участвуют в синтезе важнейших веществ, применяемых в промышленности. Одним из таких соединений является дихромат калия, о котором расскажет данная статья.
Физические свойства
Температура плавления довольна низка и составляет всего 396 ⁰C. При 610 ⁰C происходит полное термическое разложение с образованием K2CrO4, трехокиси хрома (III) и кислорода.
Получение и очистка
Для получения K2Cr2O7 используется раствор натриевого хромпика и хлорида калия. Их смешивают и подвергают сильному нагреванию до температуры 1200 ⁰C. В таких условиях протекает реакция обмена:
Для очистки кристаллов в лабораторных условиях используют метод перекристаллизации. Готовят раствор, разводя 100 граммов дихромата калия в 1 литре горячей воды. Его тщательно перемешивают, фильтруют и подвергают упариванию так, чтобы от первоначального объёма осталось около 1/7. Остаток охлаждают при постоянном перемешивании. Таким путем образуются мелкие кристаллы, которые следует отфильтровать под тягой при помощи воронки Бюхнера. В процессе нужно провести три промывания очень холодной водой.
Трёхкратная перекристаллизация позволит получить образец с содержанием реагента дихромат калия от 99,92 до 100 %. Чтобы добиться такой чистоты готовят раствор из 100 граммов препарата и 150 мл кипятка. Его хорошо перемешивают и выливают тонкой струйкой в эксикатор или фарфоровую чашку. По мере охлаждения образуются кристаллы, которые фильтруют на пористой стеклянной воронке или платиновом конусе. Проводится сушка при 100 ⁰C в течение 2—2,5 часов. Полученное твердое образование дробят и продолжают прогревать при 200 ⁰C ещё в течение 12 часов. Такую последовательность действий повторяют 3 раза.
Окислительные свойства
Одним из сильнейших окислителей является дихромат калия. Химические свойства этого вещества можно наблюдать в следующих опытах:
Опыт «Извержение вулкана»
Одним из наиболее впечатляющих химических опытов является «извержение вулкана». Его демонстрация потребует специального оборудования, нацеленного на защиту органов дыхания. Для эксперимента придётся прикрыть кожные покровы и надеть респиратор, ведь продуктом реакции станет ядовитая трехокись хрома, которая вредна для человека.
На несгораемую подложку, в качестве которой можно использовать асбестовое полотно, кафель или кристаллизатор, помещается небольшая кучка двухромовокислого калия (альтернативный реагент (NH4)2Cr2O7). В центре сделайте углубление, капните спирт и подожгите его. По мере горения происходит разложение хромпика с образованием кислорода. Газ включается в реакцию и обеспечивает эффект синего пламени. На лабораторном столе бушует настоящий вулкан! Остальными продуктами горения станут K2CrO4, трехокись хрома (III). Эти вещества очень токсичны, при попадании на кожу вызывают ожоги и изъязвления.
«Фараонова змея»
Не менее интересен опыт под названием «фараоновы змеи» с использованием реактива дихромат калия. Реакции с его участием выглядят впечатляюще: растворы меняют цвет, кристаллы разлагаются с образованием окрашенного в зелёный оттенок оксида Cr2O3.
Чтобы получить «змею», разотрите в ступке смесь из равных частей хромпика и сахара, добавьте половину порции нитрата натрия. Все компоненты увлажните и подмешайте немного коллодия. Возьмите стеклянную трубочку и запрессуйте туда кашицу. Подожгите один конец сосуда, и вы увидите, как из другого начнёт выползать чёрная «змейка». Когда она остынет, то окрасится в зелёный цвет. При этом сахароза сгорает до углерода, нитрат натрия разложится с образованием O2 и NaNO2, а хромпик образует трехокись.
Выращивание кристаллов
Если приготовить насыщенный раствор бихромата калия, можно вырастить фантастические кристаллы. Выглядят они весьма впечатляюще, а сделать такую красоту очень просто. Достаточно поставить стакан с горячим раствором в место, защищённое от света, вибрации и сквозняка. Внутрь ёмкости опустите верёвочку и закрепите её на краю. Нужно подождать несколько дней, и вы увидите, как на нитке образуются красно-оранжевые кристаллы.
Применение в промышленности
Дихромат калия нашёл применение сразу в нескольких отраслях промышленности. Его используют в производстве пигментов для лакокрасочных изделий, для дубления кожи, дезинфекции семян. Окислительные свойства позволяют применять хромпик для создания спичечных головок, борьбы с коррозией металлов, изготовления пиротехнических изделий и сухих электролитов.
Смесь реагента с концентрированной серной кислотой — идеальное средство для мытья химической посуды.
Дихромат калия
| Дихромат калия | |
|---|---|
 | |
| Систематическое наименование | Дихромат калия |
| Традиционные названия | Бихромат калия, двухромовокислый калий, хромпик |
| Хим. формула | K2Cr2O7 |
| Состояние | оранжевые кристаллы |
| Молярная масса | 294,19 г/моль |
| Плотность | 2,676 г/см³ |
| Т. плав. | 396 °C |
| Т. кип. | 500 °C |
| Т. разл. | 500 °C |
| Энтальпия образования | −2033 кДж/моль |
| Растворимость в воде | 4,9 г/100 мл |
| Координационная геометрия | Тетраэдральная |
| Кристаллическая структура | Триклинная |
| ГОСТ | ГОСТ 2652-78 |
| Рег. номер CAS | 7778-50-9 |
| PubChem | 24502 |
| Рег. номер EINECS | 231-906-6 |
| SMILES | |
| Рег. номер EC | 231-906-6 |
| RTECS | HX7680000 |
| ChEBI | 53444 |
| ChemSpider | 22910 |
| ЛД50 | 25 мг/кг (крысы, орально) |
| Токсичность | высокотоксичен, канцероген, мутаген, аллерген, сильный окислитель |
| Пиктограммы СГС |      |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дихромат калия (двухромовокислый калий, бихромат калия, техн. хромпик) — неорганическое соединение, калиевая соль дихромовой кислоты с химической формулой K2Cr2O7, имеет вид оранжевых кристаллов. Обладает сильными окислительными свойствами, в связи с чем широко применяется в химии, фотографии, пиротехнике и различных областях промышленности. Высокотоксичен и канцерогенен.
Иногда хромпиком также называют дихромат натрия (Na2Cr2O7).
Содержание
Физические и химические свойства
Оранжевые кристаллы с температурой плавления 396 °C. Разлагается при нагреве выше 500 °C. Растворим в воде (г / 100 г): 4,6 (0 °C), 15,1 (25 °C), 37,7 (50 °C), незначительно растворим в этаноле. Сильный окислитель.
В кислой среде восстанавливается до солей хрома (III). Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов:
Также в кислой среде при pH 3,0—3,5 обладает способностью окислять металлическое серебро:
6Ag + Cr2O7 2− + 14H + ⟶ 6Ag + + 2Cr 3 + + 7H2O
Кристаллический дихромат калия при нагревании с серой и углеродом восстанавливается до оксида хрома (III):
Водные растворы дихромата калия обладают дубящими свойствами, в частности, задубливают желатину.
Получение
Получают действием хлорида калия на дихромат натрия:
2KCl + Na2Cr2O7 ⟶ K2Cr2O7 + 2NaCl
Применение
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
В чёрно-белой фотографии применяется в качестве отбеливателя для удаления металлического серебра из эмульсии. Не применяется в цветной фотографии, так как для отбеливания требует кислой среды, а при pH ⩽ 4 красители, образовавшиеся в эмульсии при цветном проявлении, обесцвечиваются. Вместо этого в цветной фотографии для отбеливания используются составы на основе гексацианоферрата III калия и железной соли трилона Б.
Безопасность
Высокотоксичен, канцерогенен, аллерген, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. Среди соединений шестивалентного хрома наиболее токсичен. ПДК составляет 0,01 мг/м³ (в пересчёте на CrO3). При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Хромпик купить
Хромпик (дихромат калия, бихромат калия, калий двухромовокислый) это неорганическое химическое соединение, соль хромовой кислоты.
Физико-химические свойства.
Растворимость хромпика в воде
Применение.
Хромпик применяется для обработки шкур при дублении и протравливании. Благодаря сильным окислительным свойствам используется в пиротехнике, производстве красителей, технологиях обработки воды для технических нужд. Хромпик применяют при изготовлении лакокрасочных хромовых пигментов.
Применение хромпика для умягчения жесткой воды для промышленных теплообменников.
Для вод склонных к осаждению карбонатных осадков на стенках теплообменников используют ингибиторные смеси, в состав которых входит калия бихромат:
Состав №1: хромпик 20 мг/л; натрия пирофосфат 20 мг/л.
Состав №2: хромпик 12 мг/л; цинка сульфат 4 мг/л.
Применение хромпика для защиты от коррозии теплообменников дизелей тепловозов.
Хромпик обладает хорошими антиоксидными защитными свойствами для многих металлов и сплавов. Охладительную систему дизелей тепловозов заполняют дистиллированой или обессоленой водой. Но не смотря на это охладительные системы интенсивно корродируют в местах завихрений водяного потока и щелевых зазорах. А, также, образуются трещины на рубашках двигателей.
Для защиты большинства моделей охладительных систем тепловозов используют композицию: хромпик 0,5 г/л, натрия фосфат 0,5 г/л; натрия нитрит 0,5 г/л.
Для моделей теплобменников состоящих из меди и алюминия используют состав: хромпик 500 мг/л; натрия силикат 50 мг/л. рН=6-7.
Применение хромпика в составе антифризов.
Хромпик в качестве ингибитора входит в состав охлаждающих рассолов холодильной техники (растворы из хлорида натрия и хлорида магния).
Концентрация хромпика для таких рассолов составляет 3-6 г/л для теплообменников из латуни и 10 г/л для теплообменников из алюминия.
Применение хромпика для чистки от нагара двигателей внутреннего сгорания.
Нагар представляет собой асфальтосмолистые вещества, образующие на рабочих поверхностях двигателей трудноудалимые пленки. Удалить нагар довольно сложно, так как пленка нагара инертна и прочно сцеплена с поверхностью детали.
Составы очищающего раствора для черных металлов:
Состав №1. Каустическая сода 100 г/л; хромпик 5 г/л. Температура раствора 80-95°С, продолжительность обработки — до 3 ч.
Составы очищающего раствора для деталей из алюминиевых сплавов:
Состав №1. Кальцинированная сода 20 г/л; хромпик 5 г/л; жидкое стекло 8 г/л; хозяйственное мыло 10 г/л. Температура раствора 85-95°С, продолжительность обработки — до 3 ч.
Состав №2. Кальцинированная сода 10 г/л; хромпик 5 г/л; хозяйственное мыло 10 г/л. Температура раствора 80-95°С, продолжительность обработки — до 3 ч.
Применение хромпика для оксидирования металлов.
Процесс оксидирования металлов заключается в создании на поверхности металлов тонкой зашитной пленки, предотвращающей металл от разрушения.
В ряде случаев оксидирование металлических деталей производят с целью создания эстетически красивого внешнего вида (лучшего товарного вида). Это относится к подсвечникам, люстрам, элементам коллекционного холодного и огнестрельного оружию, ювелирным серебряным украшениям пр.
Оксидирование металлов является альтернативой лако-красочным покрытиям и является, в большинстве случаев, более стойким покрытием.
Для некоторых изделий, например стальной кузов автомобиля или алюминиевый фюзеляж самолета, оксидирование производят перед покраской. Краска в этом случае ложится более равномерно и держится дольше.
Оксидирование металлов также называют еще пассивированием, потому как оксидная пленка делает металл пассивным к факторам окружающей среды. Оксидирование стали иногда называют воронением стали.
Составы для оксидирования с применением хромпика:
— для меди и медных сплавов:
Состав №1. Хромпик 100 г/л; серная кислота 15 г/л. Температура раствора — 45°С, продолжительность обработки 5-10 мин.
Состав №2. Хромпик 150 г/л. Температура раствора — 60°С, продолжительность обработки 2-5 мин.
— для алюминия и алюминиевых сплавов:
Состав №1. Хромпик 200 г/л. Температура раствора — 20°С, продолжительность обработки 5-10 мин.
Состав №1. Хромпик 50 г/л. Температура раствора — 25-40°С, продолжительность обработки 20 мин.
Состав №1. Хромпик 120 г/л. Температура раствора — 60°С, продолжительность обработки 15 мин. Затем детали промывают, сушат и покрывают любым нейтральным машинным маслом. Оксидная пленка имеет черный цвет.
Применение хромпика для выделки шкур.
Хромпик применяют в технологии дубления шкур. Последовательность операций при дублении хромпиком следующая: сначала шкуры загружают в раствор поваренной соли концентрации 30 г/л, затем через 30 минут добавляют хромпик 3 г/л и уксусную кислоту 1,2 г/л. Затем через 3 часа добавляют гипосульфит 3 г/л. Общая продолжительность дубления 6-8 часов.
Хромпик применяют в технологии протравливания шкурок кролика при крашении их в коричневый цвет. Для этого используют состав: поваренная соль 10 г/л; хромпик 1,8-2 г/л; моющий порошок 1 г/л. Последовательность операций следующая: Хромпик и красители предварительно растворяют в горячей воде (температура 70-75°C). Шкурки загружают в раствор и тщательно перемешивают в течение 3 часов (не менее 1 раза каждые 10 минут). Затем шкурки выгружают, отжимают и встряхивают. Для крашения шкурок приготавливают раствор температурой 40°C.
Проверка хромпиком серебра в ювелирном деле.
Для определения пробы серебра в ювелирных изделиях используют раствор хромпика и серной кислоты.
Состав раствора: вода дистилированная 100 мл; хромпик 9,4 г; серная кислота H2SO4 6,8 мл.
Применение этого раствора требует определенных навыков. Точность определения пробы составляет 20 единиц. Подходит для ювелирных изделий выше 600-й пробы.
Определение по этому методу заключается в следующем. На поверхности ювелирного изделия (в неприметном месте) делают потертость абразивным предметом, например, напильником. Таким образом снимают оксиды металлов ювелирного изделия. Затем наносят каплю раствора реактива. Происходит химическая реакция металлов присутствующих в ювелирном изделии. Через 15-20 секунд каплю раствора удаляют бумажной салфеткой. Смотрят на место контакта металла с раствором.
Цвет в зависимости от пробы серебра:
Применение хромпика при изготовлении зеленого пигмента для красок.
Из хромпика производят пигменты зеленого цвета для всех видов лакокрасочных покрытий, для художественных красок, для окраски пластмасс, изготовления денежных знаков и др.
Наибольшее распространение получил термический способ обработки хромпика. Технологическая схема получения пигментного оксида хрома из хромпика выглядит следующим образом. Шихта, состоящая из хромпика, серы, солей аммония или гипса загружается в шаровую мельницу. Шихта измельчается и тщательно смешивается. Затем шихта поступает на первое прокаливание в печь с температурой 650-700 °С. При этом происходят следующие реакции:
Продукт прокаливания измельчают в шаровой мельнице, отмывают от водорастворимых примесей, отфильтровывают на фильтре, высушивают в сушилке и загружают на повторное прокаливание с температурой 700-800 °С. Затем проводится дополнительная промывка пигмента, фильтрация, сушка и измельчение в дезинтеграторе.
Получение хромпика.
Хромпик получают обработкой натрия бихромата хлоридом калия.
Дихромат калия – название неорганического соединения, представляющего собой калиевую соль дихромовой кислоты. Давайте поговорим о данном веществе и узнаем много интересного.
Характеристика, формула и физические свойства
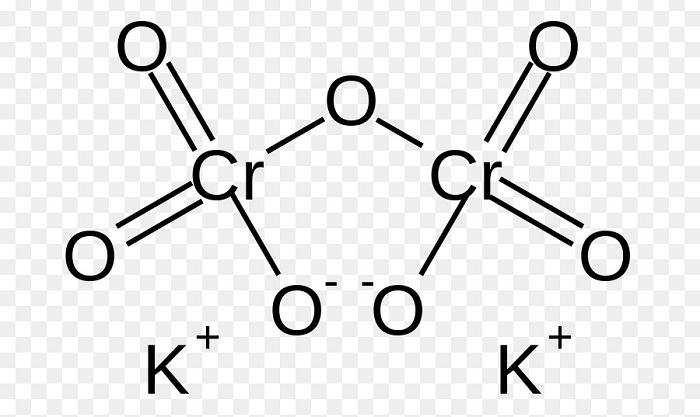
Структурная формула дихромата калия
Одной из особенностей дихромата калия является его ярко-оранжевый цвет и кристаллообразная структура.
Температура плавления соединения равна 396 0 C, а температура кипения и разложения — 500 0 C.
Ярко выражены окислительные свойства дихромата калия, по этой причине вещество широко применяется в фотографии, химии и промышленности.
Является канцерогеном, аллергеном, сильнейшим окислителем и токсичным веществом.
Химические свойства
Имеет высокую растворимость в воде (4,9 г/100 мл) и небольшую при взаимодействии с этиловым спиртом. В кислой среде происходит восстановление до солей хрома (III).
В качестве примера можно привести то, что он может окислять галогенид-ионы до свободных галогенов:
Если среда имеет pH от 3 до 3.5, двухромовокислый калий реагирует на металлическое серебро – окисляет его:
6Ag + Cr2O7 2- + 14H + => 6Ag + + 2Cr 3- + 7H2O.
При нагревании кристаллического бихромата калия с углеродом С и серой S происходит восстановление вещества до оксида хрома:
При электролитической диссоциации дихромат калия распадается на ионы калия и дихромат-ион:
Получение дихромата калия
В основе получения соединения лежит следующая химическая реакция:
Токсичность
Вещество относится к первому классу опасности. Это значит, что оно наиболее токсично и может нанести большой вред организму, поэтому при работе с ним требуется соблюдать меры безопасности.
Раствор бихромата калия повреждает органы дыхания и кожные покровы, нарушает хрящевую ткань и вызывает сильнейшие отравления при попадании в организм. Работая с данным соединением необходимо защищать кожу и дыхательные пути.
Применение калия двухромовокислого
Имеет широкий спектр применения, например:
для дубления, так как раствор двухромовокислого калия с водой имеет все свойства для этого;
применяется для мытья лабораторной посуды;
при обработке черно-белых фотографий бихромат калия используется в качестве отбеливающего реагента;
так как окислительные свойства соединения крайне высоки, то оно выступает окислителем при обработке фотографий и занятиях живописью, а также в спичечной промышленности и пиротехнике.