хлорсодержащие органические соединения что к ним относится
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
хлороргани́ческие соедине́ния, группа химических соединений, содержащих хлор; в сельском хозяйстве используются главным образом в качестве инсектицидов, акарицидов и фунгицидов. К Х. с. относятся: альдрин, гексахлорциклогексан (ГХЦГ), гексахлорбензол, гаммаизомер ГХЦГ, гептахлор, дильдрин, ДДТ, каптан, металлилхлорид, полихлорпинен, полихлоркамфен, хлорпикрин, тиодан и др. Выпускают их в виде дустов, концентратов эмульсий, смачивающихся порошков, дымовых шашек и т. д. основные способы применения: опрыскивание растений, окуривание семян, фумигация помещений перед загрузкой зерна, фумигация зернопродуктов с целью уничтожения фитопатогенных грибов и бактерий. X. с. высокотоксичны, стойки во внешней среде, способны к кумуляции; в организме теплокровных обладают эмбриотропным (см. Эмбриотоксичность) и мутагенным действием. Для X. с. характерна также слабая избирательность (в большинстве случаев они губительны для полезной энтомофауны и энтомофагов). При несоблюдении техники безопасности и превышении установленных дозировок X. с. могут вызвать острое или хроническое отравление (в последнем случае может проявиться их эмбриотропное действие).
При отравлении наблюдают вялость, потерю аппетита, раздражение слизистых оболочек глаз и дыхательных путей, поражение внутренних органов (печени, почек) и нервной системы.
Лечение. При остром отравлении симптоматическое; специфическая терапия с помощью антидотов не разработана. Профилактика. Зелёные части растений, обработанных X. с., можно использовать на корм скоту лишь после распада препарата (например, для гексахлорциклогексана этот срок составляет 75 суток). См. также Пестициды.
Полезное
Смотреть что такое «ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ» в других словарях:
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ — ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. см. ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Физико химические свойства и применение. Хлорорганические соединения (ХОС) широко применяют в качестве инсектицидов, акарицидов и фунгицидов для борьбы с вредителями зерновых, зерно… … Болезни рыб: Справочник
хлорорганические соединения — organiniai chloro junginiai statusas T sritis ekologija ir aplinkotyra apibrėžtis Organiniai junginiai, kurių molekulėje chloras yra sujungtas su angliavandenilių grupės anglimi. Šiems junginiams priklauso chlorintieji bifenilai ir ištisa… … Ekologijos terminų aiškinamasis žodynas
Хлорорганические пестициды — (ХОП): дихлордифенилтрихлорэтан (ДЦТ), гексахлорциклогехсан (ГХЦГ), ДДТ, Гексахлоран, ТХАН имеют высокую токсичность, медленный метаболизм в природных объектах, свойство биоаккумуляции. Являются предшественниками диоксинов и диоксиноподобных… … Википедия
Галогенорганические соединения — Галогенорганические соединения органические вещества, содержащие хотя бы одну связь C Hal углерод галоген. Галогенорганические соединения, в зависимости от природы галогена, подразделяют на: Фторорганические соединения;… … Википедия
Гетероциклические соединения — (гетероциклы) органические соединения, содержащие циклы, в состав которых наряду с углеродом входят и атомы других элементов. Могут рассматриваться как карбоциклические соединения с гетерозаместителями (гетероатомами) в цикле. Наиболее… … Википедия
Металлоорганические соединения — Металлорганические соединения (МОС) органические соединения, в молекулах которых существует связь атома металла с атомом/атомами углерода. Содержание 1 Типы металлоорганических соединений 2 … Википедия
Ароматические соединения — Запрос «Арены» перенаправляется сюда; см. также другие значения. Бензол одно из наиболее распространённых ароматических соединений Ароматические соединения циклические о … Википедия
Элементоорганические соединения — Ферроцен пример элементоорганического соединения Элементоорганические соединения органические вещества, в которых углерод непосредственно связан с атомами, отличными от водорода, кислорода, серы, азота … Википедия
Фторорганические соединения — – это галогенсодержащие соединения, содержащие хотя бы один атом фтора. В 30 х годах прошлого века для разделения изотопов UF6 возникла необходимость в устойчивых к нему смазочных материалах. Проблема была решена предоставленным Джоном Саймонсом… … Википедия
Хлорсодержащие органические соединения что к ним относится
ХЛОРОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ. Физико-химические свойства и применение. Хлорорганические соединения (ХОС) широко применяют в качестве инсектицидов, акарицидов и фунгицидов для борьбы с вредителями зерновых, зерно-бобовых, технических и овощных культур, лесонасаждений, плодовых деревьев и виноградников, а также используются в медицинской и ветеринарной санитарии для уничтожения зоопаразитов и переносчиков болезней. Выпускают их в виде смачивающихся порошков, минерально-масляных эмульсий, дустов. У нас разрешены для применения следующие препараты: гексахлорциклогексан (ГХЦГ), гамма-изомер ГХЦГ (линдан), гексахлорбутадиен (ГХБД), дилор, мезокс, полихлоркамфен (ПХК), тедион, каптан, тиодан и некоторые другие. Запрещено использовать такие опасные пестициды, как альдрин, дильдрин, эндрин и галекрон, ДДТ. Однако ДДТ пока сохраняет свое значение в карантинных ситуациях. Благодаря резко выраженным кумулятивным свойствам н персистентности он пока циркулирует в объектах внешней среды.
ХОС представляют собой галоидопроизводные многоядерных циклических углеводородов (ДДТ и его аналоги), циклопарафинов (ГХЦГ и его аналоги), соединений диеного ряда (альдрин, дильдрин, гексахлорбутадиен, гептахлор, дилор), терпенов (ПХП и ПХК), бензола и других соединений.
Все ХОС плохо растворяются в воде и хорошо в органических растворителях, маслах и жирах. Причем в пресной воде растворимость их выше, чем в соленой (эффект “высаливания”). В водоемах они поглощаются частицами органических веществ и осадком, вследствие чего их свойства и локализация могут меняться в разных типах водоемов. В акваториях, загрязненных нефтью, возникает опасность концентрирования ХОС в пленке, растворимых фракциях и в донном осадке.
ХОС обладают высокой химической стойкостью к воздействию различных факторов внешней среды, относятся к группе высокостабильных и сверхвысокостабильных пестицидов. В почве ДДТ сохраняется 12 и более лет, ПХП н ПХК — до 0,5 — 2 лет, линдан и кельтан — до одного года. Коэффициент выноса ХОС из почвы с поверхностным стоком составляет для ДДТ 0,02 — 0,3%, ГХЦГ — 0,06 — 0,10%, что соответствовало концентрации в воде 0,03 — 0,3 мкг/л (Ц. И. Бобовникова и др.). Обладая этими свойствами, ХОС накапливаются в гидробионтах и передаются по пищевой цепи, увеличиваясь примерно на порядок в каждом последующем звене. Однако не все препараты обладают одинаковой персистентностью и кумулятивными свойствами. В гидросфере и организме гидробионтов они постепенно разлагаются с образованием метаболитов. По вышеназванным причинам в зонах интенсивного земледелия остатки ХОС и метаболитов в организме гидробионтов обнаруживаются постоянно, что следует учитывать при диагностике отравлений.
В пресных и морских водоемах, а также гидробионтах, помимо хлорорганических пестицидов, встречаются сходные с ними полихлорированные бифенилы (ПХБФ) и терфенилы (ПХТФ), используемые в промышленности. По своим физико-химическим свойствам и физиологическому действию на организм, а также методам анализа они весьма близки к хлорорганическим пестицидам. Поэтому необходима дифференциация этих групп хлорированных углеводородов.
Токсичность. Механизм действия ХОС на рыб во многом сходен с их влиянием на теплокровных животных. Рыбы и другие водные организмы более чувствительны к ХОС, чем наземные животные. Особенно чувствительны к ХОС водные ракообразные и насекомые, которых нередко используют для контроля загрязнения воды как индикаторные организмы.
В организм рыб ХОС поступают осмотически через жабры и через пищеварительный тракт с кормом. Интенсивность поглощения ХОС рыбами увеличивается при повышении температуры воды. Гидробионты способны концентрировать ХОС в гораздо больших количествах, чем в окружающей среде (воде, грунте), коэффициент накопления этих веществ составляет в грунте 100, зоопланктоне и бентосе — 100 — 300, рыбах — 300 — 3000 и более. По этому показателю они относятся к группе веществ со сверхвысокой или с выраженной кумуляцией. Суммарные концентрации ХОС в воде пресных и морских водоемов обычно ниже микрограмма на литр.
В первую очередь ХОС накапливаются в органах и тканях, богатых жирами или липоидами. У рыб их больше всего находят во внутреннем жире, головном мозге, желудочной и кишечной стенке, гонадах и печени, меньше —в жабрах, мышцах, почках и селезенке. С возрастом рыб отмечено увеличение концентрации ХОС. При метаболизме жиров во время голодания и миграции рыб, а также при стрессовых состояниях накопленные в организме ХОС могут вызвать отравления рыб.
ХОС относят к ядам политропного действия с преимущественным поражением центральной нервной системы и паренхиматозных органов, особенно печени. Кроме того, они вызывают расстройство функций эндокринной и сердечно-сосудистой системы, почек и других органов. ХОС также резко угнетают активность ферментов дыхательной цепи, нарушают тканевое дыхание. Некоторые препараты блокируют SH-группы тиоловых ферментов. ХОС опасны для рыб своими отдаленными последствиями: эмбриотоксическим, мутагенным я тератогенным действием. Они снижают иммунологическую реактивность и повышают восприимчивость рыб к инфекционным болезням. ХОС относятся к группе высокотоксичных для рыб соединений (см. таблицу).
| Токсичность основных хлорорганических пестидов для рыб | |||||
| Название и синонимы препаратов | Виды рыб | Летальные концентрации CK 50 по ДВ | Авторы | ||
| мг/л | экспозиция | ||||
| ДДТ (дихлордифенил трихлорэтан, азотокс, | 0,032 | 36 ч | D. W. Jonson, 1968 | ||
| дикофан, пентахлорин | Лосось | 0,08 | 36 ч | ||
| и др.) | Щука | 0,05* | 48 ч | D. Ludemann, 1962 | |
| Карась | 0,07 — 0,03 | 96 ч | Y. Litchfild, 1949 | ||
| ДДТ э. к. | Карп | 0,25 — 0,35** | 48 ч | R. L. Spehar, 1982 | |
| ДДТ с. п. | Карп | 5,0** | 48 ч | To же | |
| Гамма-изомер ГХЦГ | Карп | 0,17 — 0,28 | 48 ч | D. Ludemann, 1962 | |
| 90%-ный технический э. к. | Радужная форель | 0,3* | 48 ч | Тот же | |
| (гексахлорциклогексан, | 0,2* | 48 ч | ” | ||
| ГХЦГ, линдан, гамма-изомер) | Пескарь | 0,08 | 96 ч | С. Marcelle, 1983 | |
| Плотва | 0,08 | 24 ч | В. В. Метелев, 1971 | ||
| Карась | 0,12 | 48 ч | R. L. Spehar, 1982 | ||
| Гексахлоран технический (8 — 12% гамма-изомера ГХЦГ) | Карп | 2,5 — 12,5** | 96 ч | Y. Mertlik, 1973 | |
| Гептахлор (велзикол 104, гептамюль) | Карп, радужная форель, щука | 0,4 — 0,6* | 48 ч | D. Ludemann, 1962 | |
| Разные виды рыб | 0,008 — 0,019 | 96 ч | H. H. Мельников, 1985 | ||
| Гексахлорбензол | Те же | 0,25 — 3,6 | 96 ч | R. L. Spehar, 1982 | |
| Полихлоркамфен (ПХК, токсафен, килфен и др.) | Радужная форель | 0,23* | 48 ч | D. Ludemann, 1962 | |
| Окунь | 0,16 | 24 ч | В. В. Метелев, 1971 | ||
| Плотва | 0,26 | 24 ч | Тот же | ||
| Карп, толстолобик | 0,22 | 96 ч | Л. И. Грищенко и др., 1978 | ||
| Верховка | 0,04 | 96 ч | Те же | ||
| Вьюн | 0,18 | 96 ч | ” | ||
| Карп | 0,022* | 25 дн. | ” | ||
| Полидофен (40% ПХК + 20% ДДТ) | Карп | 0,17 | 96 ч | ” | |
| Полихлорпинен (ПХП, стробан) | Карп, линь Пелядь | 1,0* 0,5* | 24 ч 24 ч | Е. В. Бурмакин, 1965 | |
| Щука | 0,25* | 24 ч | Тот же | ||
| Плотва, налим | 0,1* | 24 ч | ” | ||
| Окунь | 0,05* | 24 ч | ” | ||
| Метоксихлор (марлат) | Разные рыбы | 0,04 | 96 ч | Н. Н. Мельников, 1985 | |
| Калган (ортоцид) | Радужная форель | 0,25* | 24 ч | Тот же | |
| Карп | 0,25 | 24 ч | ” | ||
| Кельтан (дикофол, хлорэтанол) | Карп | 2,16 — 2,93 | 96 ч | Л. И. Грищенко и др., 1983 | |
| Молодь верховки и пескаря | 1,55 — 1,62 | 96 ч | Те же | ||
| Тиодан (эндосульфан, малике, циклодан, ти | 0,01* | 48 ч | D. Ludemann, 1962 | ||
| мул) | Щука | 0,005* | 48 ч | Тот же | |
| Карп | 0,011 | 48 ч | ” | ||
| Разные виды рыб | 0,001 — 0,009 | 48 ч | R. L. Spehar, 1982 | ||
| * Абсолютно смертельные концентрации (СК 100 ). | |||||
| ** Концентрация по препарату. | |||||
Хроническое отравление карпов ПХК и полидофеном наступает при концентрациях до 1/100 от CK 50 (0,004 мг/л), кельтаном до 1/300 от СК 50 (0,007 мг/л) и сопровождается гибелью 10 — 60% рыб в течение 60 — 80 дней воздействия. Токсические концентрации других препаратов не установлены. На основании изучения экспериментальных и природных токсикозов у погибших рыб обнаружены остатки некоторых ХОС (см. таблицу).
| Содержание ХОС в органах рыб послеотравления | |||||
| Пестицид | Виды рыб | Органы | Остатки ХОС, мг/кг | Авторы | |
| острое отравление | хроническое отравление | ||||
| ГХЦГ (линдан) | Радужная форель | Печень | 11,7 — 14,6 | F. Braun. 1980 | |
| Мышцы | 2,3 — 3,5 | ||||
| ПХК | Карпы (сеголетки) | Внутренние органы | 4,2 — 7.5 | 1,5 — 1, 6 | Л. И. Грищенко и др., 1978, 1982 |
| Мышцы | 1,6 — 1,8 | 0.1 — 0.5 | |||
| Полидофен | Карпы (сеголетки) | Внутренние органы | 3, — 3,9 | 1,5 | Те же |
| Мышцы | 0,3 — 1,5 | 0,1 — 0.5 | |||
| Кельтан | Карпы (сеголетки) | Внутренние органы | 8 — 24 | 1,5 — 4,4 | ” |
| Мышцы | 5.8 | ||||
| Тиодан (эндосульфан) | Форель, хариус | Жабры | 0,4 — 1,5 | F. Braun, и др., 1980 | |
| Печень | 0,6 — 4,5 | ||||
| Мышцы | 0,3 — 1,0 | ||||
| Карповые | рыба целиком | 1.0 — 4,7 | Те же | ||
В органах рыб, перенесших отравление, остатки ПХК, полидофена и кельтана обнаруживают до 50 дней, а в трупах рыб до 8. При хранении погибших рыб в холодильнике они сохраняются в тканях около 4 мес.
При поступлении ХОС с кормом интоксикация наступает при достижении летального уровня их содержания в органах рыб, что доказано на экспериментальной модели кумулятивного токсикоза (Ф. Я. Комаровский и др.).
В естественных условиях уровень накопления ХОС в рыбах зависит от объема применения и величины остатков пестицидов в сточных водах. В зонах с умеренным применением хлорорганических пестицидов их остатки во внутренних органах рыб составляют: планктонофагов (плотва, тюлька) — 0,01 — 0,5 мг/кг и хищников (судак, окунь, щука) — 0,2 — 2,5 мг/кг. В жировых отложениях возможно увеличение на 1 — 2 порядка.
Из представителей зоопланктона наиболее чувствительны к ХОС водные членистоногие и ракообразные. Токсические концентрации для дафний находятся на уровне 0,001 мг/л, циклопов — более 0,01 мг/л. В то же время простейшие, моллюски, хирономиды к ним довольно устойчивы.
Симптомы и патоморфологические изменения. Несмотря на различие в химической структуре, картина отравлений рыб хлорорганическими пестицидами однотипна. В первую очередь они действуют на рыб как нервные яды.
Сроки появления признаков отравления зависят от величины концентраций препаратов и времени их воздействия. При остром отравлении они наступают через несколько часов после начала контакта с ядом, а при хроническом — через 7 — 10 дней.
Наиболее бурно симптомы проявляются при остром отравлении и характеризуются они повышенной возбудимостью, резким повышением подвижности рыб, отсутствием реакции на прикосновение к телу, нарушением координации движения (плавание по кругу, спирали, опрокидывание на бок) и полной потерей равновесия, замедлением дыхания. В агональной стадии развиваются параличи, гибель наступает от паралича центра дыхания. При вскрытии погибших рыб обнаруживают выраженное полнокровие внутренних органов, особенно печени и предсердия, иногда встречаются мелкоточечные кровоизлияния в жабрах. Гистологическими исследованиями устанавливают застойную гиперемию сосудов печени, почек, головного мозга, зернистое и жировое перерождение, а при высоких концентрациях вакуольную дистрофию печеночных клеток (иногда их некробиоз), токсический отек жаберных лепестков, незначительное набухание респираторного эпителия.
При хроническом отравлении рыбы перестают потреблять корм, угнетены или ведут себя беспокойно, интенсивно плавают у поверхности воды, затем они теряют равновесие, перевертываются на бок и погибают в состоянии депрессии. Печень погибших рыб набухшая, увеличена в объеме, с бледноватым оттенком. Отравление сопровождается тяжелыми дистрофическими и некробиотическими изменениями во внутренних органах и головном мозге. В печени обнаруживают обширные очаги зернисто-жировой и водяночной дистрофии, а также фокусы некробиоза печеночных клеток, снижение или отсутствие в них гликогена. Иногда в печени отмечают гипертрофию клеток с наличием в них митотических фигур деления, а также скопление в их цитоплазме липофусцина.
В почках — дистрофия и последующая деструкция эпителия канальцев. Отмечена дистрофия и некробиоз клеток гемопоэтической ткани.
При высоких концентрациях препаратов жаберные лепестки отечны, респираторный эпителий набухший, отслоен от мембраны, частично десквамирован. При низких концентрациях эти изменения слабо выражены. Постоянно отмечают дистрофию нейронов головного мозга и инволюцию фолликулярного эпителия в яичниках.
В случаях острого и особенно хронического отравления устанавливают снижение уровня гемоглобина и количества эритроцитов (на 10 — 20%), лейкопению (число лейкоцитов снижено на 60%), нейтрофилию, лимфоцитопению. В эритроцитах отмечена гипохромазия, анизоцитоз, пойкилоцитоз, макро- и микроцитоз.
При поступлении пестицидов с кормом обнаруживают десквамативный катар кишечника, застойную гиперемию и дегенеративно-некробиотические изменения в печени.
Диагноз ставят на основании комплексных исследований; анамнестических данных, клинико-анатомической картины интоксикации и обнаружения пестицидов в воде, грунте, органах рыб и других гидробионтах. Хлорорганические пестициды в этих объектах определяют газохроматографическим методом согласно “Методическим указаниям по определению ХОП и ПХБ при их совместном присутствии в объектах внешней среды и биоматериале:”, утвержденным Минздравом СССР. Для определения ПХК, полидофена и кельтана в воде и органах рыб разработаны и утверждены ГУВ Госагропрома СССР методы тонкослойной хроматографии.
Прямым доказательством отравления рыб служат обнаружение ХОС в воде и органах рыб на уровне вышеприведенных летальных показателей и наличие клинико-анатомических признаков интоксикации. В сомнительных случаях данные химического анализа необходимо сравнивать с остатками ХОС в органах рыб из благополучных водоемов. В рыбах и других объектах из крупных естественных водоемов дополнительно определяют содержание полихлорбифенилов.
Профилактика заключается в недопущении внесения ХОП в водо-охранной зоне, склоновых участках и основной водосборной площади водоемов, соблюдении правил применения, хранения, транспортирования и утилизации пестицидов, периодическом контроле их остатков в воде, грунте, гидробионтах. Присутствие ХОС в воде рыбохозяйственных водоемов не допускается. Допустимые остаточные количества гексахлорана (сумма изомеров) в рыбе 0,2 мг/кг, ДДТ в рыбе и рыбных консервах 0,2 мг/кг (временно), ПХК и ПХП не допускаются, для остальных ХОС не установлены.
Рыба, содержащая остатки хлорорганических пестицидов, реализуется согласно санитарно-гигиеническим правилам.
Химико-токсикологическое значение хлорорганических пестицидов
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Химико-токсикологическое значение и анализ хлорорганических пестицидов
В группу хлорорганических пестицидов входят перхлорированные углеводороды, которые широко применяются, в основном, как инсектициды. Производные хлорфенок- сиуксусной кислоты используются как средства для борьбы с сорными растениями. Особенностью хлорсодержащих ядохимикатов является их способность сохраняться в почве, воде и растениях длительное время. Например, ДДТ может сохраняться в почве 8-12 лет после обработки растений. Некоторые хлорорганические пестициды обнаруживаются в тканях животных за много километров от места применения за счет переноса их воздушными потоками. Все они медленно разрушаются в окружающей среде, поэтому вымываются водой из почвы и могут попадать в водоемы.
В организм человека хлорорганические соединения попадают через ЖКТ вместе с пищевыми продуктами, через легкие при вдыхании пыли. Некоторые пестициды этой труппы могут всасываться через неповрежденную кожу. Большинство хлорсодержащих пестицидов обладает кумулятивными свойствами, поэтому при длительном контакте с ними могут наблюдаться хронические отравления Предварительный анализ объекта на группу хлорорганических пестицидов
Специальных тестов для этих целей не разработано, предложено использовать метод тонкослойной хроматографии и реакцию отщепления хлора. Этим методам можно придать судебно-химическое значение при отрицательном результате.
Объект анализа массой 10 г (содержимое желудка, образцы веществ, изъятых с места происшествия) экстрагируют дважды петролейным эфиром, используя роторный смеситель. Эфирные экстракты промывают последовательно водой очищенной, раствором гидроксида натрия и еще раз водой очищенной. Слой петролейного эфира фильтруют через безводный сульфат натрия.
Анализ с помощью хроматографии в тонком слое сорбента. Часть полученного экстракта наносят на хроматографическую пластинку с тонким слоем силикагеля, подсушивают и хроматографируют. В качестве подвижной системы используют циклогексан. Затем пластинку вынимают, высушивают и обрабатывают раствором перманганата калия, опрыскивают 2-аминоэтанолом и нагревают 20 мин при 100°С. Охлажденную пластинку обрабатывают раствором нитрата серебра и облучают УФ-лампой (254 нм) в течение 10-15 мин. При наличии в объекте хлорсодержащих пестицидов образуются пятна коричневого или черного цвета.
Реакция отщепления хлора. Часть извлечения из объекта в специальном приборе испаряют досуха, добавляют к остатку концентрированную серную кислоту, дихромат калия и сульфат серебра в качестве катализатора. Смесь нагревают, происходит разрушение хлорсодержащего соединения, и выделяется свободный хлор, который улавливают в раствор йодида кадмия в присутствии крахмала – образуется синее окрашивание за счет вытеснения йода хлором.
При обнаружении пятен на пластинке и получении положительной реакции отщепления хлора проводят основное исследование на отдельные хлорсодержащие пестициды.
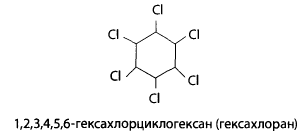
11.2.1 Гексахлорциклогексан (ГХЦГ)
Гексахлоран имеет несколько пространственных изомеров, из них у-изомер проявляет инсектицидные свойства и выпускается по названием линдан.
ГХЦГ – вещество темно-серого или светло-серого цвета, малорастворимое в воде, при повышенной температуре возгоняется с частичным разложением. Применяется ГХЦГ в виде порошков (дустов), эмульсий, дымовых шашек. Он используется для борьбы с вредителями зерновых культур, садов, лесных насаждений, паразитами животных.
Токсическое действие ГХЦГ на человека проявляется в виде гиперемии кожи, отечности, раздражении конъюнктивы глаз. ГХЦГ длительно задерживается в организме (в жировой ткани), медленно выводится через почки, ЖКТ, переходит в молоко кормящей матери. При приеме внутрь ГХЦГ вызывает тошноту, при всасывании в кровь поражается ЦНС, наблюдаются клонические и тонические судороги. Летальная доза составляет 200 мг/кг.
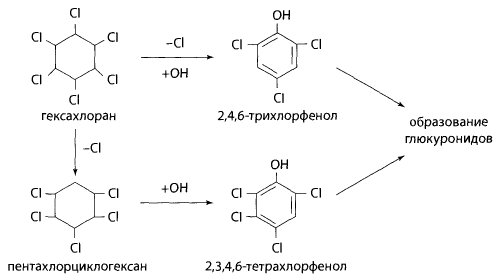
Метаболизм гексахлорана в организме проходит по пути дехлорирования, гидрокси- лирования и образования глюкуронидов во второй фазе метаболизма.
Объекты исследования: желудок с содержимым, печень, почки, кровь, моча.
Для изолирования из желудка с содержимым, печени или почек 100 г объекта измельчают, помещают в круглодонную колбу, смешивают с водой до кашицеобразной массы. Далее проводят перегонку с водяным паром. Собирают 300 мл дистиллята. В ходе перегонки на внутренней стенке холодильника может появиться серовато-белый налет, а в дистилляте белые частицы ГХЦГ. После отгонки холодильник промывают эфиром. Эфирный раствор присоединяют к дистилляту. Дистиллят переносят в делительную воронку и три раза экстрагируют диэтиловым эфиром по 100 мл. Эфирные вытяжки объединяют, промывают водой в делительной воронке. Затем эфир отгоняют до небольшого объема, переносят в выпарительную чашку и осторожно упаривают до сиропообразной массы. Эту массу используют для обнаружения ГХЦГ следующими испытаниями.
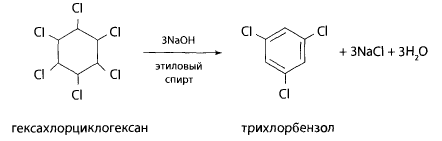
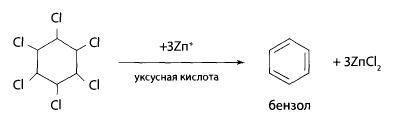
Реакция дехлорирования с последующим нитрованием. Часть остатка из чашки помещают в колбу с обратным холодильником, добавляют двукратный объем 10% спиртового раствора гидроксида калия и нагревают в течение часа на водяной бане. При кипячении со спиртовой щелочью ГХЦГ отщепляет 3 и более атомов хлора.
Затем упаривают эту смесь до 1/3 объема, подкисляют азотной кислотой и прибавляют раствор нитрата серебра. При этом выпадает белый осадок хлорида серебра.
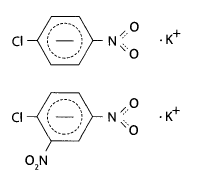
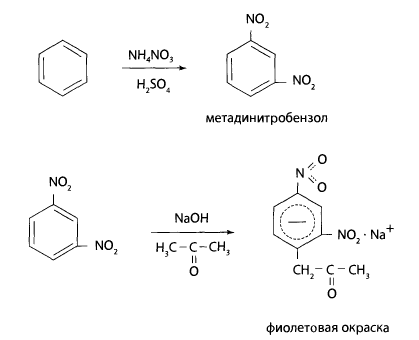
Полученный осадок отфильтровывают, фильтрат упаривают до небольшого объема, добавляют к нему 0,1 г нитрата натрия и 2 мл концентрированной серной кислоты. Смесь нагревают на песчаной бане в течение 10 мин при температуре 125-130°С. После охлаждения смесь экстрагируют в делительной воронке диэтиловым эфиром. Эфир осторожно выпаривают. Остаток растворяют в 0,5 мл ацетона и добавляют 2 мл 10% спиртового раствора гидроксида калия – появляется красно-фиолетовая или розовая окраска. Предел обнаружения – 4 мг ГХЦГ в 100 г объекта.
При дехлорировании ГХЦГ образуется бензол или хлорбензол, которые при взаимодействии с серной кислотой и нитратом натрия превращаются в п-нитро- или м-динитропроизводные, Нитропроизводные с ацетоном и гидроксидом калия образуют окрашенные соединения состава:
Реакция с янтарной кислотой и сульфатом железа(Ш). К части сухого остатка из чашки добавляют несколько кристалликов янтарной или фталевой кислоты. Отверстие пробирки закрывают фильтровальной бумагой, смоченной 0,1% раствором сульфата железа(Ш). Пробирку погружают в глицериновую баню, нагретую до 200°С, и температуру бани постепенно повышают до 230°С. При наличии ГХЦГ в пробе на бумаге появляется синее пятно.
Можно предположить, что в результате реакции ГХЦГ с янтарной (фталевой) кислотой образуются летучие фенольные соединения, которые дают с сульфатом железа(ПГ) синее окрашивание. Предел обнаружения составляет 30 мг ГХЦГ в пробе.
Для изолирования ГХЦГ из крови в пробирку с притертой пробкой вносят 2 мл цельной крови, 10 мл диэтилового эфира, смесь взбалтывают 15 мин и сливают эфирную вытяжку. Экстрагирование повторяют еще 2 раза с 10 мл эфира. Эфирные вытяжки сливают вместе, добавляют к ним 5 г безводного сульфата натрия и взбалтывают в течение 10 мин. Затем эфирную вытяжку отделяют, осторожно упаривают до небольшого остатка (около 1 мл).
Для изолирования ГХЦГ из мочи 20 мл мочи экстрагируют трижды эфиром по 20 мл. Далее экстракты обрабатывают безводным сульфатом натрия и после упаривания оставшуюся эфирную вытяжку используют для обнаружения и количественного определения ГХЦГ.
Обнаружение ГХЦГ в извлечениях из крови и мочи проводят с помощью тонкослойной хроматографии и описанных выше реакций.
Обнаружение ГХЦГ методом ТСХ. На линию старта хроматографической пластинки со слоем силикагеля наносят несколько капель эфирной вытяжки. Рядом наносят каплю «стандарта». Пятна подсушивают и хроматографируют, используя в качестве подвижной фазы н-гексан. После окончания хроматографирования пластинку подсушивают и обрабатывают водно-ацетоновым аммиачным раствором нитрата серебра, а затем облучают УФ-лучами в течение 15-20 мин. ГХЦГ проявляется в виде серо-черных пятен
Для количественного определения ГХЦГ рекомендованы методы ГЖХ, фотоколориметрии и аргентометрии.
При газожидкостной хроматографии используют электронозахватный детектор (ДЭЗ). Определение с помощью детекторов такого типа основано на измерении электропроводности между двумя электродами. В ДЭЗ ионы образуются под воздействием радиоактивного излучения. Его источником могут быть 3 Н, 63 Ni, 90 Sr и др. Детектор состоит из ионизационной камеры с источником радиоактивного излучения и блока питания (2 электрода с определенной разницей потенциалов). Когда в детектор поступает соединение, способное захватывать электроны, происходит изменение электропроводности между электродами. Свойством захватывать электроны обладают молекулы химических соединений, в состав которых входят атомы галогенов, фосфора, серы, азота, кислорода. Обнаружение хлорсодержащих пестицидов проводят по времени удерживания, а количественное определение – по высоте или площади пика.
Фотоколориметрический метод. Он используется чаще всего для определения ГХЦГ в крови и моче. Метод основан на дехлорировании ГХЦГ до бензола или хлорбензола, переведении их в нитропроизводные и получении окрашенных соединений с гидроксидом калия в присутствии ацетона. Дехлорирование ГХЦГ в остатке после испарения эфира проводят с помощью цинковой пыли в присутствии 2 мл ледяной уксусной кислоты.
К полученному раствору добавляют 1 мл нитрующей смеси (10% раствор нитрата аммония в концентрированной серной кислоте) и нагревают в течение часа на асбестовой сетке. После охлаждения смесь экстрагируют эфиром, эфир испаряют и к сухому остатку добавляют ацетон и 1 мл 40% раствора гидроксида натрия.
Через 20 мин измеряют оптическую плотность окрашенного в фиолетовый цвет раствора с помощью фотоколориметра в кювете с толщиной поглощающего слоя 20 мм с зеленым светофильтром.
Определение ГХЦГ аргентометрическим методом проводят по методике, описанной ранее при определении алкилгалогенидов (см. раздел 9.4.6).
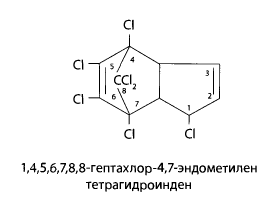
11.2.2 Гептахлор
Гептахлор – это белое кристаллическое вещество со слабым камфорным запахом, нерастворим в воде, растворяется в органических растворителях. Промышленностью гептахлор выпускается в виде 25% концентрата эмульсии и применяется в качестве инсектицида.
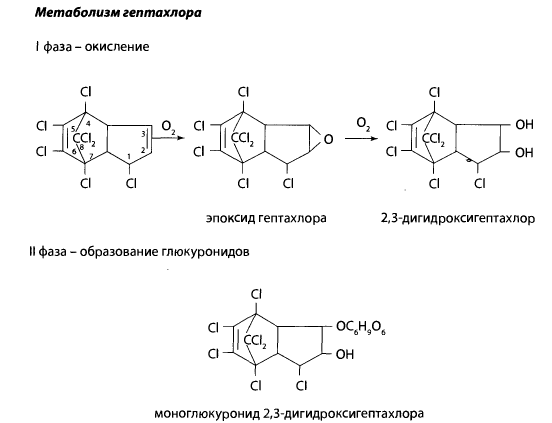
В организме гептахлор окисляется до эпоксигептахлора, который отличается более высокой токсичностью, чем сам гептахлор. Гептахлор и эпоксигептахлор накапливаются в тканях организма и оказывают токсическое действие. В почве продукты метаболизма гептахлора сохраняются в течение нескольких лет.
Объектами исследования являются кровь, моча, при смертельном отравлении – желудок с содержимым, печень.
Для изолирования гептахлора лучшими экстрагентами являются диэтиловый эфир, бензол, гексан.
Извлечение гептахлора из цельной крови проводят 3 раза по 10 мл, из 20 мл мочи 3 раза по 20 мл экстрагента. Для изолирования из паренхиматозных органов 100 г объекта настаивают трехкратно в течение 30 мин с диэтиловым эфиром или гексаном по 100, 50 и 50 мл. Вытяжки в каждом случае объединяют, обрабатывают безводным сульфатом натрия или взбалтывают с насыщенным раствором сульфата натрия в 20% растворе серной кислоты с целью очистки, упаривают до минимального объема и далее используют для качественного и количественного определения.
Для обнаружения гептахлора используют следующие реакции.
Реакция гептахлора с диэтиламином. Часть извлечения выпаривают досуха. Остаток растворяют в дихлорэтане, затем по стенке пробирки добавляют 5-7 капель смеси диэтиламина и 0,1 М раствора гидроксида калия в метаноле (1:2). Смесь взбалтывают – появляется зеленая, быстро исчезающая окраска.
Реакция с диэтаноламином проводится, как и предыдущая. В качестве реактива используется смесь диэтаноламина и 0,1 М раствора гидроксида калия в метаноле (1:2). При наличии гептахлора появляется фиолетовое окрашивание.
Реакция с анилином и пиридином. Часть извлечения испаряют досуха, остаток растворяют в бензоле, добавляют 5 капель анилина и 2 капли 0,1 М раствора гидроксида калия в метаноле. Смесь нагревают на водяной бане 15 с и прибавляют 1 мл пиридина и снова помещают в водяную баню на 10 с. Смесь перемешивают. Через 1-3 мин появляется темно-зеленое окрашивание.
Реакция с раствором гидроксида калия. К части извлечения прибавляют 1 мл 0,1 М раствора гидроксида калия в метаноле и взбалтывают. Пробирку помещают на 30 с в водяную баню, затем прибавляют 1 мл бензола. Постепенно развивается розовое или пурпурное окрашивание.
Количественное определение. Для количественного определения используют метод ГЖХ с электронно-захватным детектором. Определение ведут по высоте или площади пика в присутствии внутреннего стандарта.
11.2.3 Токсикологическое значение других хлорорганических пестицидов
В настоящее время число хлорорганических пестицидов насчитывает несколько десятков. Все они имеют определенное токсикологическое значение и вносят вклад в «токсическую ситуацию» в мире. Поэтому все импортируемые и производимые пищевые продукты в нашей стране подвергаются анализу на содержание хлорорганических соединений.
ДДТ – 4,4′-дихлордифенилтрихлорметилметан. Это белый кристаллический порошок, малорастворим в воде, растворим в органических растворителях. Токсическое воздействие ДДТ выражается в быстрой усталости, головных болях, нарушениях сердечной деятельности, тошноте, рвоте. Отмечаются снижение в крови содержания эритроцитов и повышение содержания лейкоцитов. На кожу и слизистую оболочку глаз оказывает раздражающее действие.
Полихлоркамфен – твердое, воскообразное вещество коричневого цвета, практически нерастворимое в воде, растворимое в большинстве органических растворителей. Токсическое действие выражается подобно предыдущему препарату. Так как полихлоркамфен накапливается в фосфолипидах спинного и головного мозга, его действие более выражено на ЦНС. При попадании в организм больной ощущает сначала дискомфорт, потом действие проявляется бессистемно: может быть нарушена ориентация в пространстве, появиться нарушение памяти и т.д.
Полихлорпинен – это вязкое бесцветное вещество, практически нерастворимое в воде, хорошо растворимо в органических растворителях. Токсическое действие проявляется как раздражение кожи, отечность, изъязвления, при попадании в глаза развивается серозно-гнойный конъюнктивит. При всасывании в кровь больной теряет сознание с тонико-клоническими судорогами, может развиться отек легких. При вскрытии отмечается полнокровие внутренних органов, отек мозга.
Хлорфеноксиуксусные кислоты. Чаще всего применяют производные 2,4-Д (2,4-дихлорфенокеиуксусной кислоты), реже производные 2,4,5-Т (2,4,5-трихлорфенок- сиуксусной кислоты). Токсическое действие 2,4-Д и 2,4,5-Т на организм теплокровных животных и человека сходно по характеру. Они действуют на центральную и периферическую нервные системы, эндокринные железы. При отравлении наблюдаются повышенная саливация, раздражение слизистых оболочек глаз, дыхательных путей, диспепсические явления, судороги.
Химико-токсикологический анализ перечисленных хлорорганических соединений проводится по схемам, как указано для ГХЦГ и гептахлора, с использованием хроматографии в тонком слое сорбента, ГЖХ, для некоторых веществ – реакций окрашивания, ГХ-МС (после дериватизации), УФ-спектрофотометрии, ВЭЖХ и др.