хлорпикрин что это такое
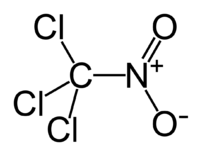
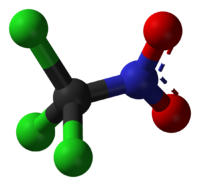
Хлорпикрин
| Хлорпикрин | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорпикрин, нитрохлороформ, трихлорнитрометан. |
| Химическая формула | CCl3NO2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 164.376 г/моль |
| Плотность | 1,6539 (20 °C) г/см³ |
| Термические свойства | |
| Температура плавления | -69 °C |
| Температура кипения | 112,3 °C |
| Классификация | |
| SMILES | C([N+](=O)[O-])(Cl)(Cl)Cl |
Содержание
Методы синтеза
Хлорпикрин впервые получил Стенхауз еще в 1848 году при взаимодействии 2,4,6-тринитрофенола (пикриновой кислоты) с хлорной известью. Позднее этот старинный процесс был использован в промышленных процессах, при помощи которых в первую мировую войну хлорпикрин получали для военных целей. Действие гипохлоритов кальция (т.е. дешёвой хлорной извести) приводит к расщеплению цикла 2,4,6- тринитрофенола и одновременно к хлорированию продуктов расщепления.
Вместо трудно растворимой пикриновой кислоты применяли легкорастворимый пикрат кальция, который получали смешением пикриновой кислоты с окисью кальция, и к смеси добавляли кашицу хлорной извести. Теплоты этой реакции достаточно для испарения образующегося хлорпикрина, пары которого затем конденсируют. Затем хлорпикрин легко перегоняется с водяным паром для очистки.
В настоящее время основным промышленным способом синтеза хлорпикрина является хлорирование нитрометана в щелочной среде:
CH3NO2 + 3NaOCl 
Хлорпикрин может также быть синтезирован нитрованием хлороформа ацетилнитратом:
CHCl3 + CH3COONO2 
Физико-химические свойства
Хлорпикрин-бесцветная, маслянистая, сильно преломляющая свет жидкость с резким специфическим запахом. На свету он становится зеленовато-желтоватым, что можно объяснить частичным его разложением с образованием хлора и окислов азота. Т. кип. 112—113 °C (760 мм рт. ст.) и 49 °C (40 мм рт. ст.), т. пл. — 62,2 (64) °С.
Зависимость давления пара, максимальной концентрации от давления.
| Температура, °C | Давление пара, мм рт. ст. | Максимальная концентрация, мг/л |
|---|---|---|
| 0 | 5,91 | 57 |
| 10 | 10,87 | 104 |
| 20 | 16,91 | 184 |
| 30 | 30,50 | 295 |
Широкий температурный интервал, в котором хлорпикрин существует в жидком состоянии, и его высокая летучесть даже при низких температурах позволяет применять его в любое время года. В зимние месяцы достигается концентрация, меньшая абсолютно токсичной, но достаточная для подавления противника.
Стойкость на местности, лишенной растительности, составляет при обычной температуре около 6 ч. В этот период выход на зараженную местность или ее преодоление без противогаза невозможны. Растворимость в воде при 25 °C, составляет 0,16 %. Хлорпикрин хорошо растворим в органических растворителях.
Из неорганических растворителей он хорошо растворяется в четыреххлористом кремнии и олове. Следует отметить, что хорошая смешиваемость с ОВ, например с ипритом, азотистым ипритом, дифосгеном, фосгеном, фосфорорганическими ОВ, делает хлорпикрин важным компонентом для тактических смесей, особенно в случае сравнительно низкоплавких ОВ, в результате чего становится возможным их применение в зимнее время.
Водой хлорпикрин не гидролизуется. Хлорпикрин легко дегазируется спиртовым раствором сульфида натрия, или растворами гидразина.
Хлорпикрин при высоком давлении и нагревании превращается в фосген.
Токсические свойства
Хлорпикрин раздражает кожу и слизистые оболочки. Он вызывает слезотечение, смыкание век, бронхит и отёк лёгких. Жидкий хлорпикрин вызывает тяжёлые поражения кожи.
У большинства людей концентрация 0,002 мг/л за 3-30 сек вызывает слезотечение и смыкание век, концентрация 0,05 мг/л — непереносима. Более высокие концентрации ведут к болям в области желудка, рвоте и потере сознания. Концентрация около 0,2 мг/л за несколько секунд или минут приводит к полной утрате боеспособности.
Хлорпикрин как боевое отравляющее вещество
Из-за невысокой для современных ОВ токсичности и сильного раздражающего действия хлорпикрин не рассматривается как боевое ОВ. С другими ОВ хлорпикрин также в настоящее время не используется, поскольку его раздражающее действие практически сразу дало бы возможность обнаружить применение ОВ.
Благодаря раздражающему действию и простоте обращения хлорпикрин используется в качестве учебного (имитация газовой атаки) и проверочного (тестирование средств химзащиты) ОВ. Однако из-за того, что при нагревании хлорпикрин разлагается с образованием фосгена, применение его в качестве учебного ОВ требует соблюдения мер предосторожности. В связи с этим в настоящее время хлорпикрин как учебное ОВ постепенно заменяется другими ОВ раздражающего действия.
Хлорпикрин что это такое
К удушающим относятся вещества, поражающие главным образом легочные ткани и вызывающие отек легких. Речь идет о следующих соединениях: CG — фосген (карбонилхлорид, дихлорангидрид угольной кислоты); DP — дифосген (трихлорметилхлорформиат, трихлорметилхлоркарбонат); CL — хлор; PS — хлорпикрин.
Лучше всего среди них известен фосген. Вещества этой группы раздражают бронхи, трахею, гортань, глотку и нос, а это вместе с острым отеком легких приводит к ощущению удушья.
Хлор рассмотрен также в отдельной статье о загрязнении воздуха.
Более 80 % всех жертв БОВ в первую мировую войну вызвано именно этим веществом. Дифосген, в принципе представляющий собой соединение фосгена с хлороформом, разработан уже после ее окончания с целью «улучшения» фосгена, но в 30-е годы его производство было свернуто с появлением веществ нервно-паралитического действия. Хлорпикрин применяли во время первой мировой войны как БОВ, раздражающее кожу и слизистые.
в) Отравление фосгеном и дифосгеном:
— Физические свойства. Фосген при комнатной температуре и атмосферном давлении представляет собой бесцветный газ с запахом свежего сена. Он тяжелее воздуха, поэтому в зависимости от погодных условий может скапливаться на некоторое время в траншеях, низинах и древесно-кустарниковых зарослях.
— Защита. Адекватную защиту против веществ удушающего действия обеспечивает стандартный полевой противогаз или пылеулавливающий фильтр.
— Механизм действия фосгена и дифосгена:
Дыхательная система. Массивному отеку легких предшествуют поражение бронхиального эпителия, развитие эмфизематозных очагов, дольковых ателектазов и отек околососудистой соединительной ткани. Трахея и бронхи после экспозиции к фосгену обычно выглядят нормально. Это резко контрастирует с картиной отравления хлором или хлорпикрином, когда эпителиальная выстилка обеих этих структур бывает сильно повреждена и слущивается.
— Клиника отравления фосгеном и дифосгеном:
1. Начальный период. Сначала бывает слабое раздражение глаз и глотки с кашлем, нехваткой воздуха, чувством стеснения в груди, тошнотой, иногда рвотой, головной болью и слезотечением.
2. Латентный период. Затем следует латентный период продолжительностью от 30 мин до 48 ч, когда пациент относительно бессимптомен и при объективном обследовании грудной клетки признаков поражения не выявляется.
3. Отек легких. Затем, если отравление сильное, быстро развивается отек легких с учащенным поверхностным дыханием, цианозом и болезненным приступообразным кашлем, приводящим к отхаркиванию обильной пенистой, белой или желтоватой жидкости. Обследование грудной клетки демонстрирует прогрессирующее ослабление дыхательных шумов с булькающими хрипами по всей области легких. Усиливаются общее недомогание, состояние тревоги, одышка и цианоз. Гиповолемия, гипоксия и недостаточность кровообращения могут привести к летальному исходу.
Рентгенограмма грудной клетки примерно в середине клинического латентного периода иногда позволяет выявить начало токсического отека легких гораздо раньше, чем он станет симптоматическим. В фирме Bayer в Германии используют персональные фосгеновые дозиметры.
— Диагностика. Раздражение носа и глотки фосгеном можно спутать с инфекцией верхних дыхательных путей. Затрудненное дыхание и жалобы на стеснение в груди позволяют также подозревать отравление нервно-паралитическим веществом или острый приступ астмы. Некардиогенный отек легких можно принять за отек, связанный с сердечной недостаточностью. Диагноз зависит от подтверждения экспозиции к фосгену в анамнезе. Клиническое состояние коррелирует с газовым составом артериальной крови. Ранняя диагностика промышленной передозировки фосгена затруднительна. Обоняние выявить такую экспозицию не позволяет.
Существенные изменения уровня гемоглобина, гематокрита, РаО2, РаСО2 и рН часто появляются только ближе к концу клинически латентного периода.
— Лечение отравления фосгеном и дифосгеном: Поддерживающая терапия:
1. Показаны покой и тепло: покой во время латентной стадии очень важен, поскольку любая активность в период между экспозицией и появлением легочной симптоматики повышает вероятность летального исхода.
2. При кашле: кодеина фосфат (30—60 мг).
3. Кислород: по возможности увлажненный. Своевременное использование перемежающегося положительного давления, положительного давления в конце выдоха (ПДКВ), маски («ПДКВ-маски») или, если необходимо, интубации с дыхательным аппаратом или без него может отсрочить или свести к минимуму отек легких и облегчить гипоксемию.
4. Седатация: не применяйте седативных средств, пока не обеспечена адекватная оксигенация и не подготовлено оборудование для вспомогательного дыхания на случай необходимости. Атропин, барбитураты, аналептики и антигистаминные средства противопоказаны.
5. Антибиотики: используются только при развитии бактериального бронхита или пневмонита, но не профилактически.
6. Диуретики при токсическом отеке легких малоэффективны, но они бывают полезны в сочетании с ПДКВ в плане уменьшения интерстициального отека.
Специфические средства. Стероиды, примененные вскоре (желательно в течение 15 мин) после экспозиции, могут уменьшить тяжесть отека. Когда он уже начал развиваться, они гораздо менее эффективны. Первая доза в 5 раз выше обычно используемой при астме. Затем в течение 12 ч применяют половину этой дозы, а в следующие 72 ч, пока риск отека легких не исчезнет, — стандартную противоастматиче-скую дозу.
Рекомендуются: бетаметазона валерат, беклометазона дипропионат или дексаметазона натрия фосфат.
Схема применения стероидов:
1. Ингаляция (дексаметазона натрия фосфата): 4 дозы-нажима (на головку аэрозольного баллончика) сразу, а затем по одному каждые 3 мин, пока не пройдет чувство раздражения. После этого по 5 нажимов с интервалом 15 мин, пока не кончится содержимое стандартного ингалятора. Затем в течение дня 1 нажим в час и по 5 нажимов каждые 15 мин до 30 нажимов в сумме перед отходом ко сну.
Такую схему повторяют ежедневно как минимум в течение 5 сут или дольше, если возникают аномалии, например признаки отека легких или инфильтраты на рентгенограмме грудной клетки, после чего ингаляции можно отменить. Если выздоровление идет медленно, свести дозу к 6 нажимам в день до полной нормализации состояния.
2. Если используется беклометазона или бетаметазона дипропионат, как можно быстрее проводят ингаляцию 10 доз-нажимов «разбрызгиваний» стероида из аэрозольного ингалятора. Следующие 10 ч применяют по 5 нажимов 1 раз в час, затем в течение как минимум 5 сут — 1 нажим ежечасно круглосуточно. Системная терапия: сначала внутривенно 20 мг бетаметазона или эквивалент этой дозы; повторяют внутривенно или внутримышечно каждые 6 ч в течение 24 ч и снижают дозу на протяжение следующих 5 сут.
3. Системная стероидная терапия.
Начинают как можно быстрее после экспозиции с 2 г метилпреднизолона внутривенно или внутримышечно (или с эквивалента этой дозы), повторяют через 6 и 12 ч. Затем вводят эту дозу с интервалом 12 ч от 1 до 5 сут в зависимости от тех же критериев, что и при стероидной ингаляционной терапии. Можно назначить антибиотики и противогрибковые средства для предупреждения инфекции и грибковой суперинфекции. Альтернативная схема системного лечения следующая:
День 1 1000 мг преднизолона внутривенно;
День 2 и 3800 мг преднизолона внутривенно;
День 4 и 5700 мг преднизолона внутривенно;
День 6 Если рентгенограмма грудной клетки остается нормальной, начинают быстро снижать дозу.
В острой стадии бронхоспазма могут потребоваться адреналин и кислород. Применяют также отхаркивающие средства.
Антидоты. Антидоты для фосгена не известны.
Перечный аэрозоль. Главный ингредиент перечного аэрозоля — экстракт кайенского перца. Известны отдельные сообщения о тяжелом поражении легких и летальном исходе после его применения. Необходимы дальнейшие клинические исследования с контролем.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
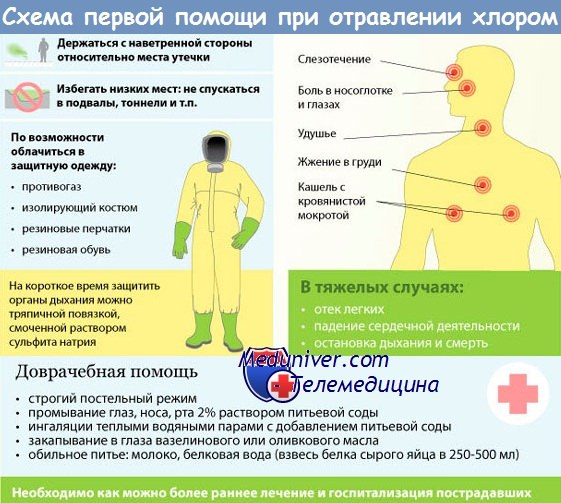
Характеристика аварийно химически опасных веществ (АХОВ)
Ниже рассматриваются лишь некоторые вещества (аммиак, хлор, хлорпикрин, формальдегид), наиболее широко используемые в национальной экономике. В Республики Карелия функционирует более 300 объектов экономики, располагающих значительными запасами опасных химических веществ. По токсичным свойствам и широкому распространению сжиженные аммиак и хлор являются наиболее опасными АХОВ.
Физико химические свойства. Аммиак – бесцветный газ с резким запахом нашатырного спирта, в 1,7 раза легче воздуха, хорошо растворяется в воде. Растворимость его в воде больше, чем всех других газов: при 20°C в одном объеме воды растворяется 700 объемов аммиака.
Температура кипения сжиженного аммиака – 33,35°С, так что даже зимой аммиак находится в газообразном состоянии. При температуре минус 77,7°С аммиак затвердевает.
При выходе в атмосферу из сжиженного состояния дымит. Облако аммиака распространяется в верхние слои приземного слоя атмосферы. Нестойкое АХОВ.
Поражающее действие в атмосфере и на поверхности объектов сохраняется в течение одного часа.
Пожаро и взрывоопасность. Горючий газ. Горит при наличии постоянного источника огня (при пожаре). При горении выделяет азот и водяной пар. Газообразная смесь аммиака с воздухом (при концентрациях в пределах от 15 до 28 % по объему) взрывоопасна. Температура самовоспламенения 650°С
Действие на организм. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Вызывают при этом обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении охлаждается, и при соприкосновении с кожей возникает обморожение различной степени.
Запах аммиака ощущается при концентрации 37 мг/м3. Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м3. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м3, глаз – 490 мг/м3. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7–14 г/м3 – эритематозный, 21 г/м3 и более – буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м3. Кратковременное воздействие аммиака в концентрации 3,5 г/м3 и более быстро приводит к развитию общетоксических эффектов.
Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м3; максимальная разовая 0,2 мг/м3.
Признаки поражения аммиаком: обильное слезотечение, боль в глазах, потеря зрения, приступообразный кашель; при поражении кожи химический ожог 1 й или 2 й степени.
Использование. Аммиак используется при производстве азотной и синильной кислот, мочевины, соды, азотсодержащих солей, удобрений, а также при крашении тканей и серебрении зеркал; как хладоагент в холодильниках; 10 % й водный раствор аммиака известен под названием «нашатырный спирт», 18–20 % й раствор аммиака называется аммиачной водой и используется в качестве удобрения.
Аммиак перевозится и часто хранится в сжиженном состоянии под давлением собственных паров (6–18 кгс/см2), а также может храниться в изотермических резервуарах при давлении, близком к атмосферному давлению. При выходе в атмосферу дымит, быстро поглощается влагой.
Поведение в атмосфере. При выбросе паров в воздух очень быстро формируется первичное облако с высокой концентрацией аммиака. Образуется оно очень быстро (в течение 1–3 мин). За это время в атмосферу переходит 18–20 % вещества.
Вторичное облако возникает при испарении аммиака с площади разлива. Характеризуется оно тем, что концентрация его паров на 2–3 порядка ниже, чем в первичном облаке. Однако их продолжительность действия и глубина распространения значительно больше. В таких случаях за внешнюю границу зоны заражения принимают линию, обозначающую среднюю пороговую токсодозу – 15 (мг мин)/л. Продолжительность действия вторичного облака определяется временем испарения разлившегося вещества, которое, в свою очередь, зависит от температуры кипения и летучести вещества, температуры окружающей среды, скорости ветра и характера разлива (свободно или в поддон).
Аммиак почти в 2 раза легче воздуха, а это существенно влияет на глубину его распространения. Так, по сравнению с хлором глубина распространения первичного и вторичного облака, а также площадь зоны заражения будут примерно в 25 раз меньше.Заражает водоёмы при попадании в них.
Хлор – первое отравляющее вещество, применённое в первую мировую войну. Германское командование использовало хлор для газовой атаки 22.04.1915 года. Из 6000 баллонов на фронте 6 км в течение 5 мин было выпущено 120 т хлора, который распространился на глубину 5–8 км. Потери составили 15000 человек. Хлор к настоящему времени утратил значение как ОВ, однако весьма широко используется в различных отраслях производства.
Физико химические свойства. Хлор – зеленовато желтый газ с резким удушающим запахом. Плохо растворяется в воде, хорошо – в некоторых органических растворителях. В практических условиях растворимость хлора в воде незначительна и составляет 3 кг на 1 т воды. При обычном давлении сжижается при температуре – 34°С, образуя маслянистую жидкость желтовато зелёного цвета, затвердевающую при минус 101°С. Твёрдый хлор это бледно жёлтые кристаллы.
Под давлением хлор сжижается уже при обычных температурах. Температура кипения сжиженного хлора –34,1°С, следовательно, даже зимой хлор находится в газообразном состоянии. При испарении образует с водяными парами белый туман. Один килограмм жидкого хлора дает 0,315 м3 газа. Хорошо адсорбируется активным углём. Химически очень активен.
Пожаро и взрывоопасность хлора. Негорюч, но пожароопасен, поддерживает горение многих органических веществ. В смеси с водородом взрывоопасен. При нагревании ёмкости взрывается.
Действие хлора на организм. По физиологическому действию на организм хлор относится к группе веществ удушающего действия. В момент контакта он оказывает сильное раздражающее действие на слизистую оболочку дыхательных путей и глаза. Признаки поражения наступают сразу после воздействия, поэтому хлор является быстродействующим АХОВ. Проникая в глубокие дыхательные пути, хлор разрушает лёгочную ткань, вызывая отёк лёгких.
В зависимости от концентрации (токсодозы) хлора степень тяжести отравления может быть различной.
При воздействии хлора уже в незначительных концентрациях наблюдается покраснение коньюктивы глаз, мягкого нёба и глотки, а также бронхит, лёгкая одышка, охриплость, чувство сдавливания в груди.
Пребывание в атмосфере, содержащей хлор в концентрациях 1,5–2 г/м3, сопровождается появлением болевых ощущений в верхних дыхательных путях, жжением и болью за грудиной (чувство сильного сдавливания в груди), жжением и резью в глазах, слезотечением, мучительным сухим кашлем. Через 2–4 ч появляются признаки отёка лёгких. Увеличивается одышка, учащается пульс, начинается отделение пенистой жёлтоватой или красноватой мокроты.
Предельно допустимая концентрация хлора в воздухе рабочей зоны производственного помещения составляет 1 мг/м3, однако человек начинает ощущать хлор в атмосферном воздухе при превышении концентрации 3 мг/м3. Следовательно, если чувствуется резкий удушливый запах хлора, то работать без средств защиты уже опасно. Раздражающее действие возникает при концентрации около 10 мг/м3. Воздействие 100–200 мг/м3 хлора в течение 30–60 минут опасно для жизни. Предельно допустимая концентрация хлора в атмосферном воздухе населённых пунктов равна: среднесуточная 0,03 мг/м3; максимальная разовая 0,1 мг/м3.
Признаки поражения хлором: сильное жжение, резь в глазах; слезотечение; учащённое дыхание; мучительный сухой кашель; сильное возбуждение; страх; в тяжёлых случаях остановка дыхания. При утечке или розливе хлора нельзя прикасаться к пролитому веществу, так как оставшийся в проливе хлор захолаживается до температуры минус 34°С.
Использование. Находит широкое применение для отбеливания тканей и бумажной массы, в производстве пластмасс, каучука, пестицидов, дихлорэтана, в цветной металлургии, а также в коммунально бытовом хозяйстве для обеззараживания воды.
;Хлор хранят и перевозят к местам потребления только в сжиженном состоянии. Наиболее распространённым способом хранения и транспортировки жидкого хлора является хранение под давлением, соответствующим давлению насыщенных паров хлора при температуре окружающей среды. Обычно он хранится в цилиндрических (10–250 м3) и шаровых (600–2000 м3) резервуарах в сжиженном состоянии под давлением собственных паров, величина которого зависит от температуры жидкого хлора. При температуре 25°С оно составляет 8 кгс/см2, а при температуре 60°С – 18 кгс/см2. Сжиженный хлор перевозят в железнодорожных цистернах, контейнерах и баллонах, которые одновременно могут являться временными хранилищами.
Поведение в атмосфере. При разрушении емкости происходит бурное (в зависимости от давления) испарение хлора. Доля мгновенно испарившегося хлора зависит от температуры хранящегося жидкого хлора. Чем выше его температура, тем большая доля хлора практически мгновенно испаряется при аварийном выбросе (20% при 20°С и 30% при 40°С). При этом образуется так называемое первичное облако с концентрациями, значительно превышающими смертельные концентрации. Продолжительность поражающего действия первичного облака хлора на небольших удалениях от места аварии будет составлять от нескольких десятков секунд до нескольких минут.
Вторичное облако, образующееся при испарении хлора с площади розлива, характеризуется концентрацией этого вещества в нем на 2–3 порядка ниже, чем в первичном облаке. Однако продолжительность действия в этом облаке хлора значительно больше и определяется временем испарения разливающейся жидкости. Испарение идет за счет тепла поддона или подстилающей поверхности, а также окружающего воздуха. Время испарения зависит от количества вещества, характера разлива: в поддон или свободно (в обваловку) и от метеорологических условий. Испарение может длиться несколько часов и даже суток.
Газообразный хлор в 2,5 раза тяжелее воздуха, поэтому облако хлора перемещается по направлению ветра близко к земле. Обладает хорошей проникающей способностью в негерметичные сооружения. Может скапливаться в низких участках местности, подвалах домов, колодцах, тоннелях и защитных сооружениях, не оборудованных в противохимическом отношении. За внешнюю границу зоны заражения принимается линия средней пороговой токсодозы, вызывающей начальные симптомы поражения. Она составляет 0,6 (мг.мин)/л.
Физико химические свойства. Хлорпикрин (ХП) – маслянистая жидкость бледно темного цвета, с очень резким раздражающим запахом картофельной ботвы, хорошо испаряющаяся даже зимой. Его пары в 5,7 раза тяжелее воздуха. Плохо растворим в воде, хорошо – в органических растворителях, горючих и смазочных материалах. Хорошо адсорбируется активным углём. Слабо гидролизуется даже при кипячении, не разлагается щелочами, кислотами. Температура кипения – 112,3°С.
Пожаро и взрывоопасность хлорпикрина. Взрывоопасен при нагревании. При нагревании до 400°С разлагается с образованием фосгена.
Действие хлорпикрина на организм человека. Поступает через органы дыхания. Является раздражающим веществом, обладает сильным слезоточивым действием. При концентрации 2 мг/м3 слезотечение начинается через несколько секунд. Непереносимая концентрация его паров составляет 80 мг/м3. В больших концентрациях ХП обладает удушающим действием, вызывая, как фосген, токсический отек легких. Концентрация паров ХП 0,8 г/м3 смертельна при 30 минутной экспозиции, а концентрация 8,0 г/м3 при 3 минутной экспозиции. В капельно жидком состоянии ХП вызывает слабые поражения кожи.
Предельно допустимая концентрация в воздухе рабочей зоны – 0,7 мг/м3. Предельно допустимая концентрация хлорпикрина в атмосферном воздухе населённых пунктов: среднесуточная 0,007 мг/м3; максимальная разовая 0,007 мг/м3.
Признаки поражения хлорпикрином: отсутствие скрытого периода действия (быстрое развитие сильного раздражения слизистой оболочки глаз и органов дыхания); резь, жжение и боль в глазах, слезотечение, першение в горле, кашель, рвота; при попадании на кожу дерматит.
Использование хлорпикрина. Используется главным образом для борьбы с вредителями сельского хозяйства, а также в качестве учебного опасного химического вещества при технической проверке противогазов (для проверки подбора лицевой части и исправности противогаза).
Защита. От паров ХП надежно защищает общевойсковой противогаз, гражданские противогазы типа ГП5 и ГП7, а также промышленный противогаз с коробкой марки А (БКФ). При работе с большим количеством ХП необходимо использовать средства защиты кожи.
Физико химические свойства. Формальдегид – бесцветный газ с резким удушающим запахом, несколько тяжелее воздуха (относительная массовая плотность паров 1,03), хорошо растворяется в воде. Заражает водоёмы. Водный (35–40% й) раствор формальдегида называют формалином (технический продукт содержит до 20% метилового спирта). Температура кипения минус 19,0 °С, температура плавления минус 118°С.
Пожаро и взрывоопасность. Горючий газ. В смеси с воздухом и кислородом взрывоопасен, воспламеняется от огня (пределы воспламенения от 7 до 73% по объему).
Использование формальдегида. Формальдегид используется для получения фенолоформальдегидных смол, изопрена, красителей, взрывчатых веществ, лекарств, а также как дубящее, антисептическое и дезодорирующее средство.
Признаки поражения характерны для раздражающих веществ. Через несколько часов после воздействия формальдегида развиваются явления поражения глубоких отделов дыхательных путей: резкий кашель, давление в груди, одышка, тошнота рвота, двигательное возбуждение, нарушение сознания, судороги. В более поздний период отмечаются явления гепатита.
Предельно допустимая концентрация в воздухе рабочей зоны 0,5 мг/м3. Защиту органов дыхания обеспечивают фильтрующие общевойсковые и гражданские противогазы, а также промышленные противогазы марки А, М, БКФ.