хлорид аммония что это такое
Аммония Хлорид
Химическое название
Химические свойства
Химическая формула Хлорида Аммония: NH4Cl. Соединение также называют хлористым аммонием, нашатырем, это аммонийная соль соляной кислоты. Представляет собой белый мелкий кристаллический гигроскопический порошок, без специфического запаха, соленого привкуса. Порошок при нагревании улетучивается. Средство хорошо растворяется в горячей и холодной воде, растворимо в этаноле. Молярная масса средства = 53,5 грамм на моль.
Вещество вступает в реакцию с щелочами. Реагирует с нитритом натрия при температуре выше 100 градусов с образованием азота, воды и хлорида натрия. Разложение Хлорида Аммония происходит при пропускании через него электрического тока, в результате образуется хлористый азот. Гидролиз химического соединения происходит по катиону, в кислой среде. Молекулярное уравнение: NH4Cl + H2O ↔ NH4OH +HCl.
Качественная реакция на Хлорид Аммония. При нагревании вещество с щелочью будет выделяться аммиак. Например, во время реакции с гидроксидом натрия выделится хлорид натрия, аммиак и вода.
В промышленных масштабах средство получают путем упаривания маточного раствора, который остается после отделения NaHCO3. В лаборатории вещество получают во время реакции аммиака с хлороводородом в присутствии хлорида натрия.
Фармакологическое действие
Фармакодинамика и фармакокинетика
После приема внутрь Аммония Хлорид быстро и достаточно легко всасывается через стенки кишечника и проникает в систему воротной вены. В тканях печени метаболизируется до мочевины, при этом образуются ионы водорода и Cl, которые создают кислую среду и нейтрализуются гидрокарбонатом натрия. Происходит подкисление мочи и форсируется диурез. Мочегонный эффект сопровождается интенсивным выведением ионов калия. Во время метаболизма вещества в легочной ткани образуются активные метаболиты, обладающие противомикробным и умеренным раздражающим действием.
Средство стимулирует работу желез слизистой оболочки дыхательных путей и выведение жидкого бронхиального секрета, активизирует работу ресничного эпителия и увеличивает сократимость бронхов. Диуретический эффект напрямую зависит от работы почек и их способности нейтрализовать ионы аммония, она накопления в интерстициальной жидкости ионов хлора и водорода.
Лекарство эффективно при лечении ПМС, болезни Меньера, в рамках комплексной терапии интоксикации фенциклидином.
Показания к применению
Противопоказания
Аммония Хлорид противопоказан к приему:
Побочные действия
Вещество способно раздражать слизистую оболочку желудка, вызывать рвоту и тошноту; при частом приеме могут развиться симптомы интоксикации аммиаком, сильное потоотделение, общая слабость и бледность, аритмия, подергивание мышцами, брадикардия, вплоть до комы.
Инструкция по применению (Способ и дозировка)
Аммония Хлорид назначают внутрь. В зависимости от показаний применяют различные дозировки и схемы терапии.
Передозировка
Лекарство может вызвать дезориентацию, тяжелый метаболический ацидоз, кому, головные боли и спутанность сознания. В качестве терапии вводят щелочные растворы, лактат или гидрокарбонат натрия.
Взаимодействие
Лекарство усиливает противомикробный эффект от приема метенамина.
Особые указания
Вещество рекомендуется принимать после еды.
При беременности и лактации
Средство противопоказано к приему беременными женщинами.
Препараты, в которых содержится (Аналоги)
Торговое название средства: Хлорид Аммония.
Отзывы
Отзывов о применении лекарства очень мало. Однако резко негативные отсутствуют. Да данный момент вещество назначают не часто. Его бывает сложно купить в аптечной сети.
Цена, где купить
Купить Аммония Хлорид для не медицинского применения можно оптом по цене приблизительно 30 рублей за кг.
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Аммония хлорид начали использовать еще с древности. В античной Греции вещество применялось для храмовых обрядов и лечения людей. Непонятное название химического соединения скрывает знакомый всем препарат, ведь что такое нашатырь, знает каждый: без него не обходится ни одна домашняя аптечка.
Что такое хлорид аммония
Первенство в получении вещества принадлежит древним египтянам и грекам. Название происходит от египетского слова «Аммоний». Так называли божество, в храме которого вдыхали испарения «нушадира» – раствора, сделанного из порошка с пещерных стен. С годами слово стало звучать как «нашатырь». Ammonium chloride, или хлорид аммония – это соль аммония. Выглядит как сухой кристаллический порошок без запаха, слегка солоноватый, белого цвета.
Хлорид аммония – формула
Структурная формула хлорида аммония – NH4Cl, по строению вещество представляет собой химическое соединение аммония с хлором. Лабораторный метод получения реагента выглядит как процесс упаривания маточного раствора хлорной извести. Второй способ – реакция взаимодействия между хлором и аммиаком. Народные умельцы придумали, как получить вещество из солевых батареек путем очищения и выпаривания.
Хлористый аммоний – свойства
Вскоре после открытия порошка ученые выделили свойства хлорида аммония:
Для получения нашатырного спирта сухой реактив смешивается с водой. В отличие от исходного соединения у него другая формула и свойства. Водный раствор обладает резким запахом. Чрезмерное вдыхание приводит к передозировке и летальному исходу. Врачи советуют хранить нашатырь отдельно от других лекарств. Пользоваться веществом нужно с особой осторожностью, ограничивая вдыхание несколькими секундами. Признаки передозировки хлористым аммонием и его производными:
Аммоний хлористый – применение
Полезные свойства аммиака способствовали тому, что он нашел широкое распространение во многих отраслях. Применение хлорида аммония нередко в таких сферах, как:
В медицине и фармакологии аммиак и его растворы используются чаще. Раствор хлорида аммония применяется в фармацевтике:
На втором месте находится пищевая промышленность. Добавка с маркировкой Е510 указана в перечне многих продуктов, использующихся в изготовлении: хлебобулочных, макаронных, кондитерских изделий, фруктовых вин. В Финляндии и других европейских странах принято добавлять вещество для усиления вкуса. Популярные лакричные конфеты Salmiakki и Tyrkisk Peber тоже сделаны с применением хлористого аммония.
В последнее время ученые провели ряд опытов, которые подтвердили, что пищевая добавка Е510 после термообработки теряет свои полезные свойства и становится вредна для здоровья. Многие производители продуктов питания предпочли полностью отказаться от ее использования, заменив на более безвредные аналогичные компоненты. Однако в других сферах соль аммония остается незаменимой.
Хлористый аммоний в виноделии
Для изготовления вина на заводах и дома используют порошкообразный препарат. Хлористый аммоний в виноделии служит подкормкой для дрожжевой среды. Добавлять его нужно не чаще одного раза за месяц. Для этого препарат покупают в аптеке, сначала растворяют в жидкости, а затем вносят по 0,3 г на каждый литр сусла. Мастера-виноделы советуют использовать пипетку или шприц, чтобы случайно не переборщить с количеством раствора.
Хлористый аммоний в быту
Использовать хлористый аммоний в быту научились еще наши бабушки. Он хорошо справляется с сильными загрязнениями на одежде, посуде, бытовой технике, украшениях. Овощи на грядках станут плодоносить лучше, если добавить к воде для полива несколько кристаллов соли аммония. Техническая форма вещества для этих целей продается в ветеринарной аптеке или магазине для садоводов. Хранить его нужно в герметичной емкости подальше от детей, соединение имеет третий класс опасности.
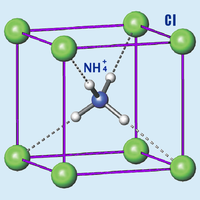
Хлорид аммония
| Хлорид аммония | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид аммония |
| Химическая формула | NH4Cl |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветные кубические кристаллы |
| Отн. молек. масса | 53,49 а. е. м. |
| Молярная масса | 53,49 г/моль |
| Плотность | 1,527 г/см³ |
| Термические свойства | |
| Температура плавления | возгонка при 337,6 °C |
| Энтальпия образования (ст. усл.) | -314,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде | (при 20 °C) 37,2 г/100 мл |
| Классификация | |
| Рег. номер CAS | [12125-02-9] |
Хлорид аммония (хлористый аммоний, техническое название — нашатырь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Содержание
Свойства
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г. Водные растворы вследствие гидролиза имеют слабокислую реакцию; хорошо растворим в жидком аммиаке.
При нагревании до 338 °C полностью распадается на NH3 и HCl (возгонка).
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NH4Cl.
Иногда используют реакцию взаимодействия аммиака с хлором:
Применение
Примечание
Не следует путать нашатырь (хлорид аммония) с нашатырным спиртом — раствором аммиака в воде.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Полезное
Смотреть что такое «Хлорид аммония» в других словарях:
хлорид аммония — хлористый аммоний … Cловарь химических синонимов I
АММОНИЯ ХЛОРИД — (NH4Cl), аммониевая соль соляной кислоты. В прошлом его называли нашатырем. Хлорид аммония твердое тело белого цвета, отличается летучестью, высокой растворимостью; его получают путем реакции между аммиаком и хлоридом водорода. Применяется в… … Научно-технический энциклопедический словарь
АММОНИЯ СОЛИ — хим. соед., содержащие однозарядный катион аммония NН+4, напр. хлорид аммония NH4Cl, нитрат аммония NH4NН3 … Естествознание. Энциклопедический словарь
АММОНИЯ ХЛОРИД — Ammonii chloridum. Синонимы: аммоний хлористый, нашатырь, амохлор, ацидамон и др. Свойства. Белый кристаллический, слегка гигроскопический порошок, без запаха, холодящий, солоноватый на вкус; улетучивается при накаливании (NH4CL). Легко раствори … Отечественные ветеринарные препараты
Хлорид бериллия — Общие Систематическое наименование Хлорид бериллия Химическая формула BeСl2 Эмпирическая формула BeСl2 Физические свойства Состояние ( … Википедия
Хлорид магния — Хлорид магния … Википедия
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид хрома(IV) — Общие Систематическое наименование Хлорид хрома(IV) Традиционные названия Хлористый хром Химическая формула CrCl4 Физические свойства Состояние … Википедия
Хлористый аммоний — применяется со времен древнего мира
Хлористый аммоний (хлорид аммония, нашатырь) — неорганическое соединение, 
Хлорид аммония был известен уже в Древней Греции и Древнем Египте. Одно из его названий, «нашатырь» происходит от египетского «нушадир» — вещества, которое жрецы собирали на стенках пещер, чтобы вдыхать его пары перед церемонией и настраиваться на общение с божественными силами. «Аммоний» ведет историю названия от имени египетского бога Солнца Амона. В Древней Греции вещество добывали из сажи, которая образовывалась на стенках дымоходов в результате горения верблюжьего навоза, служившего грекам топливом (хлористый аммоний получается при разложении выделений животных и человека).
Хлорид аммония встречается в природе в вулканических пещерах и около трещин в земной коре, в виде налета или корочек.
Свойства
NH4Cl — белый кристаллический порошок (реактив технической чистоты может быть желтоватым или розовым), слегка гигроскопичный, без запаха, солоноватый на вкус. Хорошо растворяется в воде и жидком аммиаке, с ростом температуры водорастворимость увеличивается. Вступает в реакцию со щелочами с образованием соли, воды и аммиака. В гораздо меньшей степени реактив растворяется в этиловом и метиловом спиртах. Горит с выделением густого белого дыма. Полностью разлагается при температуре свыше 338 °С, а также под действием электрического тока. Горящий хлорид аммония выделяет аммиак, который раздражает органы дыхания.
Водный раствор реактива — это нашатырный спирт, жидкость с резким запахом, который возбуждающе действует на нервную систему. Реактив используется как лекарство, но лечение нашатырным спиртом должно проводиться строго по рекомендации врача, так как передозировка может привести к остановке дыхания и коме (в качестве антидота вводят щелочные растворы, например, натрия гидрокарбонат). К тому же это лекарство имеет противопоказания.

Хлористый аммоний относится к веществам умеренно опасным (класс 3), работать с ним следует в средствах защиты: резиновых перчатках, защитных очках и респираторе, в помещении с приточно-вытяжной вентиляцией. Нужно следить, чтобы реактив не попал на кожу и слизистые оболочки. Хранить хим. реактив нужно в герметично закрытых многослойных мешках, в крытых помещениях без доступа влаги. Соединение опасно для окружающей среды.
Применение
— В цветной металлургии для травления металлов.
— Как составная часть электролитов в гальванике.
— Для удаления оксидной пленки при пайке и лужении стали, для производства сухих батарей в электротехнике.
— В текстильной индустрии — для отверждения клеев и лаков.
— Для получения нашатырного спирта, которым приводят в чувство при потере сознания. Также хлорид аммония является компонентом сердечных противоотечных средств, средств против кашля. Его используют для усиления некоторых мочегонных лекарств.
— В пищепроме это пищевая добавка E510, разрешенная в России и европейских странах. Его применяют для улучшения свойств муки, как загуститель и эмульгатор, для изготовления плодовых и ягодных вин, лакричных конфет, как приправу к рыбе. В последнее время добавка Е 510 применяется все реже из-за подозрений в ее вреде.
— При изготовлении сигнальных дымовых шашек, как дымообразователь.
— В сельском хозяйстве, при выращивании некоторых культур в качестве азотного удобрения на нейтральных и щелочных почвах.
— В аналитической химии и биологии в качестве фиксанала.
— Как составная часть быстрого фиксажа при проявке фотографий.
— При изготовлении фитилей для свечей.
— В быту в разведенном виде — для очистки различных поверхностей и украшений, при стирке.
В магазине «ПраймКемикалсГрупп» вы можете купить аммоний хлористый BASF в порошке, а также ампулы с фиксаналом «Аммоний хлористый». На эти и другие реактивы у нас доступные цены, имеется доставка.
Хлорид аммония (Е510)

Хлорид аммония хотя и классифицируется как пищевая добавка Е510, но особенной популярностью среди производителей продуктов питания не пользуется, и в пище встречается достаточно редко. Впрочем, это замечание не вполне справедливо для стран Европейского союза – там хлорид аммония можно обнаружить в некоторых популярных продуктах и лакомствах. В химической и пищевой отрасли производства вещество ещё называют солянокислым аммонием или аммонийной солью.
Химическая характеристика, технологии получения вещества
Добавка, хотя и синтезируется искусственным путём для промышленных целей, распространена и в живой природе. Впервые с неё столкнулись ещё жители древних Египта и Греции: египтяне обнаружили белый кристаллический налёт хлорида аммония на стенах пещер в скальных породах, а позже греки начали добывать его из сажи, которая образовывалась внутри печных труб. Топливом на тот момент служил высушенный помёт верблюдов.
И сегодня вещество встречается в виде налёта и корочек на скальных породах, рядом с вулканическими сопками и в расщелинах земной коры. Кроме того, аммониевая соль является одним из продуктов распада экскрементов животных.
На вид добавка представляет собой белый порошок, состоящий из мелких кристалликов. Именно порошковая форма вещества не имеет никакого запаха, на вкус она немного солоновата и оставляет ощущение прохлады во рту. Хлорид аммония обладает высокой растворимостью в жидком аммиаке, этиловом и метиловом спирте, а также в воде, при чём особенно хорошо растворяется в тёплой или горячей воде. Получаемый таким образом водный раствор как раз и имеет тот специфический резкий запах, хорошо знакомый каждому, кто хоть раз терял сознание. Кроме того, вещество подвержено реакциям со щелочами.
Иногда аммониевая соль встречается и в виде крупных кристаллов, но для удобства промышленного пользования её всё равно измельчают в порошок.
Температура плавления добавки Е510 – 337,6 градуса Цельсия, при температуре 338 и выше градусов происходит распад. При возгорании порошкообразная добавка выделяет густой белый дым.
Существует несколько способов синтезирования хлорида аммония. В лабораторных условиях выработка происходит путём проведения реакции аммиака с хлором. Для промышленных целей вещество получают в результате нескольких этапов:
Некоторые “умельцы” получают хлорид аммония в домашних условиях, используя для этого обычные солевые батарейки.
Как пищевая добавка, вещество чаще всего используется в качестве эмульгатора и загустителя: с его помощью можно создавать однородные смеси компонентов, которые не смешиваются в обычных условиях, а также улучшить консистенцию продукта и регулировать её вязкость.
Использование свойств аммониевой соли в промышленности

Скандинавские страны пользуются свойствами добавки для изготовления лакричных конфет (это, кстати, одна из причин, почему ими нельзя увлекаться – при переедании лакрицы могут появиться тошнота и рвота именно из-за хлорида аммония). В Норвегии вещество известно как приправа к различным блюдам.
Различные сферы производства, кроме пищевой, тоже применяют аммониевую соль:
Виноделы пользуются порошковой формой добавки в качестве подкормки для дрожжевой среды зреющих вин. Всего 0,3 грамма раствора на 1 литр напитка вносится не чаще, чем раз в месяц для того, чтобы вино могло перебродить до нужного состояния.
Техническая соль аммония, которая продаётся в аптеках, может быть полезной и в быту: его раствор хорошо выводит загрязнения с одежды, мебели, украшений, посуды и бытовой техники.
Воздействие вещества на человека
Самое известное свойство соли аммония – возбуждающее. При потере сознания вдыхаемые пары раствора вещества способны оказать сильный стимулирующий эффект на дыхательные центры и привести человека в чувство.
Кроме того, добавка обладает мочегонным свойством и может применяться для борьбы с отёчностью и застоями жидкости. В таком случае предписывают принимать слабый раствор вещества в очень маленьких количествах. Добавка всасывается организмом из пищеварительного тракта и выводится почками вместе со всей лишней жидкостью. Для тех, кто имеет в анамнезе заболевания почек, приём вещества категорически запрещён.
Также хлорид аммония оказывает отхаркивающее действие при сильном кашле, вызванном хроническим бронхитом, бронхиальной астмой или пневмонией.
Вдыхание большого количества паров добавки Е510 крайне опасно, так как может спровоцировать ожог дыхательных путей и остановку дыхания. Передозировка раствором аммониевой соли вызывает неприятные симптомы отравления: тошноту, рвоту и потерю аппетита.
В некоторых государствах использование этой пищевой добавки под запретом. В России, Украине и многих странах Европейского союза строгих ограничений по её использованию нет.
Существует неподтверждённая информация о том, что в процессе термообработки хлорид аммония становится токсичным и опасным для человека. Официальных доказательств пока обнародовано не было. Также нет у науки подтверждённых данных о возможной мутагенности или онкогенности вещества.
Хлорид аммония в виде порошка или раствора применяется во многих сферах промышленности. Для человека это вещество не представляет серьёзной опасности при соблюдении некоторых элементарных требований осторожности, оно легко всасывается и выводится из организма, не причиняя ему существенного вреда. Знаменитые лакричные конфеты, а также мучные изделия, макароны, сладости и плодовое вино – в этих продуктах можно столкнуться с пищевой добавкой Е510.