химерный ген что это
Генетические маркеры
Химерные онкогены
Транслокации после крупных делеций и дупликаций являются самыми частыми хромосомными аномалиями. Различают два основных типа специфических хромосомных транслокаций:
Транслокации хромосомы 8 с хромосомами 2, 14 и 22, в результате которых происходит перемещение протоонкогена MYC (8q24) в область генов иммуноглобулинов IGH (14q32), IGK (2p12) и IGL (22q11), – классический пример аномалии первого типа. Эти гены обладают очень сильными регулярными элементами, которые начинают постоянно активировать MYC. Как правило, не участвует в перестройке первый некодирующий экзон протоонкогена. В 90% случаев лимфомы Беркитта выявляются именно эти транслокации.
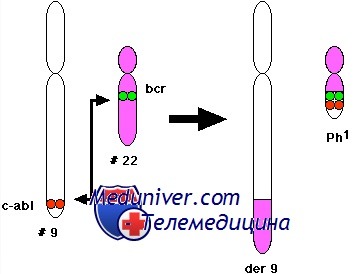
В результате транслокаций, инверсий и небольших делеций достаточно часто появляются химерные гены с новой агрессивной функцией белкового продукта – слитных белков. В 1973 г описана специфическая транслокация хромосом 9 и 22, приводящая к появлению филадельфийской хромосомы при хронической миелоидной лейкемии, – классический пример транслокаций второго типа. В результате появляется ген, кодирующий слитный белок, имеющий свойства тирозинкиназы, подобной ABL, но с аномальными трансформирующими свойствами.
Описано 358 химерных, формируемых 337 различными генами. Химерные гены определены практически во всех типах злокачественных опухолей (Mitelman et al., 2007). В злокачественных опухолях кроветворной системы встречается почти 75% химерных генов. При остром миелоидном лейкозе описано 267 химерных генов, при остром лимфобластном лейкозе – 155, в солидных опухолях – только 75. Для каждого типа заболевания характерны определённые перестройки, им соответствует определенная клиническая картина. Зачастую транслокации позволяют поставить точный диагноз, подобрать лечение и прогнозировать течение заболевания.
Химерные гены могут провоцировать развитие опухоли определённого гистогенетического типа. Образующийся в результате транслокации t(12;15)(p13;q25) химерный ген ETV6-NTRK3 вызывает ОМЛ, мезобластную нефрому, фибросаркому, аденокарциному молочной железы.
Молекулярная цитогенетика, в частности, многоцветная флуоресцентная гибридизация in situ, SKY и сравнительная геномная гибридизация позволяют осуществлять поиск новых химерных генов. Методы ОТ-ПЦР (обратная транскрипция мРНК-ПЦР) или прямого секвенирования позволяют диагностировать химерные гены, характерные для определённой опухоли.
Химерный ген что это
Хронический миелоидный лейкоз (ХМЛ) — клональное новообразование, развивающееся из стволовых кроветворных клеток. Это первая опухоль человека, при которой был обнаружен характерный хромосомный маркер. Открытие сделано в 1960 г. американскими исследователями Р. С. Nowell и D. A. Hungerford в Филадельфии, поэтому маркер был назван филадельфийской (Ph)-хромосомой. Именно с этой находки началась клиническая цитогенетика в онкологии.
Филадельфийская хромосома — укороченная хромосома из группы так называемых малых акроцентриков. В каждой нормальной женской клетке эта группа включает две пары хромосом — 21-ю и 22-ю, а в мужских клетках таких хромосом не 4, а 5, поскольку в эту группу, кроме 21-й и 22-й хромосомных пар, включена также Y-хромосома.
Ph-хромосома выявляется при обычной окраске (без G-бендинга) практически у всех больных хроническим миелоидным лейкозом (95—98 %). На дифференциально окрашенных (бендинг) хромосомах видно, что укорочена одна из хромосом 22-й пары.
Примерно у 90 % больных Ph-хромосома видна во всех анализируемых метафазах, у остальных пациентов обнаруживают как клетки с Ph-хромосомой, так и нормальные клетки, причем в отдельных случаях Ph-хромосома регистрируется в меньшинстве клеток костного мозга. Транслокация (9;22) наблюдается в миелоидных клетках, эритробластах, В-и Т-лимфоцитах, мегакариоцитах. Этот факт свидетельствует о том, что заболевание начинается с некоммитированной клетки-предшественницы гемопоэза.
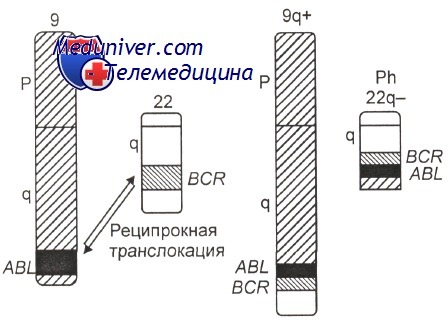
В 1973 г. знаменитым американским исследователем J. D. Rowley было установлено, что Ph-хромосома образуется не вследствие делеции хромосомы 22, как предполагали ранее, а в результате сбалансированной транслокации между хромосомами 9 и 22 (участками 9q34 и 22qll), при этом формируются две маркерные хромосомы, обозначаемые как 9q+ и 22q- (Ph). Изредка наблюдаются перестройки, скрывающие укороченную хромосому 22, — так называемая замаскированная Ph-хромосома, т. е. маленький фрагментик, оторвавшийся от любой другой хромосомы, может «прилепиться» к обломанной хромосоме 22 и «замаскировать» поломку. Эта «маскировка» довольно легко раскрывается при дифференциальной окраске.
Примерно в 10 % случаев наблюдаются атипичные транслокации, при которых стандартное цитогенетическое исследование позволяет увидеть перенос фрагмента хромосомы 22 не на 9-ю, а на какую-либо другую хромосому. Кроме того, иногда при хроническом миелоидном лейкозе обнаруживают сложные Ph-транслокации с участием не двух (9-й и 22-й), а трех или более хромосом.
Установлено, что практически при всех Ph-транслокациях участвуют хромосомы 9 и 22, однако это не всегда видно при стандартном цитогенетическом исследовании, но обнаруживается при использовании FISH и ПЦР.
Большинство исследователей считают, что тип Ph-транслокации (стандартная, атипичная или сложная) не имеет клинического значения.
Использование молекулярно-генетических методов позволило установить, что в хромосоме 9 разрыв проходит через ген (протоонкоген) ABL, идентифицированный ранее в одном из вирусов лейкоза у мышей. В хромосоме 22 наблюдается разрыв гена ВСЯ. В результате слияния фрагментов названных генов (ABL и BCR) образуется химерный ген BCR-ABL, расположенный, как правило, на делетированной хромосоме 22 (Ph-хромосома) Схематическое изображение молекулярно-генетических событий, приводящих к развитию хронического миелоидного лейкоза, показано на рисунке.
Примерно в 70 % случаев, кроме транскрипта BCR-ABL, обнаруживают продукт (транскрипт) другого химерного гена, образующегося в результате t(9;22) —ABL-BCR на der (9), однако его роль в развитии хронического миелолейкоза неясна.
Установлен еще один важный факт: примерно у 20—25 % больных хроническим миелолейкозом имеется делеция в маркерной хромосоме 9q+. Эта аномалия не видна при «простом хромосомном анализе». Ее можно обнаружить только при использовании FISH со специально разработанными зондами. Размер делеции варьирует от пациента к пациенту: делетированный участок может включать последовательности гена BCR, перенесенные на хромосому 9 с хромосомы 22, последовательности самой хромосомы 9 или последовательности обеих этих хромосом.
Установлено, что делеция возникает одновременно с формированием специфической t(9;22), ее частота одинакова в группах больных, обследованных на разных стадиях хронического миелолейкоза. Независимо от метода лечения (даже при использовании программ, включающих гливек) прогноз у больных с интерстициальной делецией в маркере 9q+ существенно хуже, чем у больных без этой аномалии. Длительность хронической фазы и соответственно выживаемость у больных с делецией значительно меньше. Так, при обследовании большой группы больных (241) обнаружено, что медиана выживаемости была 38 мес для больных с делецией (39 человек) и 88 мес для группы больных без делеции (202 человека). Различия статистически значимы.
Применение этого информативного прогностического метода пока, к сожалению, не вошло в широкую клиническую практику, поскольку он весьма сложен и требует дорогостоящих реактивов и оборудования.
Роль делеции маркера 9q+ в прогрессии хронического миелолейкоза пока до конца не выяснена. Выпадение кодирующих последовательностей генов ABL и/или BCR в результате делеции приводит к тому, что экспрессируется только один химерный ген BCR-ABL, но нет экспрессии гена ABL-BCR. Возможно, и это событие играет роль в профессии лейкоза. Обсуждается также возможность инактивации неизвестных пока генов-супрессоров, локализованных в хромосомном районе, который делетируется.
Химерный ген BCR-ABL кодирует белок с мол. м. 210 000, обладающий более высокой протеинкиназной активностью, чем продукт нормального протоонкогена ABL (Р145). При лейкозе, вызванном у мышей вирусом Абельсона, онкогенной активностью обладает белок — продукт гибридного гена gag/abl с высокой протеинкиназной активностью. В эксперименте проводили вырезание гена gag/abl, после этого вирус терял способность вызывать лейкоз у мышей.
Изучение разрывов в генах ABL и BCR при хроническом миелолейкозе показало, что у разных больных их локализация неодинакова. Так, в гене ABL протяженность участка, на котором могут происходить разрывы, велика —до 200 kb, а в гене BCR разрывы локализуются обычно на маленьком участке — 8,5 kb, т. е. имеется кластер разрывов, отсюда название самого гена BCR (breakpoint cluster region).
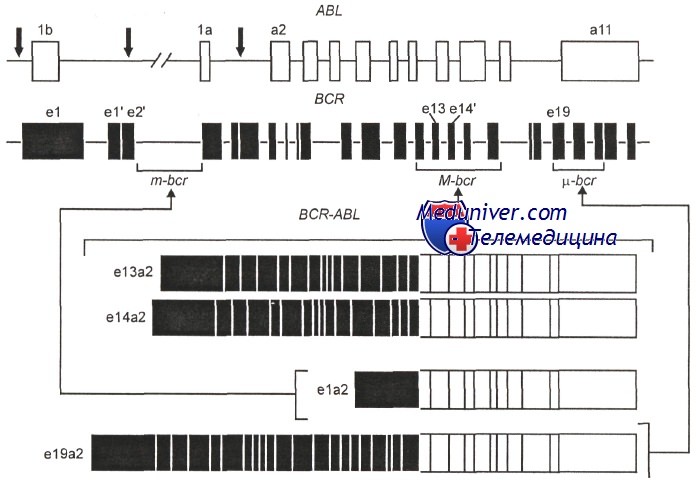
Первый ряд — разрывы в гене ABL; второй ряд — три кластера разрывов в гене BCR: m-BCR, М-BCR и u-BCR. Ниже три типа транскриптов химерных генов BCR-ABL, различающихся по длине вошедших участков гена BCR
В подавляющем большинстве случаев t(9;22) разрывы гена BCR обнаруживают на участке, обозначаемом M-BCR, при этом химерный ген включает длинный фрагмент гена BCR и в результате возникает характерный для хронического миелолейкоза белок P210Bcr/Abl. Кроме того, при t(9;22) разрывы в гене BCR могут локализоваться на одном из двух других типичных участков, называемых m-bcr и u-bcr. Разрывы в области m-bcr приводят к образованию химерного белка Р190Bcr/Abl, т. е. белка меньшей величины, чем Р210Bcr/Abl. При локализации разрывов в u-bcr образуется более крупный белок Р230Bcr/Abl.
Эти молекулярные различия не строго коррелируют с клиническими особенностями лейкозов. Так, Р190Bcr/Abl характерен для двух абсолютно разных лейкозов: с одной стороны, это Ph-позитивный острый лимфобластный лейкоз, а с другой — хронический гранулоцитарный лейкоз с выраженным моноцитозом и миелодиспластическими чертами. При обнаружении Р230Bcr/Abl обычно наблюдается картина так называемого нейтрофильного варианта хронического миелолейкоза, т. е. хронический миелолейкоз, при котором формула крови представлена зрелыми нейтрофилами и единичными метамиелоцитами. Кроме того, название «нейтрофильный гранулоцитарный лейкоз» используется на протяжении многих лет для обозначения Ph(BCR-ABL)-негативного хронического миелолейкоза — относительно доброкачественного варианта, наблюдаемого у пожилых людей, но редко встречающегося и у подростков.
Как отмечалось, коррелятивная связь между типом химерного белка (P190Bcr/Abl, Р210Bcr/Abl или Р230Bcr/Abl) и клинико-гематологичесой картиной лейкоза не является строгой. Любой из этих белков может быть обнаружен при классической картине хронического миелолейкоза. Есть также сообщения о нередком сочетании двух типов белков (Р210Bcr/Abl| и Р190Bcr/Abl) при типичном хроническом миелолейкозе и при остром лимфобластном лейкозе.
Реальная частота «атипичных» белков BCR-ABL при типичном хроническом миелолейкзе неизвестна, поскольку исследования на большом материале не проводились.
Решающая роль гена BCR-ABL и его продукта — белка Р210 в развитии хронического миелолейкоза продемонстрирована на разных модельных системах in vivo и in vitro. Так, трансдукция bcr/abl в стволовые гемопоэтические клетки мыши с последующей трансплантацией этих клеток облученным сингенным животным вызывает у них миелопролиферативное заболевание, сходное с хроническим миелолейкозом человека. Установлено, что онкогенный потенциал химерного белка BCR-ABL обусловлен его высокой тирозинкиназной активностью. Дерегуляция тирозинкиназной активности — одно из центральных событий в злокачественной трансформации клеток.
При введении клеток, экспрессирующих р210Bcr/Abl, группе летально облученных мышей в условиях одного и того же эксперимента у одних животных развивался лейкоз, очень похожий на хронический миелолейкоз человека, а у других — самые разнообразные новообразования из гемопоэтических клеток: миеломоноцитарные лейкозы, макрофагальные опухоли, пре-В- и Т-клеточные лимфомы, ретикулоклеточные саркомы и эритроидные опухоли. Причина различий не выяснена. Эти опыты, как и эксперименты с трансгенными мышами, показывают, что вся цепь событий, приводящая к развитию картины хронического миелолейкоза, пока еще не установлена.
В самом обобщенном виде «молекулярный патогенез» хронический миелолейкоз описывают так: химерный ген BCR-ABL кодирует белок с постоянно активированной тирозинкиназной активностью; это в свою очередь приводит к активации множества сигнальных путей и выраженным изменениям клеточного цикла, адгезии и апоптоза. Считают, что этих событий достаточно для инициации злокачественной трансформации клетки и поддержания опухолевого фенотипа.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Выявление и количественное определение мРНК химерного гена bcr-abl (р210) в Москве
Лабораторный анализ основного маркера хронического миелоидного лейкоза.
Приём и исследование биоматериала
Когда нужно сдавать анализ Выявление и количественное определение мРНК химерного гена bcr-abl (р210)?
Подробное описание исследования
Хронический миелоидный лейкоз (ХМЛ), или миелолейкоз, — клональное онкогенетическое заболевание, которое происходит из мутировавших злокачественных кроветворных — миелоидных — клеток костного мозга. На данный момент причины, по которым развивается миелолейкоз, не установлены. К факторам риска в основном относят инфекционные заболевания и радиационное облучение.
Для хронического миелоидного лейкоза характерны:
Ph, или филадельфийская хромосома, — это аномальная хромосома, которая возникает при обмене участков 9 и 22 хромосом. Данный обмен называют транслокацией, в результате неё возникает химерный онкоген BCR-ABL, который приводит к бесконтрольному росту клеток миелоидной линии (нейтрофилов, эозинофилов, базофилов и моноцитов). В норме избыточное кроветворение блокируется специфическими сигналами, однако аномальный белок BCR-ABL не воспринимает их. Со временем опухолевая масса вытесняет нормальные клетки кровяного ростка костного мозга.
При обмене участков 9 и 22 хромосом в местах обмена образуются разрывы. В зависимости от места разрыва могут быть разные транскрипты — генетические материалы в виде молекулы РНК — BCR-ABL. Основной транскрипт (мРНК) этого гена — p210. Данное исследование направлено на количественное определение именного этого варианта транскрипта BCR-ABL.
Клиническая картина хронического миелоидного лейкоза протекает в три фазы: хроническая, фаза акселерации и бластный криз. Заболевание начинается бессимптомно, затем появляется интоксикация и характерный синдром — гепатоспленомегалия (увеличение размеров печени и селезенки). В этот период в крови можно обнаружить избыточный уровень лейкоцитов. По мере прогрессирования болезни объем селезенки увеличивается в несколько раз, в крови выявляется анемия и низкий показатель тромбоцитов, а также появляются бластные клетки. Клинически у пациентов могут быть следующие симптомы:
Диагноз хронический миелолейкоз устанавливают при помощи полимеразной цепной реакции (ПЦР), который количественно определяет мРНК BCR-ABL p210. Помимо этого, данный метод используют у пациентов с выявленным ХМЛ для оценки эффективности получаемого лечения, проводимого в основном таргетными препаратами — ингибиторами BCR/ABL тирозинкиназы.
Химерный ген что это
Этиология и встречаемость хронического миелоидного лейкоза (ХМЛ). Хронический миелоидный лейкоз (ХМЛ) (MIM №608232) — клональная экспансия трансформированных кроветворных клеток-предшественниц, при которой возрастает число циркулирующих миелоидных клеток. Трансформация клеток-предшественниц происходит за счет экспрессии онкогена BCR-ABL.
Хронический миелоидный лейкоз (ХМЛ) составляет до 15% всех случаев лейкоза у взрослых и встречается с частотой 1-2 на 100 000; скорректированная возрастная встречаемость более высокая среди мужчин, чем среди женщин (1,3-1,7 против 1,0).
Патогенез хронического миелоидного лейкоза (ХМЛ)
Приблизительно 95% пациентов с хроническим миелоидным лейкозом (ХМЛ) имеют филадельфийскую хромосому; остальные — сложные варианты транслокаций. Протоонкоген Абельсона (ABL), кодирующий нерецепторную тирозинкиназу, находится в сегменте 9q34, а ген точечного разрыва кластерного региона (BCR), кодирующий фосфопротеин, — в 22qll.
При образовании филадельфийской хромосомы ген ABL разрывается в интроне 1, а ген BCR в одном из трех кластерных регионов разрыва; в производной хромосоме 22 фрагменты генов BCR и ABL соединяются «голова в хвост». Объединенный ген BCR-ABL в транслоцированной хромосоме 22 генерирует белок, изменяющийся по величине в зависимости от длины пептида Bcr, присоединяющегося к N-концу.
До настоящего времени функции белков Abl и Bcr в норме окончательно не определены. Белок Abl довольно хорошо сохраняется в ходе эволюции многоклеточных. Он присутствует как в ядре, так и в цитоплазме и связан с внутренней цитоплазматической мембраной. Относительное количество белка Abl в этих частях клетки изменяется в различных типах клеток, а также в ответ на стимулы.
Abl участвует в клеточном цикле, ответе на стресс, передаче сигналов от интегринов и в нервном развитии. Функциональные области Bcr включают двойную спираль для полимеризации с другими белками, область треонин-серин-киназы, область обмена ГДФ-ГТФ, вовлеченную в регуляцию белков семейства Ras, и область активации ГТФ, участвующую в регуляции Rac и Rho ГТФаз.
Экспрессия Abl не приводит к трансформации клеток, вызываемой экспрессией химерного белка Bcr-Abl. У трансгенных мышей, вырабатывающих химерный Bcr-Abl с рождения, развивается острый лейкоз, а инфицирование здоровых мышей ретровирусами, экспрессирующими Bcr-Abl, вызывает ряд острых и хронических лейкозов, в зависимости от генетического фона.
В отличие от белка Abl, химерный белок Bcr-Abl имеет активность конститутивной тирозинкиназы и ограничен цитоплазмой, где энергично связывает микрофибриллы актина. Bcr-Abl фосфорилирует несколько цитоплазматических субстратов и тем самым активизирует сигнальные каскады, управляющие ростом, дифференцировкой и, возможно, адгезией кроветворных клеток.
Неправильная активизация этого сигнального пути приводит к неуправляемому распространению гемопоэтических стволовых клеток, выходу незрелых клеток из костного мозга, и, в конце концов, к хроническому миелоидному лейкозу (ХМЛ).
По мере развития хронического миелоидного лейкоза (ХМЛ) становится все более агрессивным. В ходе этой эволюции клетки опухоли у 50-80% пациентов приобретают дополнительные хромосомные изменения [трисомию 8,i(17q), или трисомию 19], вторую филадельфийскую хромосому. Кроме описанных цитогенетических изменений, при развитии хронического миелоидного лейкоза (ХМЛ) также часто мутируют гены-супрессоры опухолевого роста и протоонкогены.
Фенотип и развитие хронического миелоидного лейкоза (ХМЛ)
Хронический миелоидный лейкоз (ХМЛ) — двух- или трехфазная болезнь. Начальный, или хронический этап характеризуется незаметно подкрадывающимся началом с постепенным развитием усталости, недомогания, потери массы тела и минимальным или умеренным увеличением селезенки. Со временем хронический миелоидный лейкоз (ХМЛ) обычно переходит в фазу акселерации и затем в бластный криз, хотя некоторые пациенты переходят непосредственно от хронической фазы в бластный криз.
Развитие хронического миелоидного лейкоза (ХМЛ) включает появление дополнительных хромосомных аномалий в клетках опухоли, прогрессирующего лейкоцитоза, анемии, тромбоцитоза или тромбоцитопении, всевозрастающую спленомегалию, лихорадку и костные нарушения. Властный криз — состояние острого лейкоза, бласты могут быть миелоидными, лимфоидными, эритроидными или недифференцированными. Фаза акселерации — промежуточная между хронической фазой и бластным кризом.
Приблизительно 85% больных диагностируют в хронической фазе. В зависимости от метода исследования, средний возраст постановки диагноза колеблется от 45 до 65 лет, хотя заболеванию подвержены лица любых возрастов. При отсутствии лечения показатель перехода из хронической фазы в бластный криз составляет приблизительно 5-10% в первые 2 года и затем 20% за год. Поскольку бластный криз быстро приводит к летальному исходу, развитие криза равнозначно смерти.
Особенности фенотипических проявлений хронического миелоидного лейкоза (ХМЛ):
• Возраст начала: от середины до конца зрелости
• Лейкоцитоз
• Спленомегалия
• Усталость и недомогание
Лечение хронического миелоидного лейкоза (ХМЛ)
Выяснение молекулярной основы хронического миелоидного лейкоза (ХМЛ) привело к разработке специфического ингибитора тирозинкиназы Bcr-Abl — иматиниба (гливек). Теперь это лекарство — основной препарат при лечении хронического миелоидного лейкоза (ХМЛ). Более 85% больных дают четкий цитогенетический ответ на терапию иматинибом, с исчезновением t(9;22) в клетках, получаемых при пункции костного мозга.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Химерный ген что это
Молекулярно-биологическое исследование, позволяющее количественно оценить содержание в клетках белкового продукта мутантного гена BCR-ABL, который играет основную роль в развитии хронического миелолейкоза.
Количественная ПЦР в реальном времени, транскрипт химерного гена BCR-ABL.
BCR/ABL1, mRNA Detection, Reverse Transcription-PCR (RT-PCR), Quantitative, Monitoring Chronic Myeloid Leukemia (CML); Tyrosine kinase inhibitor (TKI) therapy monitoring, PCR.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Исследование проводится методом полимеразной цепной реакции. Принцип метода основан на обнаружении в исследуемом материале фрагментов ДНК химерного гена BCR-ABL, их избирательном синтезе с образованием большого числа копий. Копирование ДНК мутантного гена происходит после добавления в реакцию праймеров – последовательностей ДНК, аналогичных BCR-ABL. При этом праймеры должны быть идентичны той разновидности гена, содержание которой исследуется в образце, – для генов, кодирующих белки с разной молекулярной массой (р190, р210 и р230), нужны разные праймеры, так как их ДНК, хоть и совсем незначительно, но отличаются друг от друга. При проведении исследования в рамках первичной диагностики могут быть сделаны ПЦР на разные транскрипты гена, но в последующих измерениях целесообразно определять транскрипт, выявленный изначально, чтобы оценивать динамику его снижения. Одновременно с копированием мутантного гена производится копирование контрольного гена, исходное количество которого заведомо известно. Уровень мутантного гена рассчитывают относительно контрольного в процентах, в соответствии с международной шкалой экспрессии гена BCR-ABL (IS), или по уровню снижения в логарифмах (в 10 раз – 1 log, в 100 раз – 2 log) по сравнению с выявленным до начала лечения. При этом оценка по IS более предпочтительна.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Результат выражается в процентах – уровень экспрессии мутантного гена BCR-ABL относительно контрольного гена. Уровни достигнутого ответа дифференцируются следующим образом:
0,1% и менее – большой молекулярный ответ – снижение транскрипта в 1000 раз (или на 3 логарифма) от исходного;
0,001% и менее или не определяется – полный молекулярный ответ.
Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с обязательной микроскопией мазка крови)
Стандартное кариотипирование клеток костного мозга
Кто назначает исследование?
Гематолог, онколог, терапевт, врач общей практики.
Wintrobe’s clinical hematology / editors, John P. Greer, Daniel A. Arber, Bertil Glader, Alan F. List, Robert T. Means Jr., Frixos Paraskevas, George M. Rodgers. – 13th edition. Lippincott Williams & Wilkins, 2014. Pages 1711-1712.
NCCN Clinical Practice Guidelines in Oncology: Chronic Myeloid Leukemia. Version 4.2018 – January 24, 2018. Available at www.nccn.org.