Графическая формула это что
Электронная и электронно-графическая формула
Что такое электронная и электронно-графическая формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
Составление электронной и электронно-графической формулы
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным, что наиболее наглядно отражается при составлении электронно-графических формул.
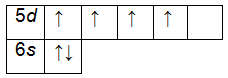
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента алюминия. |
| Ответ | Алюминий имеет порядковый номер 13 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 13 протонов, а вокруг ядра имеется три оболочки, по которым движутся 13 электронов. |
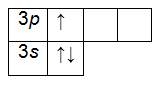
Электронная формула алюминия выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Электронно-графическая формула имеет следующий вид:
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента хлора. |
| Ответ | Хлор имеет порядковый номер 18 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 17 протонов, а вокруг ядра имеется три оболочки, по которым движутся 17 электронов. |
Электронная формула хлора выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Электронно-графическая формула имеет следующий вид:
Химические формулы веществ
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Таблица 1: Информация, которую дает химический знак
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака |
(произношение)
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Таблица 3: Информация, которую дает химический знак
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Исключение составляют:
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
1 моль (6,02·10 23 молекул) СаСО3 содержит 1 моль ионов Са 2+ и 1 моль ионов СО3 2- ;
1 моль (100г) карбоната кальция содержит 40г ионов Са 2+ и 60г ионов СО3 2-
Графические формулы
Для составления графической (структурной) формулы вещества необходимо:
Примеры графических формул:
Структурно-графические формулы веществ



Эмпирические формулы дают информацию о качественном и количественном составе соединений. Взаимное расположение атомов в молекуле вещества отражают структурно-графические формулы, однако они не показывают пространственное расположение атомов.
При составлении структурно-графических формул можно руководствоваться следующими правилами:
1. Элементы соединяются в соответствии с их валентностью.
2. Черточка в формуле обозначает единичную химическую связь, количество черточек соответствует валентности, например:
3. Состав кислот и оснований следует начинать изображать с центрального атома,
4. Если в молекуле кислоты содержится больше атомов кислорода, чем водорода, то «избыточные» атомы кислорода соединены с центральным атомом двойной связью,
| например: HClO4 | 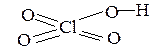 |
5. При написании графических формул солей исходят из графических формул кислот, заменяя атомы водорода на атомы металла, учитывая его валентность, например:
| Na3PO4 | 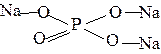 | Fe2(SO4)3 | 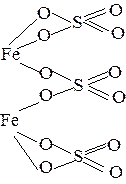 |
| KHCO3 | 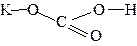 | ||
| CaOHNO3 | 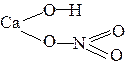 |
Структурно-графические формулы некоторых кислот приведены в табл. 5.
2.4. Общие химические свойства основных классов
неорганических веществ
Оксиды ‑ вещества, состоящие из атомов двух элементов, один из которых – кислород в степени окисления (–2). По химическим свойствам их подразделяют на индифферентные, или несолеобразующие (CO, NO), и солеобразующие, которые бывают основными, кислотными и амфотерными.
Химические свойства основных оксидов
1. Взаимодействуют с кислотами с образованием соли и воды, например:
2. Взаимодействие с кислотными оксидами с образованием солей:
3. Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых в воде оснований – щелочей:
Химические свойства кислотных оксидов
1. Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды:
2. Кислотные оксиды взаимодействуют с основными оксидами с образованием солей.
3. Большинство кислотных оксидов взаимодействует с водой с образованием кислот:
Очень немногие кислотные оксиды не взаимодействуют с водой. Наиболее известный из них оксид кремния (SiO2).
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с кислотами с образованием солей и воды.
В этих реакциях амфотерные оксиды играют роль основных.
2. Амфотерные оксиды взаимодействуют с щелочами с образованием солей и воды.
ZnO + 2КОН 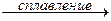
ZnO + 2КОН + H2O 
В этих реакциях амфотерные оксиды играют роль кислотных.
3. Амфотерные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей:
4. Амфотерные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей:
Оксиды могут быть получены различными способами:
1. Взаимодействием простых веществ с кислородом:
2. Разложением некоторых оксокислот:
H2SO3 
3. Разложением нерастворимых оснований:
Сu(OH)2 
4. Разложением некоторых солей:
СаСО3 
Основания ‑сложные вещества, при диссоциации которых в воде образуются гидроксид-ионы и никаких других анионов.
По растворимости в воде основания делятся на две группы: нерастворимые [Fe(OH)3, Си(ОН)2 и др.] и растворимые в воде [КОН, NaOH, Са(ОН)2, Ва(ОН)2 ], или щелочи.
Химические свойства оснований
1. Водные растворы щелочей изменяют окраску индикаторов.
Таблица 6 ‑ Изменение цвета индикаторов в растворах