Гонадотропные гормоны это что
Гонадотропные гормоны это что
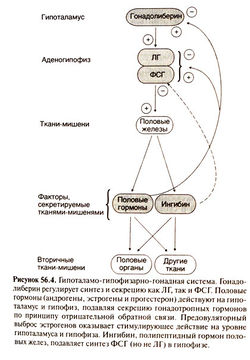
Гипоталамус и гипофиз объединены в систему, управляющую многими эндокринными органами, в том числе половыми железами (гонадами). В этой и несколких последующих статьях будет описана гипоталамо-гипофизарно-яичниковая система и механизмы регуляции менструального цикла, на которые оказывают влияние также центральная нервная система (ЦНС), другие эндокринные системы и окружающая среда. Важнейшие гормоны гипоталамо-гипофизарно-яичниковой системы — гонадотропный рилизинг-гормон (ГнРГ), фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), эстрадиол и прогестерон. Остальные гормоны (ингибин, активин, фоллистатин и эндорфины) играют вспомогательную роль.
Гипоталамус заполняет собой нижнюю часть боковой стенки и дна III желудочка головного мозга, масса его составляет около 10 г. Обычно выделяют восемь основных специфических ядер (постоянных скоплений групп нейронов) и три области гипоталамуса (менее четко отграниченных скоплений нейронов). С точки зрения репродуктивной функции наиболее важны из них дугообразное ядро и преоптическая область — именно здесь расположены нейроны, синтезирующие люлиберин. Дугообразное ядро находится в медиобазальных отделах гипоталамуса, оно расположено ближе остальных ядер к зрительному перекресту и воронке. Оно также содержит дофаминергические нейроны, угнетающие секрецию пролактина гипофизом, и нейроны, синтезирующие соматолиберин (рилизинг-фактор соматотропина).
Вещества, синтезируемые нейросекреторными клетками гипоталамуса, в том числе гонадотропный рилизинг-гормон (ГнРГ), поступают в портальную систему из срединного возвышения, выступа воронки гипофиза, расположенного на дне III желудочка. Портальная система выступает основным связующим звеном между гипоталамусом и аденогипофизом (передней частью гипофиза). В свою очередь, воронка непосредственно соединяет тела гипоталамических нейронов с нейрогипофизом (задней частью гипофиза). Она расположена сразу же позади зрительного перекреста.
Гонадотропный рилизинг гормон (ГнРГ)
Гонадотропный рилизинг гормон (ГнРГ) — гипоталамический регулятор репродуктивной функции первого порядка. Описано два типа гонадотропного рилизинг гормона (ГнРГ) человека (ГнРГ-1 и ГнРГ-2). Оба они представляют собой пептиды, состоящие из 10 аминокислот, их синтез кодирован разными генами. По меньшей мере 20 других типов ГнРГ обнаружено у рыб, амфибий и других хордовых животных; ни один из них не найден у человека.
Гонадотропный рилизинг гормон-1 был впервые описан и синтезирован в 1971 г. Эндрю Шалли и Роже Гийменом, получившими впоследствии за это Нобелевскую премию. Строение гонадотропного рилизинг гормона-1 общее у всех млекопитающих, а его действие одинаково как у самцов, так и у самок. Гонадотропный рилизинг гормон-1 синтезируется из более сложного белка-предшественника, в своем составе имеющего 92 аминокислоты и содержащего гонадотропный рилизинг гормон-ассоциированный пептид. Затем гонадотропный рилизинг гормон-1 транспортируется по аксональному пути, именуемому тубероинфундибулярным трактом, к срединному возвышению гипоталамуса, откуда дозированно поступает в циркуляцию портальной системы гипофиза. Период полужизни гонадотропного рилизинг гормона-1 очень короткий (2-4 мин), так как он быстро расщепляется в участках между аминокислотами 5 и 6, 6 и 7, 9 и 10. Из-за столь короткого периода полужизни и быстрого разведения в периферическом кровотоке определить концентрацию гонадотропного рилизинг гормона-1 в крови достаточно трудно, к тому же она не коррелирует с активностью гипофиза.
Основные эффекты гонадотропного рилизинг гормона-1 по отношению к гонадотропинам аденогипофиза таковы:
• синтез и накопление гонадотропинов;
• перемещение гонадотропинов из резервного пула к участку, где может произойти их быстрое высвобождение;
• непосредственная секреция гонадотропинов.
Выбросы гонадотропного рилизинг гормона-1 происходят в соответствии с внутренней ритмической активностью соответствующих нейронов дугообразного ядра. Импульсный выброс ГнРГ-1 из срединного возвышения в пределах пограничных значений частоты и амплитуды обеспечивает нормальную секрецию гонадотропинов. Непрерывное, а не импульсное воздействие ГнРГ-1 приводит к угнетению секреции ФСГ и ЛГ и супрессии транскрипции генов, ответственных за синтез гонадотропинов.
В отсутствие обратной связи с половыми железами частота пика ГнРГ составляет 1 раз в час. Во время менструального цикла частота и амплитуда пика ГнРГ варьирует в зависимости от обратной связи с гипоталамусом. В целом фолликулярная фаза характеризуется частыми низкоамплитудными пиками, а лютеиновая — редкими высокоамплитудными пиками. Однако как у разных индивидуумов, так и у одного и того же индивидуума в разное время существуют большие различия в частоте и амплитуде пиков. У человека оценить частоту и амплитуду пиков ГнРГ можно, измерив частоту и амплитуду колебаний содержания ЛГ в крови.
Синтез гонадотропного рилизинг гормона-2 происходит в основном за пределами головного мозга, в тканях почек, костного мозга и предстательной железы. Этим он отличается от ГнРГ-1, который за пределами головного мозга образуется в незначительном количестве. Хотя ГнРГ-2 и способен индуцировать высвобождение ФСГ и ЛГ, по-видимому, у него есть множество других функций в организме, например регуляция клеточной пролиферации и способствование секреции яичниковых и плацентарных гормонов. Попытки в середине 90-х годов прошлого века идентифицировать эстрогеновые рецепторы (ЭР) на нейронах, синтезирующих ГнРГ, сначала были безуспешными. Однако в последующем, с появлением более совершенных технологий, такие рецепторы все же были обнаружены в дугообразном ядре.
Оба идентифицированных типа рецепторов опосредуют действие эстрогена in vivo на нейроны, синтезирующие ГнРГ. Ген ГнРГ содержит гормон-реактивный участок для комплекса «эстроген-эстрогеновый рецептор». Транскрипция ГнРГ-1 и ГнРГ-2 по-разному регулируется эстрогеном. Регуляторные эффекты эстрадиола на ГнРГ представляются достаточно сложными. Эстроген ингибирует экспрессию/синтез гена ГнРГ, но секреция гормона при этом может как возрасти, так и уменьшиться или не измениться.
Активность гипоталамуса регулируется также нервными импульсами из высших мозговых центров. Нейроны, синтезирующие ГнРГ, имеют обширные связи как друг с другом, так и с прочими нейронами. Эффекты этих нейротранс-миттеров позволяют понять механизмы влияния на менструальный цикл некоторых физиологических или патологических состояний.
Клетки, синтезирующие гонадотропный рилизинг гормон, эмбриологически происходят из обонятельной области. Нейроны, вырабатывающие ГнРГ, так же как и обонятельные клетки эпителия носовой полости, снабжены ресничками. В процессе эмбриогенеза нейроны, синтезирующие ГнРГ, мигрируют из медиальной обонятельной плакоды в дугообразное ядро гипоталамуса. Общее происхождение нейронов, выделяющих ГнРГ, и обонятельных клеток можно проиллюстрировать на примере синдрома Кальманна, при котором дефицит ГнРГ сочетается с аносмией. Считают, что синдром Кальманна вызван множественными дефектами генов, ответственных за миграцию нервных клеток.
Общее происхождение нейронов, синтезирующих гонадотропный рилизинг гормона, и обонятельных клеток предполагает связь между феромонами и цикличностью менструаций. Феромоны — переносимые по воздуху химические вещества с малой молекулярной массой, которые организм индивидуума синтезирует и выделяет во внешнюю среду. Их могут воспринимать другие индивидуумы того же вида, что влияет на сексуальное и социальное поведение воспринимающих. Хорошо известно, что у женщин, работающих или живущих вместе, зачастую постепенно синхронизируются менструальные циклы. Более того, показано, что не обладающие запахом компоненты отделяемого подмышечных желез менструирующих женщин могут изменять характеристики менструального цикла у женщин, подвергающихся воздействию этих компонентов. Предположительные механизмы этих изменений опосредованы взаимодействием обонятельных нейронов и нейронов, синтезирующих гонадотропного рилизинг гормона.
Гонадотропные гормоны это что
Соматотропин — гормон роста (growth hormon) (СТГ) гипофиза приготовляют для экспериментальных наблюдений во флаконах — один флакон содержит 4 ME лиофилизиропанного гормона. Растворяется в водном растворе новокаина. Обладает видовой специфичностью.
Как показали эксперименты, содействует процессам роста, оказывая интенсивное анаболическое действие. Повышает уровень сахара в крови. Содействует задержке солей натрия, калия и фосфора в организме. При длительном введении у экспериментального взрослого животного (бульдога) можно наблюдать акромегалоидизацию, увеличение объема конечностей и нижней челюсти.
Для лечения больных с задержкой роста применяют анаболические стероидные препараты, что ведет в детском и подростковом возрасте к ускорению процессов роста.
Жирорегулирующий фактор гипофиза адипозин (Adiposinum). Липомобилизующий фактор гипофиза получен из гипофизов убойного скота. Терапия ожирения адипозином дает потерю в весе. Повышаются процессы сгорания. В крови увеличивается количество липопротеидов и неэстерифицированных жирных кислот. Приготовляется в ампулах 1 мл—50 мг для внутримышечных инъекций. Па курс лечения 20—30 инъекций.
Гонадотропные гормоны (ГТГ)
Гонадотропные гормоны гипофиза подразделяются на фолликулостимулирующий гормон (ФСГ), лютеинизирующий (ЛГ) и ЛТГ — пролактин.
Под воздействием гонадотропных гормонов гипофиза наступает половое формирование и половое развитие. Формируются и начинают функционировать половые железы, секретируя половые гормоны. Развиваются вторичные половые признаки и половые органы. Гонадотропиые гормоны наряду с половыми гормонами обеспечивают половую функцию организма (потенцию и сперматогенез), в женском организме регулярные менструации, возникновение и нормальное течение беременности, роды и лактацию.
Препараты, содержащие гонадотропины, приготовляют из мочи и крови беременных женщин, лошадей и экстрагируют из плаценты.
Хорионический гонадотропин (Gonadotropinum chorionicum). Содержит как фолликулостимулирующий, так и лютеинизирующий фактор. Преобладает действие ЛГ, который содействует овуляции и формированию желтого тела в яичнике и определяет нормальное течение беременности.
В мужском организме хорионический гонадотропин участвует в формировании клеток Лейдига в мужских половых железах, в созревании сперматозоидов и усиливает секрецию тестостерона.
При гипогенитализме, обусловленном недостаточной продукцией гонадотропных гормонов гипофиза, применение хорионического гонадотропина весьма эффективно.
Применение гонадотропина показано при гипоталамо-типофизарных синдромах, протекающих с пониженной секрецией гонадотропинов. Длительная аменорея при болезни Симмондса и Шихена под воздействием лечения гонадотропинами, эстрогенами и прогестинами сменяется нормальным менструальным циклом. Эта комбинированная терапия может быть в какой-то мере эффективной при гипогенитализме у больных, страдающих адипозо-генитальной дистрофией, и при гипофизарном карликовом росте, стимулируя формирование гонад и половых органов.
Рецепт:
Rp. Gonadotropini chorionici 1,0 (1500 единиц)
D. t. d. N. 12 in ampul. S. По 1 мл З раза в неделю внутримышечно
Ампулы выпускаются с содержанием хорионического гонадотропина по 500, 1000 и 1500 единиц.
Большие дозы назначают при гипогенитализме, синдроме Клайпфельтера. Маленькие дозы назначают при гипогенитализме и крипторхизме у детей и подростков (500—1000 единиц). Хорионический гоиадотропин назначают женщинам при ановуляторном цикле, что стимулирует развитие фолликулов в яичниках. В течение 5—6 дней, начиная с 12-го дня цикла, применяют по 1000 единиц ежедневно.
Осложнения при лечении хорионическим гонадотропином редки, однако возможны аллергические реакции.
Противопоказанием к применению хорионического гопадотропина является воспалительный процесс в области половых желез и половых органов, наличие кист, опухолей. При отсутствии половых желез после хирургического вмешательства применение гопадотропина нецелесообразно.
Гонадотропные гормоны
Содержание
Гонадотропные гормоны [ править | править код ]
К гонадотропным гормонам гипофиза относят фолликул-стимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ). Хорионический гонадотропин (ХГ) тоже влияет на половые железы, но синтезируется плацентой. Эти три гормона вместе с тиреотропным гормоном (ТТГ) сходны по строению и образуют семейство гликопротеидных гормонов. Все они состоят из двух субъединиц: а-субъединица у всех одинаковая, а β-субъединицы различаются и обеспечивают специфическую активность. При этом β-субъединицы всех гормонов достаточно схожи, за исключением β-субъединицы ХГ, которая содержит дополнительный участок из 30 аминокислотных остатков на С-конце и несколько дополнительных углеводных остатков. Углеводные остатки увеличивают период полувыведения (Т1/2) этих гормонов в сыворотке, а также участвуют в их связывании с рецепторами. У человека ген, кодирующий β-субъединицу ФСГ, локализуется в сегменте 11р13, а β-субъединицу ЛГ — в сегменте 19ql2.32, по соседству по меньшей мере с 7 генами, кодирующими β-субъединицу ХГ. Ген, кодирующий а-субъединицу этих гормонов, локализуется в сегменте 6q21—q23.
Секреция гонадотропных гормонов [ править | править код ]
Регуляция секреции гонадолиберина [ править | править код ]
Механизм действия гонадолиберина [ править | править код ]
Рецептор гонадолиберина относится к рецепторам, сопряженным с G-белками; его ген находится в сегменте 4q21. При связывании гонадолиберина или его аналогов с рецептором происходит активация белков Gq и GM, которые, в свою очередь, активируют фосфолипазу С, что приводит к увеличению внутриклеточной концентрации кальция. Это в итоге стимулирует синтез и секрецию ЛГ и ФСГ. Хотя цАМФ не принимает заметного участия в передаче сигнала от рецептора гонадолиберина, активация этого рецептора увеличивает активность аденилатциклазы. Рецепторы гонадолиберина присутствуют также в яичниках и яичках, однако их физиологическое значение остается неизвестным.
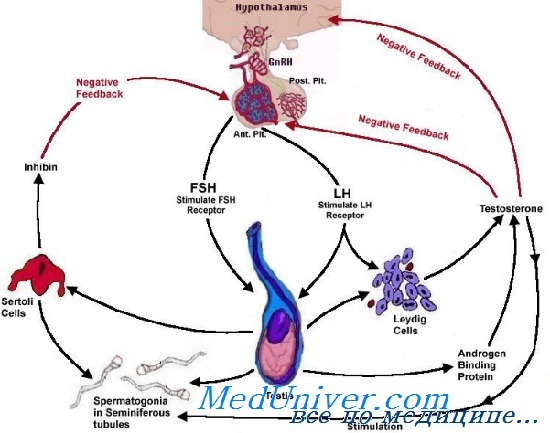
Половые гормоны также регулируют синтез ЛГ и ФСГ, воздействуя на гипоталамус и в меньшей степени — на гипофиз. Эта регуляция по-разному осуществляется у мужчин и женщин и зависит от возраста и фазы менструального цикла. У женщин низкие концентрации эстра-диола и прогестерона подавляют синтез гонадотропных гормонов за счет опосредованного опиоидами действия на нейроны, отвечающие за импульсную секрецию гонадолиберина. Однако длительное повышение концентрации эстрадиола действует по принципу положительной обратной связи, приводя к предовуляторному выбросу ЛГ. У мужчин синтез гонадотропных гормонов подавляется тестостероном, причем частично это обусловлено его прямым действием, а частично — превращением в эстрад иол.
Ингибин — пептидный гормон, образующийся в половых железах и играющий важную роль в регуляции секреции гонадотропных гормонов. Он синтезируется клетками гранулярного слоя фолликулов в яичниках и клетками Сертоли в яичках в ответ на стимуляцию гонадотропными гормонами и местными факторами роста. Ингибин действует непосредственно на гипофиз, избирательно подавляя секрецию ФСГ, но не Л Г. Ингибин относится к тому же семейству гликопротеидов, что и трансформирующий фактор роста |3 и фактор регрессии мюллеро-вых протоков.
Механизм действия гонадотропных гормонов [ править | править код ]
ЛГ и ХГ связываются с рецептором Л Г (ген этого рецептора находится в сегменте 2р21), а ФСГ — со своим рецептором (ген этого рецептора находится на длинном плече 2-й хромосомы). Оба рецептора сопряжены с G-белками и обладают большим внеклеточным гликозилированным доменом, ответственным за распознавание гормона. При связывании рецептора с лигандом G,-белок активирует аденилатциклазу, что ведет к повышению концентрации цАМФ. При высокой концентрации лиганда рецепторы через Gq-белок активируют также протеинкиназу С и увеличивают концентрацию кальция за счет активации фос-фолипазы С. Все или почти все эффекты гонадотропных гормонов можно воспроизвести введением в клетку аналогов цАМФ, поэтому значение протеинкиназы С и Са2+ во внутриклеточной передаче сигнала остается неясным.
Физиологические эффекты гонадотропных гормонов [ править | править код ]
ЛГ и ФСГ были названы в соответствии с их действием на яичники; функция этих гормонов у мужчин была изучена позднее. У мужчин ЛГ действует на клетки Лейдига, стимулируя синтез андрогенов, в основном тестостерона. Тестостерон обеспечивает половое влечение, развитие вторичных половых признаков и сперматогенез в извитых семенных канальцах. ФСГ действует на клетки Сертоли, стимулируя образование ими белков и питательных веществ, необходимых для созревания сперматозоидов.
У женщин действие ФСГ и ЛГ более сложно. ФСГ стимулирует рост и развитие фолликулов, а также индуцирует экспрессию гена рецептора ЛГ на текоцитах и клетках гранулярного слоя в яичниках. Кроме того, ФСГ активирует ароматазу в клетках гранулярного слоя, стимулируя синтез эстрадиола. ЛГ действует на текоциты, стимулируя образование в них андростендиона, основного предшественника эстрадиола в яичниках у женщин детородного возраста. ЛГ необходим также для разрыва фолликула при овуляции и для синтеза прогестерона желтым телом. Наконец, связывание ЛГ со своим рецептором на клетках гранулярного слоя увеличивает экспрессию гена рецептора ФСГ, что усиливает действие последнего.
Значение гонадотропных гормонов в регуляции функций половых органов отчетливо выявляется при мутациях генов самих гормонов или их рецепторов (Achermann and Jameson, 1999). У женщин с мутациями генов рецептора ФСГ или β-субъединицы самого ФСГ наблюдаются первичная аменорея и бесплодие, у них не созревают фолликулы, отсутствуют желтые тела и не развиваются молочные железы. Эти данные, а также эффективность ФСГ при некоторых формах бесплодия (см. ниже) красноречиво свидетельствуют о важной роли ФСГ в функционировании яичников. У мужчин при таких же мутациях уменьшен размер яичек и наблюдается олигозооспермия, хотя в некоторых случаях сохраняется фертильность.
Описан только один случай мутации с потерей функции гена β-субъединицы Л Г: у 46-летнего мужчины отсутствовало половое развитие, наблюдались гипоплазия клеток Лейдига и бесплодие. Наружные половые органы у него были развиты по мужскому типу, что, видимо, объясняется синтезом андрогенов под действием ХГ во время внутриутробного развития. Проявления мутаций с потерей функции гена рецептора ЛГ при мужском кариотипе варьируют от мужского гипогонадизма до развития наружных половых органов по женскому типу и отсутствия полового развития. Вероятно, вирилизации наружных половых органов не происходит из-за нарушения действия как ЛГ, так и ХГ во время внутриутробного развития. У женщин, гомозиготных по мутантным аллелям гена рецептора Л Г, отмечаются первичная аменорея или олигоменорея и бесплодие, а при гистологическом исследовании выявляются множественные кисты яичников.
Мутации, ведущие к постоянной активации рецептора ЛГ, возникают преимущественно у мужчин и наследуются аутосом-но-доминантно. Они ведут к преждевременному половому развитию из-за неуправляемого синтеза тестостерона во внутриутробном и в препубертатном периодах. При некоторых из этих мутаций высок риск опухолей яичка.
Применение гонадолиберина и его аналогов [ править | править код ]
В табл. 56.3 перечислены синтетические аналоги гонадолиберина, применяемые в клинике. Синтетический гонадолиберин называется гонадорелином. Замена аминокислотного остатка в положении 6 защищает аналоги гонадолиберина от протеолиза, а замена С-концевого остатка повышает сродство к рецептору. Такие аналоги обладают большей активностью и более длительным действием по сравнению с нативным гонадолиберином, Т1/2 которого составляет всего 2—4 мин.
Антагонисты гонадолиберина, в отличие от его аналогов длительного действия, не вызывают кратковременного повышения уровней гонадотропных гормонов в сыворотке. Современные антагонисты гонадолиберина, по-видимому, не приводят к местному и системному выбросу гистамина и анафилакгоидным реакциям, что ограничивало применение первых препаратов этой группы. Два антагониста гонадолиберина гаиреликс и цетрореликс применяют при искусственном оплодотворении для подавления выброса ЛГ во время стимуляции яичников. Ганиреликс доступен в США, а цетрореликс—только в Европе. Теоретически быстрое подавление выброса ЛГ дает возможность лучше контролировать стимуляцию яичников (см. ниже) и тем самым сокращает цикл искусственного оплодотворения. Однако практическую ценность этих препаратов при искусственном оплодотворении еще предстоит уточнить в клинических испытаниях.
Диагностическое применение [ править | править код ]
Один из препаратов гонадорелина (гонадорелина гидрохлорид) применяют для дифференциальной диагностики гипофизарного и гипоталамического поражения при вторичном гипогонадизме. Уровень ЛГ в сыворотке измеряют до введения гонадорелина в дозе 100 мкг п/к или в/в и в течение 2 ч (через 15,30,45,60 и 120 мин) после введения. Увеличение секреции ЛГ свидетельствует о наличии функционирующих гонадотропных клеток аденогипофиза. При длительном дефиците гонадолиберина чувствительность гонадотропных клеток к нему может снижаться, поэтому низкий уровень ЛГ при проведении пробы с гонадолиберином не обязательно говорит о поражении гипофиза. Пробу с гонадолиберином можно также использовать для дифференциальной диагностики истинного (связанного с секрецией гонадолиберина) и ложного преждевременного полового развития.
Лечение бесплодия [ править | править код ]
Другой препарат гонадорелина (гонадорелина ацетат) используют при нарушениях репродуктивной функции, связанных с дефицитом гонадолиберина. Препарат вводят в/в с помощью специального инфузионного насоса в импульсном режиме, имитирующем физиологическую секрецию, 2,5 мкг каждые 60—90 мин. Если овуляция не наступает, доза, вводимая за один импульс, может быть постепенно увеличена до 10 мкг. Принципы введения и дозы указаны в инструкции изготовителя. Гонадорелин реже, чем гонадотропные гормоны, вызывает многоплодную беременность. При лечении гона-дорелином не требуется столь тщательно контролировать уровень эстрогенов в сыворотке и проводить УЗИ яичников. Побочные реакции возникают редко, чаще всего развивается флебит в месте введения. При лечении гонадорелином у женщин восстанавливается физиологическая секреция половых гормонов, устанавливается менструальный цикл и происходит овуляция. Однако из-за технической сложности этот метод лечения применяют только в специализированных клиниках (Hayes et al., 1998).
При бесплодии у мужчин с помощью гонадорелина можно добиться роста яичек, нормальной секреции половых гормонов и сперматогенеза. Однако метод относительно дорог и требует постоянного ношения инфузионного насоса. К тому же гонадорелин не одобрен ФДА для лечения мужского бесплодия. Поэтому обычно предпочтение отдают гонадотропным гормонам.
Аналоги гонадолиберина длительного действия применяют также при индукций овуляции. Эти препараты подавляют предовуляторный выброс ЛГ и предотвращают лютеинизацию неовулирующего фолликула. Разработано несколько схем лечения, при которых длительно или краткосрочно вводят аналоги гонадолиберина совместно с гонадотропными гормонами, обеспечивающими созревание фолликула (см. ниже), а затем для индукции овуляции назначают ХГ (Lunenfeld, 1999).
Подавление секреции гонадотропных гормонов [ править | править код ]
Как уже говорилось, аналоги гонадолиберина длительного действия ведут к десенситизации рецепторов гонадолиберина, в результате чего секреция гонадотропных, а соответственно и половых, гормонов резко снижается. Такая «медикаментозная кастрация» оказалась очень удобной в тех случаях, когда нужно сократить выработку половых гормонов. Очевидное показание к подобному лечению — истинное преждевременное половое развитие у детей, при котором длительное введение аналогов гонадолиберина очень эффективно и почти не сопровождается побочными реакциями.
Аналоги гонадолиберина длительного действия в целом хорошо переносятся и вызывают вполне предсказуемые побочные эффекты, обусловленные нарушением синтеза половых гормонов: приливы, сухость влагалища, атрофический вагинит, снижение плотности костной ткани. В связи с этим при таких заболеваниях, как эндометриоз и миома матки, лечение обычно продолжают не более 6 мес или дополнительно назначают эстрогены для поддержания плотности костной ткани.
Диагностическое применение гонадотропных гормонов [ править | править код ]
Тест на беременность [ править | править код ]
В крови и моче беременных в больших количествах присутствует ХГ, поэтому в качестве теста на беременность можно использовать иммунохимическое выявление β-субъединицы ХГ. Качественное определение β-субъединицы ХГ в моче лежит в основе тестов на беременность для домашнего применения, продаваемых в США без рецепта. Эти тесты позволяют быстро выявить беременность уже через несколько дней после задержки менструации.
Количественное определение концентрации ХГ в плазме в клинических и научных целях проводят с помощью РИА. Обычно это делают для оценки прогрессирования беременности, а также при подозрении на внематочную беременность, пузырный занос или хориокарциному.
Определение времени овуляции [ править | править код ]
Диагностика расстройств репродуктивной функции [ править | править код ]
Количественное измерение уровня ФСГ и ЛГ в плазме методом РИА (по уровню β-субъединиц) используют для диагностики некоторых нарушений репродуктивной функции. Низкие или неопределяемые уровни ФСГ и ЛГ свидетельствуют о вторичном гипогонадизме и о поражении гипофиза или гипоталамуса. При первичном гипогонадизме уровни этих гормонов, наоборот, высокие. При аменорее у женщин или задержке полового развития у мужчин и женщин определение уровня ФСГ и ЛГ позволяет отличить поражение половых желез от поражения гипоталамо-гипофизарной системы.
По уровню ФСГ на 3-й день менструального цикла можно судить о фертильности. Даже при нормальном менструальном цикле уровень ФСГ 15 МЕ/мл и более говорит о низкой фертильности, и успех искусственного оплодотворения при этом маловероятен (см. ниже).
Проба с ХГ используется у мужчин для оценки функции клеток Лейдига по степени стимуляции синтеза тестостерона. Эту пробу попользуют при подозрении на нарушение функции клеток Лейдига (например, при задержке полового развития). Уровень тестостерона в сыворотке определяют после нескольких инъекций ХГ. Сниженная секреция тестостерона говорит о патологии клеток Лейдига, а нормальная — о поражении гипоталамо-гипофизарной системы.
Лечебное применение гонадотропных гормонов [ править | править код ]
Изначально гонадотропные гормоны для клинического применения получали из человеческих гипофизов (трупный материал) и из мочи женщин. Препараты гипофиза сейчас не используют из-за риска передачи возбудителя болезни Крейтцфельдта—Якоба. Из мочи получают несколько препаратов. ХГ, который по действию аналогичен Л Г, получают из мочи беременных. Из мочи женщин в постменопаузе получают препарат менотропин, который содержит примерно одинаковые количества ЛГ и ФСГ, а также другие белки мочи. Поскольку менотропин относительно плохо очищен, во избежание аллергических реакций его вводят в/м. Другой препарат — урофоллитропин — представляет собой очищенный ФСГ, получаемый путем удаления ЛГ иммунологическими методами. Урофоллитропин сверхвысокой очистки получают при помощи моноклональных антител к ФСГ. Он очищен настолько, что его можно вводить п/к.
Методами генной инженерии получена линия клеток млекопитающих, синтезирующая а- и р-субъединицы ФСГ. Получающийся при этом рекомбинантный ФСГ близок по характеру гликозилирования к нативному ФСГ. Сегодня выпускается два препарата рекомбинантного ФСГ — фоллитропин а и фоллитропин Р; их углеводные структуры слегка различаются. Оба эти препарата вводят п/к, поскольку они намного чище препаратов, получаемых из мочи, и значительно лучше стандартизованы. Рекомбинантные препараты стоят намного дороже нативных, однако данных за то, что они эффективнее или реже вызывают такие побочные реакции, как синдром гиперстимуляции яичников, пока нет. Вероятно, в будущем методами генной инженерии удастся получить аналоги гонадотропных гормонов более длительного действия и с более высокой активностью.
Женское бесплодие [ править | править код ]
Бесплодием страдают около 10% супружеских пар детородного возраста. Для лечения бесплодия все шире применяют гонадотропные гормоны (Vollenhoven and Healy, 1998); часто их используют при искусственном оплодотворении. Хотя основным показанием к их назначению служит хроническая ановуляция в результате вторичного гипогонадизма (группа 1 по классификации ВОЗ), гонадотропные гормоны используют и для индукции овуляции при синдроме поликистозных яичников (группа II по классификации ВОЗ) в том случае, когда кломифен неэффективен (гл. 58). Кроме того, гонадотропные гормоны применяют при бесплодии на фоне нормальной овуляции, хотя в этих случаях сначала пробуют лечение кломифеном. Назначать гонадотропные гормоны должны врачи с достаточным опытом лечения бесплодия и эндокринных расстройств.
При хронической ановуляции назначение одного ФСГ в большинстве случаев вызывает овуляцию. Обычно ФСГ назначают в дозе 75 МЕ/сут в течение первых 6—7 дней цикла, после чего при помощи влагалищного УЗИ оценивают число и размер созревающих фолликулов. УЗИ обычно проводят каждые 2—3 сут. Созревание фолликула считается адекватным, если обнаружен фолликул диаметром 18 мм. Если обнаружено три и более фолликула диаметром более 16 мм, ФСГ отменяют из-за опасности синдрома гиперстимуляции яичников (см. ниже) и применяют барьерные методы контрацепции для предотвращения многоплодной беременности. Определяют также концентрацию эстрадиола, которая должна находиться в диапазоне 500—1500 пг/мл. Более низкие значения указывают на недостаточную стимуляцию яичников, а более высокие — на опасность синдрома гиперстимуляции яичников. При недостаточной стимуляции яичников доза ФСГ может быть увеличена до 150 МЕ/сут.
Для завершения созревания фолликула и индукции овуляции на следующий день после отмены ФСГ назначают ХГ в дозе 5000—10 000 ME. При лечении гонадотропными гормонами в 10—20% случаев развивается многоплодная беременность, что связано с развитием нескольких третичных фолликулов и выходом нескольких яйцеклеток.
Гонадотропные гормоны используют при искусственном оплодотворении, в том числе при экстракорпоральном оплодотворении и микроинъекции сперматозоидов в цитоплазму яйцеклетки. С помощью ФСГ стимулируют развитие фолликулов, а для окончательного их созревания назначают ХГ, после чего зрелые яйцеклетки извлекают из третичных фолликулов хирургическим путем. Затем производят экстракорпоральное оплодотворение полученных яйцеклеток с помощью спермы или микроинъекции сперматозоидов в цитоплазму яйцеклетки. Эмбрионы переносят в полость матки или в маточную трубу. При искусственном оплодотворении риск многоплодной беременности зависит от числа перенесенных эмбрионов.
Помимо многоплодной беременности и ее возможных осложнений основным побочным эффектом гонадотропных гормонов является синдром гиперстимуляции яичников. Для этого синдрома характерно быстрое накопление жидкости в полости брюшины, плевральной полости и даже перикарде. Считается, что причина этого синдрома — выделение яичниками вещества, повышающего сосудистую проницаемость. Синдром гиперстимуляции яичников проявляется вздутием живота, болью в животе, тошнотой, рвотой, поносом, выраженным увеличением яичников, одышкой и олигурией. Синдром гиперстимуляции яичников может осложниться гиповолемией, водно-электролитными нарушениями, гемоперитонеумом, РДСВ, тромбоэмболиями и нарушением функции печени. При подозрении на развитие этого синдрома ХГ не назначают.
В некоторых исследованиях выдвигалось предположение, что гонадотропные гормоны увеличивают риск рака яичников, однако это осталось недоказанным. Важно отметить, что при стимуляции яичников ФСГ и менотропином не возрастает риск пороков развития у детей, рожденных из стимулированных яйцеклеток.
Мужское бесплодие [ править | править код ]
Лечение гонадотропными гормонами может быть эффективно, если причина бесплодия — их дефицит. Поскольку гонадотропные гормоны относительно дороги, а при длительном приеме может развиться резистентность к ним, обычно половое развитие стимулируют андрогенами, а гонадотропные гормоны применяют позже, для достижения собственно фертильности.
Лечение, как правило, начинают с введения ХГ в дозе 1000— 5000 ME в/м 3 раза в неделю до нормализации синтеза половых гормонов, о чем судят по клиническим признакам и уровню тестостерона в плазме. После этого дозу ХГ снижают до 2000 ME 2 раза в неделю и дополнительно вводят менотропин в дозе по 75—150 ME ЛГ и ФСГ 3 раза в неделю. Наиболее частое побочное действие гонадотропных гормонов — гинекомастия; она возникает почти у каждого третьего больного и, вероятно, связана с повышенной продукцией эстрогенов: Для созревания яичек требуется примерно 6 мес, а для установления полноценного сперматогенеза лечение приходится продолжать до 2 лет. После начала сперматогенеза или его возобновления (при вторичном гипогонадизме, возникшем после полового созревания) для продукции спермы достаточно поддерживающей терапии I ХГ. Как уже говорилось, все большую роль в лечении бесплодия, вероятно, будут играть рекомбинантные гонадотропные гормоны.
Крипторхизм [ править | править код ]
Читайте также [ править | править код ]
Предупреждение [ править код ]