Гонадотропин рилизинг гормон что это такое
Гонадотропин-рилизинг-гормон
» data-image-caption=»» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Гонадотропин-рилизинг-гормон.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Гонадотропин-рилизинг-гормон.jpg?fit=825%2C550&ssl=1″ />
Гонадотропин-рилизинг-гормон выделяется нервными клетками головного мозга. Он контролирует выработку лютеинизирующего гормона и фолликулостимулирующего гормона гипофизом.
Альтернативные названия гонадотропин-рилизинг-гормона:
Что такое гонадотропин-рилизинг-гормон?
Гонадотропин-рилизинг-гормон вырабатывается и секретируется специализированными нервными клетками в гипоталамусе головного мозга. Он попадает в крошечные кровеносные сосуды, переносящие этот гормон из мозга в гипофиз, где он стимулирует выработку еще двух гормонов — фолликулостимулирующего гормона и лютеинизирующего гормона.
Эти гормоны попадают в общую циркуляцию крови и воздействуют на яички и яичники, инициируя и поддерживая их репродуктивные функции. Фолликулостимулирующий гормон и лютеинизирующий гормон контролируют уровень гормонов, вырабатываемых семенниками и яичниками (таких как тестостерон, эстрадиол ипрогестерон), и они важны для контроля выработки спермы у мужчин, а также созревания и высвобождения яйцеклетки во время каждого менструального цикла у женщин.
Как контролируется гонадотропин-рилизинг-гормон?
В детстве уровень гонадотропин-рилизинг-гормона чрезвычайно низок, но по мере приближения полового созревания наблюдается повышение уровня гонадотропин-рилизинг-гормона, что вызывает начало полового созревания.
Когда яичники и семенники полностью функциональны, выработка гонадотропин-рилизинг-гормона, лютеинизирующего гормона и фолликулостимулирующего гормона контролируется уровнями тестостерона (у мужчин), эстрогенов (например, эстрадиола) и прогестерона (у женщин). Если уровень этих гормонов повышается, производство гонадотропин-рилизинг-гормона снижается, и наоборот.
Есть одно исключение из этого правила: у женщин в середине менструального цикла эстрадиол (вырабатываемый фолликулом в яичнике, содержащий доминирующую яйцеклетку) достигает критической точки. Это стимулирует большое увеличение секреции гонадотропин-рилизинг-гормона и, как следствие, выброс лютеинизирующего гормона, стимулирующего высвобождение зрелой яйцеклетки. Этот процесс называется овуляцией.
Что произойдет, если у меня будет слишком много гонадотропин-рилизинг-гормона?
Что произойдет, если у меня будет слишком много гонадотропин-рилизинг-гормона?
» data-medium-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-гонадотропин-рилизинг-гормона.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-гонадотропин-рилизинг-гормона.jpg?fit=825%2C550&ssl=1″ loading=»lazy» src=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/%D0%A7%D1%82%D0%BE-%D0%BF%D1%80%D0%BE%D0%B8%D0%B7%D0%BE%D0%B9%D0%B4%D0%B5%D1%82-%D0%B5%D1%81%D0%BB%D0%B8-%D1%83-%D0%BC%D0%B5%D0%BD%D1%8F-%D0%B1%D1%83%D0%B4%D0%B5%D1%82-%D1%81%D0%BB%D0%B8%D1%88%D0%BA%D0%BE%D0%BC-%D0%BC%D0%BD%D0%BE%D0%B3%D0%BE-%D0%B3%D0%BE%D0%BD%D0%B0%D0%B4%D0%BE%D1%82%D1%80%D0%BE%D0%BF%D0%B8%D0%BD-%D1%80%D0%B8%D0%BB%D0%B8%D0%B7%D0%B8%D0%BD%D0%B3-%D0%B3%D0%BE%D1%80%D0%BC%D0%BE%D0%BD%D0%B0.jpg?resize=900%2C600&ssl=1″ alt=»Что произойдет, если у меня будет слишком много гонадотропин-рилизинг-гормона?» width=»900″ height=»600″ srcset=»https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-гонадотропин-рилизинг-гормона.jpg?w=900&ssl=1 900w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-гонадотропин-рилизинг-гормона.jpg?resize=450%2C300&ssl=1 450w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-гонадотропин-рилизинг-гормона.jpg?resize=825%2C550&ssl=1 825w, https://i1.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/06/Что-произойдет-если-у-меня-будет-слишком-много-гонадотропин-рилизинг-гормона.jpg?resize=768%2C512&ssl=1 768w» sizes=»(max-width: 900px) 100vw, 900px» data-recalc-dims=»1″ /> Что произойдет, если у меня будет слишком много гонадотропин-рилизинг-гормона?
Неизвестно, каковы эффекты слишком большого количества гонадотропин-рилизинг-гормона. Крайне редко могут развиваться аденомы (опухоли) гипофиза, увеличивающие выработку гонадотропинов, что приводит к гиперпродукции тестостерона или эстрогена.
Что произойдет, если у меня будет слишком мало гонадотропин-рилизинг-гормона?
Дефицит гонадотропин-рилизинг-гормона в детстве означает, что человек не переживает период полового созревания. Примером может служить редкий генетический синдром, известный как синдром Каллмана, который вызывает потерю развития нервных клеток, продуцирующих гонадотропин-рилизинг-гормон, с последующей потерей пубертатного развития и полового созревания. Это чаще встречается у мужчин, чем у женщин, и приводит к потере развития яичек или яичников и бесплодию.
Любая травма или повреждение гипоталамуса также может вызвать потерю секреции гонадотропин-рилизинг-гормона, что остановит нормальную выработку фолликулостимулирующего гормона и лютеинизирующего гормона, вызывая потерю менструального цикла (аменорею) у женщин, потерю выработки спермы у мужчин. и потеря выработки гормонов яичками и яичниками.
Что такое Гонадотропин-рилизинг гормон?
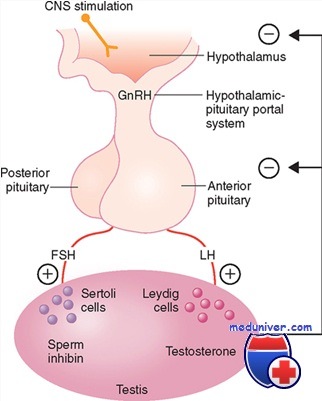
Гонадотропин-рилизинг гормон (ГнРГ) – это один из представителей небольших по размеру гормонов, которые производит передняя доля гипоталамуса. Эти гормоны по строению являются пептидами (то есть состоят из небольшого количества соединенных вместе аминокислот) и имеют несколько названий: рилизинг-факторы, гипоталамические гормоны, рилизинг-гормоны. Все семейство рилизинг-факторов можно разделить на две группы: либерины и статины. Эти гормоны нужны, чтобы влиять на функции периферических эндокринных желез:
Стоит отметить, что некоторые предствители гипоталамический гормонов (например, соматотропный гормон) могут влиять на рост и развитие всех органов и тканей в большей или меньшей степени.
Либерины стимулируют действие эндокринных желез, заставляя их вырабатывать гормоны. Статины же тормозят работу этих желез, уменьшая выработку гормонов.
Лютеинизирующий гормон (ЛГ) оказывает стимулирующее действие на яичники, заставляя их вырабатывать эстрогены. Кроме этого, он необходим для инициации овуляции и образование желтого тела.
У мужчин этот гормон действует на клетки Лейдига, побуждая их синтезировать тестостерон.
Фолликулостимулирующий гормон (ФСГ) в женском организме ускоряет образование и развитие фолликулов в яичниках и синтез ими эстрогеном. В мужском же организме этот гормон действует на клетки Сертоли, активируя сперматогенез.
Таким образом, гонадорелин опосредованно отвечает за нормальную работу репродуктивной системы человека.
Особенности ГнРГ
Регуляция работы организма – довольно тонкая вещь, поэтому ГнРГ имеет ряд особенностей:
Во-вторых, влияние на синтез гонадолиберина может происходить за счет нервной системы:
Действие ГнРГ на организм человека
Органом мишенью для гонадотропин-рилизинг фактора является передняя доля гипофиза. Там есть клетки, имеющие рецепторы к данному гормону. При раздражении этих рецепторов происходит увеличение концентрации ионов кальция внутри клеток, что способствует высвобождению двух гормонов: ФСГ и ЛГ.
Так как конечной целью всего этого каскада является высвобождение половых гормонов (эстрогена и тестостерона), стоит рассмотреть какое действие они оказывают.
Действие эстрогена в женском организме:
Действие тестостерона в мужском организме:
И эстроген и тестостерон есть у людей обоих полов, но в разном соотношении. Половые гормоны, кроме вышеперечисленного, регулируют множество функций в большей или меньшей степени (например, уровень холестерина в крови). Также, ключевая их роль заключается в формировании организма растущего ребенка по женскому или мужскому типу.
Применение ГнРГ в медицине
Использование гонадолиберинов в медицине обычно связано с наличием заболеваний репродуктивной системы. Существует два основных пути использования ГнРГ:
Первый, связан с ситуациями, при которых в организме есть недостаток половых гормонов. В этом случае гонадотропин нужен чтобы усилить их образование. Примеры таких состояний:
Второй путь заключается во введении ГнРГ тогда, когда в организме есть либо избыток половых гормонов, либо существует гормон-зависимая опухоль. При этом по механизму отрицательной обратной связи происходит уменьшение образования собственного гонадолиберина и как следствие уменьшается количество эстрогенов или андрогенов. Примеры таких ситуаций:
Стоит отметить, что все группы вышеперечисленных препаратов должны использоваться только тогда, когда для этого есть показания. Настоятельно рекомендуется применение этих лекарств только после консультации с лечащим врачом.
Гормональное лечение миомы матки
Вопросы лекарственной терапии миомы матки до настоящего времени остаются в разряде нерешенных. А как хотелось бы вылечить миому матки без операции!
Однако, несмотря на тот факт, что литературе уже достаточно подробно описаны эффекты и свойства препаратов, использующихся в подобных случаях не всегда обоснованно, достаточно широко специалистами-гинекологами продолжают назначаться подобного рода схемы.
В этом разделе хотелось бы более подробно остановиться на препаратах, которые вводят женщину в полностью обратимый (т.е. самостоятельно заканчивающийся после отмены лечения) искусственный климакс.
В университетской группе клиник «Я здорова» можно пройти все необходимые обследования для оценки репродуктивного и соматического здоровья как женщине, так и мужчине.
И быть уверенным друг в друге.
Для создания этого состояния, основанного на выключении функции яичников подобной тому состоянию, которое физиологически наблюдается в климаксе, используются препараты агонистов (аналогов) гонадотропин-рилизинг-гормонов. Сокращенно эту группу веществ принято называть так: аГнРГ.
Какие же препараты относятся к данной группе веществ?
Приведем основные торговые названия данных препаратов:
Механизм действия данных препаратов один и тот же. Различается только цена, обусловленная установкой производителя.
В чем суть действия лечения?
В норме в головном мозге, точнее, в гипофизе происходит выработка двух важных гормонов: ЛГ (лютеотропный гормон) и ФСГ (фолликулостимулирующий гормон). Именно этими двумя гормонами и контролируется деятельность всей репродуктивной системы женщины: выработка женских половых гормонов (эстрогенов), мужских (андрогены), контроль процессов овуляции и роста фолликулов и т.д. На механизмах этого воздействия в данном разделе не будем останавливаться подробно.
При использовании препаратов аГнРГ, которые являются подобием (только в 100 раз активнее) натуральных гормонов, на первом этапе в гипофизе усиливается выработка ЛГ и ФСГ, однако через несколько часов за счет высокой активности препаратов, синтез естественных гормонов прекращается. Таким образом, влиять на работу яичников просто становится нечему. Репродуктивная система «засыпает».
Овуляция не происходит, эндометрий не претерпевает циклических изменений, содержание эстрогенов очень низкое (поскольку нет гормонов, которые стимулируют его синтез) и т.д. Возникает состояние подобное естественному климаксу.
В подобном состоянии клетки гипофиза могут находиться до тех пор, пока продолжается воздействие препаратов.
После прекращения лечения функция репродуктивной системы восстанавливается самостоятельно.
Область применения терапии аГнРГ («искусственный климакс»)
Продолжительность лечения не более 6 месяцев
Послеоперационное дополнительное лечение эндометриоза.
Использование препаратов в протоколах программы ЭКО
Использование схем с аГнРГ по показаниям значительно улучшает эффективность стимуляции овуляции.
Использование для лечения миомы матки
Например, размеры миомы матки не позволяют сделать лапароскопию. В таком случае возможно предоперационная подготовка агонистами ГнРГ, с последующей лапароскопией на фоне их действия при адекватном уменьшении размеров узлов. Однако, использование данных препаратов приводит к «размягчению» капсулы миомы матки и самой ткани опухоли, что в некоторых случаях может технически осложнить выполнение операции. Именно поэтому вопрос предоперационной подготовки в такой форме является сейчас спорным.
— Возможно использование данной терапии по определенным схемам у женщин, которым категорически не показано оперативное вмешательство, и которые уже близки к состоянию «естественной постменопаузы». В этом случае постепенно «искусственный климакс» замещается «естественным». Рост миомы матки прекращается
Однако, это лечение не может рассматриваться без учета побочных эффектов агонистов ГнРГ, о которых Вы узнаете ниже.
Особенности препаратов аГнРГ
На фоне использования агонистов ГнРГ у пациентки возникают все симптомы, характерные для постменопаузы, связанное с гипоэстрогенией, т.е. низким содержанием женских половых гормонов:
Необходимо также отметить, что терапия препаратами аГнРГ достаточно дорогостоящая, при этом, суммарный курс лечения по стоимости может превышать стоимость оперативного вмешательства.
В некоторых случаях с целью коррекции побочных эффектов терапию дополняют препаратами эстрогенов, т.е. женских половых гормонов, либо используют прерванные курсы. Для облегчения симптомов возможно использование также препаратов ряда «Ременс».
Таким образом, к сожалению, гормональное лечение миомы матки в настоящее время неэффективно! Его использование может привести к ухудшению состояния (росту миомы матки на фоне отмены, обострению клинической симптоматики (кровотечения, боли)), а также затруднить и отсрочить выполнение оперативного вмешательства.
Гонадотропин рилизинг гормон что это такое
Гипоталамо-гипофизарная ось играет ключевую роль в регуляции синтеза гормонов яичниками. Гипоталамус соединен с гипофизом через портальную сосудистую систему, обеспечивающую транспортировку гипоталамических рилизинг-факторов из большого мозга в гипофиз. Гипоталамус, являясь координирующим центром, подает точные сигналы (посредством импульсной секреции ГнРГ) клеткам-гонадотрофам, которые в свою очередь секретируют ФСГ и ЛГ.
Обрыв этой связи на любом уровне приводит к снижению уровня гонадотропинов с последующей недостаточностью секреции яичниковых гормонов.
Способность экстрактов гипоталамуса стимулировать выработку гонадотропинов была впервые продемонстрирована в конце 50-х гг. прошлого века. В 1971 г, спустя почти 15 лет, гонадотропин-рилизинг гормон (ГнРГ) был выделен из гипоталамического экстракта и подробно описан. Затем он был успешно синтезирован и получен в форме, необходимой для клинического применения.
Однако первые клинические исследования не давали ожидаемых результатов до тех пор, пока не была выяснена истинная природа его импульсного выделения. В своем классическом эксперименте на макаках-резусах Кнобиль и соавт. показали, что нормальная выработка ЛГ и ФСГ невозможна без пульс-инфузий ГнРГ с интервалами приблизительно 60 мин. Более того, изменение частоты пульс-инфузий (в большую или меньшую сторону) или перевод на непрерывное введение ГнРГ приводили к недостаточности секреции и выброса ЛГ и ФСГ. Такие же результаты были получены и при исследованиях на людях.
Импульсное введение гонадотропин-рилизинг гормона (ГнРГ) воспроизводит нормальные паттерны гормональных изменений, что ведет к восстановлению овуляций и фертильности у женщин с гипоталамической формой аменореи.
Гонадотропин-рилизинг гормон (ГнРГ) продуцируется секреторными нейронами, расположенными в аркуатном ядре медиобазального гипоталамуса и преоптическом ядре переднего гипоталамуса. Нервные окончания этих клеток находятся в латеральных отделах наружного слоя срединного возвышения, прилегающих к воронке гипоталамуса. ГнРГ присущ импульсный характер секреции, который задается гипоталамическим генератором импульсов, расположенным в аркуатном ядре.
От того, какова будет частота и амплитуда импульсных выбросов гонадотропин-рилизинг гормона (ГнРГ), во многом зависит секреция гонадотропинов и соответственно активность половых желез. Физиологичная частота (приблизительно 1 раз в час) позитивно регулирует рецепторы к ГнРГ, что повышает чувствительность гипофиза к последующей стимуляции ГнРГ. Это создает эффект «самозакачки»: уровень ЛГ постепенно повышается с каждым последующим импульсным выбросом ГнРГ. Урежение частоты импульсов приводит к ановуляции и аменорее, нарастание частоты или постоянное выделение ГнРГ негативно влияет на рецепторы к ГнРГ, обусловливая резистентность к гонадотроминам.
«Генератор импульсов» подвержен модификации посредством двух главных механизмов: гормональных сигналов и нейрональных сигналов. К гормональным сигналам относятся отрицательная и положительная обратные связи от стероидных гормонов (например эстрогенов и прогестерона), а также пептидных гормонов гонадного происхождения. Нейрональные сигналы могут поступать из различных источников и опосредуются нейротрансмиттерами — ацетилхолином, катехоламинами, серотонином, эндогенными опиоидами и у-аминомасляной кислотой. Считается, что норадреналин стимулирует рецепторы к ГнРГ, в то время как опиоиды дают ингибирующий эффект.
Дофамин может оказывать как стимулирующее, так и ингибирующее действие в зависимости от физиологического состояния.
Биохисия и синтез гонадотропин-рилизинг гормона (ГнРГ)
Гонадотропин-рилизинг гормон (ГнРГ) представляет собой линейный декапептид, образующийся путем посттрансляционного процессинга крупной молекулы-предшественника препро-ГнРГ. Молекула препро-ГнРГ состоит из 92 аминокислот и функционально может быть разделена на 3 части. Вначале расположен сигнальный пептид из 23 аминокислот, затем идет декапептид, затем последовательность Глу-Лиз-Арг, необходимая для протеолитического процессинга и С-терминального аминирования молекул ГнРГ. Последующие 56 аминокислотных остатков названы ГнРГ-ассоциированным пептидом (ГнРГ-АП) и, возможно, обладают пролактин-ингибирующей активностью. Уточнение структуры ГнРГ привело к разработке агонистов ГнРГ длительного действия, к которым относятся бусерелин, лейпролид и нафарелин.
Гонадотропин-рилизинг гормон (ГнРГ) кодируется одним геном, расположенным на коротком плече хромосомы 8 (локус 8р11-р21). У человека этот ген содержит 4 экзона: экзон 2 кодирует про-ГнРГ, экзон 3 и, частично, 2 и 4 кодируют ГнРГ-АП, экзон 4 — длинный нетранслируемый регион 3′. Процессинг молекулы происходит преимущественно в ядре тела клетки (соме). После транскрипции мРНК транспортируется в цитоплазму, где происходят трансляция и образование декапептида. ГнРГ и продукты его расщепления (ГнРГ-АП и про-ГнРГ) затем транспортируются к нервным окончаниям и там все вместе секретируются в портальную систему гипофиза.
Выявление гонадотропин-рилизинг гормона (ГнРГ)
Период полужизни гонадотропин-рилизинг гормона (ГнРГ) очень короток (2-4 мин) из-за его расщепления пептидазами в гипоталамусе и гипофизе. Пептидазы расщепляют молекулу ГнРГ в месте соединения Гли-Лей и в положении 10. За счет выраженного эффекта разведения уровни ГнРГ в периферической крови человека оказываются слишком низкими, чтобы достоверно оценить параметры выброса. Однако на других видах была показана сильная корреляция между концентрацией ГнРГ и уровнем ЛГ в образцах крови из портальной системы гипофиза и периферической крови. Таким образом, частое измерение уровня ЛГ может служить точным индикатором паттернов секреции ГнРГ. Уровень ФСГ также коррелирует с секрецией ГнРГ, но имеет меньшее значение из-за длительного периода полужизни ФСГ.
Aнтагонист гонадотропин-рилизинг гормона ганиреликс (оргалутран).
| Революционное развитие вспомогательных репродуктивных технологий идет параллельно с прогрессом фармакологии. При проведении стимуляции суперовуляции все большее предпочтение отдается наиболее эффективным, безопасным и экономичным препаратам и схемам их применения. Существенный шаг вперед был сделан в результате внедрения протоколов, включающих рекомбинантные гонадотропины. Сегодня создалась перспектива пересмотра стандартов стимуляции суперовуляции в программах ВРТ благодаря появлению принципиально нового класса аналогов гонадолиберина — антагонистов ГнРГ (гонадотропин-рилизинг гормона). |
В результате контролируемой стимуляции яичников гонадотропинами происходит мобилизация значительно большего числа фолликулов, чем в естественном менструальном цикле, в результате концентрация эстрадиола (Е2) значительно превышает физиологический уровень и может вызвать преждевре менный пик ЛГ («паразитарный» пик). Такой преждевременный пик ЛГ наблюдается приблизительно в 20% случаев стимуляции яичников гонадотропинами и приводит к преждевременной овуляции, что неблагоприятно влияет на качество ооцитов или приводит к их потере для ВРТ (овуляции). Для предупреждения «паразитарного» пика ЛГ применяются аналоги ГнРГ [3—6].
В 1971 г. в Сан-Франциско A. Schally с соавторами была расшифрована структура ГнРГ (pGlu-His-Trp-Ser-Tyr-Gly-Leu-Arg-NH2). Эта работа позднее (1977 г.) была отмечена вручением Нобелевской премии в области медицины [1]. На основе химической структуры природного ГнРГ было создано много лекарственных препаратов. В настоящее время выделяют два класса аналогов ГнРГ — агонисты и антагонисты (ант-ГнРГ). Агонисты и антагонисты ГнРГ были получены одновременно, в 1972 г., однако внедрение последних в клиническую практику началось значительно позже. Антагонисты ГнРГ первого поколения обладали не
достаточно выраженным эффектом, относительно коротким периодом полувыведения, вызывали аллергические реакции и были плохо растворимы. Аллергические реакции (от простого покраснения до анафилактического шока) возникали из-за стимуляции рецепторов тучных клеток и высвобождения гистамина [7—9]. Только третье поколение ант-ГнРГ оказалось лишенным этих недостатков. Современные ант-ГнРГ имеют превосходные показатели по степени подавления пиковой секреции ЛГ и при этом низкий анафилактогенный потенциал [10]. В настоящее время в США и европейских странах зарегистрированы два ант-ГнРГ — ганиреликс и цетрореликс. В 2002 г. ганиреликс зарегистрирован в России.
Механизм действия аналогов ГнРГ
Механизм действия антагонистов ГнРГ практически противоположен действию агонистов [4]. После введения ант-ГнРГ непосредственно конкурентно блокируют рецепторы ГнРГ в гипофизе [2, 5, 6, 11, 13]. Активации рецепторов при этом не происходит и количество рецепторов ГнРГ в гипофизе не снижается. В отличие от агонистов ГнРГ антагонист действует немедленно (снижение уровня ЛГ наблюдается уже через несколько часов) и прочно связывается с рецептором ГнРГ [11, 14], не вызывая его активации (рис. 1 и табл. 1). Благодаря удачной химической формуле рецептор-связывающая активность ганиреликса превосходит активность природного ГнРГ в 9 раз [7] при минимальной из всех антагонистов ГнРГ способности связываться с рецепторами гистамина [18].
Подавление гипофиза становится более контролируемым. Степень подавления секреции гонадотро пинов напрямую зависит от дозы антагониста ГнРГ [3, 15, 16]. Назначение антагонистов ГнРГ во время стимуляции суперовуляции требуется на то непродолжительное время, когда фолликулы вступили в завершающую фазу роста и существует риск преждевремен ного выброса ЛГ (обычно с 6-го дня стимуляции). Эндогенный ФСГ подавляется только в позднюю фолликулиновую фазу, по этой причине для цикла КСС требуется меньшая доза ФСГ. Действие антагонистов обратимо. После отмены препаратов функция гипофиза быстро восстанавливается (после инъекции ганиреликса в течение 2-х суток) (рис. 3).
Таблица 1. Сравнение механизма действия антагонистов и агонистов ГнРГ
 |
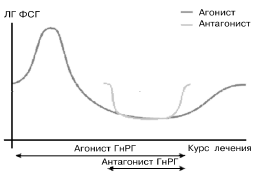 |
| Рис. 1. Показаны характерные различия между действием агонистов и антагонитов ГнРГ. Для достижения эффекта супрессии требуется разная длительность введения. |
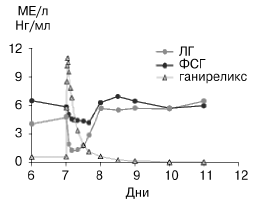 |
| Рис. 2. Уровень ЛГ и ФСГ в сыворотке крови после подкожного однократного введения 0,25 мг ганиреликса. |
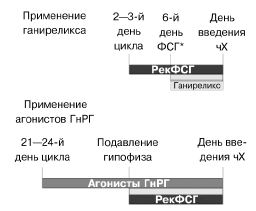 |
| Рис. 3. Графическое сравнение протокола стимуляции суперовуляции рекФСГ с применением ганиреликса и с применением агонистов ГнРГ по «длинному» протоколу. |
* В случае бедного ответа со стороны яичников назначение ганиреликса может быть отложено до тех пор, пока один из фолликулов не достигнет диаметра 14 мм и более. В случае выраженного роста фолликулов введение ганиреликса может быть начато с 5-го дня стимуляции суперовуляции.
После введения ганиреликса происходит значитель ное снижение уровня гонадотропинов в крови, причем уровень ЛГ снижается в большей степени, чем уровень ФСГ. Так, после однократного введения 0,25 мг ганиреликса концентрация ЛГ снижается на 74%, а уровень ФСГ на 32% [16]. Супрессия после однократного введения длится 4—16 ч после инъекции (рис. 2).
Период полужизни ганиреликса составляет около 13 ч [3]. На протяжении ежедневного курса применения ганиреликса, его концентрация в крови сохраняется достаточной для подавления гонадотропной активности гипофиза и предупреждения преждевремен ного выброса ЛГ. После многократного введения концентрация ганиреликса в крови сохраняется в эффективных пределах в течение 2—3 дней [19]. Таким образом, фармакокинетику препарата характеризуют быстрое начало действия (в течение нескольких часов), связанное с высокой биодоступностью и прямым блокирующим действием на рецепторы гонадотрофов, быстрое восстановление уровня гонадотропинов после прекращения инъекций, связанное с быстрым выведением ганиреликса из организма и немедленной обратимостью его действия на рецепторы. Фармакокинетика ганиреликса предсказуема и пропорциональ на введенной дозе. Свойства препарата (табл. 2) позволяют точно контролировать активность гипофиза, вовремя подавлять ее и вовремя восстанавливать.
Таблица 2. Основные фармакокинетические и фармакодинамические свойства ганиреликса
 |
Протокол применения ганиреликса для предупреждения преждевременного выброса ЛГ
Введение в клиническую практику ант-ГнРГ — ганиреликса, позволяет проводить процесс стимуляции яичников на современном и безопасном уровне, в коротком и простом режиме, что отвечает интересам пациента. Такие отличительные свойства ганиреликса, как подавление секреции гонадотропинов без интернализации рецепторов на гонадотрофах, быстрый и обратимый характер действия, позволили существенно усовершенствовать протоколы контролируемой суперовуляции без снижения ее эффективно сти [5, 11].
В первую очередь это касается последовательности назначения ант-ГнРГ и гонадотропинов. Введение ганиреликса начинают на относительно поздних стадиях фолликулогенеза, на этапе появления лидирующе го фолликула, достигшего 14 мм в диаметре (по данным УЗ-мониторинга) (см. рис. 3).
Во всех исследованиях ант-ГнРГ — ганиреликса стимуляция фолликулогенеза осуществлялась рекомбинантным фоллитропином бета (пурегон, «Органон», Нидерланды). Стимуляцию с помощью рекФСГ можно начинать в обычном режиме на 2—3-й день после прихода менструации. Ганиреликс вводят подкожно, один раз в день. Предпочтительно начинать введение ганиреликса на 6-й день стимуляции рекФСГ. Назначение ганиреликса может быть отложено при отсутствии фолликулярного роста на фоне рекФСГ. В этом случае начинать введение ганиреликса нужно с того дня, когда по крайней мере один фолликул достигнет 14 мм в диаметре (по данным УЗ-мониторинга).
Режим дозирования рекФСГ подбирается и корректируется индивидуально для каждой пациентки и скорее зависит от числа и размера растущих фолликулов, чем от уровня эстрадиола [5]. Применение ганиреликса должно продолжаться до того момента, пока фолликулы не достигнут нужной величины. Процесс созревания фолликулов завершается путем введения овуляторной дозы человеческого хорионического гонадотропина (чХГ). Также ведутся работы [38] по применению агонистов ГнРГ в качестве триггеров овуляции (например, трипторелин в дозе 0,1—0,2 мг).
Следует заметить, что в клинических исследова ниях поддержка лютеиновой фазы проводилась с помощью препаратов прогестерона и чХГ согласно обычной практике центров, участвовавших в исследовани ях. В то же время, поскольку после отмены ант-ГнРГ функция гипофиза восстанавливается быстро, ожидается, что в протоколах с антагонистами гонадолиберина потребуется меньшая степень поддержки лютеиновой фазы, особенно с применением чХГ, чем в протоколах с агонистами ГнРГ [20].
Оптимальная доза ганиреликса, которая бы предупреждала преждевременное высвобождение ЛГ во время контролируемой стимуляции суперовуляции, была определена в ряде многоцентровых, двойных слепых, рандомизированных исследований в 13 центрах ЭКО с участием 333 женщин [3, 21, 22]. Применялись шесть разных дозировок ганиреликса от 0,0625 мг до 2 мг. Было показано, что доза 0,25 мг является оптимальной. На ней была получена самая высокая частота имплантации эмбрионов (21%), частота беременности (34% на попытку и 27% на перенос) и минимальная частота преждевременной лютеинизации (менее 1%). При использовании бульших доз снижалась частота имплантации, при меньших дозах ганирелик са резко возрастал риск преждевременного выброса ЛГ. В настоящее время не существует данных в пользу целесообразности применения других доз ганирелик са. Вопрос об использовании больших доз у женщин с индексом массы тела более 35 кг/м2 находится на этапе исследований.
Клинический опыт применения ганиреликса
Эффективность и безопасность ант-ГнРГ — ганиреликса изучалась в трех контролируемых, проспективных, рандомизированных исследованиях [24—26]. Исследования проводились в 43 центрах ЭКО Европы, США, Канады и Средней Азии:
1. Европейское исследование, 701 пациентка (EU).
2. Североамериканское исследование, 297 пациенток (NA).
3. Европейско-Среднеазиатское исследование, 337 пациенток (EU/MА).
Пациентки были рандомизированно разделены на группы: получавшие ганиреликс или традиционно применявшийся агонист ГнРГ. Во всех исследованиях применяли рекомбинантный фоллитропин бета (пурегон) в постоянной стартовой дозе в течение 5 дней (табл. 3), после чего дозу рекФСГ корректировали в зависимости от ультразвуковой картины ответа яичников на стимуляцию. Ежедневное введение ганиреликса начинали с 6-го дня стимуляции и до дня введения человеческого хорионического гонадотропина (чХГ) включительно. Агонисты ГнРГ в группах сравнения назначали по «длинному» протоколу ежедневно с 21—24-го дня менструального цикла. Критерием назначения овуляторной дозы чХГ (10 000 МЕ прегнила, «Органон», Нидерланды) было достижение, по крайней мере, тремя фолликулами диаметра более 17 мм. Затем проводили ЭКО или ИКСИ и поддержку лютеиновой фазы по традиционной методике центра.
Таблица 3. Сравниваемые режимы терапии в трех контролируемых многоцентровых рандомизированных исследованиях эффективности и безопасности ганиреликса
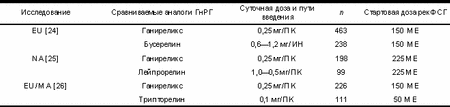 |
ПК — подкожно, ИН — интраназально.
Цель этого исследования была показать, что эффективность и безопасность применения антагониста ГнРГ — ганиреликса не уступает агонистам ГнРГ, традиционно применямым по «длинному» протоколу. Оценка суммарной эффективности после сбора данных по нескольким центрам проводилась по усредненным параметрам эффективности, в расчете которых учитывалась доля участия того или иного центра.
Результаты гормонального мониторинга
Непосредственно во время применения ганирелик са случаи преждевременного выброса ЛГ наблюдались очень редко, что подтверждалось повышением прогестерона более 1 нг/мл. В EU исследовании у 1,5% пациенток, в EU/MA у 0,4% и в NA у 1,5% пациенток. Общая частота неэффективного подавления ганиреликсом преждевременного выброса ЛГ составила 1,2%, а неэффективность агонистов ГнРГ составила 0,8%.
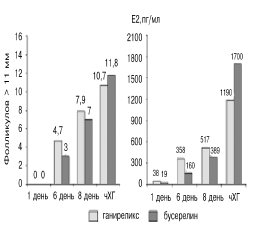 |
| Рис. 4. Среднее число прогрессирующих фолликулов и средние концентрации эстрадиола на 1-й, 6-й, 8-й дни стимуляции и в день введения чХГ [24]. |
В группе ганиреликса стимуляцию овуляции начинали со 2-го или 3-го дня менструального цикла, тогда как в группе бусерелина рекФСГ назначали только после подтверждения десенситизации гипофиза. Как видно на рис. 4, к 6-му дню стимуляции не было фолликулов диаметром более 11 мм у 13,2% пациенток в группе ганиреликса и у 31,5% пациенток в группе бусерелина. Особенно ясные различия между ганирелик сом и агонистом ГнРГ были получены при сравнении скорости роста фолликулов и уровня эстрадиола [24]. На рис. 4 представлена динамика числа фолликулов диаметром более 11 мм и концентрации эстрадиола в крови во время стимуляции овуляции в Европейском исследовании. Измерения производились на 1-й, 6-й и 8-й дни стимуляции. В группе пациенток, у которых применялся ганиреликс, наблюдался более быстрый рост фолликулов в течение первых 5 дней стимуляции яичников, чем у пациенток, у которых гормональная система была подавлена бусерелином. Это подтвержда ется большим числом растущих фолликулов к 6-му дню стимуляции и более высоким уровнем эстрадиола. Увеличение эстрадиола в группе ганиреликса наблюдалось с 38 пг/мл в 1-й день до 358 пг/мл на 6-й день стимуляции. У пациенток, получавших бусерелин, рост уровня эстрадиола был менее выраженным: с 19 пг/мл до 160 пг/мл. К 8-му дню стимуляции различия между группами были менее заметными. К дню назначения чХГ число фолликулов диаметром более 11 мм было несколько меньше в группе ганиреликса, также в этой группе концентрация эстрадиола была ниже в среднем на 500 пг/мл.
Так же как и в EU, в NA исследовании отмечался более быстрый рост фолликулов в первые дни стимуляции в группе ганиреликса. На 6-й день стимуляции яичников среднее число фолликулов диаметром более 11 мм в группе ганиреликса было почти в 2 раза больше и составляло 6,3, а в группе лейпрорелина 3,5. Соответственно уровень эстрадиола в сыворотке крови также был почти в 2 раза выше у пациенток из группы ганиреликса и составил 939 пг/мл, а у пациенток из группы лейпрорелина 425 пг/мл. Сывороточ ная концентрация ЛГ также была значительно выше у пациентов, получавших ганиреликс (3,3 МЕ/л против 1,8 МЕ/л).
Результаты EU/MA исследования оказались также сходными с EU. Если обобщить результаты, то можно придти к заключению, что в первый день стимуляции яичников у пациенток, которым будет применяться ганиреликс, сывороточные концентрации ЛГ, ФСГ и эстрадиола выше, чем средний уровень этих гормонов в группе, получавшей агонист. На 6-й день стимуляции сывороточный уровень ЛГ у пациенток, получавших ганиреликс, также оставался выше, чем у пациенток групп антагонистов. Средние концентрации ФСГ были сравнимы. В день введения чХГ сывороточный уровень ЛГ не различался между группами. Сывороточные концентрации прогестерона не отличались между группами с 1-го дня стимуляции до дня введения чХГ.
В табл. 4 представлены результаты проведенного лечения в каждой группе трех обсуждаемых исследований. По сравнению с применением бусерелина, у пациенток группы ганиреликса в EU исследовании созревало меньше на один преовуляторный фолликул, и получали яйцеклетку на одну меньше, чем в группе бусерелина. Всего в 357 случаях проводили классическое ЭКО и в 291 случае — ИКСИ. У 10 пациенток применяли и ЭКО, и ИКСИ. Группы не различались по частоте используемых методов оплодотворения. Общая частота оплодотворения составила 62,1% в каждой группе. Кроме того, группы не различались по числу полученных эмбрионов хорошего качества. В среднем осуществляли перенос 2,2 эмбрионов в каждой группе, из них эмбрионов хорошего качества 2,0 в группе ганиреликса и 1,9 в группе бусерелина.
В расчете на попытку частота наступления беременности составила 20,3% в группе ганиреликса и 25,7% в группе бусерелина. Эти данные включают одну спонтанно наступившую беременность у пациентки из группы бусерелина. При расчете на перенос эмбрионов частота беременности составила 26,3% для получавших ганиреликс и 28,6% для пациенток группы бусерелина (различия не достоверны).
В табл. 4 также представлены наиболее значимые клинические результаты NA исследования. По сравнению с группой пациенток, получавших лейпрорелин, в группе ганиреликса было получено несколько меньше ооцитов (средняя разница составила 2,4 яйцеклетки). Частота оплодотворения было одинаковой и составила 62,4% в группе ганиреликса и 61,9% в группе лейпрорелина. Также не отличались между группами среднее число полученных эмбрионов хорошего качества (4,3 против 4,8) и среднее число перенесенных эмбрионов (2,9 против 2,8).
Таблица 4. Сравнение эффективности ганиреликса и агонистов ГнРГ в трех рандомизированных многоцентровых исследованиях [24—26]. Данные приведены с указанием стандартной ошибки среднего
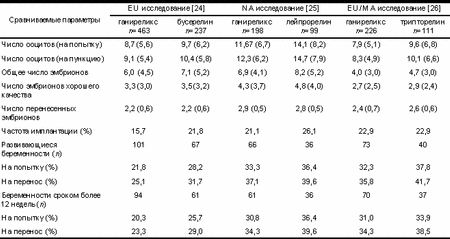 |
Различия между группами по результатам клинической эффективности недостоверные.
Частота наступления беременности в расчете на попытку составила 30,8% в группе ганиреликса и 36,4% в группе пациенток, получавших лейпрорелин ацетат. При этом наблюдались значительные колебания частоты наступления беременности в зависимости от исследовательского центра. Так, в группе ганиреликса частота наступления беременности колебалась от 13,6 до 77,8%, а в группе лейпрорелина ацетата от 8,3 до 81,8%. При сравнении частоты наступления беременности между центрами оказалось, что в 5 центрах была получена достоверно более высокая частота беременности в группе ганиреликса и в 5 центрах, наоборот, достоверно более высокая частота беременности была в группе лейпрорелина.
Исследователи предположили, что клинический результат в случае применения препаратов для стимуляции яичников может иметь значительную зависимость от наличия у лечащих врачей достаточного опыта работы с препаратом. Это предположение подтверди лось. Если проанализировать результаты лечения 357 пациенток в тех 10 центрах, в которых ранее уже применялся ганиреликс в период проведения исследова ний поиска оптимальной дозы (II фаза), то в этих центрах средняя частота наступления беременности была сходна между группами ганиреликса и агониста ГнРГ. В группе ганиреликса частота беременности составила 24,2% и в группе агониста ГнРГ 23,6%. Если же проанализировать результат лечения 363 пациенток в 10 центрах, которые имели первый опыт работы с ганиреликсом, то частота беременности составила 16,5% в группе ганиреликса и 27,5% в группе агониста ГнРГ.
Наиболее значимые клинические результаты Европейско-Среднеазиатского исследования представле ны в табл. 4 [26]. По сравнению с группой пациенток, получавших трипторелин, в группе ганиреликса было получено меньше яйцеклеток (7,9 против 9,6 на попытку). Среди пациенток, которым проводилось ИКСИ, среднее число ооцитов в метафазе II составило 6,8 (81%) в группе ганиреликса и 8,2 (80%) в группе трипторелина. Средняя частота оплодотворения в группах не отличалась и составила соответственно 64,0 и 64,9%. Также не различались между группами такие показатели, как число эмбрионов высокого качества и число перенесенных эмбрионов. Средняя частота имплантации была достаточно высокой и одинаковой в обеих группах (22,9%). Частота самопроизвольных выкидышей составила 10,3% от числа клинически подтвержденных беременностей в группе ганиреликса и 11,4% в группе трипторелина. Частота беременности сроком более 12 нед (на попытку) в группе ганиреликса составила 31%, в группе трипторелина 33,9%.
В трех крупных контролируемых рандомизирован ных исследованиях эффективности ганиреликса в дозе 0,25 мг проводилось сравнение с приемом агонистов ГнРГ по «длинному» протоколу (бусерелина, лейпрорелина ацетата или трипторелина). Во всех трех исследованиях показано, что применение ганиреликса не уступает, а по ряду показателей имеет значитель ные преимущества перед использованием агонистов ГнРГ:
— меньшую продолжительность применения аналогов ГнРГ (4—5 дней вместо 22—26);
— меньшую продолжительность стимуляции овуляции (на 1—2 дня);
— меньшие дозы гонадотропинов на цикл стимуляции (приблизительно на 300 МЕ);
— быстрый рост фолликулов в течение первых дней стимуляции рекомбинантным ФСГ;
— финальная когорта фолликулов несколько меньше и вырабатывает несколько меньше эстрадиола, число яйцеклеток меньше на 1—2;
— одинаковая частота оплодотворения и одинаковое число эмбрионов хорошего качества;
— высокий клинический результат, заключающий ся в числе и качестве ооцитов, частоте оплодотворе ния, числе и качестве эмбрионов, частоте имплантации и частоте наступления и прогрессирования беременности.
Меньшее число инъекций и укорочение длительности лечения является основным преимуществом ганиреликса перед агонистами ГнРГ. Применение ганиреликса упрощает программу ЭКО, делает ее более удобной и менее обременительной для пациенток.
Применение ант-ГнРГ — ганиреликса в программе ЭКО приводит к значительному снижению частоты побочных эффектов по сравнению с агонистами ГнРГ. Среди пациенток, участвовавших в EU исследовании, частота синдрома гиперстимуляции яичников (СГЯ) составила 2,4% в группе ганиреликса против 5,9% в группе бусерелина [24]. В двух других работах [25, 26] частота СГЯ в группах ганиреликса составила 2,9%, в группах применения агонистов ГнРГ 3,8%. Меньшая частота развития СГЯ при применении ганиреликса связана с тем, что на момент введения чХГ имеется меньше фолликулов и меньше уровень эстрадиола (основной фактор риска СГЯ).
Также во всех исследованиях ганиреликса большое внимание обращалось на местную переносимость препарата, появление реакций на инъекции [5, 24]. На примере NA и EU/MA исследований (табл. 5) показано, что частота местных реакций, появлявшихся в течение часа после инъекции, в группе ганиреликса была в два раза ниже, чем после введения агонистов ГнРГ по «длинному» протоколу.
Таким образом, ганиреликс безопасен для пациентов, хорошо переносится как при однократном применении, так и при использовании в следующих попытках ЭКО. Частота развития побочных реакций при приеме ганиреликса низкая и не отличается от групп сравнения.
Новые возможности применения ганиреликса
Применение ганиреликса открывает новые возможности для индукции овуляции [28—30]. Так, предлагается вместо чХГ в качестве триггера овуляции использовать однократное введение агонистов ГнРГ, которые бы вызвали высвобождение эндогенных ЛГ и ФСГ. Эта возможность вызвать индукцию овуляции без увеличения риска развития СГЯ была испытана Itskovitz с коллегами [31, 32]. С этой целью использовали дозу трипторелина (декапептил) 0,2 мг у 8 пациенток, у которых имелся высокий риск развития СГЯ (по крайней мере 20 фолликулов диаметром более 11 мм и/или уровень сывороточного эстрадиола более 3000 пг/мл). В день, когда должна была проводиться индукция овуляции, среднее число фолликулов >11 мм было 25,1±4,5, а средние концентрации Е2 составляли 3675 (2980—7670) пг/мл. Через 4 ч после инъекции агонистов ГнРГ и высвобождения эндогенных гонадотропинов сывороточные концентра ции ЛГ и ФСГ составили 219 МЕ/л и 19 МЕ/л соответственно. Среднее число полученных ооцитов было 23,4±15,4, из которых 83% были зрелыми (находились в метафазе II второго деления мейоза). При этом ни у одной из 8 пациенток не появились симптомы СГЯ. Беременность от переноса полученных в этом цикле стимуляции эмбрионов наступила в 4 случаях (50%). Исследователи пришли к заключению, что агонисты ГнРГ могут применяться в качестве эффективного триггера высвобождения эндогенного овуляторного ЛГ с целью достижения ооцитами зрелости и с целью предупреждения развития СГЯ у пациенток высокого риска. При сравнении эндокринного профиля после инъекции чХГ или инъекции трипторелина в схемах с ганиреликсом наблюдался более физиологичный пик ЛГ именно при введении агониста [38]. Возможно, эти исследования позволят в ближайшем будущем отказываться от использова ния чХГ в качестве триггера овуляции.
Таблица 5. Частота появления умеренно выраженных или тяжелых местных реакций на подкожное введение ганиреликса и агонистов ГнРГ в Североамериканском и Европейско-Среднеазиатском исследованиях [25, 26]
 |
Еще одной особенностью стимуляции с ант-ГнРГ является потенциальная возможность у ряда пациенток отказаться от поддержки функции желтого тела в посттрансферном периоде [20]. Ганиреликс, как препарат с коротким периодом полувыведения, открывает в данном аспекте новые перспективы.
В настоящее время продолжаются исследования ганиреликса по применению этого препарата при некоторых онкологических заболеваниях (таких как рак простаты, рак яичника), доброкачественной гиперплазии простаты, миоме матки [33—37]. Преимущест вом антагониста ГнРГ по сравнению с агонистами ГнРГ является отсутствие нежелательной фазы активации функции гипофиза.
1. Schally A.V., Arimura A., Baba Y., Nair R.M.G., Matsuo H., Redding T.W., Debeljuk L., White W.F. Isolation and properties of the FSH and LH-releasing hormone. Biochem Biophys Res Commun 1971; 43: 393—9.
2. River J. GnRH antagonists: the future. In: Lunenfeld B., ed. GnRH Analogues — The State of the Art 2001. UK: Parthenon Publishing Group 2002; 1—13.
3. The ganirelix dose-finding study group. A double-blind, randomized, dose-finding study to assess the efficacy of the GnRH antagonist ganirelix (Org 37642) to prevent premature LH surges in women undergoing controlled ovarian hyperstimulation with recombinant FSH (Puregon). Hum Reprod 1998; 13: 3023—31.
4. Hsueh A.J., Jones P.B. Extrapituitary actions of gonadotropin-releasing hormone. Endocrinol Rev 1981; 2: 437—61.
5. Felberbaum R.E., Ludwig M., Lunenfeld B., Diedrich K. GnRG antagonists in assisted reproduction. In: Lunenfeld B., ed. GnRH Analogues — The State of the Art 2001. UK: Parthenon Publishing Group 2002; 71—86.
6. Diedrich K., Diedrich C., Santos E. et al. Suppression of the endogenous luteinizing hormone surge by the gonadotrophin releasing hormone antagonist cetrorelix during ovarian stimulation. Hum Reprod 1994; 9: 788—91.
7. Rabinovici J., Rothman P., Monroe S.E., Nerenberg C., Jaffe R.B. Endocrine effects and pharmacokinetic characteristics of a potent new gonadotropin-releasing hormone antagonist (ganirelix) with minimal histamine-releasing properties: studies in postmenopausal women. JCEM 1992; 75: 1220—5.
8. Nelson L.R., Fujimoto V.Y., Jaffe R.B., Monroe S.E. Suppression of follicular phase pituitary-gonadal function by a potent new gonadotropin-releasing hormone antagonist with reduced histamine-releasing properties (ganirelix). Fertil Steril 1995; 63: 963—9.
9. Jiang G., Stalewski J., Galyean R., Dykert J., Schteingart C. et al. GnRH antagonists: a new generation of long-acting analogues incorporating urea functions at positions 5 and 6. J Med Chem 2001; 44: 453—67.
10. Deghenghi R. Antarelix™. In: Filicori M., Flamigni C., eds. Treatment with GnRH Analogs: Controversies and Perspectives. Carnforth: Parthenon Publishing 1996; 89—91.
11. River J., Jiang J.C., Lahrichi S.L. et al. Dose relationship between GnRH antagonists and pituitary suppression — GnRH
analogues and Reproductive Medicine. Eds. R.G. Edwards, H. Beard, J.P.W.Vermeiden. Hum Reprod 1996; 11 (Suppl 3): 133—147.
12. Daya S. The role of meta-analysis in determining which gonadotropin to use for ovarian stimulation. In: Z. Shoham, C.M. Howles, H.S. Jacobs, eds. Female Infertility Therapy. London: Martin Dunitz 1999; 177—88.
13. Olivennes F., Fanchin R., Bouchard P. et al. Scheduled administration of a gonadotrophin releasing hormone antagonist (cetrorelix) on day 8 of in vivo fertilization cycles: a pilot study. Hum Reprod 1995; 10: 1382—6.
14. Hernandez E.R. Embryo implantation: the rubicon for GnRH antagonists. Hum Reprod 2000; 15: 1211—16.
15. Fujimoto V.Y., Monroe S.E., Nelson L.R., Downey D., Jaffe R.B. Dose-related suppression of serum luteinizing hormone in women by a potent new gonadotropin-releasing hormone antagonist (ganirelix) administered by intranasal spray. Fertil Steril 1997; 67: 469—73.
16. Obery J., Mannaerts B., Huisman J.A.M., Timmer C.J. Pharmacokinetic and pharmacodynamic characteristics of ganirelix (Orgalutran): Part II. Dose-proportionality and gonadotropin suppression after multiple doses of ganirelix in healthy female volunteers. Fertil Steril 1999; 72: 1006—12.
17. Nerenberg C., LaFargue J., Gee C., Chu F., Wolfe L., Chan R., Tarnowski T. Radioimmunoassay of ganirelix in plasma or serum. J Immunoass 1993; 14: 191—207.
18. Rivier J. GnRH analogues towards the next millenium. In: B. Lunenfeld, ed. GnRH Analogues — The State of the Art at the Millennium. Carnforth, UK: Parthenon Publishing 1999; 31—45.
19. Obery J.J., Mannaerts B., Kleijn H.J., Timmer C.J. Pharmacokinetic and pharmacodynamic characteristics of ganirelix (Orgalutran): Part I. Absolute bioavailability of 0,25 мg ganirelix after single subcutaneous injection in healthy female volunteers. Fertil Steril 1999; 72: 1001—5.
20. Albano C., Grimbizis G., Smitz J. et al. The luteal phase of non-supplemented cycles after ovarian superovulation with human menopausal gonadotropin and the gonadotropin-releasing hormone antagonist Cetrorelix. Fertil Steril 1998; 70: 357—359.
21. Itskovitz-Eldor J., Kol S., Mannaerts B., Coelingh Bennink H.C. First established pregnancy after controlled ovarian hyperstimulation with recombinant follicle stimulating hormone and the gonadotropin-releasing hormone antagonist ganirelix (Org 37642). Hum Reprod 1998; 13: 294—5.
22. De Jong D., Macklon N.S., Mannaerts B. High-dose gonadotropin-releasing hormone antagonist (ganirelix) may prevent ovarian hyperstimulation syndrome caused by ovarian stimulation for in vivo fertilization. Hum Reprod 1998; 13: 573—5.
23. Kol S., Lightman A., Hillensjљљ T. et al. High doses of GnRH antagonist in IVF do not adversely effect the outcome of subsequent freeze-thaw cycles. Hum Reprod 1999; 14: 2242—44.
24. The European Orgalutran study group (Borm G., Mannaerts B.). Treatment with the gonadotropin-releasing hormone antagonist ganirelix in women undergoing controlled ovarian hyperstimulation with recombinant follicle stimulating hormone is effective, safe and convenient: results of a controlled, randomized, multicentre trial. Hum Reprod 2000; 15: 1490—98.
25. The North American Ganirelix Study Group (Fluker M., Grifo J., Leader A. et al.). Efficacy and safety of ganirelix acetate versus leuprolide acetate in women undergoing controlled ovarian hyperstimulation. Fertil Steril 2001; 75: 38—45.
26. The European and Middle East Orgalutran Study Group. Comparable clinical outcome using the GnRH antagonist ganirelix or a long protocol of the GnRH agonist triptorelin for the prevention of premature LH surges in women undergoing ovarian stimulation. Hum Reprod 2001; 16: 644—51.
27. Akman M.A., Erden H.F., Tosun S.B. et al. Addition of GnRH antagonist in cycles of poor responders undergoing IVF. Hum Reprod 2000; 15: 2145—7.
28. Olivennes F., Fanchin R., Bouchard P., Taieb J., Frydman R. Triggering of ovulation by a gonadotropin-releasing hormone (GnRH) agonist in patients pretreated with a GnRH antagonist. Fertil Steril 1996; 66: 151—3.
29. Olivennes F. Induction of final oocyte maturation by a single dose of GnRH agonist after ganirelix treatment. France. 6th International Symposium on GnRH Analogues in Cancer and Human Reproduction. Abstract 2001.
30. Boerrigter P.J. Opportunities in COH with the GnRH antagonist ganirelix. The Netherlands. 6th International Symposium on GnRH Analogues in Cancer and Human Reproduction. Abstract 2001.
31. Itskovitz J., Kol S., Mannaerts B. Prevention of ovarian hyperstimulation syndrome by triggering the preovulatory LH surge with the GnRH agonist triptorelin (Decapeptyl) after GnRH antagonist ganirelix (Orgalutran) treatment in women undergoing ovarian stimulation for in vivo fertilisation: a preliminary report. Hum Reprod (accepted).
32. Itskovitz-Eldor J., Kol S., Mannaerts B. Use of a single bolus of GnRH agonist triptorelin to trigger ovulation after GnRH antagonist ganirelix treatment in women undergoing ovarian stimulation for assisted reproduction, with special reference to the prevention of ovarian hyperstimulation syndrome: preliminary report. Hum Reprod 2000; 15: 1965—8.
33. Grundker C., Emons G. Biology of GnRH systems in cancer and human reproduction. In: Lunenfeld B., ed. GnRH Analogues — The State of the Art 2001. UK: Parthenon Publishing Group 2002; 15—42.
34. De Blok S., Oberye J. Rapid reduction of leiomyoma volume during treatment with the GnRH antagonist ganirelix. The Netherlands. 6th International Symposium on GnRH Analogues in Cancer and Human Reproduction. Abstract 2001.
35. Westphalen S., Emons G. GnRH analogues in ovarian and endometrian cancers. In: Lunenfeld B., ed. GnRH Analogues — The State of the Art 2001. UK: Parthenon Publishing Group 2002; 111—125.
36. Shaw R. An update on the treatment of uterine fibroids with GnRH analogues. In: Lunenfeld B., ed. GnRH Analogues — The State of the Art 2001. UK: Parthenon Publishing Group 2002; 135—144.
37. Zlotta A.R. GnRH analogues in prostate cancer. In: B. Lunenfeld, ed. GnRH Analogues — The State of the Art 2001. UK: Parthenon Publishing Group 2002; 43—70.
38. Fauser B.C., Jong D., Olivenness F., Wramsby H., Tay C., Itskovitz-Eldor J., Hooren H.G. Endocrine profiles after triggering of final oocyte maturation with GnRH agonists after cotreatment with the GnRH antagonist ganirelix during ovarian hyperstimulation for in vivo fertilization. J Clin Endocrinol Metab 2002; 2: 2144—2150.
Муж возвращается домой страшно взлохмаченный, разъяренный, он кричит, ругается, топает ногами:
Е.А. Осина, С.М. Белобородов, Б.В. Леонов, К.А. Яворовская
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
— Проклятый Бин Ладен! Чтоб его разорвало, чтоб его черти съели, будь он проклят!
— Дорогой, тебе-то что он сделал?
— Как что? Письмо прислал!
— С сибирской язвой?!
— Какой язвой! С гонореей!