Гнойник на печени что это
Гнойник на печени что это
Ограниченные гнойные заболевания печени встречаются редко, но трудно поддаются диагностике и протекают тяжело. Среди госпитализированных в хирургический стационар больных пациенты с абсцессами печени составляют до 0,16%.
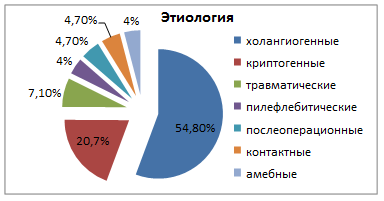
Выделяют следующие группы абсцессов печени: 1) холангиогенные (54,8%); 2) криптогенные (19,1%); 3) травматические (7,1%); 4) пилефлебитические (4%); 5) послеоперационные (4,7%); 6) контактные (4,7%); 7) амебные (4%) [1] (рис. 1).
Рис. 1. Этиология абсцессов печени
Лечение этой патологии чаще хирургическое, и до внедрения пункционных методов лечения больные с абсцессами печени обычно подвергались большим полостным операциям, нередко сопровождающимся послеоперационной летальностью от 16,9% до 55,0% [2, 3]. В современной хирургии с диагностической и лечебной целью широко используют компьютерную томографию (КТ) и ультразвуковое исследование (УЗИ) 4.
До внедрения в клиническую практику КТ и УЗИ лечение ограниченных гнойников печени проводилось в основном на основании клинических данных. Прорывом в лечении и, конечно, «золотым стандартом» в лечебной тактике явилось внедрение в клиническую практику методов КТ и УЗИ. Чрескожная пункция и дренирование гнойников печени свое доминирующее место в хирургии приобрели при ультразвуковой навигации. Метод открыл новые возможности для диагностики и лечения, позволил внедрить малотравматичные методы эвакуации гнойников печени. Ведущее место в лечении больных с абсцессом печени занимают пункционные методы. К их достоинствам относят: отсутствие риска общего обезболивания, сокращение сроков нахождения на стационарном лечении, низкий уровень операционной агрессии, невысокий процент летальных исходов 5.
Цель исследования: анализ результатов лечения абсцессов печени пункционным способом под ультразвуковой навигацией.
Материалы и методы исследования
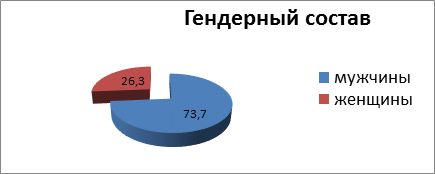
В отделениях хирургии ГКБ № 8 г. Уфы с 2014 по 2019 гг. с солидными абсцессами печени находились 19 больных. Возраст пациентов варьировал от 31 до 72 лет, средний возраст составил 53,5±0,3 года, соотношение мужчин и женщин было соответственно14 (73,7%) и 5 (26,3%) (рис. 2).
Рис. 2. Гендерный состав анализируемых больных (%)
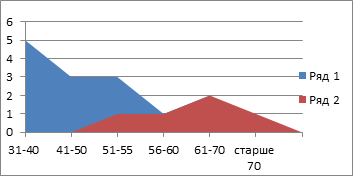
Следует отметить, что в анализируемой группе преобладали более молодые мужчины (их средний возраст составил 38±0,15 года) и более пожилые женщины (средний возраст 65±0,15 года) (рис. 3).
Рис. 3. Частота встречаемости абсцессов печени
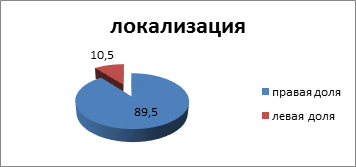
Пик заболеваемости приходился на возраст от 31 до 55 лет (43± 0,3 года) (11 пациентов, 57,9%). Гнойный процесс в правой доле выявлялся в 17 (89,5%) случаях, в левой доле – в 2 (11,5%) случаях (рис. 4).
Рис. 4. Локализация абсцессов печени (%)
УЗИ больным с подозрением на абсцесс печени проводили в течение первых 3 суток от момента госпитализации. Степени тяжести состояния больных определяли при помощи шкалы SAPS II, в анализируемой группе среднее число баллов составило 41±1,18. Средний период диагностики составил 4,1±0,7 сут. (таблица).
Этиология абсцессов печени в клинической группе
Результаты исследования и их обсуждение
При УЗИ обычно выявляли увеличение размеров печени, образование округлой или неправильной формы с анэхогенной структурой содержимого, а по периферии имелась капсула повышенной эхогенности. В диагностике приоритетными являлись результаты УЗИ, по ним фактически определялась тактика лечения. При необходимости дифференциальной диагностики применялась КТ. Исходя из стадии формирования абсцессов бактериальной этиологии выделяют 3 возможные вариации эхоскопической картины.
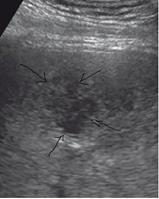
Первоначально при УЗИ в печени выявляется неоднородный, нечетко обозначенный фрагмент паренхимы повышенной эхогенности, внутри которой выделяется бесструктурный гипоэхогенный участок (стадия инфильтрации). В этой стадии в паренхиматозной ткани печени вероятно выявление участка сниженной яркости, который имеет разнородное строение и неотчетливые контуры, которые переходят в здоровую ткань. В центре этого участка мы наблюдаем анэхогенный бесструктурный участок некроза (рис. 5).
Такая картина может наблюдаться непродолжительный отрезок времени, буквально несколько часов, и уловить во время УЗИ ее удается редко.
Рис. 5. Эхограмма. Стадия некроза печени
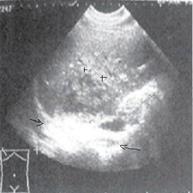
Со временем в зоне инфильтрации образуется полость с гноем, без четких границ, ее содержимое гипоэхогенное, чаще неоднородное (стадия абсцедирования). Характер содержимого полости связан с наличием гноя и тканевого детрита. В ткани печени, прилежащей к данному участку, имеется воспаление средней степени выраженности. Клинические проявления, соответственно, становятся более выраженными, что соответствует образованию гетерогенной жидкости (рис. 6).
Помимо свойственных для жидкостной структуры эхографических признаков («усиление» задней стенки, эффект боковых теней, эффект длительного псевдоусиления эхосигнала), обнаруживаются нестандартные показатели: внутреннее содержимое полости абсцесса обособляется, в связи с этим образуется граница «жидкость – жидкость» с горизонтальным уровнем, более плотная часть содержимого при этом находится ниже границы; у верхней стенки полости вероятно присутствие воздушных пузырьков в виде гиперэхогенных структур (они дают реверберирующий эффект – «хвост кометы»).
Рис. 6. 2-й вариант эхографической картины, стадия абсцедирования
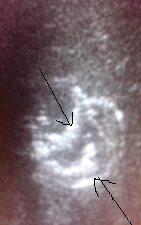
Третья стадия (хронизации процесса) характеризуется выявлением плотной, толстой пиогенной капсулы по контуру гнойника. При УЗИ мы наблюдаем хронический абсцесс печени, характеризующийся четкими контурами, центральной частью сниженной яркости, толстая стенка очага эхогенная, с явлениями кровотока. Также вероятно выявление кальцинированных компонентов в капсуле (рис. 7). Следовательно, выявление при УЗИ в печени очага обызвествления является возможным признаком обратного развития абсцесса.
Рис. 7. Стадия хронизации абсцесса печени
При проведении исследования с помощью аппарата УЗИ в абсцессах могут быть выявлены в различной степени акустические эффекты, которые присущи кистам. Также имеются такие особенные признаки абсцессов, как разграничение содержимого на два компонента: жидкость и осадок, в гнойной полости выявляются пузырьки воздуха (гиперэхогенные компоненты с реверберирующим эффектом на стенках полости), сдвиг содержимого гнойной полости, который фиксируется с помощью УЗИ.
Для проведения пункционных, УЗ-ассистированных методов лечения противопоказаниями являлись технические причины (отсутствие безопасной пункционной трассы) и тяжелые нарушения свертывающей системы крови.
Пациентам после постановки диагноза под местной анестезией и под контролем УЗИ производили чрескожно-чреспеченочную пункцию и дренирование места абсцесса. Для наглядного контроля при прицельных чрескожных пункциях и для введения дренажей пользовались ультразвуковыми аппаратами «Aloka 1000» и «Medison SonoAce» с конвексным и линейным датчиком с диапазоном частоты 3,5–10 МГц. Для более точного позиционирования пункционной иглы применялся биопсийный адаптер. Показания для выполнения пункционного лечения выставлялись при помощи ультразвуковой диагностики, пункция осуществлялась только под ультрасонографической навигацией, что позволяло проводить прицельную и безопасную пункцию. Для пункции применяли иглы с внешним диаметром 1,5 мм, длиной 15–20 мм.
Местная анестезия, которую применяли при пункционном лечении, является вполне достаточной. Место пункции зависит от пораженного сегмента печени, но чаще ее проводили по задней подмышечной линии. Нами был использован также добавочный доступ в XI–X межреберье между передней и средней подмышечными линиями справа для проведения пункционной манипуляции для более качественного промывания при полостях большого размера. Во время манипуляции производили максимальное удаление гноя из полости с последующим промыванием полости дезинфицирующим раствором (хлоргексидином, диоксидином). В послеоперационном периоде проводили антибактериальную, дезинтоксикационную и направленную на общее укрепление организма терапию.
Мы добились выздоровления всех 19 пациентов путем пункционной аспирации (12 человек) и катетеризации (в 7 случаях). При этом для санации внутрипеченочного гнойника 8 пациентам была достаточна однократная пункция, в 3 случаях потребовалась двукратная и в 1 – трехкратная.
Катетеризацию мы проводили чаще всего катетерами pig tail диаметром 8–12 Fr. При абсцессах менее 10 см в диаметре было достаточно дренирования одним микродренажом (5 больных). При абсцессах большого размера (диаметром более 10 см) и наличии выраженной капсулы мы выполняли двойное дренирование полости (2 случая, 10,5%).
Среднесуточное стояние дренажа у этих больных составило 8±1,4 сут.
В каждом случае мы проводили микробиологическое исследование извлеченной посредством пункции жидкости. При этом этиологическими факторами содержимого абсцесса выступали разнообразные микроорганизмы: гемолитический стрептококк, золотистый стафилококк, энтеробактерии, кишечная палочка, клебсиелла, анаэробные микроорганизмы. Нередко при посеве гноя выделяется смешанная флора. Во время выполнения процедуры эвакуации содержимого полость сокращалась на 60–75%. В динамике после катетеризации абсцесса печени в различные сроки наблюдали полное сокращение остаточных полостей. В проекции дренированного абсцесса жидкость не определяется, в ткани печени визуализируются два дренажа (рис. 8).
Рис. 8. УЗИ в динамике. В проекции дренированного абсцесса в ткани печени визуализируются два дренажа
Больные после первичной пункции находились под наблюдением хирурга поликлиники, в зависимости от общего состояния им выполнялись контрольное УЗИ и по показаниям повторные пункции. Интервал между пункциями определялся индивидуально в зависимости от ультрасонографической динамики, чаще через 1,5–2 месяца. Дренаж мы убирали, если по нему отсутствовало отделяемое после контрольного исследования с помощью аппарата УЗИ.
При пункции абсцессов наблюдалось 2 осложнения. При эвакуации содержимого абсцесса при помощи медицинского электроотсоса отмечалось необильное наружное кровотечение, остановленное при помощи тугого наполнения полости физиологическим раствором на 13–15 мин. В другом случае при пункции краевого абсцесса VI сегмента печени размерами более 12 см в диаметре был прорыв гноя в брюшную полость, что удалось ликвидировать при помощи лапароскопической санации.
1. Способ санации абсцессов печени с помощью пункции под контролем УЗИ обладает доступностью, эффективностью и низкой травматичностью. Данная методика повышает эффективность комплексного лечения, снижая интоксикацию и вероятность послеоперационных осложнений.
2. При небольших абсцессах печени (до 5 см в диаметре) пункция абсцесса в большинстве случаев оказывается достаточной для его санации, при абсцессах от 5 до 10 см в диаметре лечебный эффект может быть достигнут дренированием одним микродренажом, при диаметре абсцесса более 10 см в диаметре и выраженной капсуле полость предпочтительнее дренировать двумя катетерами.
3. Частота постманипуляционных осложнений при лечении абсцессов печени с помощью диапевтических технологий невысока, эти осложнения могут быть купированы без лапаротомии.
Возможности ультразвуковой диагностики абсцесса печени (клиническое наблюдение)
УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
Эпидемиология абсцессов печени изучена недостаточно. В разных странах показатели заболеваемости могут сильно отличаться, и составляют от 2,3 на 100 тыс. населения в Северной Америке до 275,4 на 100 тыс. на Тайване [3]. До начала эры антибактериальной терапии основной причиной развития абсцессов печени являлся острый аппендицит. Летальность была крайне высокой и составляла около 80%. С внедрением в клиническую практику антибиотиков и хирургических методов лечения этот показатель значительно снизился, оставаясь, однако, на уровне 10-40%. Параллельно изменилась и структура этиологических факторов абсцессов печени. На первый план стали выходить заболевания желчевыводящих путей и печени, злокачественные новообразования и осложнения инвазивных медицинских процедур [4, 5].
Этиология абсцессов печени гетерогенна. В качестве основных причин выделяют инфекционно-воспалительные заболевания, злокачественные новообразования, ятрогенные состояния и тупые травмы печени (см. таблицу). В развитых странах преобладают абсцессы бактериальной этиологии, в то время как в Юго-Восточной Азии и Африке наиболее частой их причиной остается амебиаз [3].
| Гематогенные абсцессы (портальные и артериальные) | Холангиогенные абсцессы | Абсцессы при заболеваниях печени | Ятрогенные причины и травмы |
|---|---|---|---|
| Сепсис | Холангит как следствие холедохолитиаза, стриктур, новообразований желчевыводящих путей, хронического описторхоза | Первичные злокачественные образования печени (аденокарцинома и др.) и метастатическое поражение печени | Чрескожные инъекции этанола Химиоэмболизация печеночной артерии Радиочастотная абляция образований печени |
| Воспалительные заболевания органов брюшной полости, ведущие к пилефлебиту: — аппендицит; — острый холецистит; — панкреатит; — дивертикулит; — болезнь Крона; — язвенный колит; — перитонит | Билиодигестивные анастомозы, свищи | Гранулемы печени | Оперативные вмешательства и эндоскопические процедуры на желчевыводящих путях и печени: — стентирование; — папиллосфинк-теротомия; — холедоходуоденостомия; — резекция печени; — ортотопическая трансплантация печени |
| Нарушение целостности кишечной стенки с последующим развитием бактериемии: — эндоскопическая полипэктомия; — неметастатический рак толстой кишки | Острый холецистит (гематогенный или прямой путь распространения инфекции) | Гематомы печени | Тупые травмы печени |
| Амебиаз |
Основными факторами риска развития печеночных абсцессов служат сахарный диабет, цирроз печени, иммунодефицитные состояния, пожилой возраст, мужской пол [4].
Несмотря на значительный прогресс медицины, критически важной остается ранняя и точная диагностика абсцессов печени. Трудности при трактовке клинической картины, результатов лабораторных и инструментальных методов исследования могут стать причиной поздней диагностики, несвоевременного начала лечения, развития тяжелых осложнений и, как следствие, неблагоприятного исхода заболевания. Так, по данным T. Pang и соавт., диагноз абсцесса печени удавалось установить в среднем через неделю после появления его первых симптомов [6].
Клинические проявления абсцессов печени неспецифичны и могут зависеть от их размера, количества и локализации. Большинство пациентов предъявляют жалобы на боль в правом подреберье, лихорадку и другие симптомы интоксикации (озноб, миалгию, слабость, потливость, тахикардию, тошноту, анорексию). Боль нередко усиливается при глубоком вдохе, перемене положения тела, может иррадиировать в правое плечо, лопатку, надплечье. При объективном обследовании может быть выявлена гепатомегалия. Иногда имеют место желтуха и асцит. На первый план часто выходит клиническая картина заболевания, приведшего к развитию абсцесса [2, 5-8].
Лабораторные показатели мало специфичны и отражают наличие активного воспалительного процесса. В общем анализе крови отмечаются лейкоцитоз, ускорение СОЭ. При биохимическом исследовании повышен уровень С-реактивного белка, билирубина, АЛТ, АСТ [1, 4].
Для определения этиологии абсцессов печени большое значение имеет бактериологическое исследование содержимого абсцесса и крови.
В ультразвуковой картине абсцесса печени имеется ряд особенностей, связанных со временем его существования. В фазе формирования при наличии соответствующих клинико-лабораторных данных в паренхиме печени можно выявить зону сниженной эхогенности с неоднородной структурой и нечеткими, переходящими в нормальную ткань контурами. В центральной части этой зоны сниженной эхогенности (зона интенсивного отека паренхимы) обычно выявляется анэхогенный бесструктурный участок, являющийся участком некроза ткани, пока без жидкостного компонента. Такая картина может наблюдаться непродолжительный отрезок времени (несколько часов). Впоследствии при параллельном нарастании клинических проявлений формируется жидкостьсодержащая анэхогенная полость с внутренним эхогенным содержимым, обусловленная наличием гноя и тканевого детрита. Помимо характерных для жидкостной структуры эхографических признаков (эффект усиления задней стенки, эффект боковых теней, эффект дистального псевдоусиления эхосигнала), наблюдаются некоторые особенные признаки: разделение содержимого полости абсцесса с образование границы «жидкость-жидкость» с горизонтальным уровнем, где более густая часть находится внизу; возможное появление в полости пузырьков воздуха (при наличии газпродуцирующей флоры, например род Klebsiella) в виде гиперэхогенных структур у верхней стенки, дающих эффект реверберации «хвост кометы»; перемещение всего внутреннего содержимого при изменении положения тела пациента; формирование четкого отграничения полости абсцесса от окружающей паренхимы печени в виде несколько неоднородного ободка (пиогенной оболочки) повышенной эхогенности толщиной 0,5-1,5 см [10].
В литературе нам встретилось описание ультразвуковой картины абсцесса печени в зависимости от преобладания инфильтративных или деструктивных изменений [11]. Авторы выделили два типа изображений абс цесса. Абсцессы I типа располагаются, как правило, в задних сегментах правой доли (VI, VII) и представляют собой участки паренхимы повышенной эхогенности различных размеров с нечеткими контурами неоднородной структуры с наличием очагов пониженной эхогенности или жидкостных образований неправильной формы, соответствующих участкам некроза. Такие абсцессы являются следствием воспалительной инфильтрации паренхимы при обострениях описторхозного холангита. Как показал опыт, учитывая преимущественно инфильтративный характер поражения, незначительный деструктивный компонент, эти абсцессы при своевременном обнаружении и адекватной антибактериальной терапии (лучше при внутрипортальном введении) могут быть излечены без оперативного вмешательства.
Абсцессы II типа являются следствием гнойного холангита, представляют собой неравномерно расширенные внутрипеченочные желчные протоки с утолщенными и уплотненными стенками, с наличием в просвете неоднородного эхогенного содержимого (гной, детрит). Для этих абсцессов характерны множественная локализация, небольшие размеры, связь с желчными протоками, стенки которых и являются стенками абсцессов. Абсцессы II типа развиваются из холангиоэктазов при длительной желчной гипертензии, обусловленной обструкцией протоков в результате склеротических изменений, стеноза большого дуоденального сосочка, обтурации описторхозным детритом.
Некоторые отличия может иметь эхографическая картина паразитарного абсцесса при амебиазе [10]. При попадании амеб развивается воспалительная инфильтрация с последующим формированием очагов некроза и лизиса печеночной ткани. При УЗИ вначале наблюдается умеренная, а затем и выраженная диффузно-очаговая неоднородность паренхимы печени со смешанной и преимущественно сниженной эхогенностью. Затем на этом фоне формируются гипоэхогенные участки неправильной формы различных размеров с неровными нечеткими контурами. В дальнейшем они образуют одну или несколько полостей, практически аналогичных по ультразвуковым признакам бактериальным абсцессам, но с рядом отличий: контуры обычно неровные с наличием «карманов», эхогенная оболочка вокруг абсцессов выражена нечетко, в полости абсцесса визуализируется неоднородное содержимое вплоть до наличия секвестров печеночной ткани и большого количества газов.
При прорывах абсцессов в брюшную, а иногда и плевральную полость, в забрюшинное пространство внепеченочно определяются скопления жидкости, аналогичной содержимому гнойника, может быть виден дефект капсулы печени.
Основным методом лечения абсцессов печени является их оперативное или чрескожное дренирование в сочетании с парентеральным введением антибиотиков 13. Терапией первой линии обычно является комбинация цефалоспорина III поколения с метронидазолом. При небольших размерах абсцессов (менее 3 см) может применяться только системная антибиотикотерапия. При амебных абсцессах препаратами выбора являются метронидазол и тинидазол [1, 2, 4].
Ключом к успешному ведению пациентов с абсцессами печени часто являются своевременная диагностика и лечение заболеваний, ставших причиной их развития.
Для иллюстрации приведенного выше краткого обзора представляем клиническое наблюдение.
Клиническое наблюдение
Пациент А., 1971 года рождения, инструктор по лечебной гимнастике. Обратился с жалобами на озноб, жар, слабость, отсутствие аппетита, незначительный неопределенный дискомфорт в правом подреберье.
Заболел за неделю до обращения в поликлинику, когда без видимой причины возникла острая «стреляющая» боль в надплечье и под лопаткой справа, усиливающаяся при дыхании. Пациент расценил боль как «мышечную». Провел сеанс лечебной гимнастики. Боль стихла. На следующий день возникла ноющая и колющая боль в правом подреберье с иррадиацией под правую лопатку, усиливающаяся при дыхании и движении. Температура тела повысилась до 37,8 °C.
На 3-й день после появления первых симптомов пациент обратился в поликлинику по месту жительства. При УЗИ органов брюшной полости выявлены признаки умеренной гепатомегалии, преимущественно правой доли печени, а в общем анализе крови отмечены лейкоцитоз до 14,6 • 109 /л и ускорение СОЭ до 59 мм/ч.
В последующие 4 дня боли в животе не возникали, однако нарастали слабость, анорексия, часто беспокоили жар и озноб. Сохранялась субфебрильная лихорадка. Принимал парацетамол. Обратился в нашу поликлинику.
Из анамнеза жизни известно, что пациент ведет здоровый образ жизни, не имеет вредных привычек. Три месяца назад выезжал в Японию, а около трех лет назад посещал Индию. Во время поездок и после них ничем не болел.
На момент обращения состояние средней тяжести. Температура тела 38,4 °C. Кожные покровы бледно-розового цвета. Подкожножировая клетчатка развита умеренно. Отеков нет. Периферические лимфатические узлы не пальпируются. В легких дыхание везикулярное, ослаблено справа в нижних отделах, хрипов нет. Тоны сердца ритмичные, ясные. АД 120/75 мм рт.ст. Пульс 102 уд/мин.
Живот не увеличен, участвует в акте дыхания, при поверхностной пальпации мягкий, безболезненный. Нижний край печени перкуторно у края реберной дуги. При пальпации печень мягкоэластической консистенции, безболезненная. Симптомы Ортнера и Мерфи отрицательные. Однако при глубокой пальпации в правом подреберье возникала колющая боль в правом надплечье. Френикус-симптом отрицательный с обеих сторон.
Стул один раз в день, оформленный, коричневого цвета, без патологических примесей. Мочеиспускание свободное, безболезненное.
Для уточнения диагноза пациенту было выполнено УЗИ органов гепатобилиарной зоны с ультразвуковой ангиографией:
Рис. 1. В-режим. В правой доле печени в проекции V сегмента визуализируется образование сниженной эхогенности с нечеткими контурами выраженно неоднородной структуры с наличием в центральных отделах участка умеренно повышенной эхогенности неоднородной структуры.
Абсцесс печени
Заболевание, которое развивается вследствие гнойного воспаления тканей печени. Образование может быть единичным или множественным и развиваться вследствие разнообразных причин.
Причины
Основной причиной абсцесса является инфекция (бактерии, паразиты), которая попадает в печень гематогенным путем (с током крови), с
инфицированной жёлчью при воспалении желчных протоков (холангит), иногда абсцессы являются следствием травмы печени.
Факторы риска
Симптомы
На начальной стадии характерно бессимптомное течение заболевания.
На более поздних стадиях наблюдаются боли в правом подреберье и симптомы интоксикации: лихорадка, учащенное сердцебиение, общая слабость, тошнота, рвота.
Осложнения
Абсцесс печени опасен перфорацией, развитием перитонита или перикардита и значимой кровопотери, сдавлением желчных протоков с развитием механической желтухи, сепсиса.
Диагностика
Лечение
Определяется лечащим врачом-хирургом.
Большинство абсцессов печени возможно вылечить с использованием минимально инвазивных технологий: пункции и дренирования полости абсцесса. Как правило, в процессе лечения назначаются антибиотики.
Выбор антибиотика определяется причиной абсцесса, а также результатами исследования выделенных из гноя бактерий на чувствительность к тем или иным антибиотикам. Такое лечение бывает эффективным при абсцессах, имеющих единую гнойную полость.
Нередко абсцессы представляют собой многокамерные жидкостные образования. Излечить такие абсцессы с помощью чрескожно устанавливаемых дренажей существенно сложнее. Мелкоячеистая структура абсцесса в виде «пчелиных сот», зачастую, исключает возможность дренажного лечения и предполагает необходимость выполнения резекции печени. Современные возможности развития хирургии печени позволяют и такие операции выполнять с применением минимально инвазивных технологий: резекцию печени можно выполнить лапароскопически.
В любом варианте течения заболевания лечение целесообразно проводить в стационаре, специализированном на хирургии печени и имеющим опыт минимально инвазивных вмешательств на печени. При условии своевременного хирургического вмешательства- прогноз благоприятный.
Основные рекомендации
Успех лечения и риск рецидива заболевания во многом определяются полноценностью устранения причины формирования абсцесса. Это особенно актуально для пациентов с холангиогенными абсцессами, возникающими в результате абсцедирующего холангита. В связи с этим пациенты с холангиолитиазом и стриктурами жёлчных протоков после хирургического лечения должны находится под постоянным наблюдением хирурга, специализирующегося в лечении хирургических заболеваний печени. Наблюдение предполагает регулярное (1 раз в 3-6 мес. выполнение УЗИ брюшной полости и сдачу анализов крови).
Паразитарные абсцессы требуют длительного диспансерного наблюдения за больными в течение 1-2 лет, даже при условии выздоровления после оперативного вмешательства и специфического лечения.
У большинства пациентов абсцессы возникают в результате гематогенного распространения инфекции из первичного очага, который зачастую остается невыявленным (кариозные зубы, хронические воспалительные заболевания различных органов и др.). Тем не менее, именно при таких абсцессах в случае их успешного лечения риск повторного возникновения абсцесса в печени относительно невысок. Пациентам следует находится под наблюдением хирурга ближайшие нескольких месяцев после лечения.
Отсутствие рецидива заболевания в течение года и более существенно снижает риск повторного возникновения болезни.