Глиома low grade что это
Глиома головного мозга: симптомы и лечение
Глиома головного мозга представляет собой наиболее часто встречающийся вид опухоли, растущий из глиальной ткани, которую составляют вспомогательные клетки нервной системы. На долю глиом приходится около 60% всех опухолей, локализованных в головном мозге. Название разновидностей глиом – астроцитом, эпендимом и других происходит от названия клеток, образующих опухоль.
Услуги по диагностике и лечению глиомы головного мозга предлагает ведущий многопрофильный медицинский центр Москвы – Юсуповская больница. Положительные результаты лечения достигаются благодаря высокому профессионализму врачей центра онкологии и передовым технологиям, которые применяются для борьбы с опухолями головного мозга.
Классификация
Степени
Существует классификация ВОЗ, согласно которой глиомы подразделяются на четыре степени:
Симптомы
Симптоматика глиомы головного мозга зависит от локализации опухоли, её размеров, она состоит из общемозговых и очаговых симптомов.
Наиболее часто глиома головного мозга проявляется упорными и постоянными головными болями, при которых у больных возникает тошнота и рвота, после которой не наступает облегчение, а также судорожным синдромом.
Помимо этого, в зависимости от того, какой отдел мозга поражен глиомой, у больных нарушается речь, ослабевают мышцы, может наблюдаться появление парезов и параличей рук или ног, лица и других частей тела. Может нарушаться зрительная или осязательная функция, координация походки и движений.
Может измениться психика, часто отмечается развитие поведенческих расстройств. Кроме того, у больных с глиомами мозга нарушается память и мышление. Вследствие нарушения циркуляции ликвора развивается внутричерепная гипертензия и гидроцефалия.
Диагностика
Диагностика глиомы головного мозга основывается на результатах тщательного неврологического обследования и других специальных диагностических исследований.
В первую очередь врач центра онкологии Юсуповской больницы проводит оценку состояния рефлексов и кожной чувствительности, двигательной функции конечностей. При наличии жалоб больного на ухудшение зрительной функции ему назначается консультация врача-офтальмолога.
Нервно-мышечная система оценивается с помощью инструментальных методов диагностики – электромиографии и электронейрографии. Кроме того, проводится люмбальная пункция, позволяющая выявить атипичные клетки в цереброспинальной жидкости. Данное исследование применяют также для проведения вентрикулографии и пневмомиелографии.
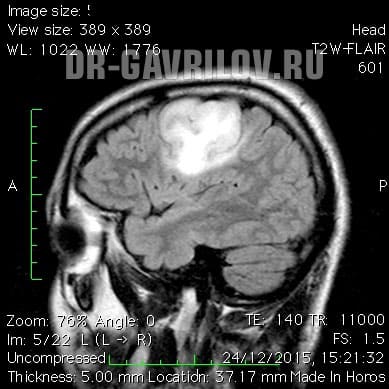
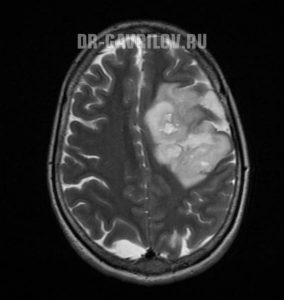
Огромное значение в диагностике опухолей мозга имеют современные методы визуализации, обеспечивающие получение послойного изображения тканей головного мозга. К ним относят компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ). Данные исследования считаются довольно безопасными и очень информативными, с их помощью определяется локализация, размер, форма и структура новообразования.
Для определения смещения срединных структур головного мозга проводится ультразвуковое исследование мозга (М-эхо).
Дополнительно может быть назначено проведение церебральной контрастной ангиографии (рентгеновского исследования сосудов мозга), электроэнцефалографии, сцинтиграфии и ПЭТ.
Лечение
Как любое злокачественное опухолевое образование, глиома головного мозга лечится тремя основными методами, которые используются в современной онкологии, – с помощью хирургического вмешательства, лучевой терапии (в том числе радиохирургии) и химиотерапии.
Золотым стандартом лечения глиомы головного мозга является хирургическое лечение. При условии операбельности опухоли проводится операция по удалению новообразования.
До операции и после неё проводится лучевая терапия. При неоперабельных опухолях (если глиома локализована в труднодоступном месте) данный метод применяется как отдельный. На сегодняшний день традиционную лучевую терапию заменила стереотаксическая – радиохирургия.
Химиотерапевтическое лечение глиомы может применяться как в дооперационный, так и в послеоперационный период.
Хирургическое лечение
Операция по удалению злокачественной глиомы является открытой, предполагающей трепанацию черепа, при которой вскрывается черепная коробка. Основная цель хирургического вмешательства – удалить максимальный объем опухоли, оставив нетронутыми здоровые ткани головного мозга, тем самым предотвращая неврологические нарушения. Определенная локализация глиом позволяет достичь эффекта хирургического лечения до 98%.
Ни одна операция по удалению опухоли не гарантирует стопроцентного результата, так как всегда имеется вероятность, что в тканях головного мозга остались раковые клетки. Однако хирургическое вмешательство обеспечивает устранение сдавления окружающих тканей головного мозга и симптоматики глиомы, а также восстановление циркуляции ликвора, если имеется внутричерепная гипертензия.
Эффективность хирургического лечения глиомы мозга во многом зависит от мастерства и опыта оперирующих специалистов. Лечение опухолей головного мозга в центре онкологии Юсуповской больницы проводится с применением высокоточных томографов и нейронавигаторов, благодаря чему вероятность развития рецидива заболевания сводится к минимуму.
Лучевая терапия
Проведение лучевой терапии может быть назначено перед хирургическим вмешательством для уменьшения размеров опухоли перед её иссечением, либо после операции для уничтожения всех оставшихся опухолевых клеток.
Кроме того, данный метод может использоваться как самостоятельный при локализации опухоли в труднодоступном месте, что препятствует её хирургическому удалению. В таком случае лучевая терапия не способствует полному уничтожению опухоли, однако может значительно приостановить её рост.
Традиционная лучевая терапия сопровождается рядом нежелательных эффектов: у больных возникает тошнота, снижается аппетит, повышается утомляемость. В месте лучевого воздействия высока вероятность выпадения волос и развития лучевого дерматита. Как правило, побочные действия лучевой терапии проявляются через 10-14 дней после облучения.
Кроме того, известны и поздние осложнения радиоактивного облучения – у пациентов нарушается память в разной степени, может развиться радиационный некроз (вокруг омертвевших тканей опухоли образуется рубцовая ткань).
Радиохирургия
Ввиду того, что хирургическое лечение опухолей головного мозга не является гарантом полного излечения, после операции может случится рецидив заболевания. Поэтому целесообразно применение дополнительных методов лечения – лучевой терапии и химиотерапии. Как правило, рецидивы локализуются на границах здоровой ткани с областью, где было удалено новообразование. В таких случаях рекомендуется использовать радиохирургию: кибер-нож, гамма-нож, новалис.
Радиохирургия является инновационной методикой лучевой терапии, суть которой заключается в облучении глиомы пучком радиации с различных углов, что обеспечивает попадание радиации на опухоль и минимальное облучение мягких тканей.
В ходе процедуры положение головы больного и локализация опухоли постоянно контролируется с помощью компьютерной или магнитно-резонансной томографии, благодаря чему пучок радиации направляется исключительно на злокачественное новообразование.
Данный метод отличается неинвазивностью, так как никаких разрезов для его выполнения не требуется. Благодаря этому отсутствует риск развития интраоперационных осложнений и побочных эффектов, связанных с традиционной лучевой терапией.
Важно понимать, что эффект от лучевой терапии наступает постепенно, в отличии от хирургического вмешательства. Однако радиохирургия зачастую является единственным альтернативным методом лечения неоперабельных глиом головного мозга.
Лечение глиомы в Юсуповской больнице
Врачи-онкологи Юсуповской больницы владеют колоссальным опытом и эффективными методиками лечения онкологических недугов. Для каждого пациента составляется индивидуальная программа лечения, основанная на результатах тщательного диагностического обследования. Центр онкологии Юсуповской больницы оснащен инновационным оборудованием для проведения качественной диагностики и лечения глиом и других опухолей головного мозга.
Запись на консультацию онколога проводится по телефону Юсуповской больницы или онлайн на сайте через форму обратной связи. Врач-координатор ответит на все ваши вопросы и расскажет о стоимости медицинских услуг и условиях госпитализации пациента.
Лечение глиомы головного мозга
Содержание:
Глиома – опухоль головного мозга, которая берет начало из клеток нейроглии. Новообразования являются наиболее распространенным видом патогенеза злокачественного характера различной степени агрессивности. Симптомы глиомы у взрослых и детей будут зависеть от места ее образования. Основными методами диагностики являются КТ и МРТ, самый точный результат получают при проведении цитогистологического анализа отобранного материала (биопсия). Основной метод лечения глиомы головного мозга – хирургическое удаление патологического новообразования. Лечение всегда носит комплексный характер, кроме операции назначается химио- и радиотерапия. Восстановление и продолжительность жизни после удаления опухоли зависит от многих факторов: адекватности лечения, степени злокачественности новообразования головного мозга, стадии заболевания, общего состояния больного и многих других факторов. Наилучший прогноз имеют доброкачественные глиомы, наихудший – глиомы 3 и 4 степени злокачественности. Например, при глиобластоме продолжительность жизни, как правило, не более двух лет.
Происхождение глиом головного мозга и характеристика
До сих пор нет единого мнения насчет того, какие именно клетки дают начало глиальным опухолям. Классическое мнение основано на том, что глиомы развиваются из зрелых клеток глии (олигодендроцитов и астроцитов). В последнее время больше склоняются к тому, что они образуются в так называемых «промежутках злокачественности». Это значит, что опухоли головного мозга данного типа формируются из незрелых медленно пролиферирующих клеток, которые постепенно малигнизируются (перерождаются в рак). Как именно будет развиваться новообразование зависит от трансформаций в геноме, например, астроцитомы (разновидность глиомы) формируются при мутациях в гене TP53,
Доля глиом в общей популяции опухолей головного мозга составляют около 60%. Чаще всего новообразования формируются в головном мозге, имеют первичный характер. Глиома ствола головного мозга диагностируется сравнительно редко. Цвет неоплазий от темно-красного до нежного розового, форма в большинстве случаев напоминает круг или веретено, но может иметь и неправильные очертания. Величина зависит от стадии болезни: от нескольких миллиметров до 10-14 см.
Наиболее частым местом локации опухоли является зона хиазм или мозговых желудочков. Доброкачественная глиома, как правило, не распространяется на костные структуры черепа и не прорастает в оболочки головного мозга, однако, этого нельзя исключать. Злокачественная глиома растет сначала медленно, но по мере прогрессирования канцерогенеза, ее рост ускоряется. Характерен инфильтративный рост, т. е. способность врастать в соседние ткани, что при диагностике не позволяет определить четкие границы патогенного очага.
Обратите внимание. Для глиом головного мозга не характерно метастазирование, однако, они приводят к вырождению соседних тканей.
Причины возникновения и факторы риска
Рак и доброкачественные дисплазии могут формироваться в головном мозге в любом возрасте, однако вероятность развития патологии увеличивается по мере взросления. Общий пик заболеваемости приходится на седьмой десяток лет. Опухолевый процесс чаще развивается у мужчин, нежели у женщин.
Основные причины возникновения глиомы головного мозга, следующие:
Важно. Специфической профилактики против рака головного мозга нет. Уменьшает вероятность развития опухолевого процесса минимизация факторов риска, здоровый образ жизни, качественное питание, регулярные занятия спортом и спокойный эмоциональный фон.
Классификация
Зависимо от вида клеток головного мозга, которые переродились и дали начало патогенезу, различают следующие виды опухолей:
По классификации ВОЗ (которая является общепринятой) неоплазии ранжируют зависимо от степени злокачественности.
Доброкачественные глиомы
Это опухоли первой степени злокачественности, например, астроцитомы: гигантоклеточная, пилоцитарная, ювенильная субэпендимальная. Они являются доброкачественными, потому что медленно растут, не имеют признаков рака, легко поддаются лечению. Прогноз жизни при доброкачественной глиоме благоприятный. После удаления новообразования пациенты живут 10 лет и дольше.
Глиома низкой степени злокачественности
Вторая степень злокачественности. Ее также относят к доброкачественным новообразованиям, но уже с пограничной степенью злокачественности. Рост патологической ткани медленный (low-grade), они хорошо дифференцированы, как правило, есть только один признак рака (атипия клеток). Опухоли данного вида могут перерождаться в рак и легко переходить на третью и четвертую степень злокачественности. К ним относятся диффузная и фибриллярная астроцитомы. Лечение комплексное: операция по удалению атипичных тканей, дополнительно радио- и химиотерапия.
Злокачественные глиомы
Сюда относят глиомы 3 и 4 степени злокачественности:
Неоплазии делят на два вида, зависимо от особенностей роста:
Симптоматика
Клинические проявления подразделяют на общие и очаговые. Последние проявляются зависимо от того, в каком отделе мозга формируется патологическое образование.
Общие симптомы
Общие признаки рака головного мозга (или доброкачественной опухоли) возникают по причине увеличения давления внутри черепа, сдавливания телом опухоли соседних тканей и негативного влияния ее метаболитов. К общим симптомам относят:
Важно понимать. Что общие симптомы не являются специфичными. Если они беспокоят регулярно, нужно срочно посетить врача.
Патологический процесс на ранних стадиях, как правило, протекает латентно или признаки его слабы. Часто новообразования находят случайно, при обследовании пациента на предмет другой болезни или в профилактических целях.
Очаговые симптомы
Это специфические признаки, возникающие в результате поражения церебральных структур ЦНС. Клиническая картина зависит от места локации патологического очага:
Диагностика
После устной беседы и физикального осмотра (изучается координация, состояние психики, работа анализаторов и другие внешние признаки) больной обследуется при помощи:
Наиболее достоверный метод – биопсия (забор ткани выполняется при удалении рака или стереотаксической биопсии). Гистологический анализ образцов ткани дает полное представление о виде новообразования и всех его особенностях.
Лечение глиомы головного мозга
Хирургическое удаление глиомы головного мозга – является основным методом выбора. Лечение всегда носит комплексный характер. Результаты операции подкрепляются назначением радио и химиотерапии (до и после операции). Как правило, операция по удалению глиом дает хороший результат только в случае неоплазий доброкачественного характера, находящихся на первой стадии патогенеза. В это время удается произвести полное удаление аномальных тканей.
В других случаях это сделать трудно или невозможно. Патологические ткани прорастают в соседние, их границы четко неразличимы, поэтому контур опухоли не поддаётся идентификации, например, при диффузных типах рака. Вне зависимости от метода выполнения операции: радикального (трепанация или резекция черепа) или малоинвазивного (стереотаксические методики и другие), их смысл остается неизменным – важно постараться удалить всю патологическую ткань (тотальное удаление) или ее большую часть (субтотальное).
Чаще данные опухоли обнаруживаются на прогрессирующем этапе развития, что не дает возможности выполнить тотальное удаление. В таком случае основным методом лечения становится радиотерапия, например, так осуществляется лечение диффузной глиомы ствола мозга. Противопоказаниями к проведению операции может быть наличие других видов рака, слабое здоровье пациента или его преклонный возраст, близость рака к жизненно важным структурам, прорастание неоплазии в оба полушария, локация с трудным доступом.
Период восстановления и прогноз жизни
Период восстановления после удаления глиомы головного мозга будет зависеть от многих факторов. Самые главные из них: качество новообразования, стадийность, успех оперативного лечения и общее состояние больного. Если говорить в целом, то прогноз жизни при глиоме неблагоприятный. При субтотальном удалении опухоли существуют высокие риски рецидива, поэтому продолжительность жизни после операции на глиоме головного мозга при частичном ее удалении невысока. Полное удаление возможно на первой стадии доброкачественной опухоли. Около 80% больных проживают дольше пяти лет при условии тотального иссечения опухоли первой степени злокачественности. При рецидиве глиомы 3 или 4 степени злокачественности прогноз не превышает двух лет.
Глиомы головного мозга


ГЛИАЛЬНЫЕ ОПУХОЛИ ГОЛОВНОГО МОЗГА
Глиомы развиваются из нейроэпителиальных (глиальных) клеток, которые входят в состав ткани головного мозга.
Впервые глиальные клетки были отнесены в отдельную группу элементов нервной системы в 1871 году.
Глиальные клетки можно разделить на 4 основных типа: клетки эпиндемы, микроглии, олигодендроциты и астроциты.
Доброкачественная опухоль растет медленно, и оказывает неблагоприятное действие на окружающие ткани, сдавливая их. Злокачественная опухоль имеет агрессивно- быстрый рост, разрушая окружающие ткани, рорастая сосуды и ткани, инфильтрируя ткань головного мозга, не имеющей четких границ.
Глиомы развиваются из:
Классификация глиальных опухолей
В настоящее время существует множество классификаций глиальных опухолей
Доброкачественные опухоли медленно растут, редко инфильтруют окружающие ткани, вред, который они наносят, как правило, связан с компрессией окружающих тканей и структур головного мозга. Очень большая доброкачественная глиома может создавать опасность для жизни пациента, в той же мере, что и злокачественная.
Классификация ВОЗ (Всемирной Организации Здравоохранения) считается самой удобной и используется чаще других
В основе этой классификации лежит 4 основных признака:
Тип глиальной опухоли
Первая степень злокачественности
Признаков злокачественности нет.
Ювенильная астроцитома, субэпендимальная астроцитома, пилоцитарная астроцитома
Вторая степень злокачественности
Один признак злокачественного заболевания, чаще всего, атипия клеток. Эти опухоли хорошо дифференцируются, темп их роста медленный (low-grade), имеют доброкачественный характер
Диффузная астроцитома, фибриллярная астроцитома
Третья степень злокачественности
Четвертая степень злокачественности
Все признаки злокачественного заболевания и некроз тканей
Согласно классификации Всемирной организации здравоохранения (World Health Organization) глиомы можно разделить по степени их злокачественности.
Опухоли первой степени имеют благоприятный прогноз, так как они медленно растут (почти стопроцентная пятилетняя выживаемость). Опухоли четвертой степени имеют плохой прогноз и минимальную выживаемость, мало кто из больных остается в живых через год после хирургического вмешательства.
Клинические проявления заболевания зависят сразу от нескольких факторов:
Обычно все опухоли глиальной ткани вызывают неврологическую симптоматику:
На долю глиом приходится 50% всех первичных опухолей головного мозга.
Хирургическая резекция глиом – это основной метод лечения
Лучевая и химиотерапия – это дополнительные методы к лечению глиом
Радиохирургия методика «Гамма –нож» применяется при остаточном объеме или рецидиве опухоли, после ранее проведенных операций, лучевой терапи, при условии наличия четких границ опухолевой ткани размером не более 3,0 см в наибольшем измерении и общем состоянии пациента по индексу шкалы Карновского не менее 70 баллов
Рис. 1 Методика «Гамма-нож» в лечении астрацитома (Graed II) в до и послеоперационном периоде через 14 месяцев.
Метод «Гамма-ножа» может использоваться в лечении глиальных опухолей но при определенных условиях, о которых Вы можете узнать у специалиста
О больнице
Учредителем Бюджетного учреждения Ханты-Мансийского автономного округа – Югры «Окружная клиническая больница» является Ханты-Мансийский автономный округ – Югра. Дата государственной регистрации – 7 августа 2012 года.
Глиома low grade что это
ГУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Башкортостан, Уфа
ГБУЗ «Башкирский республиканский клинический онкологический диспансер», Уфа
Факторы прогноза и подходы к лечению диффузных глиом низкой степени злокачественности
Журнал: Онкология. Журнал им. П.А. Герцена. 2015;4(6): 83-89
Борисов К. Е., Сакаева Д. Д. Факторы прогноза и подходы к лечению диффузных глиом низкой степени злокачественности. Онкология. Журнал им. П.А. Герцена. 2015;4(6):83-89.
Borisov K E, Sakaeva D D. Prognostic factors for low-grade diffuse gliomas and approaches to their treatment. P.A. Herzen Journal of Oncology. 2015;4(6):83-89.
https://doi.org/10.17116/onkolog20154683-89
ГУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Башкортостан, Уфа
В обзоре рассмотрена роль прогностических факторов при глиомах низкой степени злокачественности у взрослых пациентов. Оценено влияние морфологии опухоли, ее размера и объема резекции на выживаемость пациентов. Представлены данные об эффективности лучевой терапии, химиотерапии и комбинированного лечения.
ГУЗ «Республиканский клинический онкологический диспансер» Минздрава Республики Башкортостан, Уфа
ГБУЗ «Башкирский республиканский клинический онкологический диспансер», Уфа
Понятие «глиомы низкой степени злокачественности» (ГНСЗ) объединяет различные типы медленно растущих глиом головного и спинного мозга, которые имеют I или II степень злокачественности по классификации ВОЗ [1]. ГНСЗ составляют около 10—15% всех глиом у взрослых и около 50% у детей [2], причем у детей чаще встречаются пилоцитарная астроцитома и другие глиомы I степени злокачественности, а у взрослых преобладают диффузные ГНСЗ II степени злокачественности, прежде всего астроцитарного ряда (диффузная астроцитома — ДА и олигоастроцитома — ОА), на долю которых приходится до 75% всех диффузных ГНСЗ взрослых.
Выживаемость без прогрессирования (ВБП) у пациентов с диффузными глиомами составляет 7,7—18% в течение 10 лет, общая выживаемость (ОВ) — 48—63% в течение 10 лет и 22% к 20 годам наблюдения [3—5]. Однако существует большая вариабельность в течении ГНСЗ от индолентного до агрессивного с выживаемостью, сопоставимой с выживаемостью при анапластических опухолях ВОЗ grade III. На выживаемость влияют многие факторы, среди которых возраст, общесоматический статус, размер и морфологическое строение опухоли, объем операции.
Морфологическое строение опухоли
Олигодендроглиальные опухоли (ОДО) считаются более благоприятными, чем астроцитарные, особенно при наличии характерной для ОДО транслокации 1p19q: медиана ОВ больных с ГНСЗ при наличии данной мутации вдвое выше, чем при ее отсутствии (80 мес против 41 мес) [6]. В свою очередь ДА, самая частая опухоль ВОЗ grade II, делится на несколько гистологических подтипов: фибриллярная астроцитома встречается у 65,2% больных, протоплазматическая — у 5,8% и гемистоцитарная — у 29%. Больные с гемистоцитарной астроцитомой достоверно старше, чем больные с фибриллярным и протоплазматическим вариантами (46,7 года против 37,7 года), чаще подвергаются послеоперационной лучевой терапии (ЛТ) (р=0,0001), почти всегда имеют мутацию ТР53. Их выживаемость существенно ниже, чем у больных с другими подтипами астроцитом (38 мес против 82 мес, p=0,0001), т. е. астроцитарная, особенно гемистоцитарная, гистология ассоциирована с плохим прогнозом (р=0,074) [7].
Возраст
У пациентов старше 55 лет ГНСЗ протекают более агрессивно. У них чаще наблюдается неврологический дефицит, низкий общесоматический статус, бо́льший размер опухоли, меньший объем оперативного лечения (ОЛ) [8]. У этой категории больных преобладает астроцитарная гистология. Так, по данным клиники Мейо [9], ДА была диагностирована у 69% больных, ОА — у 22%, ОД — лишь у 9%. Медиана ВБП составила 2,1 года, медиана ОВ — 2,7 года, 5- и 10-летняя ОВ — 31 и 18% соответственно. При этом медиана ОВ больных с ДА была всего 2,1 года, в то время как у больных с ОД она достигала 9,3 года. Близкие показатели выживаемости пожилых людей приводятся и в других исследованиях: медиана ВБП в районе 1,5 года [10], а медиана ОВ — 2,3 года [11]. Таким образом, все авторы делают заключение о более злокачественном течении глиом ВОЗ grade II у пожилых людей. Вопрос о целесообразности в данной ситуации максимально возможного ОЛ с последующей адъювантной терапией остается дискутабельным, поскольку в некоторых исследованиях [9, 10] не было выявлено статистически достоверного улучшения выживаемости пожилых больных при увеличении объема операции и использовании адъювантной ЛТ.
Исходный размер опухоли, объем операции, размер резидуальной опухоли
Большинство авторов указывают, что исходный размер опухоли, объем резекции и объем резидуальной опухоли являются ключевыми факторами прогноза. Так, М. Berger и соавт. [12] ретроспективно проанализировали результаты лечения 53 пациентов и обнаружили, что у больных с исходным объемом опухоли менее 10 см 3 не отмечалось прогрессирования в течение 4 лет, независимо от размера остаточной опухоли. По данным J. Smith и соавт. [13], 5-летняя ВБП при исходном объеме опухоли менее 25 см 3 составляет 72%, при объеме 25—50 см 3 — 62%, а при объеме более 50 см 3 — 38%.
В настоящее время не существует рандомизированных исследований, изучавших влияние объема операции на выживаемость больных с ГНСЗ, поэтому тактика лечения базируется на данных ретроспективных исследований, мнении экспертного сообщества и описании отдельных случаев [14]. В течение длительного времени у молодых, соматически здоровых пациентов с минимальной симптоматикой считалась оправданной тактика «наблюдай и жди», при которой оперативное лечение откладывалось до прогрессирования заболевания. Такая тактика основывалась на результатах нескольких ретроспективных исследований [15, 16], в которых было показано, что отсрочка оперативного лечения не влияет на выживаемость и качество жизни пациентов. Тем не менее известно, что длительное существование ГНСЗ является фазой, предшествующей анапластической трансформации опухоли, и может повлиять на выживаемость. Популяционное исследование в Норвегии показало, что 5-летняя ОВ при раннем хирургическом вмешательстве составила 74%, а при тактике «наблюдай и жди» 60% (HR 0,56, р=0,03) [17]. Таким образом, решение об операции должно приниматься с учетом многих факторов, среди которых возраст, общесоматический статус и предпочтения пациента, локализация и размер опухоли.
В исследовании J. Smith и соавт. [13], в которое были включены 216 больных с ГНСЗ (43% — ДА, 57% — ОД/ОА), все больные, которым была выполнена полная резекция опухоли, оставались свободны от прогрессирования, по крайней мере, 4,5 года. У остальных больных объем резидуальной опухоли прямо коррелировал с частотой рецидивов и обратно коррелировал с длительностью ВБП. Полное удаление опухоли обеспечивало вполне удовлетворительные показатели выживаемости даже без всякого адъювантного лечения. При резекции опухоли на 90% и более 5- и 8-летняя ОВ составила 97 и 91% соответственно, а при операциях меньшего объема лишь 76 и 60% соответственно.
Еще несколько исследований продемонстрировали аналогичные результаты. В частности, в исследовании II фазы RTOG 9802 [18] (111 больных, 55% — ДА/ОА, 45% ОД) 2- и 5-летняя ВБП составила соответственно 82 и 48%, 2- и 5-летняя ОВ — 99 и 93%. При резидуальной опухоли диаметром менее 1 см риск рецидива в течение 5 лет составил 26%, 1—2 см — 68%, а при диаметре более 2 см — 89%.
В исследовании, проведенном в Японии, были проанализированы результаты хирургического лечения ГНСЗ в зависимости от объема резекции у 153 больных (32% — ДА, 68% — ОД/ОА) [19]. Было показано, что при удалении более 90% объема опухоли 5-летняя ВБП составила 76% с медианой 9 лет, в то время как при операции меньшего объема лишь 35,3% с медианой 4,7 года (р 3 5-летняя ВБП наблюдалась у 73% больных с медианой 8,6 года, при опухоли бо́льшего объема лишь у 12% с медианой 3,6 года (р 3 ¾ больных остаются свободными от рецидива более 5 лет, а 91—97% больных живы 8 лет и более. Однако это утверждение справедливо не для всех ГНСЗ. При более детальном анализе выяснилось, что выигрыш в выживаемости при большом объеме операции и минимальном размере резидуальной опухоли имеют только больные с астроцитарными опухолями, но не больные с олигодендроглиомами. Возможно, это связано с тем, что клетки ОД проникают на 10—26 мм от видимого при МРТ края опухоли [21], что ведет к переоценке объема резекции, или же с тем, что ОД в принципе демонстрируют менее агрессивную биологию с более длительной выживаемостью пациентов, что умаляет значение расширенного хирургического лечения.
Исходя из вышеизложенного, при лечении диффузных ГНСЗ, особенно астроцитом, необходимо стремиться к максимально возможному объему резекции опухоли, если это технически возможно и не грозит существенным увеличением неврологического дефицита. Современные хирургические технологии базируются на новом подходе к лечению ГНСЗ — «онкофункциональном балансе» [22]. Используются такие методики, как нейронавигация, пре- и интраоперационное картирование, что позволяет выполнять операции в соответствии с индивидуальной архитектоникой мозга, минимизируя до 2% риск перманентного неврологического дефицита и сохраняя высокое качество жизни (КЖ) пациентов. Хотя хирургическое лечение приводит к некоторому временному ухудшению неврологического статуса, большинство пациентов полностью восстанавливаются в течение 3 мес. Для уменьшения повреждения активных областей мозга во время хирургического вмешательства возможно проведение операции у пациента в сознании. Влияние такой методики на КЖ пациентов крайне незначительно: по 10-сантиметровой шкале уровень боли возрастал с 1,3 всего лишь до 2,1 см, а уровень тревожности с 2,2 до 2,6 см. Таким образом, переносимость данного вида хирургического вмешательства очень хорошая, хотя и требуется адекватное обезболивание и соответствующая подготовка пациентов для снижения тревожности и максимальной кооперации с персоналом [23].
Суммируя данные о влиянии различных прогностических факторов, EORTC провела анализ выживаемости у больных с глиомами II степени злокачественности на основании данных исследований EORTC 22844 и EORTC 22845. В результате основными факторами неблагоприятного прогноза названы: возраст старше 40 лет, астроцитарное происхождение опухоли, исходный размер опухоли 6 см и более, распространение опухоли через мозолистое тело на противоположное полушарие, наличие неврологического дефицита до операции. При наличии одного—двух факторов неблагоприятного прогноза медиана ОВ пациентов составила 7,7 года, а при наличии 3 факторов и более — 3,2 года [24].
В 2008 г. группа ученых из Калифорнийского университета Сан-Франциско (UCSF) предложила новую прогностическую модель [25], в которой значимыми факторами неблагоприятного прогноза указывались: возраст старше 50 лет, статус Карновского 80% и менее, исходный размер опухоли более 4 см, вовлечение так называемой «eloquent cortex», т. е. отделов коры, отвечающих за сенсорную, моторную и речевую функции. При стратификации пациентов на группы низкого (0—1 фактор), промежуточного (2 фактора) и высокого (3—4 фактора) риска 5-летняя ВБП составила 76, 49 и 18% соответственно, а 5-летняя ОВ — 97, 81 и 56% соответственно. Включение в число неблагоприятных прогностических факторов поражения «eloquent cortex» связано с тем, что у таких больных объем резекции, как правило, меньше из-за опасности развития выраженного неврологического дефицита.
Из-за относительно благоприятной естественной истории ГНСЗ вопрос об оптимальной лечебной стратегии при неполной резекции остается открытым. В исследовании EORTC 22845 сравнивалась немедленная адъювантная послеоперационная ЛТ и отсроченная ЛТ, назначавшаяся лишь при развитии рецидива. Всего было рандомизировано 311 больных. Хотя О.В. была одинакова в обеих группах (7,2 года против 7,4 года), тем не менее ВБП была на 2 года больше при послеоперационной ЛТ: 5,3 года против 3,4 года, 5-летняя ВБП — 55% против 35% (р Таблица 1. Результаты лечения рецидивов ГНСЗ темозоломидом
Режимы продленного назначения темозоломида имеют теоретическое обоснование в механизме действия препарата. При продленном назначении существенно увеличивается дозовая плотность препарата. Если при стандартном режиме 5/28 она составляет 250 мг/м 2 /нед, то при режиме 21/28 в 1,5 раза больше — 393,75 мг/м 2 /нед. Кроме этого, увеличивается экспозиция препарата, что приводит к деплеции метилгуанинметилтрансферазы (MGMT), которая является суицидальным энзимом и истощается при длительном назначении алкилирующих препаратов. Это особенно важно для темозоломидрезистентных опухолей без метилирования гена-промотора MGMT и с высоким уровнем экспрессии протеина MGMT, при которых продленное назначение темозоломида может способствовать преодолению резистентности к препарату. Наконец, имеются сведения об антиангиогенном эффекте метрономного назначения препаратов [45, 46].
При ГНСЗ было проведено несколько исследований продленного назначения темозоломида [42—44]. Темозоломид 75 мг/м 2 в режиме 21/28 в первой линии ХТ прогрессирующей или рецидивной ГНСЗ позволил достичь ОО у 30—52% и КОР у 84—86% пациентов. Однолетняя ВБП составила 73% с медианой около 22 мес. Токсичность была умеренной. В отличие от стандартного режима реже наблюдалась нейтропения, тромбоцитопения, тошнота и рвота [42, 43]. S. Kesari и соавт. [44] изучили режим назначения темозоломида по 75 мг/м 2 /сут в течение 7 нед с 4-недельным перерывом. ОО был достигнут у 20% больных, СЗ — у 75%, т. е. КОР наблюдался у 95% больных. Медиана ВБП составила 38 мес, а 5-летняя ОВ — 73% с медианой более 6 лет. Таким образом, представленный режим превосходит стандартный режим, при котором мВБП составляет 10—31 мес.
До настоящего времени оптимальный режим назначения темозоломида не определен. Н. Lashkari и соавт. [47] проанализировали 18 клинических исследований (736 пациентов), в которых использовались три различных режима. Было показано преимущество продленных режимов в отношении ВБП, ОО и гематологической токсичности, однако эти данные требуют подтверждения в рандомизированных исследованиях.
В ряде исследований оценивалась роль молекулярно-генетических предикторов ответа на лечение при рецидивах ГНСЗ. Частота О.О. и выживаемость была существенно выше при олигодендроглиальной гистологии, наличии транслокации 1p19q и метилирования гена-промотора MGMT [34, 35, 40, 41, 44]. Однако в исследовании [41], в которое рекрутировались больные только с астроцитарной гистологией, было обнаружено, что метилирование гена-промотора MGMT и наличие мутации IDH1 коррелируют с длительностью интервала между появлением первых симптомов заболевания и началом терапии темозоломидом, но не коррелируют с ВБП после начала лечения темозоломидом. То есть метилирование гена-промотора MGMT и мутация IDH1 являются скорее факторами хорошего прогноза и лучшей выживаемости, нежели предикторами ответа на ХТ.
Кроме первой линии терапии рецидивов ГНСЗ темозоломид также использовался во второй линии ХТ у больных с ОДО II степени злокачественности после прогрессирования на препаратах нитрозомочевины [48]. ОО наблюдался у 25% больных. Однолетняя ВБП составила лишь 11% с медианой 3,7 мес (у ответивших на лечение 8 мес), медиана ОВ — 12,3 мес. Характерно, что при проведении второй линии ХТ прогностическая значимость транслокации 1p19q утрачивалась, и ответ на ХТ был невысок даже у больных с наличием данной мутации [49].
Хотя опыт применения неоадъювантной ХТ темозоломидом при ГНСЗ невелик, использование данной опции при глиомах с вовлечением функционально важных областей мозга может способствовать улучшению резектабельности за счет уменьшения размера опухоли (в среднем на 36%) [50].
Другими важнейшими цитостатиками для лечения ГНСЗ являются препараты нитрозомочевины, в частности CCNU. Данные об эффективности схемы PCV на основе CCNU представлены в табл. 2. По уровню опухолевого ответа и выживаемости эта схема не уступает темозоломиду. Интересно, что в некоторых исследованиях [53, 56] результаты были одинаково хорошими как при наличии транслокации 1p19q, так и без нее. Выживаемость больных в небольшом исследовании М. Frenay и соавт. [54], в которое включались только больные с «чистой» ДА, была сопоставима с выживаемостью больных с ОДО, хотя в других исследованиях [51] имелась существенная разница в медиане ВБП между «чистой» ОД и ОА (32 мес против 12 мес), что может указывать на неблагоприятное значение астроцитарного компонента. ЛТ использовалась у части больных лишь в исследовании R. Soffietti и соавт. [51]. Это свидетельствует о том, что ГНСЗ долгое время могут контролироваться назначением одной только ХТ, что позволяет отсрочить назначение ЛТ и избежать постлучевых осложнений.
Таблица 2. Эффективность схемы PCV при рецидивах ГНСЗ
Использование схемы PCV в качестве второй линии ХТ после прогрессирования на темозоломиде показало скромные результаты. ОО наблюдался всего у 10—17% больных, медиана ВБП составила 6,5 мес, 1-летняя ВБП — 21%, медиана ОВ — 23,4 мес [57, 58]. Транслокация 1p19q не была предиктором ответа на лечение, но коррелировала с ВБП. Учитывая низкую эффективность ХТ второй линии, у таких больных имеет смысл рассматривать вопрос о назначении ЛТ, если она не применялась ранее.
Прямого сравнения эффективности и безопасности темозоломида и схемы PCV при лечении ГНСЗ не проводилось. В отличие от темозоломида, который может применяться на протяжении значительного периода времени, использование PCV не может быть длительным из-за кумулятивной токсичности. М. Peyre и соавт. [59] изучили динамику объема опухоли во время лечения PCV и после его отмены. Во время лечения наблюдалось уменьшение объема опухоли у всех пациентов со средней скоростью 10,2 мм в год, что аналогично скорости уменьшения объема опухоли при лечении темозоломидом (9,2 мм/год). После отмены ХТ уменьшение объема опухоли продолжилось у 95% больных в среднем на протяжении 3,4 года после начала ХТ и 2,7 года после прекращения Х.Т. На момент прекращения ХТ частичный опухолевый ответ (ЧО) наблюдался у 5% больных и минимальный ответ у 38%. На момент максимального снижения среднего размера опухоли (через 3,4 года после начала лечения) ЧО был зарегистрирован у 38% и минимальный ответ у 42% больных. По сравнению с ХТ темозоломидом, при проведении которой рост опухоли возобновлялся у 1/3 больных, а при отмене прогрессирование наблюдалось у 60% больных в течение 1 года [33], прогрессирование на PCV наблюдалось редко (0—6%) [52, 53, 59]. Таким образом, терапия PCV способна обеспечить более стойкий и длительный эффект при более короткой длительности лечения, что, возможно, связано с воздействием CCNU на слабо пролиферирующие стволовые клетки глиомы. На основании этих данных, косвенно подтвержденных в ретроспективном исследовании А. Lassman и соавт. [60], схема PCV может быть признана стандартом лечения ГНСЗ.
Заключение
Таким образом, лечение ГНСЗ следует планировать на основании факторов прогноза, из которых основными являются характеристики опухоли (размер и морфологическое строение) и пациента (возраст, общесоматический и неврологический статус). Тактика «наблюдай и жди» на сегодняшний день может быть оправдана только у части больных с небольшими бессимптомными опухолями и высоким риском осложнений оперативного лечения. Чисто хирургическое лечение считается адекватным лишь при полном удалении опухоли. При неполном удалении опухоли показано адъювантное лечение. Выбор вида и объема адъювантной терапии зависит от морфологических и молекулярно-генетических особенностей опухоли. Так, ОДО, особенно с наличием транслокации 1р19q, высокочувствительны к ХТ, поэтому в таких случаях целесообразна адъювантная ХТ препаратами нитрозомочевины с резервированием ЛТ для лечения рецидивов. При астроцитарных опухолях химиолучевое лечение имеет преимущества перед одной ЛТ по показателям выживаемости, поэтому должно считаться опцией выбора для адъювантной терапии астроцитарных ГНСЗ. Препараты нитрозомочевины обеспечивают более длительный контроль опухолевого роста по сравнению с темозоломидом, поэтому являются препаратами выбора для данной группы опухолей.