Гипоксия детрузора мочевого пузыря что это
Патогенез гиперактивного мочевого пузыря
Теории развития ГМП
Факторы риска ГМП
Из факторов риска возникновения гиперактивного мочевого пузыря выделяют курение, ожирение, потребление газированных и содержащих кофеин напитков, снижение потребления овощей, фруктов и хлеба, повышение потребления мяса крупного рогатого скота и, как следствие, снижение потребления куриного мяса, возраст, сахарный диабет, инфекции мочевых путей. [Dallosso 2003; Brown 2000]
Увеличение риска возникновения ГМП у курильщиков связывают с индуцированными никотином фазными сокращениями детрузора, антиэстрогенным эффектом никотина на мочевой пузырь и уретру (у женщин), а также с нарушением синтеза коллагена.
При ожирении повышается интраабдоминальное и интравезикальное давление, что приводит к хроническому воздействию на нервы органов малого таза и, следовательно, к нарушению функции мочевого пузыря (Teleman 2004; Parazzini 2003).
В газированных и других искусственных напитках содержатся различные красители, консерванты и кофеин, которые оказывают раздражающее действие на мочевой пузырь, увеличивают диурез.
Сниженное содержание растительных волокон в пище, основным источником которых являются овощи и фрукты, ведет к хроническим запорам и растяжению толстого кишечника, что может влиять на функцию нервной системы органов таза. Кроме этого, овощи, фрукты и хлеб – важный источник минералов и витаминов, особенно групп В (кофакторы реакций энергетического обмена) и С (участвует в синтезе коллагена), фитоэстрогенов [Dallosso 2003].
В мясе крупного рогатого скота (по сравнению с куриным) содержится значительное количество животных жиров, которые ведут к развитию гиперлипидемии, и, как следствие, атеросклерозу сосудов и ишемии различных органов и систем, в частности, мочевого пузыря. Аналогичный патогенез может иметь место при сахарном диабете (Teleman 2004).
Возраст также можно считать фактором риска. Так, Kessler и соавт. показали, что с возрастом снижается максимальная емкость мочевого пузыря и скорость мочеиспускания, увеличивается объем остаточной мочи и ургентная симптоматика [Kessler 2004]. Имеют значение сами по себе возрстные изменения в нижних мочевых путях, изменения сосудистой и нервно систем (Brown 1999).
У женщин одним из важных факторов риска считают гипоэстрогенное состояние в перименопаузе [Балан В.Е. 2003 и 2004; Cardoso 2002].
Повышенное потребление витамина D, калия и протеина ведет к достоверному снижению риска возникновения ГМП. Имеются доказательства снижения риска возникновения при увеличении приема витаминов ВЗ (никотинамид) и В6 (пиридоксин) [Dallosso 2004].
Нейрогенный мочевой пузырь: деликатная проблема и как ее решить
Нейрогенный мочевой пузырь — отклонение в работе мочевыделительной системы, при котором нарушаются процессы накопления и эвакуации мочи. У здорового человека их регулирует центральная нервная система, что позволяет ему волевым усилием контролировать удержание и испускание мочи. Если есть заболевания, от которых страдает головной или спинной мозг, т. е. ЦНС, то с мочеотделением могут возникнуть проблемы. Одна из них — это и есть нейрогенный мочевой пузырь.
Как проявляется заболевание
Главный симптом — проблемы с мочеиспусканием. Они могут проявляться по-разному. Все зависит от того, как работает детрузор — мышечная оболочка, сокращение которой приводит к мочеиспусканию. Так, у человека может быть гипер- или гипорефлекторный нейрогенный мочевой пузырь.
Гипорефлекторный
«Гипо–» означает сниженную функцию детрузора при выделении, т. е. редкое мочеиспускание. Из-за снижения или отсутствия сократительной активности человек не ощущает нужду даже при полном или уже переполненном мочевом пузыре. Все потому, что из-за сниженной активности детрузора не повышается внутрипузырное давление, которое нужно, чтобы преодолеть сопротивление сфинктеров мочевого пузыря. Это вызывает задержку или вялое мочеотделение, при котором приходится сильно натуживаться.
Другие характерные симптомы и признаки:
Гиперрефлекторный
Гиперрефлекторный нейрогенный мочевой пузырь. «Гипер–» означает повышенную активность детрузора, т. е. у человека наблюдается частое мочеиспускание при накоплении менее 250 мл мочи. Детрузор находится в тонусе, что увеличивает давление внутри мочевого пузыря при небольшом количестве мочи. На фоне слабых сфинктеров человек начинает ощущать частые позывы к мочеиспусканию. Это и ведет к его учащению.
Другие симптомы и признаки:
На УЗИ нейрогенный мочевой пузырь определяют по объему остаточной мочи. Но в первую очередь оценивают состояние самого органа в наполненном состоянии. Дополнительно человеку нужно вести дневник мочеиспускания, УЗИ почек, анализы крови и мочи.
Причины возникновения нарушения
Проблема может возникать при нарушениях на любом из уровней нервной системы, поскольку мочеиспускание регулируется большим количеством нервов. Все причины можно разделить на следующие категории:
Основные принципы лечения
Цель лечения — нормализовать процесс мочеотделения и помочь человеку с такой проблемой социально адаптироваться. Лечение во многом зависит от вида нейрогенного мочевого пузыря. Легче справиться с гиперрефлекторной формой. Пациенту назначают лекарства, которые снижают тонус мышц мочевого пузыря, улучшают кровоснабжение органов. Нередко применяется ботулотоксин, который вводят в мышечный слой мочевого пузыря, что помогает человеку нормально опорожняться.
В лечении нейрогенного мочевого пузыря гипорефлекторного типа очень важно регулярное и полное опорожнение. Его добиваются путем принудительного мочеотделения, наружного давления на мочевой пузырь (прием Креде), с помощью физиотерапии и специальной гимнастики для тренировки мышц тазового дна. Иногда приходится прибегать к периодической или постоянной катетеризации.
Если положение усугубилось, проблему решают хирургическим путем. Чтобы этого избежать, необходимо обратиться к врачу при первых же симптомах. Запишитесь на прием к урологу в клинику урологии имени И.М. Сеченова, позвонив по телефону или воспользовавшись формой онлайн-записи.
Гиперактивный мочевой пузырь: этиология, патогенез и методы лечения.
| Гиперактивность мочевого пузыря (ГАМП) — заболевание, достаточно легко диагностируемое, но представляющее значительные трудности в подборе лечения. Патогенез ГАМП дискутирует ся и до настоящего времени идеальное средство терапии остается иллюзорным. Достоверных данных о распространенности патологии нет, но установлено, что гиперактивный мочевой пузырь характеризуется частыми (более 8 раз в сутки) позывами к мочеиспусканию, неотложными позывами к мочеиспусканию, а также недержани ем мочи, особенно в пожилом возрасте, независимо от пола. Неотложный (императивный) позыв (urgency) — сильнейшее желание помочиться, а неотложное недержание мочи (urge incontinence) — непроизвольная потеря мочи в сочетании с неотложным позывом. |
Любые формы нарушений мочеиспускания резко снижают качество жизни, создают психологические проблемы (чувство стыда, потерю уверенности в себе), что может привести к разрушению семейных, рабочих связей, к социальной изоляции [1].
В настоящее время используют определения ГАМП, разработанные Международной ассоциацией, изучающей проблемы удержания мочи (International Continent Society — ICS) [2].
Гиперактивность мочевого пузыря (чрезмерная активность детрузора) — диагноз, который ставят только по результатам уродинамического исследования. Уродинамически гиперактивность детрузора характеризуется фазными сокращения ми детрузора і 20 см Н2О с числом мочеиспус каний за 2 ч 8 и более, императивными позывами и неудержанием мочи. Ошибочно полагать, что жалобы пациентов на неотложное мочеиспус кание (urgency) и/или неотложное недержание мочи (urge incontinence) обусловлены наличием гиперактивности детрузора (detrusor overactivity). До 22% женщин с недержанием мочи, при наличии симптомов, сходных с проявлениями гиперактивности детрузора, на самом деле имеют истинное стрессорное недержание мочи (Jarvis и соавт., 1980). И, наоборот, среди женщин с клиническими симптомами истинного недержания мочи при напряжении у 11-16% в ходе уродинамического исследования выявляется гиперактив ность детрузора как основная причина патологии 5.
В литературе встречается множество данных по эпидемиологии недержания мочи, однако их сложно сравнивать из-за терминологических не соответствий, различий в выборках и в протоколах исследований. В то же время существуют различия, обусловленные полом, возрастом, этнической принадлежностью. Частота встречаемости ГАМП в популяции 20-60 лет составляет 10% [6].
Частота распространенности недержания мочи у женщин в возрастной группе от 45 до 59 лет увеличивается [7], но изменяется пропорция возникновения разных видов недержания. Число случаев стрессорного недержания по мере увеличения длительности постменопаузы в популяции уменьшалось, в то время как частота неотложного недержания мочи увеличивалась при длительности постменопапузы более 10 лет. Отмечено увеличение преобладания гиперактивно сти мочевого пузыря с возрастом до 30% [8]. По нашим данным, частота ургентных форм недержания мочи возрастает в зависимости от длительности постменопаузы: от 12,5% при постменопаузе до 5 лет до 71,4% при длительности постменопаузы более 20 лет, что, возможно, связано с увеличением неврологической патологии у женщин этой возрастной группы.
Существует множество теорий, основанных на патофизиологических особенностях возникновения ГАМП. Каждая из этих теорий подкрепле на результатами многочисленных исследований. В целом эти теории можно разделить на две категории: основанные на нейрогенном происхождении ургентного недержания мочи и на теориях миогенной дистрофии детрузора.
Нейрогенная теория возникновения гиперактивности детрузора
Накопление мочи зависит: 1) от спинальных рефлекторных механизмов, активирующих симпатические (через поясничный отдел спинного мозга) и соматические проводящие пути к уретре; 2) от тонической подавляющей системы в головном мозге, которая подавляет передачу парасимпатического возбуждения к детрузору. Мочеиспускание осуществляется посредством угнетения симпатических и соматических путей передачи и активации спинобульбоспинальных парасимпатических рефлекторных путей, проходящих через центр мочеиспускания в «клювовид ном мосту» (rostral pons). Результаты эксперимен тальных, физиологических и анатомических исследований подтверждают предположение о наличии в стволовой части мозга (rostral pons) центра мочеиспускания, который функционирует по типу «вспышек» нейрогенной активности и стимулирует рефлекторную цепь мочеиспускания. Пусковая точка, по-видимому, регулирует «возможности» мочевого пузыря (он начинает функционировать при критическом уровне афферентной активности, поступающей от барорецепто ров в стенке мочевого пузыря), а также координирует активность мочевого пузыря и наружного сфинктера уретры [11, 12]. Центр мочеиспуска ния в стволе — стволовой центр мочеиспускания — находится под влиянием высших регулирую щих центров головного мозга. Электрическая стимуляция участков переднего и латерального гипоталамуса у животных вызывает сокращения мочевого пузыря и мочеиспускание. Стимуляция задних и медиальных участков гипоталамуса приводит к подавлению активности мочевого пузыря [12, 13]. Исследования у людей с использованием томографии с протонной эмиссией показали, что два участка коры (правый дорсолате ральный префронтальный участок коры и передняя опоясывающая извилина) в момент мочеиспускания активны [14]. Установлено, что активные участки располагаются преимущественно справа — в правой части мозга. Таким образом, очевидно, что различные изменения как в периферической, так и в центральной нервной системе могут быть причиной гиперактивности детрузора.
У пациентов пожилого возраста с недержанием мочи часто наблюдаются когнитивные расстройства. Так, один из аспектов когнитивных расстройств — ухудшение временной ориентации, тесно связан и сочетается с недержанием мочи. Функциональное сканирование головного мозга с использованием компьютерной томографии с монофотонной протоновой эмиссией, проведенное пациентам пожилого возраста с нестабиль ностью детрузора, показало недостаточность кровоснабжения коры головного мозга как в целом, так и в области фронтальных долей, в частности. Недостаточность перфузии особенно заметна в правой верхней фронтальной доле.
Миогенная теория гиперактивности детрузора
Существует мнение, что этиология ГАМП связана с качественными изменениями самой гладкой мускулатуры. В норме в мочевом пузыре гладкомышечные клетки находятся в состоянии спонтанной активности. Во время наполнения, тем не менее, их активность не синхронизирова на, потому что каждая из клеток связана лишь с несколькими из своих соседей, и нет особой взаимосвязи между отдельными пучками. Синхронная активация, наблюдаемая во время мочеиспускания, невозможна без густой плотной иннервации, и большое количество гладкомышеч ных клеток должно быть активировано с помощью нервных импульсов.
A. Elbadawi и соавт. [15] использовали электронную микроскопию для исследования образцов тканей, полученных в результате биопсии у пожилых пациентов с дисфункцией мочеиспуска ния, подтвержденной уродинамическим исследованием. Исследователи описали так называемую «размыкательную модель», или «разобщенный патерн», выявленный у пациентов с ГАМП. Особенность данной модели состояла в умеренном расширении межклеточных пространств, наличии редких промежуточных связей между клетками, но отличалась избыточным содержанием особых характерных выступающих сочленений и тесным прилеганием клеточных опор. Было высказано предположение, что выступающие сочленения и клеточные границы-опоры осуществляют непосредственное связывание между отдельными гладкомышечными клетками и что они вовлечены в генерацию миогенного — мышечного — сокращения у пациентов с ГАМП. У 5 пациентов, участвующих исходно в этом исследовании со стабильностью детрузора, со временем развилось состояние гиперактивности детрузора. Ультраструк турные исследования новых материалов биопсии показали наличие так называемой «размыкатель ной модели» в отличие от предыдущей биопсии, проведенной у тех же пациентов [15].
Как и в случаях других патологических состояний, у пациенток с симптомами ГАМП, т.е. с учащенным, неотложным мочеиспусканием и неотложным недержанием мочи, наряду с подробным изучением анамнеза и истории настоящего заболевания, должны быть проведены тщательные урологические, гинекологические и неврологические исследования. Существует мнение о значительной роли у женщин в постменопаузе гипоксии детрузора в связи с эстрогенным дефицитом.
С возрастом отмечается нарушение кровоснаб жения органов. Полагают, что когда развиваются гипоксия детрузора и метаболические нарушения в его структуре, нарушается его сократитель ная способность. Возможно, в этом случае развиваются «ознобоподобные» неконтролируемые сокращения детрузора. Это позволяет предположить, что ишемия и перфузия могут лежать в основе повреждения интрамуральных нейронов и приводить к изменению функции гладкой мускулатуры мочевого пузыря у пациенток с нестабильностью детрузора. В гладкой мускулатуре мочевого пузыря спонтанная и спровоцированная активность связаны с деполяризацией мембран и проникновением кальция в гладкомышечные клетки через кальциевые каналы L-типа. Подавление выхода кальция может ингибировать спонтанные и провоцированные сокращения мочевого пузыря. Определенный интерес представля ют экспериментальные наблюдения В.М. Державина и соавт. (1991) о возможности смягчения
ишемической дисфункции детрузора с помощью блокаторов кальциевых каналов.
Тщательный сбор анамнеза и ведение дневников мочеиспусканий включает в себя вопросы, цель которых количественно определить выраженность симптомов.
Гиперактивность детрузора можно достоверно диагностировать только с помощью уродинамического исследования, а именно, цистометрии наполнения. При уродинамическом исследовании можно оценить функцию мочеиспуска ния у пациентов с симптомами нарушения нижних отделов мочевого тракта.
При цистометрии наполнения измеряется интравезикальное давление вместе с интраабдо минальным; измерение этих двух параметров позволяет выявить причину изменения интравези кального давления — изменение контрактильно сти самого пузыря либо внутрибрюшное напряжение. Таким образом, давление детрузора можно рассчитать путем вычитания интраабдоминаль ного давления из интравезикального:
Терапия гиперактивного мочевого пузыря
Тренинг мочевого пузыря
Восстановление регулярного мочеиспускания с помощью тренировки считается одним из самых эффективных консервативных методов терапии. Данная концепция была выдвинута W. Frewen в 1979 г. [16]. Пациентов госпитализировали, и с помощью графика мочеиспускания отмечали частоту и объем мочеиспускания, которые наглядно помогали пациентам постепенно увеличить интервалы между мочеиспусканиями, а также объем выделяемой мочи. В некоторых случаях использовали седативные препараты, действующие на мочевой пузырь, для поддержания хорошего эффекта. В настоящее время данная методика широко распространена и выполнима в амбулаторных условиях. В настоящее время продолжают использовать карты-графики мочеиспус кания, так как это служит хорошей обратной связью пациентам и клиницистам и свидетель ствует об улучшении. Цель терапии — сократить частоту мочеиспусканий до 1 в 3-4 часа. Длительные положительные результаты возможны у 50% пациентов [17].
Биологическая обратная связь
Для лечения некоторых пациентов использовалась биологическая обратная связь [18]. Во время уродинамических исследований сигнал от датчика в момент сокращений мочевого пузыря преобразуется в визуальный или слуховой сигнал и передается пациенту. В ответ на этот сигнал пациент должен постараться подавить сокращения детрузора. Идея состоит в том, чтобы пациент научился распознавать и затем сознательно подавлять сокращения, если они возникают в течение каждодневной активной жизни. И хотя исходные результаты обнадеживают, длительные наблюдения неоднозначны. Вдобавок, описанная методика не смогла найти своих приверженцев из-за недоступности уродинамического оборудования и необходимости многократно катетеризировать пациентов для оценки активности мочевого пузыря.
Упражнения для укрепления мышц тазового дна
Упражнения для мышц тазового дна могут быть полезны по одной из двух причин. Первая из них — случайно открытый факт, что упражнения для мышц тазового дна, используемые женщинами при стрессорном недержании мочи, приводят к снижению сопутствующей гиперактивности детрузора. Механизм действия не ясен, но, возможно, связан с тем, что укрепление мышц предотвращает проникновение мочи в уретру, рефлекторно вызывающее сокращение детрузора. К тому же упражнения для мышц тазового дна у женщин способствуют увеличению максимального уретрального давления и тем самым снижают недержание, даже на фоне сокращений детрузора.
Широко использовалась в Европе, но в США не нашла распространения. Методика разработа на M. Fall в Швеции в 1978 г. [19]. В основе терапии — индукция сокращений мышц тазового дна с помощью вагинального или ректального датчика для лечения ГАМП. При стимуляции возможны два механизма действия: 1) прямая стимуляция мышц тазового дна, вызывающая сокращение, и 2) непрямое угнетение рефлекса никтурии. Максимальная электростимуляция, как было показано, эффективна у 50% пациентов в 1 год [20]. Но данный метод терапии не популярен среди многих пациентов из-за слишком медленного улучшения.
Другие формы лечения
Нашли своих сторонников и другие методы терапии, например, гипнотерапия и акупункту ра, которые, по данным R. Freeman, K. Boxby [21], достаточно эффективны. Тем не менее эти альтернативные методы не смогли получить всеобщее распространение и одобрение.
В настоящий момент используются различные препараты для улучшения состояний, обуслов
ленных ГАМП. Большинство из них обладают антимускариновой активностью и имеют побочные действия: сухость во рту, запоры, трудности аккомодации, сонливость. Препараты не должны назначаться пациентам с обструктивной уропатией, патологией кишечника, язвенным колитом, глаукомой или миастенией. У пациентов появляется замедленная реакция, что опасно при вождении автомобиля или при работе с некоторыми механизмами.
Самым часто назначаемым препаратом является оксибутинина хлорид, оказывающий антимускариновое, антиспазматическое и местное анестезирующее действие, хотя не все из вышеперечисленных свойств наблюдаются при терапевтических дозах (Nilvebrant, 2000). Оксибутинин имеет относительно короткий (до 2-4 ч) период полураспада, и это означает, что его можно принимать на короткое время — на время социальных мероприятий, таких, как вечера, приемы, но не в постоянном режиме. Дозы для приема внутрь составляют от 2,5 мг однократно до 5 мг 4 раза в день. Необходим индивидуальный подбор дозы, и пациентов предупреждают, что это займет определенный период, в течение которого необходимо посещать врача. Оптимальной считается доза, дающая нужный эффект при минимальных побочных реакциях. Стандартная стартовая доза для взрослых составляет 5 мг 2 или 3 раза в день. У пожилых рациональная стартовая доза составляет 2,5 мг 2 или 3 раза в день. Доза должна поддерживаться в течение 7 дней до корректировки — либо уменьшения, либо увеличения, в зависимости от выраженности клинического эффекта.
Толтеродин детрузитол — недавно появивший ся препарат, обладающий антимускариновым свойством, оказывающий на мочевой пузырь такое же действие, как и оксибутинин, но дающий незначительный эффект в отношении мускариновых рецепторов слюнных желез. Результаты свидетельствуют о том, что препарат переносится лучше, обладает большей комплаентностью (приемлемостью) по сравнению с оксибутини ном [23], но необходим индивидуальный подбор дозы — титрование.
Детрузитол является мощным конкурентным антагонистом М2 и М3 мускариновых рецепторов, локализующимся в мочевом пузыре и слюнных железах, блокирует кальциевые каналы и, таким образом, оказывает двойное действие на мочевой пузырь. За счет двойного действия толтеродина и избирательности к специфическому (М2) подтипу мускариновых рецепторов селективность толтеродина выше для мочевого пузыря, чем для слюнных желез (это показано в исследованиях in vivo), что, по-видимому, и обусловливает его лучшую переносимость и приемлемость в сравнении с оксибутинином.
У женщин в постменопаузе эффективность лечения увеличивается при применении заместительной гормонотерапии, однако роль эстрогенного дефицита в генезе гиперактивного мочевого пузыря — предмет ближайших исследова ний [22].
Нейромодуляция — относительно новый метод, основанный на стимуляции корешка сакрального нерва для лечения ГАМП. До настоящего времени окончательно механизм действия не ясен, однако происходит активация интернейронов спинного мозга или b-адренергических нейронов, угнетающих активность мочевого пузыря. Пациентам производится временная стимуляция нервных окончаний крестцового отверстия с помощью накожных электродов на уровне S3. Если временное раздражение данной области дает хороший результат, то необходима установка постоянного стимулятора — имплантация. H. Shaker, M. Hassouna [24] использовали методику у 18 пациентов с неотложным недержанием мочи и показали значительное снижение и сокращение эпизодов недержания, а также увеличение резервных возможностей мочевого пузыря. Данная методика находится в стадии разработки, но результаты ранних исследований показывают, что нейромодуляция может стать достойной альтернативой при лечении ГАМП.
ГАМП в настоящее время остается клинической проблемой как для пациентов, так и для специалистов, занимающихся этой патологией. Необходимо продолжать научные исследования на уровне фундаментальных наук, чтобы понять патофизиологические процессы, лежащие в основе процесса: только тогда появится возможность создания фармакологических препаратов, специфичных для данного заболевания, которые смогут улучшить эффективность и свести к минимуму заболеваемость. В будущем, возможно, удастся идентифицировать мускариновые рецепторы, специфичные для мочевого пузыря, которые можно селективно заблокировать фармакологическими препаратами. Теоретически, это сделает возможным создание эффективной терапии для гиперактивного детрузора при отсутствии побочных эффектов. В настоящий момент существующие медицинские консерватив ные и хирургические методы лечения ГАМП требуют детального обследования пациента и решения вопроса о терапии в соответствии с выраженностью симптомов и влияния их на качество жизни.
В.Е. Балан, З.К. Гаджиева, С.А. Великая
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
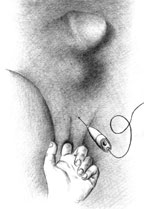 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
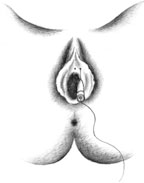 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва