Гипоксическое поражение головного мозга у новорожденных что это
Гипоксия и асфиксия у новорожденных
Одной из самых сложных и травмирующих ситуаций в жизни ребенка являются роды, даже при самом физиологическом их течении. Этот процесс требует значимой перестройки, как со стороны организма матери, так и со стороны младенца.
Если в процессе внутриутробной жизни, во время родов или в ранний период после рождения ребенок испытывает кислородное голодание – такое состояние называется гипоксией. Гипоксические повреждения возникают вследствие кислородного голодания тканей.
В зависимости от длительности течения гипоксия может быть хронической – от нескольких суток до нескольких месяцев (характерно для внутриутробной гипоксии плода) и острой – от нескольких минут до нескольких часов, возникающей при быстрых нарушениях поступления кислорода в организм (чаще при интранатальной гипоксии).
Кислородную недостаточность у родившегося ребенка называют асфиксией.
Причиной асфиксии могут быть факторы со стороны ребенка, матери, а также маточно-плацентарные. Материнские причины – это её состояние здоровья, возраст, другие социально-демографические аспекты. Имеет значение степень и динамика наблюдения за беременной женщиной, а также оценка маточно-плацентарного кровотока – фактора, помогающего минимизировать неблагоприятный фон развития острой ситуации.
Нарушения и последствия вызываемые гипоксией (асфиксией)
В зависимости от тяжести и длительности воздействия кислородная недостаточность может оказать как минимальное влияние, так и исказить всё последующее развитие ребенка. Важно, что сразу после воздействия гипоксии на мозг объём поражения может быть одним, а впоследствии может увеличиваться. Поэтому в первые дни жизни ребенка, перенесшего гипоксию или асфиксию, не всегда можно надежно спрогнозировать исход.
Доношенный ребенок биологически и генетически запрограммирован на успех без тяжелой структурной патологии, ему легче справится с острой ситуацией, возникшей в родах. У недоношенного ребенка асфиксия накладывается на структурно незрелые органы и ткани. Поэтому, степень зрелости ребенка определяет патологические изменения, которые проявляются с течением жизни.
У детей с тяжелой асфиксией речь идет о борьбе за выживаемость, а у детей с перенесенной гипоксией речь идет об улучшении качества жизни и социальной адаптации.
Как уменьшить последствия гипоксии для ребенка
Оценка интеллектуального, речевого, моторного, социально-эмоционального развития ребенка, его адаптивное поведение должно оцениваться врачами различных специальностей: неврологами, педиатрами, остеопатами, логопедами, психологами и т.д.
Врач-остеопат и неонатолог оценивают функцию различных систем организма как целостной системы, улучшая кровоснабжение, движение спинномозговой жидкости, иннервацию, подвижность тканей.
Остеопаты создают благоприятные условия для реорганизации поврежденных структур нервной системы, так как существует прямая взаимосвязь двигательной активности, языка и интеллектуальных способностей. Особенно важно систематическое наблюдение у врача-остеопата за ребенком при формировании новых навыков в процессе его роста.
Поэтому, чем раньше начать реабилитацию маленьких пациентов, тем выше шанс уменьшить последствия гипоксии.
Гипоксия в родах. Помощь остеопата
Гипоксически-ишемическое поражение центральной нервной системы перинатального генеза – это очень частый диагноз, с которым обращаются родители со своими детьми. 75-85% заболеваний нервной системы у детей своими истоками уходят в ранние сроки внутриутробного развития или проблемы в родах. Внутриматочная гипоксия и гипоксия в родах обуславливают нарушения маточно-плацентарного кровообращения, что может сопровождаться недостатком кислорода у плода. Гипоксические нарушения у детей часто связаны с функциональным дисбалансом, ограничением кровотока и движения ликвора. Остеопатия нормализует движения в теле и способствует питанию мозга, исправлению негативных послествий перенесенной гипоксии.
Гипоксия и асфиксия, происходящие в родах и в период новорожденности, не проходят бесследно и могут оказать негативное воздействие на развивающийся мозг. Исходом может стать значительная потеря нейронов, дистрофические изменения нервных клеток в коре головного мозга и в подкорковых структурах и желудочках головного мозга.
В клинической картине могут быть такие симптомы:
Диагностика гипоксии
Дети с диагнозом перинатальное постгипоксическое поражение ЦНС наблюдаются неврологом в течение 2 лет. По истечении этого срока диагноз снимается, либо меняется на более сложный (ДЦП, гидроцефалия и тд).
Методы диагностики постгипоксического состояния:
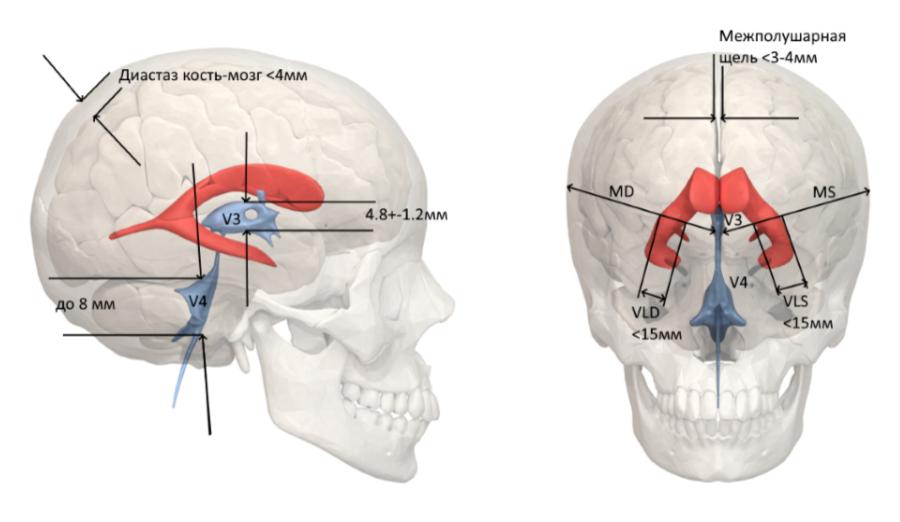
На УЗИ головного мозга определяются следующие постгипоксические изменения:
Периодичность проведения исследований у детей, перенесших гипоксию, 1 раз в 3 месяца до года и 1 раз в 6 мес. на втором году жизни.
Оценка по шкале Апгар не единственный критерий перенесенной гипоксии. Например, у плода, в ответ на недостаток кислорода, открывается сфинктер прямой кишки и меконий выходит в околоплодные воды, из-за чего они становятся зелеными. О кислородном голодании может свидетельствовать также состояние плаценты (преждевременное старение, аномалия развития сосудов, и т.д.). Иногда такие дети рождаются с высокой оценкой по шкале Апгар, но гипоксия все-таки имела место.
Мозг детей в первые 2 года жизни очень пластичный и с удовольствием принимает все методы лечения, быстро откликается и выдаёт прекрасные результаты. В последнее время остеопатическое лечение занимает заслуженное место в программе лечения детей, перенесших гипоксию.
Последствия гипоксии
Ранее мы рассматривали причины и диагностику постгипоксических состояний и договорились о том, что дети, родившиеся с оценкой 7 баллов по Апгар и ниже, рассматриваются как перенесшие гипоксию. К этой группе также относятся дети, имевшие обвитие пуповиной, недоношенные дети и т.д.
Крайне важно регулярно проводить осмотры таких детей в динамике в определенные возрастные периоды: 1 мес., 3 мес., 6 мес., 9 мес., 1 год. Целью осмотра и наблюдения является профилактика и уменьшение хронических заболеваний и снижение степени отдаленных последствий. Около 83% детей, перенесших гипоксию, имеют поражения ЦНС в различных проявлениях и сочетаниях.
В течении заболевания выделяют 3 периода:
Самые частые симптомы поражения ЦНС в остром и восстановительном периоде. Иногда эти симптомы проявляются в сочетании друг с другом:
Выражается гипертнусом икроножных мышц, тугоподвижностью в голеностопных суставах, хождением на цыпочках, задержкой темпов речевого развития, а также двигательного.
При наличии данных симптомов не стоит дожидаться планового осмотра, лучше сразу обратиться к неврологу и остеопату для ранней диагностики и лечения.
Лечение гипоксии
Постгипоксическое поражение ЦНС требует этапного лечения после проведения реанимационных мероприятий (если они были необходимы) начинается восстановительный период, применяется:
Остеопатическое лечение гипоксии в родах
Остеопатическое лечение по праву занимает одно из ведущих мест в реабилитации детей, перенесших гипоксию. Балансировка костей черепа позволяет снять напряжение с твердой мозговой оболочки и с полушарий головного мозга, тем самым обеспечивая максимально полноценное функционирование ЦНС.
Остеопатические методики позволяют осуществить дренаж венозных синусов, в результате чего налаживается резорбция ликвора и нормализуется внутричерепное давление. Освобождение шейного отдела позвоночника, устранение кривошеи способствует адекватному кровоснабжению головного мозга.
Раннее проведение остеопатического лечения на первом году жизни позволяет детям не только не отставать в развитии от своих сверстников, но иногда даже развиваться с опережением. Очень важно проводить это лечение с первых месяцев жизни, так как это поможет избавиться от отдаленных клинических патологических симптомов. Сеансы остеопатии детям проводятся начиная с первого месяца жизни. Остеопатическое лечение, создавая оптимальное функционирование ЦНС останавливает процесс постгипоксических изменений в нейронах, тем самым как-бы перепрограммирует мозг на полноценное развитие.
Не нужно бояться гипоксии, нужно предпринять весь комплекс мер для реабилитации после неё. Тем более, что современная медицина даёт нам множество инструментов для этого.
Преимущества лечения последствий гипоксии родов в нашем медицинском центре Неонатус Санус
Мы умеем и любим работать с маленькими детьми!
В нашей клинике работают опытные врачи-остеопаты, неврологи. Каждому малышу уделяется много внимания, чтобы понять ребенка, точно оценить его состояние, дать рекомендации родителям и при необходимости провести эффективное остеопатическое лечение.
В нашем центре вы можете получить лучшее обследование, лечение и рекомендации от ведущих специалистов Санкт-Петербурга.
Клинический пример лечения последствий гипоксии в нашем остеопатическом центре
Отзыв наших пациентов о лечении гипоксии
Катюша родилась от первой беременности на сроке 40 недель. Состояние после рождения было тяжелым за счёт асфиксии. Оценка по шкале Апгар 1/4 балла. Через 3 часа в связи с дыхательной недостаточностью и судорогами была переведена на реанимационное отделение. Проводилась искусственная вентиляция легких, гипотермия мозга.
Результатом тяжелой гипоксии мозга явился диагноз: Детский Церебральный Паралич, правосторонний спастический гемипарез. В возрасте 1 года 6 месяцев она впервые появилась в нашем центре. Основной жалобой была задержка двигательного развития, ходьба самостоятельная появилась только в 1год и 4 месяца. При ходьбе испытывала большие проблемы в связи с высоким гипертонусом мышц по всей правой стороне, отмечалось косоглазие и беспокойное поведение.
После проведённого лечения у девочки практически нормализовался мышечный тонус, походка максимально приблизилась к физиологической, у девочки прекрасное речевое развитие, она с удовольствием ходит в детский сад и общается со сверстниками.
Благодарим родителей за предоставленный видеоматериал.
Гипоксическое поражение головного мозга у новорожденных что это
Иркутская государственная медицинская академия последипломного образования — филиал ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск, Россия
Иркутская государственная медицинская академия последипломного образования — филиал ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск, Россия
Гипоксически-ишемические поражения головного мозга у недоношенных новорожденных
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2019;119(8-2): 63-69
Анурьев А. М., Горбачев В. И. Гипоксически-ишемические поражения головного мозга у недоношенных новорожденных. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2019;119(8-2):63-69.
Anuriev A M, Gorbachev V I. Hypoxic-ischemic brain damage in premature newborns. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2019;119(8-2):63-69.
https://doi.org/10.17116/jnevro201911908263
Иркутская государственная медицинская академия последипломного образования — филиал ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск, Россия
Одной из главных причин церебральной дисфункции у недоношенных новорожденных является гипоксия. Высокая смертность и пожизненная инвалидизация у этих детей — частый результат неонатального гипоксического повреждения головного мозга. В статье представлены данные по распространенности неврологических заболеваний, возникших в перинатальном периоде, отмечены ключевые этиологические факторы, приводящие к гипоксии как в интранатальном, так и в раннем постнатальном периоде. Подробно описан патогенез гипоксически-ишемических поражений головного мозга у недоношенных новорожденных. Рассмотрены система глутатиона, защищающая от процессов перекисного окисления липидов, глутамат-кальциевый каскад и опосредованная им эксайтотоксичность, а также процессы некроза и апоптоза нервных клеток. Отмечены преимущества и недостатки современных методов диагностики церебральных повреждений, а также проанализированы принципы терапии данных нарушений.
Иркутская государственная медицинская академия последипломного образования — филиал ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск, Россия
Иркутская государственная медицинская академия последипломного образования — филиал ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск, Россия
Преждевременные роды являются главной причиной младенческой смертности и серьезным фактором утраты человеческого потенциала выживших детей в течение последующей жизни. По данным зарубежных авторов, во всем мире ежегодно рождаются несколько миллионов детей с очень низкой массой тела (ОНМТ) [1]. В США 90% из 65 000 новорожденных младенцев с ОНМТ переживают неонатальный период из-за больших успехов в интенсивной терапии, однако у 5—10% этих детей позже обнаруживают детский церебральный паралич [2].
Внедрение современных медицинских технологий в последнее десятилетие отмечено снижением перинатальной и младенческой смертности. Вместе с тем повышение коэффициента выживаемости детей с ОНМТ и экстремально низкой массой тела (ЭНМТ) при рождении влечет за собой повышение заболеваемости и формирование ранней инвалидности [3]. Среди причин детской инвалидности патология нервной системы занимает первое место, а вклад перинатальных поражений достигает 60—80% всех неврологических заболеваний [4]. В России ежегодно из числа освидетельствованных инвалидов с детства признаются трудоспособными не более 2,5—5% по сравнению с 50% за рубежом [5].
Среди факторов, неблагоприятно влияющих на антенатальный период, большое значение имеет нарушение маточно-плацентарного кровообращения, причиной которого могут быть как экстрагенитальная, так и соматическая патология матери [6]. Нарушения маточно-плацентарного кровотока в свою очередь приводят к развитию гипоксии, являющейся центральным звеном патогенеза антенатального повреждения плода, и в первую очередь центральной нервной системы (ЦНС). В работах многих авторов установлен целый комплекс физиологических приспособительных реакций плода к неблагоприятным условиям развития, в частности к гипоксии [7—10]. Однако информации о биохимическом статусе нервной ткани плода и новорожденного при данной патологии недостаточно. Большой интерес в этом плане представляет изучение метаболизма глюкозы, особенностей свободнорадикального окисления и обмена глутамата, процессов некроза и апоптоза.
Внутриутробно плод находится в состоянии гипоксии, однако эта среда для него является физиологической, более того, на ранних этапах эмбрионального периода она необходима для нормальной дифференцировки клеток. Оксигенация плода зависит от градиентов парциального давления кислорода между материнской и плацентарной кровью, плодной кровью и плодной тканью. Известно, что в первые недели после зачатия в эмбриональном периоде уровень парциального давления кислорода (рО2) чрезвычайно низок и составляет около 18—20 мм рт.ст. Предположительно, это необходимо для защиты эмбриона, который очень чувствителен к повреждающему действию реактивных форм кислорода [11]. Гипоксия в эмбриональном периоде вызывает ангиогенез и является предпосылкой для поддержания плюрипотентности стволовых клеток [12]. Примечательно, что в I триместре беременности эмбриональные стволовые клетки развиваются при уровне рО2 около 10—15 мм рт.ст., тогда как в эндометрии рО2 составляет около 25 мм рт.ст. Стволовые клетки демонстрируют более эффективный рост и дифференцировку при низких давлениях кислорода — 10—15 мм рт.ст. [13]. Длительная гипоксия будет стимулировать ангиогенез посредством транскрипционной и посттранскрипционной регуляции факторов роста: фактор роста эндотелия сосудов, эритропоэтин, фактор роста плаценты и ангиопоэтин1 [14].
Основным регулятором адаптивных ответов клетки на гипоксию является индуцированный гипоксией фактор1 (ИГФ-1), гетеродимерный транскрипционный фактор, включающий субъединицы (ИГФ-1α и ИГФ-1β). ИГФ-1α стабилизируется, когда концентрация кислорода ниже определенного критического порога, таким образом, накапливаясь в гипоксической среде. ИГФ-1β присутствует в ядре клетки, и в условиях гипоксии он димеризуется с ИГФ-1α, улучшая доставку кислорода в ткань [15, 16]. На 14—16-й неделе беременности рО2 поднимается до стабильных значений 45—50 мм рт.ст. и сохраняется таковым до конца беременности. На поздних сроках беременности скорость пролиферации и дифференцировки клеток снижается [17, 18]. Процессы перекисного окисления липидов присутствуют с самого начала беременности, что способствует нормальному развитию плода. В конце I триместра физиологический окислительный стресс вызывает регрессию ворсинок, которые были сформированы на всей поверхности хорионического мешка, чтобы сформировать окончательную дискоидную плаценту [19]. Постнатальное увеличение концентрации кислорода вызывает всплеск образования его активных форм, при этом экспрессия антиоксидантных ферментов, таких как супероксиддисмутаза, каталаза и глутатионпероксидаза, динамически увеличиваются в течение последних недель беременности. Аналогичным образом повышается доступность наиболее важных неферментативных антиоксидантов: глутатиона, гемоксигеназы, витаминов С и Е, β-каротинов и т. д. [20]. Недоношенный ребенок более подвержен риску свободнорадикального повреждения [21]. Считается, что использование высоких концентраций кислорода во время реанимации новорожденных вызывает гипероксемию. При этом была обнаружена значительная корреляция между окисленным глутатионом (GSSG), рО2 и активностью ферментов окислительно-восстановительного цикла глутатиона [22, 23]. Многие заболевания, связанные с недоношенностью, такие как ретинопатия, бронхолегочная дисплазия, внутрижелудочковые кровоизлияния, связаны со свободнорадикальным повреждением в результате незрелости антиоксидантной системы недоношенных детей [24].
— Недостаток кислорода. Дефицит кислорода как акцептора электронов в тканях приводит к нарушению транспорта электронов в цикле Кребса и дыхательной цепи, восполнению энергии путем увеличения мозгового кровотока и анаэробного метаболизма [28].
— Роль свободных радикалов. Гипоксия-ишемия вызывает неадекватное насыщение митохондриальной цитохромоксидазы, нарушение транспорта электронов в митохондриях, что приводит к повышению концентрации супероксид-аниона и поступлению свободных радикалов из митохондрий в цитоплазму [31]. Повышение концентрации внутриклеточного Са 2+ активирует NO-синтетазу, циклооксигеназу и липооксигеназу, что способствует образованию свободных радикалов. Их избыток приводит к дополнительному высвобождению возбуждающих аминокислот и активации NMDA-рецепторов [32].
— Факторы воспаления. Действие гипоксии — ишемии на микроглию способствует синтезу цитокинов, интерлейкина-1β (ИЛ-1β), фактора некроза опухоли α (TNFα) [33]. Активность ИЛ-1β сопровождается продукцией специфических протеаз и развитием апоптоза. Избыточное образование TNFα обладает прямым токсическим эффектом и вызывает сосудистую инфильтрацию с высвобождением цитотоксических факторов, активных форм кислорода и цитокинов [34].
— Роль оксида азота (NO). NO-синтетаза содержится в эндотелиальных клетках, астроцитах, нейронах. Существует 3 изоформы NO-синтетазы: нейронная (регулирует синаптогенез и ремоделирование и зависит от Са 2+ ); эндотелиальная (регулирует сосудистый тонус, особенно вазодилатацию, и зависит от Са 2+ ); индуцируемая (присутствует в макрофагах и астроцитах, индуцируется цитокинами, независима от Са 2+ ) [35]. Активация NMDA-рецепторов вызывает продукцию нейронной NO-синтетазы, которая способствует образованию радикала оксида азота (NO.) и повреждению нейрональной ДНК [36].
Наиболее значительные потери клеток нервной ткани развиваются спустя 2—6—48 ч после рождения, вследствие патологического окислительного стресса. В таких условиях в первые часы и сутки жизни после рождения у новорожденных, перенесших гипоксию, развивается выраженный дисбаланс в системе регуляции церебрального кровообращения, который обостряет течение ишемического процесса [39].
Особенностью недоношенных детей является незрелость антиоксидантной системы, поскольку физиологическое увеличение антиоксидантной способности происходит в конце беременности, именно поэтому они более подвержены воздействию окислительного стресса, особенно когда их состояние требует проведения респираторной терапии [40]. В связи с этим возникает необходимость изучения окислительного стресса у этих детей, в частности путем измерения продуктов перекисного окисления липидов и компонентов антиоксидантной системы.
Известно, что антиоксиданты обладают противовоспалительной активностью, а систему глутатиона рассматривают как критический фактор развития воспаления и иммунных ответов [41, 42]. Это подтверждается изменением уровня цитокинов, острофазных белков и глутатиона во время воспаления [43, 44]. Система глутатиона включает его формы, ряд ферментов его синтеза и катаболизма, и механизмы транспорта. Все эти компоненты вносят важный вклад в изменение глутатионового статуса [45].
Изучая классификацию церебральных поражений у новорожденных, необходимо отметить, что наиболее популярной у неонатологов является классификация гипоксической энцефалопатии по H. Sarnat и M. Sarnat [46]. Она объединяет клинические признаки церебральной ишемии и результаты электроэнцефалографии (ЭЭГ). В данной классификации оцениваются основные показатели новорожденного: уровень сознания, нерво-мышечный статус, рефлексы, вегетативная функция, наличие судорог, ЭЭГ. В зависимости от выраженности церебральной дисфункции устанавливают I, II или III стадию энцефалопатии. Канадские неонатологи модифицировали классификацию Sarnat, дополнив ее расстройствами терморегуляции и исключив ЭЭГ и некоторые другие показатели [47]. Неонатологи Великобритании используют классификацию гипоксических церебральных нарушений L. Dubowitz и соавт.[48]. В международной классификации болезней 11-го пересмотра (МКБ-11) гипоксически-ишемические поражения головного мозга у новорожденных относятся к группе «неврологических расстройств, характерных для перинатального и неонатального периодов» [49]. Основным отличием от классификации 10-го пересмотра является то, что в МКБ-11 данная группа дополнена заболеваниями, которые ранее не выделяли отдельно. Например, перинатальный артериальный инсульт и неонатальный церебральный синовенозный тромбоз. В то же время из предложенной классификации была исключена врожденная гидроцефалия. Диагноз асфиксии новорожденного поместили в «группу других нарушений, возникающих в перинатальном периоде». При этом отдельно выделили асфиксию новорожденного с оценкой по шкале Апгар 0—3 балла и асфиксию новорожденного с оценкой по шкале Апгар 4—6 баллов. Что касается церебральных повреждений гипоксически-геморрагического характера, то их отнесли к группе «геморрагических и гематологических нарушений у плода и новорожденного». При этом несколько изменилась классификация внутрижелудочковых кровоизлияний. В МКБ-11 принято выделять 4 степени внутрижелудочковых кровоизлияний, в то время как в МКБ-10 3-я и 4-я степени были объединены.
Симптомы тяжелого повреждения ЦНС могут проявляться не сразу после рождения, а спустя несколько часов. При этом клиническая симптоматика не всегда отражает истинную степень тяжести заболевания. В связи с этим особую актуальность приобретает прижизненная оценка изменений, возникающих в клетках нервной ткани в раннем неонатальном периоде. Ультразвуковое исследование (УЗИ) позволяет выявить структурные изменения головного мозга новорожденных при перинатальном гипоксическом поражении ЦНС. Анализ ультразвуковых и патоморфологических данных свидетельствует о том, что характер ишемического поражения головного мозга зависит не только от тяжести перинатальной гипоксии, но и от зрелости ребенка [50]. У доношенных новорожденных ишемия мозга сопровождается возникновением избирательного нейронального некроза, субкортикальной и мультикистозной энцефаломаляциями, инфарктами мозга [51]. Тяжелая перинатальная гипоксия у недоношенных 34—37-й недель гестации, как правило, приводит к развитию перивентрикулярной лейкомаляции. В связи с выхаживанием глубоко недоношенных детей с ЭНМТ при УЗИ стали чаще выявлять такие формы ишемического повреждения, как диффузная лейкомаляция и перивентрикулярный геморрагический инфаркт. Следует отметить, что в первые 24—48 ч дебюта неонатального артериального ишемического инсульта данный метод не обладает достаточной чувствительностью и специфичностью, так как очаг ишемического поражения начинает появляться только на 2—3-и сутки от начала ишемии, что связано с ходом патогистологических процессов. Выраженность воспалительной реакции, интенсивность некроза и апоптоза достигают своего пика через 48—72 ч после нарушения кровообращения [52]. Это приводит к изменению эхогенности поврежденной мозговой паренхимы. Дальнейшая оценка эволюции ишемического очага не уступает по информативности магнитно-резонансной томографии (МРТ) [53, 54]. Повысить чувствительность УЗИ на ранних сроках церебрального повреждения помогает применение ультразвуковой допплерографии. Дуплексное сканирование позволяет объективно оценить гемодинамические характеристики церебральных сосудов. Ценность ультразвуковой допплерографической методики в остром периоде заболевания — выявление фазы вазодилатации, наиболее раннего признака ишемического повреждения, возникающего уже через 30 мин после развития сосудистой катастрофы и сохраняющегося в течение первых 5—6 сут [55]. Вазодилатация развивается в ответ на действие различных метаболитов и способствует увеличению поступления в ишемизированную ткань глюкозы и кислорода. Ее характерными признаками являются повышение скорости кровотока и снижение индексов периферического сопротивления в поврежденном сосудистом бассейне [56, 57]. МРТ стала наиболее информативным методом диагностики перинатальных повреждении головного мозга. Наличие различных импульсных последовательностей обеспечивает высокую чувствительность и специфичность, даже на ранних сроках развития сосудистой катастрофы [58, 59]. МРТ с получением диффузионно-взвешенных изображений и построением карт измеряемого коэффициента диффузии (ИКД) позволяет выявить ишемический очаг уже через 30 мин от момента его возникновения. ИКД служит количественной характеристикой диффузии в ткани и отражает наличие внутриклеточного отека [60]. Представленные диагностические методы необходимы для выявления, определения локализации, степени тяжести повреждения мозга и прогноза. Недостатками их являются короткий временной диагностический интервал и ограниченная возможность повторного исследования [61]. В течение последних 20 лет для прогнозирования исходов церебрального повреждения у новорожденных изучается диагностическая ценность биомаркеров [62, 63]. Учитывая патофизиологические изменения, происходящие в результате повреждения ткани головного мозга, были подробно изучены нейропротеины, кальций-связывающий белок, вазоактивные вещества, маркеры окислительного стресса, медиаторы воспаления и т. д. [64—67]. Однако, несмотря на перспективность изучения биомаркеров, отсутствуют данные о практическом их применении в медицине.
Лечение гипоксических поражений головного мозга является предметом жарких дискуссий и крайних мнений — от полного отказа в необходимости лечения нейротропными препаратами до агрессивной полипрагмазии [26]. Согласно современным воззрениям гипоксически-ишемическая энцефалопатия возникает при асфиксии, как правило, в структуре полиорганных расстройств, поэтому основной принцип терапии заключается в выведении ребенка из асфиксии и поддержании витальных функций [68]. Специфическое лечение гипоксически-ишемической энцефалопатии — терапия отека головного мозга и нейропротекция, которая подразумевает в первую очередь контроль объема цереброспинальной жидкости (ЦСЖ), церебральной перфузии и объема вещества мозга. Церебральная перфузия зависит от артериального притока, венозного оттока и интенсивности метаболизма нервной ткани. На этом этапе большое значение имеет адекватность проводимой искусственной вентиляции легких и эффективность гипотермии. Необходимо отметить, что гипотермия проводится у новорожденных с гестационным возрастом не менее 36 нед при наличии по крайней мере одного из признаков, изложенных в специальных критериях [69]. Контроль объема жидкости в ЦСЖ-путях осуществляется за счет торможения выработки ЦСЖ и улучшения ее оттока. Контроль объема мозга подразумевает усиление активного транспорта и стабилизацию мембран нейронов. Следует отметить, что на данный момент применение лекарственных препаратов в неонатологии ограничено из-за высокого риска развития побочных эффектов и отсутствия доказательной базы. Однако поиск таких препаратов продолжается по настоящее время. В частности, за последние два десятилетия произошли значительные изменения в понимании роли эритропоэтина в качестве нейропротектора. Доказано, что эритропоэтин участвует в нейрогенезе и ангиогенезе во время эмбрионального развития и активируется после травмы головного мозга [70], а также оказывает цитопротективное действие на эндотелиальные, глиальные клетки и нейроны [71]. Впервые нейропротективная роль эритропоэтина была выявлена в нескольких исследованиях in vitro и in vivo [72]. При этом удалось выяснить, что эритропоэтин обладает антиапоптотическим [73], антиоксидантным [74] и противовоспалительным эффектами [75]. Кроме того, он ослабляет эффекты воспаления, снижая реактивный астроцитоз и подавляя активацию микроглии, и уменьшает количество иммунных клеток в месте воспаления [76]. Известно, что отсутствие эндогенного эритропоэтина увеличивало ишемическое повреждение головного мозга и ухудшало выживаемость нейронов [77]. Установленные защитные эффекты эритропоэтина во время ишемии и реперфузии побудили использовать рекомбинантный эритропоэтин у недоношенных детей с церебральной ишемией, внутрижелудочковыми кровоизлияниями и перивентрикулярной лейкомаляцией [78]. Так, в одном из исследований оценивали эффективность и безопасность применения эритропоэтина при неонатальной гипоксически-ишемической энцефалопатии. В данное исследование были включены 167 новорожденных с умеренным и тяжелым церебральным поражением. Всех детей разделили на две группы. Дети первой группы получали стандартную терапию гипоксически-ишемической энцефалопатии, а детям второй группы к стандартной терапии был добавлен эритропоэтин в дозировке 300 и 500 ЕД/кг. Препарат вводили в первые 48 ч через день в течение 2 нед. Оказалось, что летальность и инвалидность на 19,2% чаще встречалась в группе детей, не получавших эритропоэтин [79].
Таким образом, проблема церебрального повреждения ишемического типа у недоношенных новорожденных является весьма актуальной. Прежде всего это подтверждается высокой частотой встречаемости данной патологии и большим риском летального исхода и инвалидизации детей. Остается открытым вопрос комплексной диагностики церебральных нарушений у недоношенных детей, потому как не существует единого алгоритма, объединяющего данные клинической картины, инструментальных и лабораторных методов исследования. Большой интерес представляет поиск предикторов неблагоприятного исхода с целью оптимизации лечебных подходов.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.