Гипоксическая ишемическая энцефалопатия новорожденного что это
Гипоксическая ишемическая энцефалопатия новорожденного что это
Гипоксически-ишемическая энцефалопатия (ГИЭ) встречается примерно у 1-6 из 1000 живорожденных и является самой важной проблемой неонатальной неврологии (Levene et al., 1985, Volpe, 2001, Ferriero, 2004). Гипоксически-ишемическая энцефалопатия (ГИЭ) относится к серьезным состояниям, при котором 15-20% пострадавших детей умирает в течение неонатального периода, а у 25% развиваются стойкие неврологические последствия (Volpe, 2008). Более двадцати лет назад было отмечено завышенное значение перинатальной гипоксии в этиологии задержки умственного развития и церебрального паралича (Freeman и Nelson, 1988, Вах и Nelson, 1993).
Badawi et al. (1998) обнаружили, что многие новорожденные подвергались антенатальным факторам риска, таким как лечение материнского бесплодия или заболеваний щитовидной железы, тогда как другие имели и анте-, и интранатальные факторы риска. Хотя не исключается возможность наличия пренатальных факторов риска, вероятно повышающих чувствительность ребенка к проблемам родового периода, в проспективном исследовании результатов MPT Cowan et al. (2003) было отмечено, что у большинства новорожденных (n=351) с неонатальной энцефалопатией повреждение мозга возникало в момент рождения или незадолго до этого.
Определение гипоксически-ишемической энцефалопатии (ГИЭ) сложное и роль асфиксии в родах трудно точно установить, так что и сам термин ставится под сомнение; вместо него предлагается неопределенное понятие «неонатальная энцефалопатия» (Nelson и Leviton, 1991, Leviton и Nelson, 1992, Badawi et al, 1998). Диагноз ГИЭ не должен устанавливаться без серьезной клинической основы и тщательного анализа альтернативных вариантов, потому что они могут играть роль в терапии и этиологии.
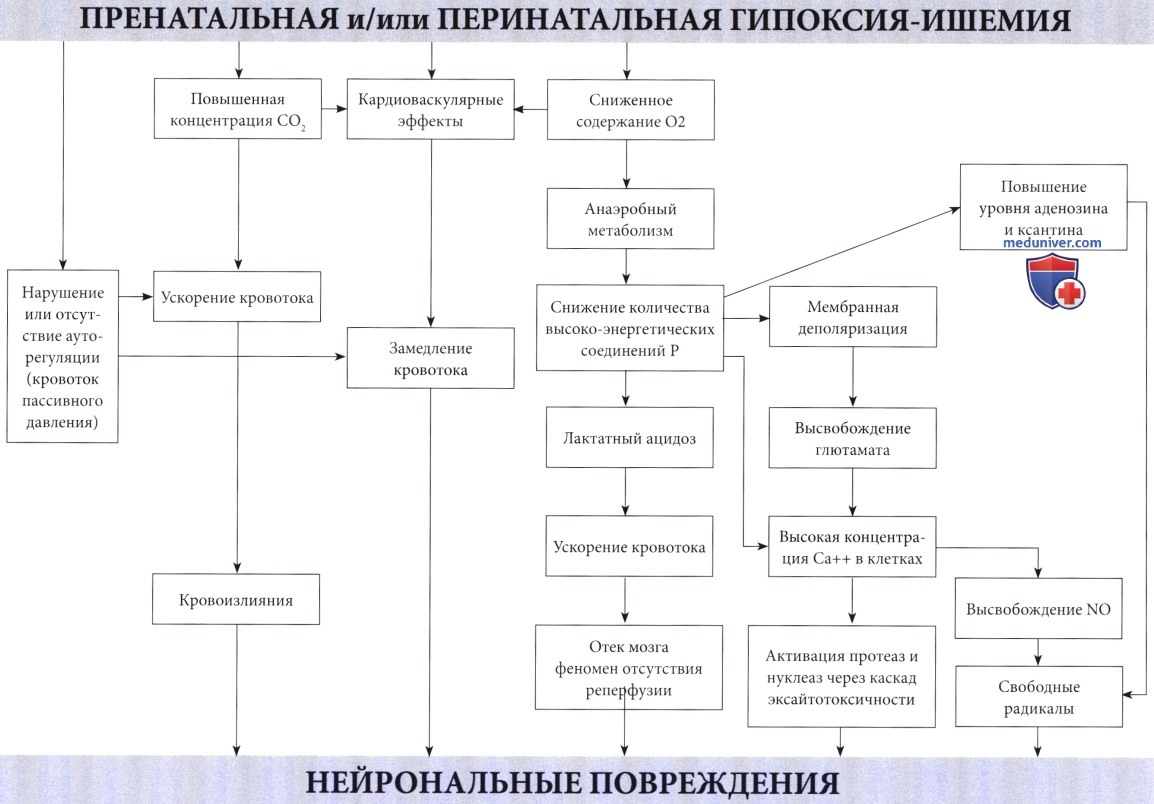
Патофизиология. Недостаточное поступление кислорода, вызывающее развитие гипоксической-ишемической энцефалопатии (ГИЭ), может возникнуть по двум механизмам: гипоксемия, т.е. ограниченный доступ кислорода в кровь; и ишемия, т.е. сниженная перфузия головного мозга. В большинстве случаев оба механизма связаны с асфиксией в виде гипоксии, сопровождающейся гиперкарбией (Altman et al., 1993). Обычно присутствующий при гипоксии ацидоз в значительной степени связан с повышенным образованием лактата. Преобразование глюкозы в молочную кислоту менее эффективно, чем окисление в цикле Кребса и митохондриальной системе транспорта электронов.
В результате окисления каждой молекулы глюкозы, переработанной в анаэробных условиях, образуется только две молекулы аденозина дифосфата (АДФ) по сравнению с 38 молекулами при аэробных условиях. Несмотря на значительное повышение скорости гликолиза и усиление мозгового кровотока из-за ацидоза и гиперкапнии (Laptook et al., 1988), потребности ткани мозга в кислороде не могут быть удовлетворены. Повышенная скорость гликолиза приводит к падению уровня глюкозы в мозге. Предупреждение этого состояния предварительным введением глюкозы повышает выработку АТФ и улучшает выживаемость (Vannucci и Yager, 1992). Однако избыточный уровень глюкозы в то же время приводит к повышенному образованию лактата, вредного для мозговой ткани взрослого, но, по-видимому, полезного для ЦНС новорожденного (Hattori и Wasterlain, 1990).
В итоге, в результате нехватки кислорода в клетках мозга снижается количество фосфокреатина и АТФ, конечных акцепторов электронов. Эти изменения были продемонстрированы у новорожденных с использованием фосфорной МРС (магнитно-резонансная спектроскопия) (Younkin et al., 1988, Laptook et al., 1989). Падение уровня высокоэнергетических соединений фосфата наблюдалось даже при стабилизации кардиопульмональной функции (Hope et al., 1984). В экспериментах на животных снижение уровня АТФ более чем на 30% происходило за 6 минут (Raichle, 1983). Также было отмечено накопление лактата, сохранявшееся в течение длительного периода времени (Groenendaal et al, 1994, Robertson et al., 1999).
Нейрональные повреждения являются следствием различных комбинаций кровоизлияний и некрозов.
Последние связаны с каскадом событий, инициированных высвобождением глютамата, приводящим к массивному входу кальция в клетки.
Образование оксида азота (NO), вероятно, также является важным фактором.
В действительности, нарушению мозговой функции предшествует сбой в энергетическом метаболизме (см. Volpe, 2001). При угрозе перебоев организм отвечает угнетением нейрональной активности по неопределенному механизму, но при длительной гипоксии этого недостаточно.
Однако мозг новорожденного чрезвычайно устойчив к гипоксии. При экспериментах на плодах обезьян потребовалось снижение сатурации кислорода на 90% в течение не менее 25 минут, чтобы вызвать повреждение ткани мозга. В результате, любой, достаточно тяжелый для повреждения мозга эпизод асфиксии вызывает нарушения и других органов, особенно сердца, и при таких условиях ишемия постоянна.
Ишемия оказывает влияние, подобное асфиксии (Painter, 1989). Процесс гликолиза ускоряется, но поглощению глюкозы препятствует нарушение кровотока, соответственно запасы высокоэнергетических фосфатов истощаются, и накапливается лактат.
Влияние гиперлактатемии многопланово. Первоначально оно благотворно, поскольку повышает приток крови к мозгу, но затем становится вредным, так как хотя бы отчасти влияет на отек мозга, который в свою очередь может сдавить капиллярное русло и вызвать ишемию (Myers, 1972). В то же время он нарушает ауторегуляцию церебрального кровообращения, приводя к мозговому кровотоку пассивного давления (Lou, 1988), что делает мозг более чувствительным к изменениям системного давления крови. Сочетание отека мозга и системной недостаточности кровообращения, вероятно, играет существенную роль в происхождении гипоксического повреждения ЦНС. Гипоксия обычно повышает долю сердечного выброса, предназначенную для головного мозга.
По мере усиления степени гипоксии наблюдается уменьшение сердечного выброса с последующей неспособностью поддерживать артериальное давление на необходимом уровне. Но показатели частоты сердечных сокращений и артериального давления остаются неизменными до тех пор, пока артериальная сатурация не снизится более, чем на 65%, а затем также линейно снижаются. Это снижение может поддерживаться на протяжении часов без развития энцефалопатии, если содержание кислорода в артериальной крови не упадет более, чем на 85% (Fenichel, 1997).
Механизм отека мозга и гипоксического повреждения у плодов до конца неясен. Levene et al. (1989) выявили хорошую корреляцию между высокой скоростью мозгового кровотока—предположительно отражающей церебральную гиперемию, которая, в свою очередь, может отвечать за повышение внутричерепного давления — и неблагоприятным течением. Lupton et al. (1988) показали, что отек в большей степени является следствием, чем причиной, нейрональных некрозов, объясняя, таким образом, ограниченную эффективность противоотечного лечения новорожденных с ГИЭ (Levene et al., 1987). Не было замечено различий в степени внутричерепной гипертензии у детей с ГИЭ в группе выживших и умерших (Goitein et al, 1983).
Последние данные подтверждают основную роль апоптоза в развитии гипоксически-ишемического повреждения мозга новорожденных, возможно, даже большую, чем некроз после повреждения. Во время неонатального поражения мозга токсичность возбуждающих медиаторов, оксидативный стресс и воспаление способствуют ускоренной гибели клеток, главным образом, посредством апоптоза или некроза, что зависит от области поражения и тяжести повреждения. В настоящее время известно, что ГИЭ состоит из двух последовательных стадий, с окончательным повреждением с отсрочкой на несколько часов во время второй из них, определяемой как вторичная недостаточность энергии. Тем не менее, профилактика возможна, как только появляется терапевтическое окно.
Механизмы повреждения и некроза клеток при гипоксии и ишемии не просто итог энергетической недостаточности. Это вторичные пусковые факторы каскада разрушительных событий при достижении критического уровня дефицита энергии. Такие события происходят в течение нескольких часов. Избыточная мембранная деполяризация и высвобождение возбуждающих аминокислотных нейротрансмиттеров, в первую очередь глютамата (Lipton и Rosenberg, 1994), приводит к массивному входу кальция через NMDA и АМРА мембранные рецепторы (Morley et al., 1994) и к накоплению кальция в цитозоле. Кальций, в свою очередь, активирует различные липазы, протеазы и нуклеазы с последующим разрушением основных клеточных белков. Свободные радикалы прямо или косвенно вызваны повышенным уровнем кальция в цитозоле (McCord, 1985) и оксида азота (Dawson et al., 1992), играющего главную роль в их образовании.
Этот каскад возбуждающих медиаторов в конечном счете приводит к повреждению мембраны, разрушению цитоскелета и, наконец, к дезинтеграции клетки.
Теоретически существует возможность предотвращения многих процессов, поэтому проводились исследования с различными средствами, в том числе блокаторами кальциевых каналов (Miller, 1993, Palmer и Vanucci, 1993); антагонистами возбуждающих аминокислот (Hattori et al., 1989), особенно магнезией (Marret et al., 1995, Nelson и Grether, 1995); ингибиторами синтеза оксида азота (Dawson et al., 1992); акцепторами свободных радикалов (Palmer и Vannucci, 1993) и веществами, подавляющими образование свободных радикалов типа аллопуринола (Palmer et al., 1990, van Bel et al., 1998, Benders et al., 2006).
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
Гипоксически-ишемическая энцефалопатия, ГИЭ
Повреждение головного мозга – гипоксия или асфиксия
Нарушения могут включать в себя эпилепсию, задержку развития, двигательные нарушения, психомоторную задержку и когнитивные нарушения. Как правило, тяжесть нарушений не может быть определена, пока ребенок не достигнет возраста трех-четырех лет.
Длительное время считалось, что асфиксия является основной причиной ДЦП, но два исследования показали, что только 9% случаев являются прямым результатом асфиксии. В оставшихся 91% случаев такие факторы, как преждевременные роды, осложнения во время родов или проблемы сразу же после рождения вызывают ДЦП. В некоторых случаях причина может не быть окончательно определена.
Когда возникает гипоксически-ишемическая энцефалопатия?
В 40 недель степень гипоксии повлияет на область поражения головного мозга; легкая гипоксия повлияет на парасагиттальной белое вещество, а тяжелая гипоксия влияет на скорлуу, таламус и парацентральное белое вещество. Область пораженного мозга будет иметь значительное влияние на симптомы, которые ребенок испытывает.
Каковы факторы риска и причины гипоксически-ишемической энцефалопатии?
Асфиксия является наиболее значимым фактором риска для ГИЭ. От степени и продолжительности кислородного голодания зависит, разовьется гипоксически-ишемическая энцефалопатия или нет, и насколько серьезными будут последствия. Факторы, могут привести к асфиксии:
Инсульт плода также увеличивает вероятность развития гипоксии-ишемической энцефалопатии. Факторы, которые могут привести к инсульта плода включают в себя:
Как поставить диагноз гипоксически-ишемической энцефалопатии?
При подозрении на гипоксически-ишемическую энцефалопатию проводятся методы нейровизуализации, чаще всего магнитно-резонансная томография.
Для того, чтобы выполнить эти исследования, врачи должны сначала заподозрить гипоксически-ишемическую энцефалопатию. Если роды были травматические, или если значительные факторы риска, такие как инсульт плода были известны во время беременности, гипоксически-ишемическая энцефалопатия может быть заподозрена при рождении. В противном случае, родители, врачи, воспитатели должны обратить внимание на видимые признаки, которые могут развиваться в течение длительного времени – задержку психо-моторного развития и задержку роста.
Некоторые признаки могут появиться вскоре после рождения. Дисфункция органов, особенно сердца, легких, почек, печени и крови будут указать возможность развития ГИЭ. Судороги в первые 24 часов жизни также может указывать на вероятность гипоксически-ишемической энцефалопатии.
Как лечится гипоксически-ишемическая энцефалопатия?
Лечение гипоксически-ишемической энцефалопатии сосредоточено на оказании помощи ребенку адаптироваться к нарушениям, которые возникают в результате травмы головного мозга. Методы реабилитации обычно используются для лечения церебрального паралича, вызванного гипоксической-ишемической энцефалопатией.
Асфиксия обычно вызывает стойкое повреждение, которое иногда продолжает прогрессировать даже после выхода из асфиксии. Чтобы предотвратить дальнейшее повреждение ребенка может быть медицинской контролировать, чтобы:
Как предотвратить гипоксически-ишемическую энцефалопатию?
Профилактические меры должны быть приняты во время беременности и во время родов включают в себя:
Четыре типа травмы или пороков развития головного мозга, которые вызывают ДЦП
Перивентрикулярная лейкомаляция
Повреждение белого вещества ткани мозга Перивентрикулярная лейкомаляция »
Перинатальная энцефалопатия
Перинатальная энцефалопатия – это различные поражения центральной нервной системы, возникшие в период внутриутробного развития, во время родов или в раннем неонатальном периоде. Перинатальная энцефалопатия может заявлять о себе синдромом угнетения или гипервозбудимости ЦНС, двигательными нарушениями, гипертензионно-гидроцефальным, судорожным, вегето-висцеральным синдромом, задержкой темпов моторного, психического и речевого развития. Диагностика перинатальной энцефалопатии включает нейросонографию, допплерографию, МРТ и КТ головного мозга, ЭЭГ. Лечение перинатальной энцефалопатии предполагает проведение посиндромной медикаментозной терапии, повторных курсов массажа, ЛФК, логопедической коррекции.
Общие сведения
Перинатальная энцефалопатия (ПЭП) – мозговая дисфункция, вызванная гипоксическим, травматическим, инфекционным, токсико-метаболическим воздействием на ЦНС плода и новорожденного. Использование собирательного термина «перинатальная энцефалопатия» в детской неврологии и педиатрии обусловлено схожестью клинической картины, развивающейся при различных механизмах повреждения головного мозга. Поэтому, строго говоря, формулировка «перинатальная энцефалопатия» не является диагнозом и требует дальнейшего синдромологического анализа.
В структуре патологии нервной системы детского возраста перинатальная энцефалопатия составляет более 60%. Последствия перинатальной энцефалопатии у детей могут варьировать от минимальной мозговой дисфункции и вегето-сосудистой дистонии до гидроцефалии, ДЦП и эпилепсии.
Причины
Ведущей причиной повреждения головного мозга плода и новорожденного в перинатальном периоде выступает внутриутробная гипоксия. Т. о., перинатальная энцефалопатия может являться следствием:
Кроме этого, перинатальная гипоксическая энцефалопатия может развиваться и в первые дни после рождения, например, при синдроме дыхательных расстройств, врожденных пороках сердца, сепсисе новорожденных и т. д.
Патогенез
Независимо от непосредственной причины, во всех случаях гипоксического поражения ЦНС пусковым механизмом служит недостаток кислорода. Другие дисметаболические нарушения (ацидоз, гипогликемия, гипо- или гипернатриемия, гипо-/ гипермагниемия, гипокальциемия) обычно возникают вслед за гипоксическим поражением ЦНС.
Классификация
В течении перинатальной энцефалопатии выделяют острый период (первый месяц жизни), ранний восстановительный (до 4-6 месяцев) и поздний восстановительный периоды (до 1-2-х лет) и период остаточных явлений.
К основным клиническим синдромам перинатальной энцефалопатии относятся синдром двигательных расстройств, синдром повышенной нервно-рефлекторной возбудимости (синдром гипервозбудимости), синдром угнетения ЦНС, гипертензионно-гидроцефальный синдром, судорожный синдром, вегето-висцеральный синдром.
При определении степени тяжести перинатальной энцефалопатии учитывается оценка состояния новорожденного по шкале АПГАР:
Симптомы перинатальной энцефалопатии
Ранние признаки перинатальной энцефалопатии могут быть выявлены неонатологом сразу после рождения ребенка. К ним относятся слабый или поздний крик новорожденного, длительный цианоз, отсутствие сосательного рефлекса, изменения двигательной активности и др.
Клиника легкой формы перинатальной энцефалопатии включает повышенную спонтанную двигательную активность новорожденного, трудности засыпания, поверхностный беспокойный сон, частый плач, мышечную дистонию, тремор подбородка и конечностей. Перечисленные нарушения обычно обратимы и регрессируют в течение первого месяца жизни.
Синдром угнетения ЦНС при среднетяжелой форме перинатальной энцефалопатии протекает с вялостью, гипорефлексией, гиподинамией, диффузной мышечной гипотонией. Типично наличие очаговых неврологических расстройств: анизокории, птоза, сходящегося косоглазия, нистагма, нарушения сосания и глотания, асимметрии носогубных складок, асимметрии сухожильно-надкостничных рефлексов. Гипертензионно-гидроцефальный синдром характеризуется напряжением и выбуханием большого родничка, расхождением швов, увеличением окружности головы, нарушением сна, пронзительными вскрикиваниями. Неврологические расстройства при среднетяжелой перинатальной энцефалопатии частично регрессируют к позднему восстановительному периоду.
Тяжелая степень перинатальной энцефалопатии сопровождается адинамией, мышечной гипотонией вплоть до атонии, отсутствием врожденных рефлексов, реакции на болевые раздражители, горизонтальным и вертикальным нистагмом, аритмичным дыханием и пульсом, брадикардией, артериальной гипотонией, приступами судорог. Тяжелое состояние ребенка может сохраняться от нескольких недель до 2-х месяцев. Исходом тяжелой перинатальной энцефалопатии, как правило, является та или иная форма неврологической патологии.
В раннем и позднем восстановительном периодах перинатальной энцефалопатии встречаются синдромы: церебрастенический (астеноневротический), двигательных нарушений, судорожный, вегегативно-висцеральный, гипертензионно-гидроцефальный.
Синдром двигательных нарушений может проявляться мышечным гипо-, гипертонусом или дистонией, гиперкинезами, парезами и параличами. Астеноневротическому синдрому соответствуют нарушения сна, эмоциональная лабильность, двигательное беспокойство ребенка.
Судорожный синдром в восстановительном периоде перинатальной энцефалопатии может выражаться не только непосредственно судорогами, но и мелкоамплитудным дрожанием, автоматическими жевательными движениями, кратковременной остановкой дыхания, спазмом глазных яблок и т. д.
Вегето-висцеральная дисфункция при перинатальной энцефалопатии проявляется микроциркуляторными нарушениями (бледностью и мраморностью кожных покровов, преходящим акроцианозом, холодными конечностями), желудочно-кишечными дискинезиями (срыгиванием, диспепсией, кишечными коликами и др.), лабильностью сердечно-сосудистой системы (тахикардией, брадикардией, аритмией) и т. д.
Исходом перинатальной энцефалопатии у детей может являться выздоровление, темповая задержка развития (ЗПР, ЗРР), минимальная мозговая дисфункция, синдром дефицита внимания и гиперактивности (СДВГ), грубые органические поражения ЦНС (ДЦП, эпилепсия, олигофрения, прогрессирующая гидроцефалия).
Диагностика
Признаки перинатальной энцефалопатии обычно выявляются при осмотре и объективном обследовании ребенка педиатром или детским неврологом. При этом важно учитывать данные о течении беременности, родов, состоянии ребенка сразу после рождения. Однако для определения характера поражения головного мозга и оценки степени тяжести перинатальной энцефалопатии требуется проведение дополнительных лабораторных и инструментальных исследований.
В целях изучения показателей метаболизма проводится определение КОС и газового состава крови, уровня глюкозы, электролитов, анализ состава спинномозговой жидкости.
Для уточнения гипоксически-ишемических изменений мозговой ткани, обнаруженных при НСГ, проводится КТ или МРТ головного мозга ребенку. С целью оценки кровоснабжения головного мозга выполняется допплерография сосудов шеи ребенку и дуплексное сканирование артерий головы. ЭЭГ ребенку представляет наибольшую ценность в диагностике перинатальной энцефалопатии, протекающей с судорожным синдромом. При необходимости обследование ребенка может дополняться ЭхоЭГ, РЭГ, электронейромиографией, рентгенографией шейного отдела позвоночника.
Ребенку с перинатальной энцефалопатией необходима консультация окулиста с исследованием глазного дна. При задержке психического и речевого развития показана консультация детского психолога и логопеда.
Лечение перинатальной энцефалопатии
В остром периоде лечение ребенка с перинатальной энцефалопатией осуществляется в отделении патологии новорожденных. Ребенку показан щадящий режим, оксигенотерапия, при необходимости – зондовое питание.
Медикаментозная терапия назначается с учетом преобладающих синдромов перинатальной энцефалопатии. Для уменьшения внутричерепной гипертензии проводится дегидратационная терапия (маннитол), вводятся кортикостероиды (преднизолон, дексаметазон и др.), выполняются лечебные спинномозговые пункции.
С целью нормализации метаболизма нервной ткани и повышения ее устойчивости к гипоксии осуществляется инфузионная терапия – введение растворов глюкозы, калия, кальция, аскорбиновой кислоты, препаратов магния и т. д. Для борьбы с судорогами используется фенобарбитал, диазепам и др. В рамках терапии перинатальной энцефалопатии показано назначение препаратов, улучшающих кровообращение и метаболизм головного мозга (винпоцетина, пирацетама, кортексина, депротеинизированного гемодеривата крови телят и др.).
В восстановительном периоде лечение ребенка с перинатальной энцефалопатией, как правило, осуществляется амбулаторно или в условиях дневного стационара. Проводятся повторные курсы лекарственной терапии ноотропными препаратами и ангиопротекторами, лечебная физкультура, плавание, массаж, физиопроцедуры (амплипульстерапия, электрофорез), гомеопатическая терапии, фитотерапия, остеопатия.
Профилактика перинатальной энцефалопатии
Полное выздоровление, как исход легкой степени перинатальной энцефалопатии наступает у 20-30 % детей. В остальных случаях в резидуальном периоде развиваются те или иные неврологические синдромы. Серьезность последствий зависит от характера и тяжести повреждения, своевременности и полноты оказания лечебной помощи. Высокая пластичность ЦНС у детей обусловливает большой резерв для восстановления нарушенных функций в первые месяцы жизни, поэтому крайне важно начать лечение как можно раньше даже при минимальных проявлениях перинатальной энцефалопатии.
Профилактика перинатальной энцефалопатии включает минимизацию факторов риска при беременности и родоразрешении. Основной задачей будущей мамы и акушеров-гинекологов на этапе ведения беременности служит предупреждение внутриутробной гипоксии, что может быть достигнуто терапией хронических заболеваний, коррекцией патологического течения беременности. Во время родов необходимо проводить профилактику интранатального травматизма плода.
Гипоксически-ишемическая энцефалопатия у детей
Необходимо также учитывать время, прошедшее с момента последнего кормления, так как после насыщения ребенок расслаблен, у него может быть снижен мышечный тонус и ряд рефлексов и реакций, а перед кормлением новорожденный может находиться в состоянии относительной гипогликемии, ведущей к беспокойству, тремору и повышению мышечного тонуса.
Коммуникабельность новорожденного как основной показатель общей активности оценивается по реакции неудовольствия при наличии дискомфорта (насильственное пробуждение, голод, мокрые пеленки и т. д.) и скорости успокоения при устранении раздражающих факторов, а также по ответу на позитивные стимулы (ответ на обращенную ласковую речь, поглаживание, взятие на руки).
Существенное значение в определении коммуникабельности и поведения новорожденного имеют взаимодействие ребенка и врача, и поэтому велика роль не только реакций новорожденного, но и настойчивость врача в их получении, его позитивность в отношении ребенка при осмотре. Для оценки коммуникабельности ребенка важна разница слуховой и зрительной реакции на одушевленные (лицо и голос врача) и неодушевленные (искусственные и естественные источники света, трещотка, звонок, хлопок) раздражители. Наличие поискового, ладонно-ротового, хватательных рефлексов и рефлекса Бабинского свидетельствует о наличии тактильной чувствительности. Покалывание ребенка иглой вызывает нахмуривание бровей, сжимание глаз, наморщивание носогубной борозды, открытие рта, надувание губ, растягивание рта, напряжение языка, дрожание подбородка, крик, а также двигательную реакцию: флексия с аддукцией конечностей. Болевая реакция возникает через несколько секунд после нанесения раздражения, что обусловлено медленной проводимостью по нервам новорожденного в силу недостаточной миелинизации.
Снижение перечисленных реакций может являться либо признаком угнетения центральной нервной системы в результате ряда соматических и неврологических заболеваний, либо поражения соответствующего анализатора. Так, отсутствие реакции на боль может быть следствием наследственной сенсорной полиневропатии.
Среди признаков общей активности ребенка необходимо отметить спонтанную двигательную активность. Ее оценка достаточно субъективна и зависит от опыта врача, объективизация же возможна лишь при анализе видеозаписи активности в течение 1 ч. Обычно спонтанные движения заключаются в периодическом сгибании и разгибании ног, их перекресте, отталкивании от опоры; движения рук на уровне груди в локтевых и лучезапястных суставах со сжатием кулаков. Наличие хореоатетоидного компонента в движениях, являющееся физиологическим для новорожденных детей, свидетельствует о преобладании экстрапирамидной (стриарной) моторики и заключается в беспокойстве языка, растопыривании и независимых друг от друга движениях пальцев.
Мимика новорожденного достаточно богата и, как правило, симметрична и заключается в сжимании глаз, нахмуривании лба, углублении носогубных складок, напряжении языка, открывании рта. Асимметрия лица возможна в первые сутки вследствие особенностей прохождения головы ребенка через родовые пути. C другой стороны, асимметрия лица может быть обусловлена поражением краниальной иннервации.
Врач изучает зрачки ребёнка, движение глазного яблока, состояние глазной щели и др., симметрию открывания рта при зевании и крике, глотание, крик, мышцы языка.
Необходимо отметить, что тремор как периодическое колебание вокруг фиксированной оси определенной амплитуды и частоты встречается почти у половины новорожденных. Низкоамплитудный высокочастотный тремор при крике или возбужденном состоянии новорожденного, а также в некоторых стадиях сна, является физиологическим явлением. По распространенности тремор может захватывать подбородок, язык, а также конечности.
Мышечный тонус является важнейшей характеристикой двигательной активности новорожденного. Можно говорить об активном мышечном тонусе ребенка (поза) и пассивном, величина которого определяется при проверке подвижности в суставах. У здорового доношенного ребенка отмечается так называемая эмбриональная поза вследствие флексорного повышения тонуса (руки согнуты во всех суставах, приведены к туловищу и прижаты к грудной клетке, кисти сжаты в кулаки, большие пальцы кистей рук лежат под четырьмя остальными; ноги согнуты в суставах и отведены в бедрах, в стопах преобладает тыльное сгибание). В ряде случаев отмечаются преимущественное физиологическое повышение мышечного тонуса в руках по сравнению с ногами и экстензия шеи. Об активном мышечном тонусе новорожденного можно судить также при удержании ребенка в воздухе лицом вниз, при этом голова ребенка располагается на одной линии с туловищем, руки ребенка слегка согнуты, а ноги вытянуты. «Проваливание» головы ребенка при его подтягивании за плечевой пояс (симптом «вялых плеч») у доношенных новорожденных возникает как при гипоксических парасагиттальных поражениях головного мозга, так и при травме шейного отдела спинного мозга.
Оценка рефлекторной деятельности осуществляется на основании как минимум трехкратной проверки данного рефлекса. При сохранении амплитуды рефлекса во всех трех пробах или незначительном снижении амплитуды в третьей рефлекс считается нормальным; при низком исходном значении амплитуды, сохраняющимся в трех пробах или прогрессивно снижающимся при повторном тестировании рефлекса, а также при необходимости повторной стимуляции для получения рефлекса он считается сниженным.
Тестирование брюшных и кремастерных рефлексов имеет ограниченную ценность в неонатологии из-за их непостоянства по выявляемости и выраженности.
Необходимо отметить, что динамическое изучение состояния нервной системы здоровых новорожденных свидетельствует о наличии почти у половины детей транзиторных физиологических изменений в неврологическом статусе ребенка. Поэтому для отнесения того или иного отклонения в неврологическом статусе новорожденного к категории физиологических или патологических необходимы его оценка в связи с другими явлениями, динамическое наблюдение, а в ряде случаев использование адекватных дополнительных методов исследования.