Гипогликемия у новорожденных что это такое
Гипогликемия у новорожденных что это такое
Гипогликемия — типичная проблема у новорождённых, однако у детей после этого периода встречается намного реже. Она обычно определяется при концентрации глюкозы в плазме менее 2,6 ммоль/л, хотя развитие клинических признаков будет зависеть от того, насколько могут использоваться другие источники энергии. Клинические признаки включают:
• повышенное потоотделение;
• бледность;
• признаки раздражения ЦНС, в том числе головную боль, судороги и кому. Неврологические последствия могут быть перманентными, если гипогликемия сохраняется, и включают эпилепсию, выраженные сложности в обучении и микроцефалию. Риск максимально высок в раннем детском возрасте, в период наиболее интенсивного развития головного мозга.
У детей имеются высокие энергетические потребности и относительно небольшие резервы глюкозы вследствие глюконеогенеза и глюкогенеза. Они имеют риск гипогликемии натощак. Младенцы никогда не должны голодать более 4 ч, например, в предоперационном периоде. Необходимо проверить уровень глюкозы в крови у тех детей, которые:
• имеют признаки септицемии или выглядят серьёзно больными;
• у которых наблюдаются продолжительные судорожные припадки;
• у которых развивается нарушение сознания. Это часто производится у постели пациента с использованием полосок, чувствительных к глюкозе, точность которых увеличивается при использовании глюкометра. Однако полоски только указывают на то, что уровень глюкозы находится в пределах низкого диапазона значений и любое указание на низкое значение должно всегда проверяться лабораторным измерением.
Если причина гипогликемии не установлена, жизненно важно производить забор крови во время гипогликемии. Кроме того, первая полученная порция мочи направляется для анализа, для того чтобы не упустить ценную возможность для установления диагноза.
Исследования, которые необходимо провести при наличии гипогликемии:
• Кровь:
— Подтверждение гипогликемии лабораторным исследованием содержания глюкозы в крови.
— Определение содержания ГР, кортизола, инсулина, С-пептида, жирных кислот, ацетоацетата, 3-гид-роксибутирата, глицерина, аминокислот с разветвлёнными цепями, ацетилкарнитинового профиля, лактата, пирувата.
• Первая моча после гипогликемии:
— Определение содержания органических кислот.
— Рассмотреть возможность сохранения крови и мочи для токсикологического анализа, например, салицилатов, сульфонилурии.
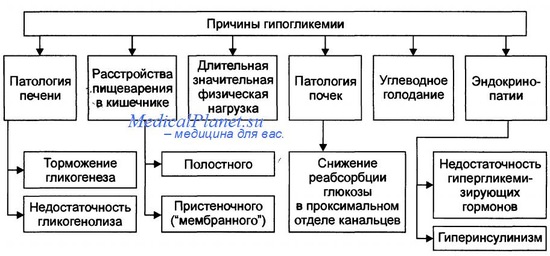
Причины гипогликемии после неонатального периода:
• Голодание
• Избыток инсулина:
— Избыточное экзогенное поступление инсулина, например, при сахарном диабете (скрытое поступление инсулина).
— Опухоли / повышение функции b-клеток — ПГГМ (ранее называемый гиперплазией островковых клеток поджелудочной железы), инсулинома.
— Индуцированный приёмом лекарственных препаратов.
— Аутоиммунный (антитела к рецепторам инсулина).
— Синдром Беквита (синдром висцеромегалии и офтальмоцеле).
• Без гиперинсулинемии:
— Заболевания печени.
— Кетотическая гипогликемия детского возраста.
— Врождённые нарушения метаболизма, например, нарушения накопления гликогена.
— Гормональный дефицит: ГР, АКТГ, болезнь Аддисона, врождённая гиперплазия надпочечников.
• Реактивная (не в результате голодания):
— Галактоземия.
— Чувствительность к лейцину.
— Непереносимость фруктозы.
— Материнский диабет.
— Гормональный дефицит.
— Отравление аспирином / алкоголем.
P.S. АКТГ — адренокортикотропный гормон. ГР — гормон роста. ПГГМ — персистирующий гипогликемический гиперинсулинизм младенцев.
Кетотическая гипогликемия — плохо определяемое понятие, при котором у маленьких детей появляется склонность к гипогликемии после короткого периода голодания, возможно, вследствие ограниченных резервов для глюконеогенеза. Ребёнок часто невысокого роста и худой, уровень инсулина у него низкий. Регулярные лёгкие закуски и напитки с дополнительной глюкозой при болезни обычно могут предотвратить гипогликемию. Это состояние проходит само собой в дальнейшей жизни.
Некоторые редкие эндокринные и метаболические нарушения могут проявляться гипогликемией практически в любом возрасте у детей. Гепатомегалия заставляет подозревать возможность врождённого нарушения накопления гликогена, при котором может быть выраженная гипогликемия.
Персистирующий гипогликемический гиперинсулинизм младенцев (ПГГМ), который ранее назывался гиперплазией островковых клеток поджелудочной железы) — редкое заболевание в младенчестве, при котором имеется мутация ионных каналов, приводящая к нарушению регуляции выброса инсулина островковыми клетками поджелудочной железы, что приводит к выраженной не-кетотической гипогликемии.
Лечение гипогликемии у детей
Гипогликемию обычно можно скорректировать внутривенной инфузией глюкозы (2-4 мл/кг 10% декстрозы). Необходимо предпринять меры по избеганию введения избыточного объёма, поскольку раствор является гипертоническим. Если происходит задержка начала инфузии или отсутствует ответная реакция, внутримышечно вводится глюкагон (0,5-1 мг).
Глюкокортикоиды могут также применяться, если есть вероятность гипопитуитаризма или гипоадренализма. Коррекция гипогликемии всегда должна быть документирована с удовлетворительными результатами лабораторного анализа глюкозы.
Гипогликемия:
• Должна быть исключена у любого ребёнка с септицемией, находящегося в тяжёлом состоянии, в продолжительном эпилептическом припадке или при нарушении уровня сознания.
• Низкий уровень глюкозы крови при тестировании возле кровати пациента (тест-полосками) должен быть подтверждён лабораторными данными.
• Если причина неизвестна, необходимо произвести забор диагностических образцов крови и мочи, если возможно, одновременно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Причины снижения уровня глюкозы в крови
| Статья подготовлена Михаилом Астаховым, врач анестезиолог-реаниматолог, высшей категории. Специально для сайта medprostor.by |
Содержание:
Гипогликемия — понижение сахара в крови. Симптомы развиваются постепенно, в течение 20-60 минут. Встречается преимущественно у лиц, страдающих сахарным диабетом I типа (инсулинозависимый) при нарушении правил заместительной терапии. Иногда возникает у беременных женщин или новорожденных детей. Минимальным приемлемым показателем глюкозы крови считается 3,3 ммоль/л. При декомпенсированном СД симптомы падения сахара в крови у человека возникают уже при 4,5 ммоль/л. В самых тяжелых случаях явления гипогликемии могут отмечаться при 6-7 ммоль/л.
Клинические признаки понижения уровня глюкозы
Падение сахара в крови, независимо от причин, имеет симптомы:
снижение интеллектуальных способностей;
туман, мушки перед глазами;
резкое, неудержимое чувство голода.
При осмотре пациента обнаруживается потливость, скачок артериального давления, тахикардия, бледность кожи. При возникновении гипогликемической комы — нарушение дыхания, сознания, сердечного ритма.
Причины снижения сахара в крови
Наиболее распространенная причина понижения глюкозы в крови — отсутствие приема пищи после инъекции инсулина у пациентов, страдающим сахарным диабетом. На долю подобных случаев приходится около 90% всех эпизодов диагностированной гипогликемии. Гормон, попадая в кровоток, способствует расщеплению и усвоению углеводов тканями. При этом их плазменный уровень критически снижается. Признаки патологии возникают при резком падении уровня сахаров с высоких цифр до низких или нормальных для здорового человека показателей (например, с 18-19 до 5-6 ммоль/л у диабетиков).
К числу других возможных причин резкого падения сахара в крови у пациентов с СД относится:
Гипогликемия у новорожденных
Причины снижения сахара в крови у детей начального периода жизни:
синдром новорожденного от матери, страдающей классическим или гестационным диабетом;
ятрогенная неонатальная гипогликемия;
другие преходящие и неуточненные нарушения углеводного обмена.
Подобные нарушения обусловлены особенностями выработки и потребления сахаров организмом ребенка. Потребление глюкозы в раннем постнатальном периоде составляет около 7 г/кг веса в сутки. Недостаточное ее поступление провоцирует активизацию процессов гликогенолиза и глюкогеногенеза, что в дальнейшем может иметь непредсказуемые последствия.
Гипогликемия у здорового человека
Порой сахар в крови падает у беременных. Это обусловлено гормональной перестройкой организма, при которой возникает гиперпродукция инсулина поджелудочной железой. Кроме того, причиной низкого сахара в крови у женщины может быть недостаточность питания. Плод потребляет достаточно большое количество глюкозы. Если расход не компенсируется за счет пищи, концентрация сахаров во внутренней среде снижается.
У людей без сахарного диабета причиной гипогликемии становится инсулинома — гормонопродуцирующая опухоль поджелудочной железы. При этом концентрация инсулина в организме увеличивается, содержание сахаров снижается. Иногда падение уровня глюкозы возникает при экстремальном голодании, когда организм оказывается неспособен компенсировать недостаток углеводов за счет внутренних резервов.
Гипогликемия у новорожденных что это такое
А. Определение. Гипогликемия — это снижение концентрации глюкозы в крови до уровня 2,2 ммоль/л (в сыворотке или плазме 2,5 ммоль/л ). Гипогликемия — одна из самых частых причин смерти новорожденных и тяжелых нарушений ЦНС у детей. Это неотложное состояние, требующее своевременной диагностики и активного лечения.
1. Гипогликемия у новорожденных (проявляется сразу после рождения или в первые 3—5 дней жизни ребенка) может быть обусловлена недоношенностью, внутриутробной задержкой развития или врожденными нарушениями углеводного обмена. Непосредственные причины гипогликемии у новорожденных:
а. Дефицит веществ — источников глюкозы (например, гликогена).
б. Наследственные дефекты ферментов метаболизма углеводов (например, глюкозо-6-фосфатазы, участвующей в образовании глюкозы из гликогена).
г. Дефицит контринсулярных гормонов.
2. Гипогликемия у грудных детей и детей старшего возраста встречается реже. Возможные причины:
б. Врожденные нарушения обмена углеводов.
в. Приобретенное эндокринное заболевание (например, первичная надпочечниковая недостаточность).
г. Голодание, употребление алкоголя, введение инсулина, случайный прием пероральных сахаропонижающих лекарственных средств.
Г. Классификация гипогликемии представлена в табл. 33.1.
Д. Группы высокого риска преходящей гипогликемии:
3. Новорожденные, родившиеся от матерей, больных инсулинозависимым сахарным диабетом или перенесших диабет беременных.
4. Новорожденные с тяжелым заболеванием (гемолитическая болезнь новорожденных, болезнь гиалиновых мембран).
Е. Распространенность гипогликемии: 1,5—3 случая на 1000 новорожденных; в группах высокого риска распространенность во много раз выше. Преходящая гипогликемия отмечается у 2 из 3 недоношенных маловесных новорожденных. Основная причина — дефицит источников глюкозы (гликогена, белков и жиров) в сочетании с дефектами ферментов глюконеогенеза в печени. Гиперинсулинемии и нарушений секреции контринсулярных гормонов у недоношенных маловесных новорожденных обычно не бывает. Преходящая гипогликемия наблюдается также у 80—90% детей, родившихся от матерей, больных инсулинозависимым сахарным диабетом или перенесших диабет беременных. У 10—20% детей из групп высокого риска развивается стойкая тяжелая гипогликемия.
А. Симптомы гипогликемии у новорожденных и грудных детей: вялость, сонливость, фасцикуляции, небольшое снижение температуры тела, вялое сосание, цианоз, апноэ, судороги. Очень важно отличить гипогликемию от других заболеваний, проявляющихся такими же симптомами (сепсиса, асфиксии, кровоизлияния в желудочки мозга, врожденных пороков сердца, последствий медикаментозного лечения матери). Дифференциально-диагностические признаки гипогликемии: низкий уровень глюкозы во время появления симптомов; исчезновение симптомов при нормализации уровня глюкозы; возобновление симптомов при снижении уровня глюкозы (триада Уиппла).
Б. У детей старшего возраста гипогликемия проявляется как у взрослых. Выделяют две группы симптомов:
1. Раздражительность, беспокойство, слабость, чувство голода, потливость, тремор, тахикардия, боли в области сердца, тошнота и рвота (обусловлены усилением секреции адреналина).
2. Оглушенность, сонливость, спутанность сознания, нарушения концентрации внимания, дизартрия, афазия, головная боль, изменения личности, судороги, потеря сознания, кома (обусловлены углеводным голоданием головного мозга).
В. У новорожденных и грудных детей симптомы гипогликемии обычно выражены не так ярко, как у детей старшего возраста.
Г. Преходящая гипогликемия у новорожденных может быть бессимптомной.
III. Критерии лабораторного диагноза гипогликемии
А. Опасная гипогликемия у доношенных новорожденных: концентрация глюкозы в крови Б. Опасная гипогликемия у недоношенных и маловесных новорожденных: концентрация глюкозы в крови В. Настораживающая гипогликемия у новорожденных: у ребенка в возрасте до 5 дней концентрация глюкозы в крови Г. Опасная гипогликемия у детей старше 5 дней: концентрация глюкозы в крови IV. Преходящая гипогликемия у новорожденных
А. Ведение больных и прогноз. У новорожденных с симптомами гипогликемии и у всех новорожденных из групп высокого риска (см. гл. 33, п. I.Д) определяют содержание глюкозы в крови с помощью тест-полосок. Если уровень глюкозы оказался ниже нормы, берут кровь для лабораторного исследования. Если диагноз гипогликемии подтвержден, назначают глюкозу в/в в виде инфузии. Преходящая гипогликемия обычно возникает в первые 6—10 ч жизни. Возникновению гипогликемии способствует задержка кормления. При правильном лечении гипогликемия проходит через 2—3 дня, после чего инфузию глюкозы постепенно прекращают. Прогноз при преходящей гипогликемии благоприятный. Тяжелых неврологических последствий не бывает, но возможны минимальные нарушения интеллекта.
Б. Важнейшие правила лечения
1. Инфузию глюкозы начинают со скоростью 6—8 мг/кг/мин (максимальный объем инфузионного раствора — 80 мл/кг/сут).
2. Нельзя вводить в периферическую вену растворы глюкозы с концентрацией > 12,5%.
3. Кормление во время инфузии стараются не прерывать.
4. Резкое прекращение инфузии может вызвать гипогликемию, поэтому дозу глюкозы уменьшают постепенно.
В. Предупреждение гипергликемии у беременных, страдающих диабетом, снижает риск гипогликемии у новорожденных. Кроме того, уменьшается риск макросомии, дыхательных нарушений, эритроцитоза, синдрома Жильбера (гипербилирубинемии новорожденных), гипокальциемии, врожденных пороков развития.
V. Стойкая гипогликемия у новорожденных
2) После введения глюкагона концентрация глюкозы в плазме возрастает более чем на 2,2 ммоль/л.
3) Содержание кетоновых тел (ацетона, бета-оксимасляной кислоты и ацетоуксусной кислоты) в моче низкое, или они отсутствуют.
4) Уровень свободных жирных кислот в крови низкий.
б. Диагноз подтверждается, если на фоне гипогликемии (при концентрации глюкозы в крови 72 пмоль/л. Обычно уровень инсулина превышает 144 пмоль/л.
2. Этиология. Наиболее частые причины гиперинсулинемии у новорожденных — гиперплазия бета-клеток поджелудочной железы, инсулинома или незидиобластоз. У некоторых детей одновременно наблюдаются все три типа дисплазии бета-клеток. Тип дисплазии может быть установлен только гистологическим исследованием ткани поджелудочной железы (биопсия во время панкреатэктомии или аутопсия).
Гиперинсулинемия и гипогликемия отмечаются примерно у 50% детей с синдромом Беквита—Видемана (макросомия, макроглоссия, грыжа пупочного канатика, спланхномегалия, увеличение почек, поджелудочной и половых желез, расщепленная мочка уха, макроцефалия, гемигипертрофия, сосудистый невус на лице). Больные с синдромом Беквита—Видемана предрасположены к нефробластоме, раку надпочечников, гепатобластоме и ретинобластоме.
3. Лечение. Если диагноз гиперинсулинемии установлен и гипогликемия сохраняется, несмотря на в/в введение глюкозы со скоростью более 10 мг/кг/мин на фоне лечения глюкокортикоидами и диазоксидом (см. табл. 33.4), необходима субтотальная панкреатэктомия (удаление 80—95% ткани поджелудочной железы) без спленэктомии. Если причина гиперинсулинемии не устранена, у больных развиваются тяжелые неврологические нарушения. Есть сообщения о применении октреотида (аналог соматостатина, подавляющий секрецию инсулина) при гипогликемии у новорожденных и грудных детей, вызванной гиперинсулинемией. К сожалению, лечение октреотидом в этих случаях малоэффективно.
В. Дефицит контринсулярных гормонов
в. Лечение. Заместительная терапия глюкокортикоидами и соматропином дает прекрасные результаты. Такое лечение может потребоваться для предотвращения гипогликемии на протяжении первого года жизни ребенка. Заместительную терапию гидрокортизоном (0,75 мг/кг/сут внутрь в 2 или 3 приема) проводят пожизненно.
Г. Врожденные нарушения обмена углеводов. Гипогликемия может наблюдаться у новорожденных с гликогенозами, галактоземией и болезнью кленового сиропа.
1. Гликогеноз типа I наиболее распространен и в большей части случаев бывает обусловлен дефектом глюкозо-6-фосфатазы — фермента эндоплазматического ретикулума гепатоцитов (см. также гл. 37). Реже причиной гликогеноза типа I служит дефект глюкозо-6-фосфат-транслоказы — белка, переносящего глюкозо-6-фосфат из цитоплазмы в просвет эндоплазматического ретикулума. Из-за недостаточности глюкозо-6-фосфатазы или глюкозо-6-фосфат-транслоказы нарушается превращение глюкозо-6-фосфата в глюкозу на конечных стадиях гликогенолиза и глюконеогенеза. Главные проявления гликогеноза типа I: гипогликемия, метаболический ацидоз (лактацидоз), гепатомегалия. Биохимические признаки: резкое повышение уровней лактата, холестерина, триглицеридов, свободных жирных кислот и мочевой кислоты в крови; уровень глюкозы после введения глюкагона (см. гл. 33, п. V.А) не увеличивается или увеличивается незначительно; могут наблюдаться кетонемия и кетонурия. Гликогеноз типа I обычно проявляется не сразу после рождения, а на протяжении первого года жизни. Однако у новорожденных с этим заболеванием в первые часы или дни жизни может возникнуть тяжелая гипогликемия, особенно при задержке кормления.
VI. Гипогликемия у грудных детей и детей старшего возраста
А. Распространенность. Гипогликемия у детей этих возрастных групп встречается гораздо реже, чем у новорожденных.
1. Наиболее вероятные причины гипергликемии у грудных детей — это легкие формы гиперинсулинемии, врожденного дефицита контринсулярных гормонов или врожденных нарушений обмена веществ. Гипогликемия, обусловленная этими нарушениями, проявляется обычно в возрасте 3—6 мес, когда ночной сон становится более продолжительным (интервалы между кормлениями удлиняются, и ночной период голодания ребенка достигает 8 ч).
2. У детей старше года гипогликемия чаще обусловлена неспособностью поддерживать нормогликемию при голодании или приобретенным дефицитом контринсулярных гормонов.
3. Чем дольше продолжается грудное вскармливание, тем позже проявляется гипогликемия.
В. Клиническая картина (см. также гл. 33, п. II). Тяжелая гипогликемия проявляется судорогами, потерей сознания или комой. При легкой или среднетяжелой гипогликемии неврологические симптомы менее выражены (раздражительность, вялость, сонливость, нарушение координации движений). Для диагностики важно оценить регулярность появления симптомов гипогликемии и их связь с длительностью интервалов между кормлениями.
Г. Принципы диагностики. Определение глюкозы, инсулина и контринсулярных гормонов в крови, взятой в момент появления симптомов, может подтвердить диагноз и установить причину гипогликемии. При появлении судорог у грудного ребенка прежде всего надо исключить гипогликемию. Если кровь в момент припадка взять не удалось, проводят пробу с голоданием и введением глюкагона под постоянным наблюдением врача. Кормление прерывают на 10—20 ч; если возникают судороги, их устраняют в/в или в/м введением глюкагона. Перед введением глюкагона и через 30 мин после введения берут кровь для определения метаболитов и гормонов (см. табл. 33.3).
Д. Дифференциальная диагностика и лечение разных видов гипогликемии
1. Гиперинсулинемия. Это самая распространенная причина гипогликемии в первые 6 мес жизни.
1) Чаще всего гиперинсулинемия обусловлена избыточной секрецией инсулина, вызванной гиперплазией бета-клеток, инсулиномой или незидиобластозом. Продолжительное голодание провоцирует гипогликемию у детей с этими заболеваниями.
2) Непереносимость лейцина. Избыточная секреция инсулина может быть вызвана аминокислотами, содержащимися в молоке, прежде всего — лейцином. У детей с непереносимостью лейцина гипогликемия возникает после кормления молоком или пищей, богатой лейцином. Секреция инсулина в ответ на лейцин обычно усилена и у детей с гиперплазией бета-клеток, инсулиномой или незидиобластозом.
3) Введение инсулина, прием пероральных сахаропонижающих средств и некоторых других препаратов может вызвать гиперинсулинемию у ребенка, не страдающего сахарным диабетом (см. гл. 33, п. VIII).
б. Лабораторная диагностика. В крови, взятой в момент появления симптомов гипогликемии, обнаруживают низкое содержание глюкозы, свободных жирных кислот и кетоновых тел. Концентрация инсулина превышает 72 пмоль/л при концентрации глюкозы менее 2,2 ммоль/л. Содержание СТГ и кортизола нормальное, метаболического ацидоза, лактацидоза и кетоацидоза нет. Введение глюкагона значительно повышает концентрацию глюкозы в плазме (см. гл. 33, п. V.А и п. VI.Г). Для дифференциальной диагностики лекарственной гипогликемии, вызванной введением инсулина, определяют концентрацию инсулина и C-пептида в одной и той же пробе сыворотки: концентрация инсулина может быть очень высокой (> 720 пмоль/л), а концентрация C-пептида непропорционально низкая (в норме инсулин и C-пептид секретируются бета-клетками в эквимолярных количествах). При гиперинсулинемии, вызванной иными причинами, концентрация C-пептида возрастает пропорционально концентрации инсулина.
2. Дефицит СТГ или кортизола редко бывает причиной гипогликемии у детей старше 1 мес. Гипогликемия, обусловленная дефицитом этих гормонов, проявляется только после продолжительного голодания. Диагноз основан на результатах анализа крови, взятой во время приступа гипогликемии; прирост концентрации глюкозы после введения глюкагона снижен или в пределах нормы. Во время голодания концентрация глюкозы снижается, а концентрация свободных жирных кислот и кетоновых тел возрастает, как при гипогликемии голодания. Клинические признаки гипопитуитаризма или повреждения гипофиза у детей старшего возраста: низкорослость, замедленный рост, симптомы внутричерепного объемного образования (например, повышение ВЧД ). Признаки первичной надпочечниковой недостаточности: гиперпигментация, повышенная потребность в соли, гипонатриемия и гиперкалиемия.
3. Гипогликемия голодания. Это самая распространенная форма гипогликемии у детей в возрасте от 6 мес до 6 лет.
а. Этиология. Причина гипогликемии голодания — неспособность поддерживать нормогликемию при голодании. Патогенез гипогликемии голодания не выяснен (за исключением гипогликемии после продолжительного голодания у больных с дефицитом контринсулярных гормонов — СТГ и кортизола). Гипогликемия голодания нередко возникает при недостаточном питании у больных с тяжелыми инфекциями или желудочно-кишечными нарушениями, особенно после долгого сна. Иногда в таких случаях гипогликемия проявляется судорогами или потерей сознания.
б. Лабораторная диагностика. В крови, взятой во время приступа гипогликемии, концентрации глюкозы и инсулина низкие, а концентрация кетоновых тел — высокая. Возможна кетонурия. Прирост концентрации глюкозы после введения глюкагона ниже нормы. Голодание в течение 14—24 ч провоцирует гипогликемию. Чтобы исключить дефицит контринсулярных гормонов, определяют содержание СТГ и кортизола.
в. Лечение. Если обнаружен дефицит СТГ или кортизола, проводят заместительную гормональную терапию. Если дефицита контринсулярных гормонов нет, назначают диету, богатую белком и углеводами; питание должно быть дробным (6—8 раз в сутки). При сопутствующих тяжелых заболеваниях рекомендуются напитки, содержащие большое количество глюкозы. Регулярно определяют концентрацию кетоновых тел в моче. Если на фоне диетотерапии появляется кетонурия, проводят инфузию глюкозы со скоростью 6—8 мг/кг/мин, чтобы предупредить тяжелую гипогликемию. Диетотерапия эффективна у большинства больных; в возрасте 7—8 лет приступы гипогликемии прекращаются.
4. Дефицит карнитина и нарушения обмена свободных жирных кислот
а. Общие сведения. Карнитин необходим для транспорта свободных жирных кислот из цитозоля в митохондрии, где происходит их окисление и образование кетоновых тел. В цитозоле свободные жирные кислоты присоединяются к коферменту A и в таком виде транспортируются через наружную мембрану митохондрий. На внешней поверхности внутренней мембраны митохондрий жирные кислоты отщепляются от кофермента A, присоединяются к карнитину и проникают внутрь митохондрий. На внутренней поверхности внутренней мембраны жирные кислоты отщепляются от карнитина и поступают в митохондриальный матрикс. Реакции присоединения и отщепления жирных кислот катализируются карнитинпальмитоилтрансферазами I и II. В митохондриальном матриксе жирные кислоты подвергаются бета-окислению. В результате образуется ацетил-кофермент A, который включается в цикл Кребса. В гепатоцитах часть кофермента A расходуется на образование кетоновых тел. При дефиците карнитина, дефектах карнитинпальмитоилтрансферазы или ферментов, катализирующих реакции бета-окисления, свободные жирные кислоты не могут быть использованы в качестве источника энергии. Поэтому потребление глюкозы тканями резко усиливается, что приводит к гипогликемии. Кроме того, недостаточное образование кетоновых тел усугубляет гипогликемию. У больных с дефицитом карнитина или с нарушениями обмена свободных жирных кислот голодание или недостаточное потребление углеводов провоцирует гипогликемию.
1) Первичный дефицит карнитина наследуется аутосомно-рецессивно и обусловлен дефектами ферментов синтеза карнитина. Первичный дефицит карнитина — редкая причина гипогликемии. Различают две формы первичного дефицита карнитина — генерализованную и миопатическую.
а) Генерализованная форма характеризуется низким содержанием карнитина в крови, мышцах, печени, сердце и других тканях и органах. Заболевание проявляется у грудных детей и у детей младшего возраста. Клиническая картина: тошнота, рвота, гипераммониемия, печеночная энцефалопатия, нарастающая слабость, кома. Прогноз неблагоприятный. Лечение левокарнитином и глюкокортикоидами эффективно не у всех больных.
б) Миопатическая форма характеризуется низким содержанием карнитина в мышцах и нормальным содержанием карнитина в крови и других тканях и органах. Клиническая картина: нарастающая мышечная слабость, тяжелая кардиомиопатия. Миопатическую форму первичного дефицита карнитина можно спутать с полимиозитом или миодистрофией. Показано лечение левокарнитином и глюкокортикоидами.
2) Вторичный дефицит карнитина может быть вызван заболеваниями печени (нарушение синтеза карнитина), почек (повышенная экскреция карнитина), недостаточным поступлением карнитина с пищей. Клиническая картина как при генерализованной форме первичного дефицита карнитина. Лечение левокарнитином не всегда эффективно.
4) Ямайская рвотная болезнь вызвана употреблением в пищу незрелых плодов тропического кустарника Blighia sapida. Содержащийся в таких плодах токсин гипоглицин A блокирует митохондриальное окисление короткоцепочечных жирных кислот и вызывает накопление масляной, изовалериановой и пропионовой кислот в крови. В результате возникают тяжелая гипогликемия и метаболический ацидоз. Другие клинические проявления: рвота, вялость, сонливость, оглушенность, судороги, кома; нередко заболевание заканчивается смертью.
5. Врожденные нарушения обмена углеводов
а. Гликогенозы (см. также гл. 37)
1) Гликогеноз типа I (недостаточность фермента глюкозо-6-фосфатазы или транспортного белка глюкозо-6-фосфат-транслоказы) может проявиться тяжелой гипогликемией уже в первые часы или дни жизни новорожденного, но чаще наблюдается у грудных детей и детей старшего возраста. Клиническая картина: низкорослость, выступающий живот, гепатомегалия, эруптивные ксантомы, кровоточивость. Биохимические признаки: гипогликемия, стойкий метаболический ацидоз (лактацидоз), гиперлипопротеидемия. Уровни свободных жирных кислот, триглицеридов, лактата, пирувата и мочевой кислоты повышены, уровень инсулина снижен. Кровоточивость обусловлена нарушением функции тромбоцитов (но количество тромбоцитов нормальное). После введения глюкагона повышается концентрация лактата, но не глюкозы. Для подтверждения диагноза необходима биопсия печени с гистохимическим исследованием и определением активности ферментов in vitro. Основной способ лечения — интенсивная диетотерапия. Цель лечения: обеспечить постоянное поступление глюкозы. В ночные часы через назогастральный зонд или гастростому в желудок непрерывно вводят глюкозу или полимеры глюкозы (4—6 мг/кг/мин) либо сырой кукурузный крахмал (в количестве, обеспечивающем 1/3 суточной калорийности). Днем ребенку дают богатую углеводами пищу; питание должно быть дробным. Такое лечение быстро нормализует концентрацию глюкозы и другие лабораторные показатели, скорость роста и размеры печени. Однако у некоторых больных после курса диетотерапии приступы гипогликемии рецидивируют. Поэтому во время и после лечения больные нуждаются в постоянном наблюдении. У нелеченных детей с гликогенозом типа I частота приступов гипогликемии и их тяжесть постепенно уменьшаются с возрастом.
2) При гликогенозе типа III (недостаточность амило-1,6-глюкозидазы) и гликогенозе типа VI (недостаточность фосфорилазы в печени) симптомы гипогликемии при голодании и гепатомегалия выражены значительно слабее. Ацидоз нехарактерен. В обоих случаях для установления диагноза необходимы биопсия печени и определение активности ферментов in vitro. Эффективно частое кормление пищей, богатой углеводами; иногда при гликогенозе типа III требуется постоянное ночное зондовое кормление.
б. Недостаточность гликогенсинтетазы — очень редкое наследственное заболевание. У таких больных вообще не синтезируется гликоген и голодание вызывает тяжелую гипогликемию.
1) Недостаточность фруктозодифосфатазы проявляется тяжелой гипогликемией при продолжительном голодании или при сопутствующем инфекционном заболевании. Характерны гепатомегалия и стойкий лактацидоз, усиливающийся при голодании. Гипогликемию устраняют в/в инфузией глюкозы и бикарбоната. Фруктозу применять нельзя, поскольку фруктоза (так же как и аланин, глицерин и молочная кислота) подавляют синтез глюкозы и усугубляют гипогликемию. Диагноз основан на определении активности фермента в биоптатах печени или в лейкоцитах.
2) При непереносимости фруктозы (недостаточности фруктозодифосфатальдолазы) гипогликемия возникает только после приема фруктозы. Характерна выраженная гепатомегалия. Тяжелая гипогликемия может сопровождаться неукротимой рвотой. При умеренной гипогликемии наблюдаются вялое сосание и задержка роста. Назначают диету, не содержащую фруктозу. Детям старшего возраста запрещают есть сладости и другую пищу, содержащую фруктозу.
3) Недостаточность фосфоенолпируваткарбоксикиназы, ключевого фермента глюконеогенеза, — очень редкая причина гипогликемии. Фосфоенолпируваткарбоксикиназа участвует в синтезе глюкозы из лактата, метаболитов цикла Кребса, аминокислот и жирных кислот. Поэтому при недостаточности этого фермента инфузия лактата или аланина не позволяет добиться нормогликемии. Напротив, введение глицерина нормализует концентрацию глюкозы, поскольку для синтеза глюкозы из глицерина фосфоенолпируваткарбоксикиназа не требуется. При тяжелой гипогликемии проводят инфузию глюкозы.
А. Общие сведения. Прием алкоголя — распространенная причина тяжелой гипогликемии у грудных детей и детей старшего возраста. Ребенок может незаметно от взрослых выпить алкогольный напиток во время вечеринки. В этом случае гипогликемия обычно возникает на следующее утро. Иногда родители сами дают ребенку пиво или вино.
Б. Патогенез. Превращение этанола в ацетальдегид катализируется алкогольдегидрогеназой. Кофактором этого фермента служит НАД — вещество, необходимое для глюконеогенеза. Прием этанола приводит к быстрому расходованию НАД и резкому торможению глюконеогенеза в печени. Этанол вызывает гипогликемию только после 6—8-часового голодания (когда запас гликогена в печени иссякает).
В. Лечение. При легкой или умеренной гипогликемии ребенку дают питье и пищу, богатые глюкозой. Тяжелую гипогликемию устраняют в/в инфузией глюкозы. После единичного приступа гипогликемии, если установлен факт употребления алкоголя, обследовать ребенка не требуется.
VIII. Лекарственная гипогликемия. Гипогликемия у детей может быть вызвана введением инсулина, приемом пероральных сахаропонижающих средств или больших доз салицилатов. Вальпроевая кислота и ее производные ингибируют окисление жирных кислот, что приводит к нарушению глюконеогенеза и вторичному дефициту карнитина. Передозировка вальпроевой кислоты и ее производных может проявляться гипогликемией без кетонемии и кетонурии, особенно после голодания.
Введение инсулина — это одна из форм жестокого обращения с детьми. Бывает и так, что родители вводят инсулин ребенку, заподозрив у него инсулинозависимый сахарный диабет. Гипогликемия, вызванная инсулином и пероральными сахаропонижающими средствами, нередко сопровождается судорогами и потерей сознания и может быть спутана с другими видами гипогликемии.
1. Aynsley-Green A, et al. Nesidioblastosis of the pancreas: Definition of the syndrome and the management of the severe neonatal hyperinsulinemic hypoglycemia. Arch Dis Child 56:496, 1981.
2. Burchell A, et al. Hepatic microsomal glucose-6-phosphatase system and sudden infant death syndrome. Lancet 2:291, 1989.
3. Carnitine deficiency. Lancet 335:631, 1990. Editorial.
4. Haymond MW. Hypoglycemia in infants and children. Endocrinol Metab Clin North Am 18:211, 1989.
5. Hug G. Glycogen storage disease. In VC Kelley (ed), Practice of Pediatrics. New York: Harper & Row, 1985.
6. Shapira Y, Gutman A. Muscle carnitine deficiency in patients using valproic acid. J Pediatr 118:646, 1991.
7. Sperling MA. Hypoglycemia in the newborn infant and child. In F Lifshitz (ed), Pediatric Endocrinology: A Clinical Guide. New York: Dekker, 1990. Pp. 803.
8. Sperling MA. Hypoglycemia. In R Behrman (ed), Nelson Textbook of Pediatrics (14th ed). Philadelphia: Saunders, 1992. Pp. 409.
9. Sudden infant death and inherited disorders of fat oxidation. Lancet 2:1073, 1986. Editorial.
10. Treem WR, et al. Hypoglycemia, hypotonia, and cardiomyopathy: The evolving clinical picture of long-chain acyl-Co-A dehydrogenase deficiency. Pediatrics 87:328, 1991.
11. Volpe JJ. Hypoglycemia and brain injury. In JJ Volpe (ed), Neurology of the newborn. Philadelphia: Saunders, 1987. Pp. 364.
12. Wolfsdorf JI, et al. Glucose therapy for glycogenosis type I in infants: Comparison of intermittent uncooked cornstarch and continuous overnight glucose feedings. J Pediatr 117:384, 1990.