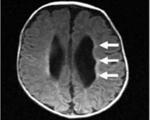
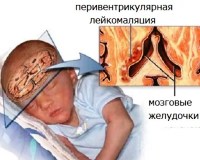
Гиперэхогенность перивентрикулярных зон у новорожденного что это такое
Підвищуйте свій
професіоналізм
ДИНАМИКА НЕЙРОСОНОГРАФИЧЕСКИХ ИЗМЕНЕНИЙ ПЕРИВЕНТРИКУЛЯРНОЙ ЛЕЙКОМАЛЯЦИИ В ВОССТАНОВИТЕЛЬНОМ ПЕРИОДЕ У НЕДОНОШЕННЫХ ДЕТЕЙ
Сучкова Т.И., Сухоносова О.Ю., Сальникова В.В., Чалова И.Л.
Детская городская неврологическая больница №5,
Центр реабилитации детей с органическим поражением ЦНС,
Харьковская медицинская академия последипломного образования, Харьков
Вступление. Поражение головного мозга недоношенных детей служит основной причиной инвалидизации и дезадаптации. Характерной для поражения мозга у недоношенных детей является перивентрикулярная лейкомаляция – некроз или глиоз белого мозгового вещества, обусловленный перинатальными причинами и локализующийся преимущественно в областях, прилегающих к наружным краям боковых желудочков
Цель: выявить особенности динамики нейросонографических и клинических проявлений перивентрикулярной лейкомаляции (ПВЛ) в раннем и позднем восстановительном периоде у недоношенных детей.
ПВЛ выявлена у 6 детей (3,6%).
Результаты. ПВЛ I степени выявлена у 1 ребенка. Нейросонографически выявляли перивентрикулярную гиперэхогенность, равную плотности сосудистых сплетений. Длительность выявления перивентрикулярной гиперэхогенности 2 недели. В неврологическом статусе наблюдали транзиторные двигательные нарушения, исчезнувшие с восстановлением нормальной эхогенности перивентрикулярных зон.
ПВЛ II степени – мелкие фокальные фронто-париетальные кисты выявлены у 3 детей. Срок их образования колебался: с рождения – у 1 ребенка и в 40 недель постменструального возраста – у 2 детей. В этот период наблюдалась большая неврологическая трансформация. Отмечали изменения в поведении детей в виде повышенной возбудимости, нарушение сна, оживление сегментарных рефлексов, тремор конечностей, оживление рефлекса Моро, снижение рефлекса опоры. Выражен лабиринтно-тонический рефлекс, сопровождающийся повышением экстензорного тонуса во всех группах мышц, в том числе шейных, приводящих к запрокидыванию головы и вытягиванию конечностей. В этот же период отмечена манифестация нарушений в зрительной системе и очаговые проявления. Видоизменяется и нейросонографическая картина – кисты смыкаются, замещаясь рубцовой и глиозной тканью. Визуализируется нормальный рисунок борозд, но расширяются наружные и внутренние ликворные пространства.
III и IV степени ПВЛ были выявлены у 2 детей: обширное перивентрикулярное кистозное поражение и проникновение кист на 10 мм и более в белое вещество. С конца 1-го месяца жизни наблюдается атрофическая или заместительная вентрикулодилятация: передние рога головного мозга округлые, расширены, 3-й желудочек расширяется пропорционально боковым желудочкам. Дети из этой группы были с тяжелым неврологическим дефицитом. В последующем сформировался детский церебральный паралич, спастические формы, ретинопатия и тугоухость. Нарушение роста и дифференцировки головного мозга сформировали задержку психического развития
Выводы. Перивентрикулярная лейкомаляция представляет собой своеобразное поражение головного мозга у недоношенных детй и является наиболее тяжелой и частой причиной детского церебрального паралича. Нарушение роста и дифференцировки головного мозга формирует задержку психического развития. Детализация динамики и наблюдение процессов, лежащих в основе этих ультразвуковых феноменов позволяет уточнить перспективы развития этих детей, выработать правильную тактику реабилитации.
Перивентрикулярная лейкомаляция
Перивентрикулярная лейкомаляция — это гипоксически-ишемическая энцефалопатия, характеризующаяся поражением белого вещества головного мозга новорожденных. Состояние чаще возникает у недоношенных, провоцируется патологиями течения беременности и родов, неадекватной респираторной поддержкой в постнатальном периоде. Заболевание проявляется мышечной дистонией, судорожным синдромом, задержкой психомоторного развития. Для диагностики болезни назначается КТ или МРТ мозга, ЭЭГ, допплерография церебральных сосудов. Лечение лейкомаляции включает медикаменты (нейропротекторы, инфузионные растворы, антиконвульсанты), индивидуальный комплекс физиотерапии, массажа, ЛФК.
МКБ-10
Общие сведения
По разным данным, перивентрикулярная лейкомаляция (ПВЛ) встречается у 4,8-9% младенцев, причем среди больных преобладают недоношенные новорожденные (78%). Наибольшая вероятность появления болезни у детей, родившихся на сроке 27-32 недели. По данным аутопсии умерших младенцев, признаки ПВЛ регистрируются чаще — у 50-75%. Заболевание имеет большую значимость в детской неврологии, поскольку может вызывать тяжелые отдаленные последствия, считается ведущей причиной ДЦП.
Причины
Основной этиологический фактор перивентрикулярной лейкомаляции — внутриутробная гипоксия, которая выступает следствием осложнений протекания беременности, материнских факторов риска либо негативного экзогенного воздействия. Также состояние может возникать при перинатальной гипоксии, которая развивается во время родов, в первые дни жизни младенца (при синдроме дыхательных расстройств, врожденных аномалиях сердца и легких, неонатальном сепсисе).
В группе риска наибольшую по численности категорию составляют недоношенные младенцы. Зачастую лейкомаляция выявляется у детей, которое были рождены от матерей с сахарным диабетом, хронической анемией, гипертиреозом либо страдавших от преэклампсии и эклампсии. Состояние возникает при выполнении экстренного кесарева сечения, неадекватном родовспоможении (травмирующие акушерские пособия). Высокая частота лейкомаляции (до 22%) отмечается при сочетании длительного безводного периода с хориоамнионитом у матери.
Патогенез
Поражение головного мозга связано со снижением кровотока в церебральных сосудах, недостаточным поступлением кислорода и питательных ингредиентов. Перивентрикулярная область наиболее чувствительна к этим изменениям, что обусловлено особенностями кровоснабжения, несовершенством процессов ауторегуляции, нейроонтогенетическими особенностями головного мозга у младенцев.
Недоношенные намного чаще страдают лейкомаляцией, поскольку у них на фоне гипоксии не увеличивается церебральный кровоток, как это бывает у рожденных в срок младенцев. В результате этого резко уменьшается кровоток в зоне между вентрикулофугальными и вентрикулопетальными артериями, быстро формируется гиперкапния и ацидоз. Расстройства микроциркуляции проявляются стазом, тромбозом, вне- и внутриклеточным отеком белого вещества.
При перивентрикулярной лейкомаляции в конечном итоге происходит некроз отельных участков мозгового вещества, образование кист, избыточное накопление медиаторов воспаления. Поскольку на 28-32 неделях в норме происходит активная миелинизация белого вещества, а в условиях гипоксии этот процесс не может происходить, недоношенные новорожденные впоследствии имеют серьезные органические поражения ЦНС.
Формирование ПВЛ возможно не только при недостатке кислорода, но и при гипероксии — при проведении ИВЛ, оказании других видов респираторной поддержки. При избыточном поступлении кислорода повышается рН крови в мозговой ткани, что вызывает рефлекторный спазм сосудов, затруднение венозного оттока. Также кислород активизирует процессы свободнорадикального церебрального повреждения.
Симптомы
Как правило, перивентрикулярная лейкомаляция формируется антенатально или на протяжении первых часов после рождения ребенка, поэтому начальные признаки заметны уже в родильном доме, особенно если младенец рожден недоношенным. При обширном повреждении белого вещества происходят нарушения сознания по типу летаргии или комы, однако возможна обратная симптоматика — повышенная возбудимость, оживление безусловных рефлексов, судорожный синдром.
Типичным проявлением патологии являются изменения тонуса мышц. На первом месяце жизни преобладает слабость мускулатуры ног в сочетании с нормальным формированием мышц верхних конечностей. У недоношенных новорожденных часто отмечается тотальная мышечная гипотония. Такие нарушения сохраняются в среднем до 6 месяцев, после чего они сменяются спастическими явлениями — повышением тонуса мускулатуры нижних конечностей, оживлением коленных рефлексов.
Течение перивентрикулярной лейкомаляции имеет неравномерный характер: периоды обострения симптоматики сменяются «мнимым благополучием», когда ребенок развивается относительно нормально. Затем происходит задержка формирования моторных навыков, развиваются различные сенсорные нарушения, дизартрия. 66% детей, особенно недоношенные, страдают от снижения остроты зрения вплоть до полной слепоты вследствие атрофии зрительных нервов.
Осложнения
Перивентрикулярные поражения белого вещества — крайне тяжелое состояние. Недоношенные дети с ПВЛ умирают в 50% случаев еще в период новорожденности, у выживших обычно наступает инвалидность с полной дезадаптацией. Пациенты с длительно сохраняющимся судорожными приступами в 85% случаев имеют грубую задержку психомоторного развития. У перенесших ПВЛ в будущем в 1,5 раза чаще встречаются фебрильные судороги, в 27 раз чаще формируется эпилепсия.
При множественных кистах в перивентрикулярной зоне у 80-97% больных (чаще — недоношенных) возникает детский церебральный паралич (ДЦП), который сопровождается глубоким психоречевым отставанием. Развитие заболевания связано с повреждением центральной части внутренней капсулы, средне- и заднелобных сегментов белого вещества полушарий. Также лейкомаляция вызывает микроцефалию (у 42% пациентов), нейросенсорную тугоухость (у 28% больных).
Диагностика
Постановка правильного диагноза в неонатальном периоде затруднена, что объясняется полиморфностью клинической картины, отсутствием патогномоничных симптомов. При физикальном осмотре выявляется асимметрия мышечного тонуса, патологическое усиление рефлексов, на более поздних этапах — спастическая диплегия. Особую настороженность следует проявлять в отношении детей, родившихся недоношенными. В план обследования новорожденных с подозрением на ПВЛ включаются:
Лечение перивентрикулярной лейкомаляции
Терапия перивентрикулярной лейкомаляции представляет собой сложную задачу, учитывая необратимый характер повреждений белого вещества, частое сочетание гипоксически-ишемической энцефалопатии с поражениями других систем организма у недоношенных. Медикаментозное лечение подбирается на основе ведущих синдромов болезни и включает следующие группы препаратов:
Учитывая высокую частоту резидуальных неврологических явлений, рекомендовано восстановительное лечение. Чтобы улучшить двигательные способности, назначаются курсы массажа, физиотерапии, лечебной физкультуры. Для развития речевых навыков требуются коррекционные занятия у логопеда, дефектолога. Детям с поражением органов чувств нужна помощь тифлопедагога, сурдопедагога. Пациентам с ДЦП необходимы специальные ходунки, костыли, инвалидные коляски.
Прогноз и профилактика
В большинстве случаев лейкомаляция отличается неблагоприятным течением, отличается высоким уровнем смертности во время младенчества. Для выживших детей прогноз напрямую зависит от тяжести органического дефекта перивентрикулярной зоны, своевременности и полноты проведенного лечения. Профилактика ПВЛ включает рациональное ведение беременности, предупреждение родового травматизма, соблюдение протоколов при респираторной поддержке в роддоме, усиленный контроль за развитием недоношенных.
Ультразвуковое исследование мозга новорожденных детей (нормальная анатомия)
УЗИ сканер HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Показания для проведения эхографии мозга
Акустическим окном для исследования мозга может служить любое естественное отверстие в черепе, но в большинстве случаев используют большой родничок, поскольку он наиболее крупный и закрывается последним. Маленький размер родничка значительно ограничивает поле зрения, особенно при оценке периферических отделов мозга.
Для проведения эхоэнцефалографического исследования датчик располагают над передним родничком, ориентируя его так, чтобы получить ряд корональных (фронтальных) срезов, после чего переворачивают на 90° для выполнения сагиттального и парасагиттального сканирования. К дополнительным подходам относят сканирование через височную кость над ушной раковиной (аксиальный срез), а также сканирование через открытые швы, задний родничок и область атланто-затылочного сочленения.
По своей эхогенности структуры мозга и черепа могут быть разделены на три категории:
Нормальные варианты мозговых структур
Борозды и извилины. Борозды выглядят как эхогенные линейные структуры, разделяющие извилины. Активная дифференцировка извилин начинается с 28-й недели гестации; их анатомическое появление предшествует эхографической визуализации на 2-6 нед. Таким образом, по количеству и степени выраженности борозд можно судить о гестационном возрасте ребенка.
Сосудистые сплетения могут быть источником внутрижелудочковых кровоизлияний у доношенных детей, тогда на эхограммах видна их четкая асимметрия и локальные уплотнения, на месте которых затем образуются кисты.
Сильвиев водопровод и IV желудочек. Сильвиев водопровод (aquaeductus cerebri) представляет собой тонкий канал, соединяющий III и IV желудочки (см. рис. 1), редко видимый при УЗ исследовании в стандартных позициях. Его можно визуализировать на аксиальном срезе в виде двух эхогенных точек на фоне гипоэхогенных ножек мозга.
IV желудочек (ventriculus quartus) представляет собой небольшую полость ромбовидной формы. На эхограммах в строго сагиттальном срезе он выглядит малым анэхогенным треугольником посередине эхогенного медиального контура червя мозжечка (см. рис. 1). Передняя его граница отчетливо не видна из-за гипоэхогенности дорсальной части моста. Переднезадний размер IV желудочка в неонатальном периоде не превышает 4 мм.
Мозолистое тело. Мозолистое тело (corpus callosum) на сагиттальном срезе выглядит как тонкая горизонтальная дугообразная гипоэхогенная структура (рис. 2), ограниченная сверху и снизу тонкими эхогенными полосками, являющимися результатом отражения от околомозолистой борозды (сверху) и нижней поверхности мозолистого тела. Сразу под ним располагаются два листка прозрачной перегородки, ограничивающие ее полость. На фронтальном срезе мозолистое тело выглядит тонкой узкой гипоэхогенной полоской, образующей крышу боковых желудочков.
Полость прозрачной перегородки и полость Верге. Эти полости расположены непосредственно под мозолистым телом между листками прозрачной перегородки (septum pellucidum) и ограничены глией, а не эпендимой; они содержат жидкость, но не соединяются ни с желудочковой системой, ни с субарахноидальным пространством. Полость прозрачной перегородки (cavum cepti pellucidi) находится кпереди от свода мозга между передними рогами боковых желудочков, полость Верге расположена под валиком мозолистого тела между телами боковых желудочков. Иногда в норме в листках прозрачной перегородки визуализируются точки и короткие линейные сигналы, происходящие от субэпендимальных срединных вен. На корональном срезе полость прозрачной перегородки выглядит как квадратное, треугольное или трапециевидное анэхогенное пространство с основанием под мозолистым телом. Ширина полости прозрачной перегородки не превышает 10-12 мм и у недоношенных детей шире, чем у доношенных. Полость Верге, как правило, уже полости прозрачной перегородки и у доношенных детей обнаруживается редко. Указанные полости начинают облитерироваться после 6 мес гестации в дорсовентральном направлении, но точных сроков их закрытия нет, и они обе могут обнаруживаться у зрелого ребенка в возрасте 2-3 мес.
Базальная (c. suprasellar) цистерна включает в себя межножковую, c. interpeduncularis (между ножками мозга) и хиазматическую, c. chiasmatis (между перекрестом зрительных нервов и лобными долями) цистерны. Цистерна перекреста выглядит пятиугольной эхоплотной зоной, углы которой соответствуют артериям Виллизиева круга.
Ножки мозга (pedunculus cerebri), мост (pons) и продолговатый мозг (medulla oblongata) расположены продольно кпереди от мозжечка и выглядят гипоэхогенными структурами.
Паренхима. В норме отмечается различие эхогенности между корой мозга и подлежащим белым веществом. Белое вещество чуть более эхогенно, возможно, из-за относительно большего количества сосудов. В норме толщина коры не превышает нескольких миллиметров.
Стандартные эхоэнцефалографические срезы
Рис. 4. Плоскости коронального сканирования (1-6).
Эхогенность – что это такое и при каких болезнях изменяются эхографические признаки
Для выявления заболеваний внутренних органов в медицине используется ультразвуковая диагностика. Для понимания этого метода нужно знать, что такое показатели эхогенности и другие ультразвуковые признаки нормального или измененного органа.
Понятие об эхогенности
УЗ-диагностика строится на способности ультразвука отражаться от внутренних органов. Датчик улавливает отраженные волны и передает их на компьютер. Врач на экране видит изображение внутренних органов в виде черных, темно-серых и белых пятен.
Процедура абсолютно безопасна для организма человека. Диагностику проводят новорожденным детям и беременным женщинам без ограничений.
Чтобы получить достоверные результаты, обследование нужно проводить правильно. Перед УЗИ брюшной полости рекомендуется придерживаться специальной диеты на протяжении трех дней. При выраженном запоре или метеоризме назначают слабительные и ветрогонные препараты.
Для обследования других органов специальной подготовки не требуется. Для проведения УЗИ на кожу наносят звукопроводящий гель. Это снижает вероятность ошибок.
Для расшифровки результатов обследования существуют эхографические признаки:
Различия между нормальной и измененной структурой органов определяются с помощью эхогенности. Это понятие обозначает степень отражения ультразвука от органов разной плотности.
Основные критерии
Выделяют три основных типа эхоструктуры органов.
Эхогенность
Также существуют анэхогенные структуры. Они поглощают ультразвук полностью. На снимке видно только черное пятно. Иногда встречается смешанная эхогенность — она представлена гипоэхогенными и гиперэхогенными структурами.
Каждое эхогенное образование имеет параметры для определения его характера:
Образования могут быть плотными или иметь полость. В последнем случае их называют кистами. В полости содержится воздух или жидкость. Кисты бывают однокамерными, когда содержат одну полость. Если их несколько, образование называют многокамерным.
Причины патологических образований
Нормой считается эхогенность средняя, или изоэхогенность. Повышенной эхогенностью обладают кости и хрящи. Пониженная эхогенность характерна для фолликулов в яичнике. Остальные случаи являются патологией.
Гиперэхогенные
Эхопозитивное образование, то есть с повышенной эхогенностью, имеет плотность, близкую к костям. Таким критериям отвечают опухоли и разрастания рубцовой ткани.
Повышенная эхогенность возникает в печени при циррозе. В норме она обладает изоэхогенной структурой, но цирроз — это замещение здоровой ткани рубцовой, которая отражает ультразвук сильнее.
Высокая эхогенность характерна для некоторых злокачественных опухолей. Они поражают печень и почки, реже поджелудочную железу.
Гиперэхогенные образования округлой формы в желчном пузыре или почках — камни. Они образуются из-за скопления желчи или солей.
Если эхогенность повышена умеренно в стенке матки, это признак миомы. Доброкачественная опухоль, образованная мышцами, растет медленно.
Гиперэхогенные новообразования отличаются четкими контурами, форма их обычно овальная. Цвет на снимке зависит от плотности. Чем плотнее новообразование, тем светлее оно выглядит.
Гипоэхогенные
Эхонегативное образование имеет плотность ниже, чем здоровый орган. Такой признак наблюдается при воспалениях, появлениях полостей.
Эхогенность снижена при воспалении любого органа. При этом он увеличивается в размере. Такой признак наблюдается при гепатите, панкреатите, простатите.
Низкой эхогенностью обладают полости, содержащие воздух или жидкость. Они называются кистами, у них есть стенка, которая на снимке выглядит светлой. Внутри же обнаруживается темное пятно, потому что воздух или жидкость плохо отражают ультразвук.
Сниженная эхогенность типична для большинства злокачественных и доброкачественных опухолей. На снимке они имеют цвет более темный, чем окружающие ткани.
Низкой эхогенностью характеризуются фиброзные мастопатии. Доброкачественные опухоли молочной железы развиваются на фоне гормональных нарушений.
Равномерно низкая эхогенность внутри полости матки — признак эндометрита. Так называют воспаление слизистой матки.
Новообразования с низкой эхогенностью имеют различные формы, их контуры чаще расплывчатые. Гипоэхогенная эхоструктура бывает диффузной, когда поражается весь орган. При опухолях и кистах гипоэхогенность имеет локальный характер.
Смешанные
Некоторые патологические образования имеют смешанную эхогенность. Так выглядит начальная стадия цирроза печени, когда еще не вся здоровая ткань превратилась в рубцовую.
Гиперэхогенные включения в гипоэхогенной опухоли — это кальцинаты. Признак характерен для рака щитовидной железы или туберкулеза. Подобные изменения наблюдаются в поджелудочной железе при сахарном диабете.
Смешанная эхогенность наблюдается при гломерулонефрите — заболевании почек. Воспалительный процесс развивается только в части органа, а часть его остается здоровой.
Анэхогенные
Новообразования, которые поглощают ультразвук, называются анэхогенными. Такими свойствами обладают кисты, содержащие много жидкости. Чаще всего это паразитарные поражения печени. Они аваскулярные, то есть к ним не подходят кровеносные сосуды.
Тонкостенные анэхогенные образования, до половины заполненные жидкостью — абсцессы. Они появляются в результате гнойного воспаления органа. Абсцессы образуются в любом органе, чаще страдает печень или почка. На снимке абсцесс выглядит как темное пятно со светлой каемкой.
Анэхогенное содержимое появляется в щитовидной железе при диффузном зобе. Заболевание характеризуется разрастанием железистой ткани.
Зная о существующих типах эхогенных образований, что это такое и какими признаками они обладают, можно диагностировать заболевание у человека. Ультразвуковая диагностика обнаруживает даже малейшие изменения, что позволяет своевременно поставить диагноз. Благодаря этому, возможно провести лечение как можно раньше.
Маркеры патологического течения перинатального периода у детей с гиперэхогенным внутрисердечным фокусом
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Цель исследования: выявить особенности течения перинатального периода у детей с антенатально диагностируемым гиперэхогенным внутрисердечным фокусом (ГВФ).
Материал и методы: группы исследования, которые формировали по методу «случай — контроль», были сопоставимы по возрасту, акушерскому и соматическому анамнезу матерей. Критерием включения в первую группу было наличие гиперэхогенного образования в сердце плода, по данным ультразвукового пренатального скрининга, а также наблюдение и рождение ребенка в ГБУЗ ТО «Перинатальный центр» (Тюмень). Первую группу составили 214 беременных (плодов с ГВФ, впоследствии новорожденных), вторую группу — 107 беременных (плодов без ГВФ, впоследствии новорожденных). Проведен ретроспективный анализ течения антенатального и интранатального периодов развития новорожденных с ГВФ; изучены особенности течения раннего неонатального периода, данные гистологического исследования плацент (n=69), результаты аутопсий перинатальных потерь (n=12).
Результаты исследования: установлено, что ГВФ, впервые визуализируемые после 20-й нед. гестации, сохранялись после рождения значительно чаще (р 0,05). Между тем только у детей с ГВФ диагностированы врожденные пороки развития различных органов (7,94%) и генерализованная цитомегаловирусная инфекция (1,46%). Постгипоксическую кардиопатию как отражение синдрома дезадаптации со стороны сердечно-сосудистой системы в 3,2 раза чаще регистрировали у новорожденных с ГВФ (р=0,005).
Заключение: сочетание ГВФ (размером 2,67±0,9 мм) с локализацией в левом или правом желудочке сердца плода и других мягких ультразвуковых маркеров, наличие структурных изменений центральной нервной системы и/или системы кровообращения диктуют необходимость обследования беременной на внутриутробные инфекции, а также проведения допплерографии маточных и пуповинных артерий для минимизации риска развития перинатальных катастроф.
Ключевые слова: перинатальный период, гиперэхогенный внутрисердечный фокус, новорожденные, перинатальные потери, врожденная аномалия, постгипоксическая кардиопатия, ультразвуковой маркер.
Для цитирования: Малинина Е.И., Рычкова О.А., Чернышева Т.В. Маркеры патологического течения перинатального периода у детей с гиперэхогенным внутрисердечным фокусом. РМЖ. Мать и дитя. 2020;3(2):132-135. DOI: 0.32364/2618-8430-2020-3-2-132-135.
Markers of the pathological course of perinatal period in children with echogenic intracardiac focus
1 Tyumen State Medical University, Tyumen, Russian Federation
2 Tyumen Cardiology Research Center — branch of Tomsk National Research Medical Center
of the Russian Academy of Sciences, Tyumen, Russian Federation
Aim: to describe the course of perinatal period in children with echogenic intracardiac focus (EIF) diagnosed in the antenatal period.
Patients and Methods: in this case-control study, the groups were similar in age, obstetric history, and somatic status of mothers. Group 1 included 214 pregnant women whose fetus (newborn later) was diagnosed with EIF. Inclusion criteria were an echoic focus within the fetal heart (by prenatal ultrasound) as well as pregnancy follow-up and childbirth in the Perinatal Center of Tyumen city. Group 2 included 107 pregnant women whose fetus (newborn later) had no this sonographic sign. Retrospective analysis of the course of antenatal and intranatal periods of newborns with EIF was performed. The course of early neonatal period was described. Placental histology (n = 69) and autopsies of perinatal losses (n=12) were discussed.
Results: it was demonstrated that EIFs identified for the first time after 20 weeks of gestation persist after delivery much more common (p 0.05). Only newborns with EIF were diagnosed with different types of birth defects (7.94%) and generalized cytomegalovirus infection (1.46%). Hypoxic cardiopathy (that illustrates cardiovascular deadaptation) was 3.2 times more common in newborns with EIF (p=0.005).
Conclusion: combination of EIF (2.67±0.9 mm) localized in the left or right ventricle and other sonographic signs, central nervous system defects and/or cardiovascular abnormalities require screening for perinatal infections as well as uterine and umbilical artery Doppler to minimize the risk of perinatal events.
Keywords: perinatal period, echogenic intracardiac focus, newborns, perinatal losses, congenital anomaly, hypoxic cardiopathy, sonographic sign.
For citation: Malinina E.I., Rychkova O.A., Chernysheva T.V. Markers of the pathological course of perinatal period in children with echogenic intracardiac focus. Russian Journal of Woman and Child Health. 2020;3(2):132–135. DOI: 10.32364/2618-8430-2020-3-2-132-135.
Введение
Интерес к изучению перинатального периода появился в конце 1960-х гг., когда в рутинную практику врачей разных специальностей вошло ультразвуковое исследование (УЗИ) высокого разрешения, что способствовало выявлению не только грубых аномалий развития того или иного органа, но и малых структурных изменений [1, 2]. Это послужило толчком к совершенствованию методов профилактики, диагностики и терапии различных заболеваний матери, плода и новорожденного и восприятию системы «мать — плацента — плод» как единого организма [3].
В 1990-х гг. работы патоморфологов D.J. Roberts и D. Genest по изучению участков кальцификации папиллярных мышц, или гиперэхогенных внутрисердечных фокусов (ГВФ), у плодов с аномальным кариотипом стали основанием для того, чтобы рассматривать данную ультразвуковую находку как маркер хромосомных аномалий [4–6]. Эти образования при проведении УЗИ совершали колебательные движения подобно прыжкам мяча и были названы «гольфный мяч» [7, 8]. Гипотезы формирования ГВФ неоднократно менялись (от нормального варианта эмбрионального развития клапанно-хордального аппарата до предиктора внутриутробного инфицирования плода), однако до сих пор не существует единого мнения об этом ультразвуковом феномене [9–13].
Цель работы: выявить особенности течения перинатального периода у детей с антенатально диагностируемым ГВФ.
Материал и методы
Настоящее ретроспективное исследование проведено на базе ГБУЗ ТО «Перинатальный центр» (Тюмень). Критерием включения было наличие гиперэхогенного образования в сердце плода, по данным ультразвукового пренатального скрининга. Группы исследования формировали методом «случай — контроль», при этом статистически значимых межгрупповых различий по возрасту, акушерскому и соматическому анамнезу матерей не было. Первую группу составили 214 беременных (плодов c ГВФ, впоследствии новорожденных), вторую группу — 107 беременных (плодов без ГВФ, впоследствии новорожденных). Анализировали течение перинатального периода новорожденных с ГВФ с использованием медицинской документации (ф111/у и ф096/у), результатов инструментального обследования (электрокардиографии, нейросонографии, эхокардиографии (ЭхоКГ), УЗИ органов брюшной полости), а также патоморфологического исследования 69 плацент (34 из первой группы и 35 — из второй) и перинатальных потерь (n=12). Не все плаценты подвергались патоморфологическому исследованию, но для настоящего исследования с учетом сформированных групп были отобраны заключения с учетом сходного срока гестации и анамнеза.
Результаты и обсуждение
В ходе исследования установлено, что в 11–13 нед. гестации при пренатальном ультразвуковом скрининге диагностируется 6,08% ГВФ, в 20–22 нед. — 84,11%, в 32–34 нед. — 9,81%. Нужно отметить, что все ГВФ, визуализируемые при первом ультразвуковом скрининге, локализовались в левом желудочке и были одиночными, имея средний размер 1,2±0,1 мм. В то же время локализация гиперэхогенных образований, диагностируемых во второй половине беременности, была различной, а также отмечались множественные фокусы, размер которых превышал 2 мм. Динамическое наблюдение показало, что к моменту рождения сохраняются лишь 0,46% ГВФ, регистрируемых до 14-й нед., и 24,3% ГВФ, выявляемых впервые после 20-й нед. гестации.
Антенатальное УЗИ выявило, что 1/3 пациентов с ГВФ начиная с 20-й нед. гестации имеют ультразвуковые признаки изменений в плаценте: аномальное прикрепление, кистозные изменения, увеличение/уменьшение количества околоплодных вод, снижение маточно-плацентарного кровотока в целом.
Таким образом, ГВФ визуализируется при ультразвуковом скрининговом исследовании на любом сроке гестации, чаще (до 90,19%) с 9-й по 22-ю нед. беременности. Его обнаружение было сопряжено с нарушениями маточно-плацентарного кровотока (р=0,033) и другими малыми ультразвуковыми маркерами хромосомных аномалий в 24,76% случаев (р 1 Малинина Елена Игоревна — к.м.н., доцент кафедры детских болезней лечебного факультета с курсом иммунологии и аллергологии, ORCID iD 0000-0001-9987-4899;
1 Рычкова Ольга Александровна — д.м.н., доцент, заведующая кафедрой детских болезней лечебного факультета с курсом иммунологии и аллергологии, ORCID iD 0000-0002-2566-5370;
2 Чернышева Татьяна Викторовна — к.м.н., доцент, заведующая детским отделением, ORCID iD 0000-0003-0137-3282.
1 ФГБОУ ВО Тюменский ГМУ Минздрава России. 625024, Россия, г. Тюмень, ул. Одесская, д. 54.
2 Тюменский кардиологический научный центр — филиал Томского НИМЦ. 625026, Россия, г. Тюмень, ул. Мельникайте, д. 111.
Контактная информация: Малинина Елена Игоревна, e-mail: malininaele@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах. Конфликт интересов отсутствует. Статья поступила 31.07.2019.
1 Elena I. Malinina — MD, PhD, associate professor of the Department of Childhood Diseases the Course of Immunology & Allergy of Medical Faculty, ORCID iD 0000-0001-9987-4899;
1 Olga A. Rychkova — MD, PhD, Associate Professor, Head of the Department of Childhood Diseases the Course of Immunology & Allergy of Medical Faculty, ORCID iD 0000-0002-2566-5370;
2 Tat’yana V. Chernysheva — MD, PhD, Associate Professor, Head of Children Department, ORCID iD 0000-0003-0137-3282.
1 Tyumen State Medical University. 54, Odesskaya str., Tyumen, 625024, Russian Federation.
2 Tyumen Cardiology Research Center— branch of Tomsk National Research Medical Center of the Russian Academy of Sciences. 111, Melnikaite str., Tyumen, 625026, Russian
Federation.
Contact information: Elena I. Malinina, e-mail: malininaele@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 31.07.2019.
Только для зарегистрированных пользователей