Гетероплазмия что это и как проявляется
Гетероплазмия что это и как проявляется
Окислительное фосфорилирование и болезни митохондриальной ДНК (мтДНК). Митохондриальные мутации обычно поражают ткани, зависящие от окислительного фосфорилирования, удовлетворяющего высокие потребности в энергии. Такая фенотипическая направленность отражает центральную роль комплекса окислительного фосфорилирования в производстве энергии клетки.
Следовательно, для большинства болезней митохондриальной ДНК (мтДНК) характерно снижение синтеза АТФ, которое, вероятно, лежит в основе дисфункции и смерти клеток. Это подтверждается и тем, что другие механизмы, кроме снижения производства энергии, лишь косвенно и слабо содействуют патогенезу болезней митохондриальной ДНК (мтДНК), однако также происходящий синтез активного кислорода как побочного продукта окислительного фосфорилирования может содействовать патологическим процессам при нарушениях митохондриальной ДНК (мтДНК).
Имеется достоверное подтверждение того, что пороговый фенотипический эффект связан с гетероплазмией митохондриальной ДНК (мтДНК); прежде чем болезнь становится клинически очевидной, в клетках пораженной ткани должен быть превышен критический порог доли молекул митохондриальной ДНК (мтДНК), несущих мутацию. Этот порог составляет почти 60% для болезней, вызванных делециями митохондриальной ДНК (мтДНК), и около 90% для болезней из-за других типов мутаций.
Наиболее часто при мутациях в митохондриальной ДНК (мтДНК) поражается нервно-мышечная система; последствия включают энцефалопатию, миопатию, атаксию, дегенерацию сетчатки и снижение функции наружных мышц глаза. Митохондриальная миопатия характеризуется так называемыми «рваными» красными волокнами (мышц) — гистологическим симптомом, вызванным распространением структурно и биохимически аномальных митохондрий в мышечных волокнах.
Спектр митохондриальных болезней широк и может включать дисфункцию печени, костного мозга, островкового аппарата поджелудочной железы с проявлениями сахарного диабета, глухоту и другие нарушения.
Необъяснимые и неожиданные стенотипические изменения при болезнях митохондриальной ДНК (мтДНК)
Гетероплазмия, как правило, встречается почти при всех болезнях митохондриальной ДНК (мтДНК), за исключением обычно гомоплазмической наследственной атрофии зрительного нерва Лебера (LHON). Гетероплазмия, приводящая к непредсказуемой и изменчивой доле мутантной митохондриальной ДНК (мтДНК) в любой конкретной ткани, несомненно, ответственна за плейотропность и переменную экспрессивность большинства мутаций митохондриальной ДНК (мтДНК).
Таким образом, в одной семье одна и та же мутация митохондриальной ДНК (мтДНК) может вызывать сахарный диабет и глухоту у одних и тяжелую энцефалопатию с судорогами у других. Другой пример — самая частая мутация мтДНК, замена 3243A>G в гене тРНК лейцина tRNA [номенклатура указывает позицию и код нормального нуклеотида — аденин в позиции 3243 — в молекуле митохондриальной ДНК (мтДНК), и нуклеотид замены (гуанин)].
Замена 3243A>G — самая частая при фенотипе MELAS, акроним для митохондриальной энцефаломиопатии с молочным ацидозом и инсультоподобными эпизодами. В некоторых семьях эта мутация приводит преимущественно к сахарному диабету и глухоте, а в других вызывает хроническую прогрессирующую наружную офтальмоплегию; и наконец, в-третьих, — кардиомиопатию или миопатию. Кроме того, мутации 3243A>G приписывается небольшая доля (
Мутации в генах тРНК и рРНК митохондриального генома
Мутации в не кодирующих белок генах тРНК и рРНК митохондриальной ДНК (мтДНК) имеют глобальное значение, поскольку они позволили понять, что не все патогенные мутации у человека происходят в генах, кодирующих белки. Более 90 патогенных мутаций обнаружено в 20 из 22 генов тРНК митохондриальной ДНК (мтДНК), и они оказались наиболее частой причиной аномалий окислительного фосфорилирования у человека.
Результирующие фенотипы обычно совпадают со связанными с другими дефектами митохондриальной ДНК (мтДНК). В набор разнообразных мутаций тРНК входит 18 нуклеотидных замен в гене tRNA, некоторые из них вызывают MELAS, подобно мутации 3243A>G, другие преимущественно связаны с миопатией. Аналогично некоторые замены в гене 12S рРНК в гомоплазмическом состоянии приводят к нейросенсорной глухоте после применения антибиотиков группы аминогликозидов.
Выяснение разных эффектов мутаций в гене tRNA, связанных с синдромом MELAS, в сравнении с мутациями, вызывающими только миопатии, привело к одному из первых объяснений соотношения между генотипом и фенотипом при болезнях митохондриальной ДНК (мтДНК). Многие мутации гена tRNA, вызывающие синдром MELAS, неизвестным способом нарушают важную биохимическую модификацию неоднозначно соответствующего азотистого основания урацила (U) в тРНК, тогда как замены, вызывающие только миопатию, не нарушают модификацию этого основания.
Неоднозначно соответствующее основание присутствует в третьей позиции многих кодонов и называется так, поскольку допускает неполное совпадение кода. Неоднозначно соответствующее основание важно для опознавания кодона и связи кодон-антикодон; при отсутствии биохимической модификации нарушается способность антикодона, содержащего немодифицированное неоднозначно соответствующее основание, декодировать некоторые кодоны.
Взаимодействие между митохондриальным и ядерным геномами
Поскольку как ядерный, так и митохондриальный геномы кодируют полипептиды окислительного фосфорилирования, неудивительно, что фенотипы, вызванные мутациями в ядерных генах, часто неотличимы от вызванных мутациями мтДНК. Кроме того, мтДНК называют «служанкой» ядерной ДНК, поскольку мтДНК зависит от множества белков ядерного генома для репликации и работы. Генетические исследования показали прямую зависимость между ядерным и митохондриальным геномами.
Первое указание данного взаимодействия было обнаружено на примере синдрома аутосомно передающихся делений в мтДНК с фенотипом, имеющим сходство с хронической прогрессирующей наружной офтальмоплегией. С этим фенотипом связаны мутации по крайней мере в двух генах. Белок, кодируемый одним из этих генов, так называемый твинкл-белок (от англ. twinkle — мерцание; назван по необычной точке приложения) оказался ДНК-праймазой или хеликазой.
Продукт второго гена — специфическая мтДНК-полимераза у, с потерей функции которой связаны как доминантные, так и рецессивные синдромы множественных делеций.
Второе аутосомное заболевание — синдром уменьшения митохондриальной ДНК (мтДНК), результат мутаций в одном из шести ядерных генов (только у небольшой части больных), ведущих к снижению числа копий мтДНК (как на митохондрию, так и на клетку в целом) в различных тканях. Большинство пораженных генов кодируют белки, необходимые для поддержки пула нуклеотидов или их метаболизма в митохондриях. Например, миопатические и гепатоцеребральные фенотипы вызваны мутациями в генах митохондриальной тимидинкиназы и дезоксигуанозинкиназы.
Другое заболевание, митохондриальная желудочно-кишечная энцефаломиопатия, — результат мутаций в гене тимидинфосфорилазы, хотя и не митохондриального белка, но особенно важной для использования митохондриальных нуклеотидов. Кроме понимания биологии митохондрий, идентификация патологических генов при таких редких нарушениях облегчает генетическое консультирование и пренатальную диагностику в некоторых семьях и способствует поиску путей лечения. Например, при недостаточности тимидинфосфорилазы уровень тимидина крови заметно повышается, что позволяет предположить терапевтическую пользу более низких уровней тимидина.
Ядерные гены могут модифицировать фенотип болезней мтДНК
Хотя основной источник фенотипической изменчивости при болезнях митохондриальной ДНК (мтДНК) — гетероплазмия, играют роль также дополнительные факторы, включая гены ядерных локусов. Надежным подтверждением существования таких факторов оказались семьи, несущие мутации, связанные с леберовской атрофией зрительного нерва; при этом заболевании мутации обычно гомоплазмические (и, следовательно, фенотипические изменения не могут объясняться гетероплазмией).
Атрофия зрительного нерва Лебера фенотипически проявляется как быстрая, безболезненная двусторонняя потеря центрального зрения из-за атрофии зрительного нерва у молодых. В зависимости от мутации часто возможно некоторое восстановление зрения, но патогенетические механизмы поражения зрительного нерва неясны.
Болеть могут как мужчины, так и женщины, но существует поразительное и необъяснимое увеличение пенетрантности болезни у мужчин; примерно у 50% носителей-мужчин и только около 10% женщин развивается симптоматика леберовской атрофии. Изменение пенетрантности и преобладание мужчин в фенотипе определяются гаплотипом в коротком плече Х-хромосомы. Гены-модификаторы в этом ядерном локусе еще не определены, но содержатся в общей популяции в частом и, вероятно, древнем гаплотипе Х-хромосомы. Если этот вариант передается человеку, унаследовавшему мутацию леберовской атрофии зрительного нерва в мтДНК от обычно здоровой матери, фенотип в значительной степени модифицируется.
Например, у мужчин, несущих аллели (кроме связанных с самым тяжелым фенотипом) леберовской атрофии зрительного нерва, нарушения зрения развиваются в 35 раз чаще, если они имеют гаплотип X, сцепленный с высоким риском. Эти наблюдения также показывают, что на самом деле локусы генов-модификаторов при моногенных болезнях возможно идентифицировать, этот Х-сцепленный локус — один из нескольких таких модификаторов, подтвержденных к настоящему времени в геноме человека.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Хотя пагубные сценарии хорошо изучены, гетероплазмия также может быть полезной. Например, у долгожителей степень гетероплазмии выше средней.
Микрогетероплазмия присутствует у большинства людей. Это относится к сотням независимых мутаций в одном организме, причем каждая мутация обнаруживается примерно в 1-2% всех митохондриальных геномов.
СОДЕРЖАНИЕ
Виды гетероплазмии
Паттерны наследования органелл
Вегетативная сегрегация
Однородительское наследование
Однородительское наследование относится к тому факту, что у большинства организмов многие потомки наследуют гены органелл только от одного родителя. Однако это не общий закон. Многие организмы, обладающие способностью различать материнский и отцовский пол, будут производить потомство со смесью материнской, отцовской и двуродительской митохондриальной ДНК.
Митохондриальное узкое место
Выбор
Хотя это недостаточно хорошо охарактеризовано, отбор может происходить для геномов органелл в гетероплазматических клетках. Внутриклеточный (« внутриклеточный ») отбор происходит внутри отдельных клеток. Это относится к избирательной сегрегации определенных генотипов в митохондриальной ДНК, которая позволяет процветать предпочтительному генотипу. Межклеточный («межклеточный») отбор происходит в более широком масштабе и относится к преимущественному росту клеток, которые имеют большее количество определенного митохондриального генотипа. Селективные различия могут возникать между естественными, непатологическими типами мтДНК при смешивании в клетках и могут зависеть от типа ткани, возраста и генетического расстояния. Селективные различия между встречающимися в природе типами мтДНК могут создавать проблемы для генной терапии.
Сниженная рекомбинация
Однако гены органелл одной линии могут рекомбинировать. Внутримолекулярная и межмолекулярная рекомбинация может вызывать инверсии и повторы в ДНК хлоропластов и может создавать субгеномные круги в митохондриальной ДНК.
Митохондриальные мутации при болезни
Мутации в митохондриальной ДНК обычно представляют собой замены одного нуклеотида, вставки одного основания или делеции.
Поскольку каждая клетка содержит тысячи митохондрий, почти все организмы содержат низкие уровни митохондриальных вариантов, что придает некоторую степень гетероплазмии. Хотя единичное мутационное событие может быть редким в его генерации, повторяющаяся митотическая сегрегация и клональная экспансия могут позволить ему доминировать в пуле митохондриальной ДНК с течением времени. Когда это происходит, это называется достижением порога и обычно приводит к физиологическим последствиям.
Серьезность и время до предъявления
Скрининг
Преимплантационный генетический скрининг (ПГС) может использоваться для количественной оценки риска поражения ребенка митохондриальным заболеванием. В большинстве случаев уровень мутации в мышцах приблизительно 18% или меньше обеспечивает снижение риска на 95%.
Известные случаи
Гетероплазмия
Задача
У эукариот часть наследственной информации закодирована в геномах органелл — митохондрий и пластид. Так, например, митохондрии содержат в себе молекулы митохондриальной ДНК * (мтДНК): на каждую клетку обычно приходится 50–100 000 молекул мтДНК. Если в отдельно взятой клетке содержится два или более разных вариантов мтДНК, то говорят, что она находится в состоянии гетероплазмии (рис. 1).

Рис. 1. Схематическое изображение эукариотической клетки в состоянии гетероплазмии (слева) и гомоплазмии (справа)
Гетероплазмия обычно возникает в результате мутации одной из множества молекул мтДНК. Даже в покоящихся клетках происходит круговорот молекул мтДНК: постепенно синтезируются (реплицируются) новые молекулы, а их избыток разрушается. Поэтому существует вероятность того, что мутантный вариант увеличит свою относительную частоту по сравнению с исходным вариантом и даже «обгонит» его.
Однако такое состояние гетероплазмии неустойчиво: в череде поколений частоты исходного и мутантного вариантов мтДНК меняются, так как митохондрии расходятся в две клетки случайным образом (рис. 2).

Рис. 2. Из-за случайного расхождения митохондрий многие клетки-потомки в ряду поколений теряют один из вариантов мтДНК и переходят в состояние гомоплазмии
Рано или поздно в процессе деления одна из клеток получает только один вариант мтДНК и тем самым переходит в состояние гомоплазмии. Это состояние практически необратимо. У большинства эукариот мтДНК наследуется строго по материнской линии, и получить утерянный вариант мтДНК неоткуда, а вероятность того, что произойдет точно такая же мутация в оставшемся варианте мтДНК, крайне мала.
У большинства многоклеточных организмов митохондриальная ДНК наследуется по материнской линии. Если в клетках зародышевой линии возникла гетероплазмия, то она может передаваться по наследству от матери потомкам. Однако на одно поколение животных приходится несколько десятков делений клеток зародышевой линии (у самок). Поэтому обычно частоты мтДНК от поколения к поколению сильно меняются или один из вариантов мтДНК теряется. Однако описаны случаи, когда гетероплазмия мтДНК сохранялась в череде нескольких поколений на приблизительно постоянном уровне и практически не приводила к выщеплению потомства только с одним из двух вариантов мтДНК.
Как вы думаете, что могло препятствовать переходу в состояние гомоплазмии (потере одного или второго варианта мтДНК) в этих случаях?
* Впрочем, бывают и исключения: есть множество вариантов дифференцированных клеток многоклеточных животных, лишенных мтДНК (пример — эритроциты млекопитающих). Кроме того, у некоторых видов эукариот в процессе эволюции митохондрии сильно редуцировались и мтДНК была утеряна (микроспоридии и др.).
Подсказка 1
В некоторых описанных случаях один из вариантов мтДНК был «неполноценный», то есть не содержал в себе всей необходимой информации, которая необходима для выполнения митохондриями своих функций.
Подсказка 2
Как правило, вредные мутации в митохондриальной ДНК проявляются на уровне целой клетки, только если относительная доля этих мутантных вариантов мтДНК превышает некий порог (обычно 60–80%). Если же доля мутантных вариантов мтДНК ниже этого порога, то клетка живет как ни в чем не бывало.
Решение
Первым, на первый взгляд очевидным, способом поддержания гетероплазмии в череде поколений является наличие двух взаимодополняющих мутаций в одном и в другом варианте мтДНК. Например, если в одной из молекул мтДНК произошла мутация, «испортившая» ген цитохром-оксидазы (COX1), а во второй — ген NADH-дегидрогеназы (ND1), то выживут только те клетки, в которых есть оба варианта мтДНК. Они смогут синтезировать необходимый для своего функционирования набор митохондриальных белков (рис. 3). Митохондрии в клетках активно делятся и сливаются друг с другом, а их содержимое перемешивается, поэтому возможность такого взаимного дополнения теоретически существует. Те же клетки, которые потеряли один из вариантов, — погибнут. Цитохром-оксидаза и NADH-дегидрогеназа нужны для клеточного дыхания, в их отсутствие клетки неспособны к размножению и быстро теряют жизнеспособность.

Рис. 3. Слияние митохондрий с мутациями в разных генах (обозначены как синяя и зеленая точки на молекулах мтДНК) теоретически может дать возможность синтезировать полный набор белков, необходимых для выполнения митохондрией ее важнейшей функции — окислительного фосфорилирования
Однако реальных примеров такой взаимной комплементации (автору задачи) неизвестно. Более того, в исследованиях, где клетки с мутациями в разных генах мтДНК искусственно заставляли сливаться, получались цибриды с нефункциональными митохондриями (D. Takai et al., 1999. Transcomplementation between Different Types of Respiration-deficient Mitochondria with Different Pathogenic Mutant Mitochondrial DNAs). Цибридами (или цитоплазматическими гибридами) называют клетки, полученные при слиянии двух клеток, если ядро одной из двух исходных клеток было утеряно, а цитоплазма осталась общей. По всей видимости, на практике неполноценные молекулы мтДНК с вредными мутациями в разных генах далеко не всегда могут дополнять друг друга.
Есть еще одна причина, по которой описанный выше вариант маловероятен. Как два дополняющих друг друга варианта мтДНК могли бы оказаться в одной и той же клетке зародышевой линии? Гаметы, которые являются клетками зародышевой линии, сливаются и образуют зиготы. Если бы гаметы содержали два разных мутантных варианта мтДНК, то оба они оказались бы в зиготе. Однако если каждый из вариантов мтДНК неполноценен (не содержит в себе полной информации, необходимой для работы митохондрий), то скорее всего гаметы, содержащие такую мтДНК, были бы неполноценными. Кроме того, для многих видов показано, что отцовская митохондриальная ДНК, попавшая в зиготу из мужской гаметы, активно уничтожается — переваривается вместе с отцовскими митохондриями в аутофагосомах.
Случаи стабильной гетероплазмии описаны для различных групп эукариот. Стабильная гетероплазмия показана для пекарских дрожжей (одноклеточные грибы) и растений. У нематод Caenorhabditis elegans и C. briggsae также известны линии со стабильной гетероплазмией. Так, например, описана линия C. elegans, в которых гетероплазмия поддерживалась на протяжении по крайней мере ста поколений: в нематодах обнаруживали один полноразмерный вариант мтДНК, второй вариант мтДНК содержал делецию одиннадцати генов (W. Y. Tsang and B. D. Lemire, 2002. Stable heteroplasmy but differential inheritance of a large mitochondrial DNA deletion in nematodes). Недавно устойчивая гетероплазмия была обнаружена в популяции обыкновенных скворцов, интродуцированных на территорию Австралии. Передача гетероплазмии из поколения в поколение описана и в случае человека.
Как предполагается, случаи стабильной гетероплазмии связаны с тем, что селекция митохондриальной ДНК происходит сразу на нескольких уровнях (рис. 4).

Рис 4. Естественный отбор мтДНК может проходить на уровне индивидуумов в популяции, клеток в организме, митохондрий в клетке и мтДНК в митохондриях. При этом некоторые варианты мтДНК могут иметь увеличенный шанс распространения в клетке, но вредить на уровне целых клеток или индивидуумов. Рисунок из статьи: L. A. Rollins et al., 2016. Selection on Mitochondrial Variants Occurs between and within Individuals in an Expanding Invasion
С одной стороны, разные варианты митохондриальных геномов «конкурируют» на уровне организма: плохие варианты (мутации в белок-кодирующих генах) обычно приводят к миопатиям или неврологическим проблемам и быстро отсеиваются естественным отбором. С другой стороны, разные варианты мтДНК конкурируют и внутри клетки — так, например, короткие митохондриальные ДНК реплицируются быстрее, чем длинные, и постепенно вытесняют их (рис. 5). В результате может возникнуть баланс: один из вариантов мтДНК вытесняет другой внутри клетки, но вредит на уровне целых клеток (или целых организмов).

Рис. 5. Разнонаправленная селекция мтДНК на уровне отдельных молекул и на уровне целых клеток приводит к стабилизации гетероплазмии в череде поколений. Мутантная мтДНК (а, обозначена красным цветом) быстрее реплицируется в клетках (например, за счет того, что в ней произошла делеция и нужно меньше времени, чтобы завершить репликацию). Поэтому в череде поколений она постепенно увеличивает свою относительную частоту по сравнению с полноразмерной мтДНК (b, обозначено синим цветов). Однако если мтДНК b становится слишком мало, то такая клетка прекращает деление или погибает. Поэтому клетки, в которых больше мтДНК b, делятся быстрее, чем клетки, в которых мтДНК b мало.
Послесловие
Рис. 6. Митохондрии фибробласта кожи человека образуют сеть. Фотография сделана с помощью флуоресцентного микроскопа, для визуализации митохондрий к клеткам добавляли родамин 123 (см. Rhodamine 123) — флуоресцентное соединение, которое накапливается в митохондриях. Фото из статьи: J. Hayashi et al., 1994. Human mitochondria and mitochondrial genome function as a single dynamic cellular unit
В условиях нашей задачи было сказано, что в клетках эукариот содержится 50–100 000 молекул мтДНК. Но как эти мтДНК распределены по митохондриям? Сколько молекул мтДНК содержится в каждой отдельной митохондрии и сколько отдельных митохондрий обычно можно обнаружить в клетке? На эти вопросы нет прямого (количественного) ответа. Это связано с тем, что митохондрии в клетках постоянно делятся и сливаются друг с другом, а во многих случаях вообще образуют единую сеть (рис. 6). Такую сеть иногда называют митохондриальным ретикулумом. Однако даже в тех клетках, в которых митохондрии представлены разрозненными органеллами, в течение времени их содержимое перемешивается. Поэтому мтДНК в клетке имеет смысл рассматривать только вместе, как совокупность, вне зависимости от того, как они распределены по отдельным органеллам (см. J. Hayashi et al., 1994. Human mitochondria and mitochondrial genome function as a single dynamic cellular unit).
Наличие множества молекул мтДНК в клетках приводит к «трагедии общин» (см. D. Haig, 2016. Intracellular evolution of mitochondrial DNA (mtDNA) and the tragedy of the cytoplasmic commons). Получается, что каждая отдельно взятая мтДНК практически ни на что не влияет. Появление одной мтДНК с вредной мутацией никак не отразится на эффективности работы митохондрий. В большинстве случаев клетка «не чувствует» до 60% дефектных мтДНК (рис. 7). Под дефектными мтДНК мы подразумеваем такие мтДНК, в которых изменения нуклеотидной последовательности не позволяют синтезировать весь необходимый набор белков, необходимых для клеточного дыхания. Превышение этого «порога патогенности» довольно быстро приводит к нарушениям в работе клеток, а если таких клеток оказалось много — к патологиям многоклеточного организма.

Рис. 7. Увеличение относительной частоты мтДНК в мутации начинает проявляться только при превышении определенного порога (своего для каждого типа мутаций)
Эти два условия — 1) «невидимость» для клетки мтДНК с вредными мутациями до тех пор, пока их доля относительно нормальной мтДНК не превысит определенный порог, и 2) случайная сегрегация (расхождение) мтДНК в процессе деления клеток — порождают для многоклеточных существ проблему. Даже незначительная доля мтДНК с вредной мутацией (ниже порога патогенности) в зиготе может привести к нарушениям у взрослого многоклеточного существа, которое разовьется из этой зиготы. В процессе развития многоклеточного организма количество клеток многократно увеличится. Так, например, человек состоит из приблизительно 3·10 13 клеток (R. Sender et al., 2016. Revised Estimates for the Number of Human and Bacteria Cells in the Body). Одни клетки получают чуть меньше, а другие чуть больше этих «неблагополучных» молекул мтДНК. Рано или поздно могут появиться клетки, в которых доля молекул мтДНК с вредными мутациями приблизительно равна порогу токсичности. При делении таких клеток с большой вероятностью будут появляться клетки, в которых доля мутантных мтДНК уже превышает порог. Такие клетки не смогут выполнять свои функции, и если таких клеток окажется много, то ткань или орган многоклеточного организма не будет справляться со своей работой.
Варианты мтДНК, которые реплицируются внутри клетки быстрее обычной мтДНК, но несут в себе вредные мутации (см. рис. 5 в решении), тем более опасны для многоклеточного организма. По мере деления клеток относительная доля таких мутаций будет постепенно возрастать, и порог патогенности будет достигнут раньше. Такие варианты мтДНК называют «эгоистичными мтДНК». Они имеют преимущество в репликации, но не несут никакой пользы (а чаще даже несут вред) для клетки или для всего организма. Предполагается, что уничтожение отцовской митохондриальной ДНК в зиготе, о котором мы упоминали выше, необходимо как раз для того, чтобы защищаться от «заражения» зародышевой линии такими вариантами мтДНК. Те немногие виды, у которых мтДНК наследуется от обоих родителей, сталкиваются с большими проблемами, если в них появляется эгоистичная мтДНК. Примером эукариот, которые получают мтДНК от обоих родителей, являются пекарские дрожжи. В них описаны мтДНК, которые вообще не несут никакой полезной информации, но в подавляющем большинстве случаев (
99 из 100) полностью замещают собой полноразмерную мтДНК, содержащую необходимую наследственную информацию (см. I. E. Karavaeva et al., 2017. Mitochondrial depolarization in yeast zygotes inhibits clonal expansion of selfish mtDNA).
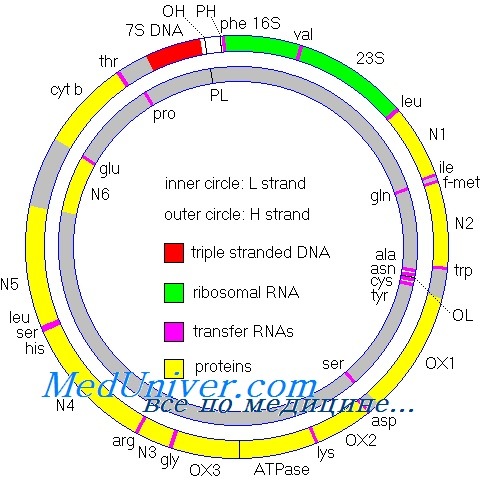
Существует большое число заболеваний человека, связанных с мутациями в митохондриальной ДНК. Многие из этих заболеваний наследственные. Поскольку у человека митохондриальная ДНК наследуется по материнской линии, то и заболевания, связанные с мутациями в мтДНК, также передаются от матери — детям. В большинстве случаев эти ассоциированные с заболеваниями варианты мтДНК находятся в состоянии гетероплазмии: одновременно с мутантной мтДНК в клетках содержится и мтДНК без вредных мутаций. Чаще всего такие митохондриальные заболевания затрагивают те ткани, в которых наиболее важна роль митохондрий: мышцы и нервные ткани. Одним из наиболее известных и распространенных митохондриальных заболеваний является нейродегенеративное заболевание — синдром MELAS. Наиболее распространенная форма MELAS связана с мутацией в одном из генов мтДНК — транспортной РНК лейцина. Этот ген кодирует транспортную РНК, которая необходима для синтеза закодированных в митохондриальной ДНК белков. Замена одного из нуклеотидов в этой РНК приводит к нарушению ее функции и большим проблемам в работе митохондрий.
Принципы сосуществования разных мтДНК внутри клетки (гетероплазмии) до сих пор не до конца ясны. Остается довольно много открытых вопросов. Не до конца понятна природа порога патогенности, далеко не всегда прослежена цепочка причинно-следственных связей между мутациями в мтДНК и нарушениями функций тканей и органов, также неизвестно, какие мутации дают молекулам мтДНК преимущества в скорости репликации, а какие нет. Однако уже сейчас ясно, что гетероплазмия очень широко распространена в природе и оказывает большое влияние на жизнь и эволюцию живых организмов.