Гетерогенное образование что это
Гетерогенное образование что это
Существуют три основные характеристики, присущие опухолевым клеткам. Во-первых, это бесконтрольный рост вне зависимости от клеточного окружения прилегающих тканей. Во-вторых, раковые клетки всегда находятся на той или иной стадии анаплазии, то есть теряют клеточную специализацию. В-третьих, раковые клетки способны метастазировать, то есть распространяться по организму и проникать в ткани далеко за пределы области развития первичной опухоли.
Эти три характеристики присущи клеткам большинства известных видов рака, однако существуют исключения. Действительно, в опухолевой ткани нарушены нормальные регуляторные механизмы контроля роста. Тем не менее обнаруживаются участки опухолевой ткани, где происходит контактное торможение роста неоплазии.
Далее, хотя большинство раковых клеток является «недифференцированными», то есть они как бы произошли от более раннего предшественника процесса тканевой дифференцировки, при некоторых видах рака опухолевые клетки сохраняют те или иные функции зрелой ткани, из которой они произошли. И только метастазирование является уникальным свойством, присущим только раковым клеткам.
Более того, поскольку чаще всего именно метастазы становятся причиной смерти больных раком, изучение биологических механизмов метастазирования является одной из ключевых задач современных исследований в онкологии.
В отдельных статьях на сайте мы рассмотрим события, происходящие вслед за воздействием на организм канцерогена и ведущие к развитию инвазивного метастазирующего злокачественного новообразования.
Большинство человеческих неоплазий по своей природе являются моноклональными. Это означает, что при канцерогенном воздействии на организм обычно первоначально поражается всего одна клетка и вся опухоль представляет собой результат размножения этой единственной клетки. Существуют две основные группы доказательств этой концепции.
Первая группа доказательств. Некоторые женщины бывают гетерозиготны по двум формам фермента глюкозо-6-фосфатдегидрогеназе (Г6ФД). Ген, кодирующий этот фермент, находится в Х-хромосоме, и женские гетерозиготы наследуют этот ген либо по отцовской, либо по материнской линии.
Если у женщины с гетерозиготным набором генов будет повреждена одна из Х-хромосом, каждая клетка ее тела будет содержать только одну из этих двух форм фермента. Обследования больных гематологическими видами рака, возникающими из гетерозиготности по гену Г6ФД, показали, что их раковые клетки всегда содержат только одну форму фермента. Это является сильным доказательством того, что рак развивается из одиночной клетки, несущей ту или иную форму гена.
При хронической гранулоцитарной лейкемии у больных обнаруживается рестрикция экспрессии ферментов в клетках гранулоцитарного ряда и, что особенно важно, в эритроцитах и тромбоцитах. Таким образом, процесс злокачественной трансформации поражает стволовые клетки.
Описанные подходы трудно применимы к раку. По-видимому, рак развивается из некоего «поля вероятности», когда толчок к развитию опухоли из тканевых клеток дают сразу несколько клональных линий, возникающих практически одновременно. Аналитические исследования женщин с раком мочевого пузыря показали, что у них все опухолевые клетки обнаруживают супрессию по одному и тому же локусу Х-хромосомы, тогда как здоровые клетки мочевого пузыря демонстрируют случайные супрессии одной из двух Х-хромосом.
Приведенный факт также подтверждает моноклональную теорию происхождения рака. Кроме того, в исследованиях было показано, что хотя делеция 9q участка хромосомы обязательно присутствует во всех раковых клетках, в некоторых клетках была также обнаружена потеря 17р и 18q участков, что предположительно связано с более поздними этапами развития опухоли. Это также говорит о том, что хотя возникновение и первичное развитие опухоли происходят из одной клетки, в процессе ее роста возможно возникновение и нарастание генетической изменчивости составляющих ее клеток.
Вторая группа доказательств моноклональной природы рака происходит из исследований лимфом и различных лимфоидных форм рака. Было показано, что иммуноглобулины, продуцируемые лимфоидными неоплазиями (и встроенные в мембрану, и выделяемые в кровяное русло, как в случае с миеломой), почти всегда являются моноклональными, принадлежащими к одному классу и обнаруживающими одинаковую рестрикцию экспрессии легких цепей.
Безоговорочное принятие теории моноклональности рака иногда заставляет исследователей приписывать раковым опухолям гораздо более предсказуемое поведение, чем это есть на самом деле. Реальное же положение вещей такое, что, несмотря на моноклональное происхождение, неоплазии в процессе своего развития обнаруживают все большую и большую гетерогенность. Этот факт необходимо всегда учитывать при лечении онкологических заболеваний и в оценке природы опухолевых метастазов.
Как же вообще возникает гетерогенность, если раковая опухоль первично моноклональна? Дело в том, что процесс злокачественной трансформации всегда сопровождается общей генетической нестабильностью, что вызывает многочисленные фенотипические изменения первоначально однородных клеток. Некоторые из мутирующих клеток выживают и дают начало новым линиям развития, некоторые погибают в результате мутации. Выживаемость мутировавших клеток зависит от их гормональной и биохимической стабильности, а также от возможности их распознавания иммунной системой.
Таким образом, зрелую опухоль можно рассматривать как конгломерат клеток моноклинального происхождения, но различающихся по способности к метастазированию, устойчивости к цитотоксическим препаратам и атакам иммунной системы организма.
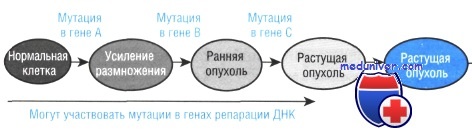
Процесс постепенного накопления хромосомных изменений в ходе прогрессии опухоли показан на рисунке на примере развития рака толстой кишки из полипа толстой кишки. По мере роста опухоли и возрастания генетической нестабильности в ее клетках возникают многочисленные разрывы хромосом, делеции и редупликации генов. Морфологически это сопровождается изменчивостью клеточных ядер и ростом числа плеоморфных цитологических форм.
Опухолевые клетки многих видов рака содержат мутации по гену, кодирующему белок р53. Этот ген кодирует наработку ядерного фосфопротеина, который участвует в контроле клеточного цикла, запрещая вступление клетки в фазу G1, если обнаруживаются повреждения клеточной ДНК. В нормальных клетках под действием ультрафиолетового облучения или цитотоксических препаратов происходит резкое увеличение содержания р53, что связано со стабилизацией белка после трансляции.
Деактивация функций р53 в результате мутации приводит к тому, что клетка вступает в митоз даже с ошибками в своем генетическом коде. Мутации в гене р53 раковых клеток приводят к конформационным изменениям фермента и делают его неактивным. Мутантные формы фермента теряют способность связываться с молекулами ДНК. Таким образом, мутация белка р53 является ключевым моментом опухолевой профессии, когда злокачественные клетки вступают в клеточный цикл без предварительной репарации поврежденных участков ДНК. В дальнейшем происходит процесс все большего накопления мутационных изменений.
Популяция раковых клеток, выросшая как потомство одной единственной клетки, в ходе своего развития обнаруживает значительную изменчивость как по скорости роста отдельных субпопуляций, так и по их цитоплазматической организации, гормонально-рецепторному статусу, чувствительности к радиоактивному облучению и цитотоксическим препаратам. В качестве примера можно привести мелкоклеточный рак легкого.
При этом заболевании клетки первичной опухоли и отдаленных метастазов значительно отличаются друг от друга по уровню цитоплазматического кальцитонина, гистаминазы и L-дофаминовой декарбоксилазы. Обнаруживаются также кариотипические различия клеток первичных и вторичных опухолей.
Гетерогенность опухолей представляет собой громадную проблему для терапии рака. Если опухоль обнаруживает изменчивость клеточных фенотипов и антигенной экспрессии, становится очень трудно оценить, какой вид иммунотерапии может дать положительный лечебный эффект. Аналогично, наличие в единичной опухоли субпопуляций клеток с различной чувствительностью к тем или иным цитостатическим препаратам обусловливает ее резистентность к химиотерапии, которая часто выявляется в ходе проведения лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
ГЕТЕРОГЕННЫЙ
Смотреть что такое «ГЕТЕРОГЕННЫЙ» в других словарях:
гетерогенный — гетерогенный … Орфографический словарь-справочник
ГЕТЕРОГЕННЫЙ — (греч. от heteros другой, и gignomai рождаю). Разный, разнородный. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. гетерогенный (гр. heterogenes) неоднородный по составу (протнвоп. гомогенный); г ая система физ.… … Словарь иностранных слов русского языка
гетерогенный — неоднородный, разнородный, разнотипный, разнохарактерный, пёстрый, разноликий, разнокалиберный, смешанный. Ant. однородный, гомогенный Словарь русских синонимов. гетерогенный см. разнородный Словарь синонимов русского языка. Практическ … Словарь синонимов
гетерогенный — ая, ое. gétérogène. Разнородный. Сл. 18. Гетероген или Этерожен. В физике и химии называют так всякое тело, еоторого части различной натуры, связи, цвета и проч. Ян. 1803. При первом взгляде на <русские> общества, les parties hétérogènes… … Исторический словарь галлицизмов русского языка
ГЕТЕРОГЕННЫЙ — ГЕТЕРОГЕННЫЙ, гетерогенная, гетерогенное (от греч. heteros иной и genos род) (научн.). Разнородный по существу или происхождению. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ГЕТЕРОГЕННЫЙ — [тэ ], ая, ое (спец.). Разнородный по своему составу или происхождению; противоп. гомогенный. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ГЕТЕРОГЕННЫЙ — (греч. heterogenes разнородный) принадлежащий другому роду, неоднородный, составленный из неоднородных элементов. Противоположность – см. Гомогенный. Философский энциклопедический словарь. 2010 … Философская энциклопедия
ГЕТЕРОГЕННЫЙ — компонент среды, неоднородный по составу, происхождению объект внешней среды. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989 … Экологический словарь
гетерогенный — разнородный различный неоднородный инородный — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии Синонимы разнородныйразличныйнеоднородныйинородный EN heterogeneous … Справочник технического переводчика
гетерогенный — heterogenic, heterogenetic гетерогенный. Xарактеризует популяцию, клетку, которым свойственно наличие более одного аллеля определенного гена (генов). (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А … Молекулярная биология и генетика. Толковый словарь.
Узлы в щитовидной железе
В данной статье мы рассмотрим такую распространенную проблему, как узелки на щитовидной железе, поговорим о том, что это, о причинах возникновениях, симптомах, могут ли они рассосаться, как лечатся и другое. Также ответим на наиболее часто задаваемые вопросы по данной теме.
Узлы в щитовидной железе
Щитовидная железа является одним из органов эндокринной системы, она расположена в области шеи, имеет две доли и перешеек. В данном органе вырабатываются важные гормоны, которые позволяют организму правильно функционировать, отвечают за обмен веществ.
Главным питающим веществом щитовидки является йод – его недостаток приводит к отклонениям и развитию патологий, которые лучше вовремя обнаружить, чтобы не допустить серьезных последствий.
Код по МКБ 10 у заболеваний щитовидной железы: Е00-Е07. В зависимости от классификации предусматривается определенный тип лечения.
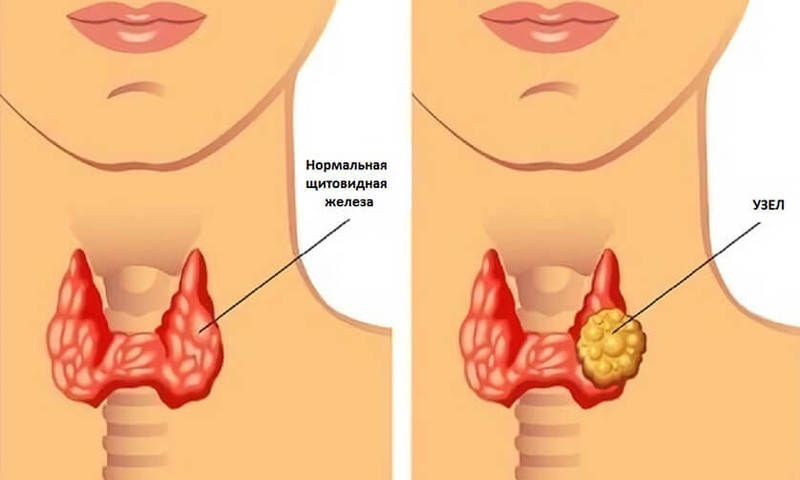
Узелок в щитовидной железе имеет округлую форму и образуется вследствие избыточного процесса деления клеток самой железы.
На практике у человека может встречаться как один узел, так и несколько в любой доле или обеих. Большее количество таких образований являются доброкачественными, однако, встречаются и злокачественные, требующие серьезного вмешательства.
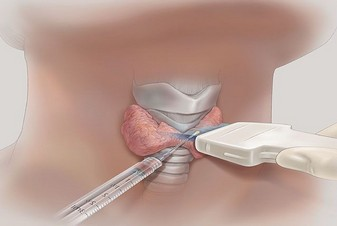
Для определения злокачественности, узлы на щитовидке подвергаются процедуре биопсии. Согласно статистике по биопсиям, 80-90% выявляют доброкачественную природу материала. На фото ниже видно, как выглядит шея у человека при обычном размере левой и правой доли щитовидки, а как она же может выглядеть при значительном увеличении размеров долей.
Чем опасны узлы в щитовидной железе
При увеличении ткани щитовидки, она может начать вырабатывать дополнительное количество гормонов, что создает дисбаланс в организме, нарушаются метаболические процессы, на фоне этого развиваются другие нарушения и заболевания. Также сильное разрастание тканей в какой-то момент может ухудшить качество жизни человека, могут проявиться такие симптомы, как резкое похудение, что связано с дисфункцией метаболических процессов, излишней потливостью, угнетением нервной системы и др.
Причины возникновения узлов на щитовидной железе
Что делать, если появился узел в щитовидке, решает врач на основании его природы и причин возникновения.
К сожалению, сегодня нет подтвержденных данных о том, почему происходит данный процесс. Но все склоняются к тому, что это связано с нехваткой йода в организме и наследственной предрасположенностью. Кроме того, что человек может получать мало йода с пищей, он может подвергаться большому потоку радиоактивного излучения. Известно, что радиация также способствует образованию узлов и даже рака.
Симптомы
Узлы щитовидной железы у женщин и мужчин обычно не сопровождаются симптомами, а выявляются на плановом УЗИ. Иногда, правда, при больших размерах, человек может заметить в области шеи нехарактерные для него припухлости или может обратить внимание на дискомфорт в области шеи при повороте головы и глотании.
Большой узел (более 1 см) врач может пальпировать и тогда на УЗИ уже уточняются его размеры и природа. Узлы небольшого размера могут не чувствоваться, поэтому важно самостоятельно раз в год делать ультразвуковую диагностику, чтобы контролировать состояние щитовидки.
Иногда пациенты путают дискомфорт, ощущение комка в горле, некоторые приступы удушья и т.п. с образование узелков в щитовидке, однако, чаще всего это сопряжено с неправильной работой других органов, например ЖКТ.
Диагностика
Если появились подозрения на узелки в щитовидке, то необходимо обратиться к врачу-эндокринологу, так как это полностью его сфера деятельности. Врач соберет анамнез, задаст необходимые вопросы по самочувствию, питанию, заболеваниях и наследственности, а также проведет пальпацию обеих долей щитовидки в области шеи.
Основными диагностическими процедурами при выявлении узлов и описания их характера выступают:
Перечисленные исследования направлены на выявление патологии и выяснение ее характера для того, чтобы назначить надлежащее лечение.
Лечение узлов щитовидной железы
Лечение назначается исходя из результатов диагностики. Сегодня доказано, что узлы могут быть при нормальных анализах гормонов, однако их значение очень важно. Если они в норме, а биопсия показала доброкачественность, то при нормальных размерах, узлы щитовидной железы не требуют хирургического вмешательства или серьезного медикаментозного лечения. Необходимо следить за их состоянием, то есть делать УЗИ и сдавать анализы на гормоны минимум раз в год.
Для поддержания функции эндокринной системы и для нормализации состояния, специалист может назначить дополнительный прием витаминно-минеральных комплексов, прием йода и селена. Также для нормализации состояния необходимо придерживаться правильного сбалансированного питания.
Как вылечить узлы на щитовидке без операции
При определенных показаниях необходимо хирургическое удаление узла или всего органа. Однако такое встречается редко. Чаще всего, пациенту назначается не хирургическое лечение, лечение гормональными препаратами и малоинвазивные процедуры, направленные на устранение избыточного объема узла и щитовидной железы.
Назначается прием синтетических гормонов, которые помогают нормализовать работу щитовидной железы, если она уже нарушена засчет нарушения выработки гормонов. Также назначаются йодсодержащие препараты, если дисфункция вызвана его нехваткой.
Для уменьшения размеров узлов в щитовидной железе могут использоваться такие методы как:
Но перечисленные методы пока еще не доступны для широкого применения и проходят клиническую апробацию.
К какому врачу обратиться
Для того чтобы лечение было успешным, необходимо изначально обратиться к квалифицированному специалисту, который проведет консультацию, поможет с расшифровкой проведенной диагностики. Таким высококвалифицированным специалистом в области эндокринного здоровья являюсь я, Романов Георгий Никитич. Я кандидат медицинских наук, почти четверть века веду врачебную практику, как в государственных, так и в частных мед. учреждениях, имею большой опыт лечения пациентов с узлами в щитовидной железе.
Кроме очных приемов в клинике, провожу платные онлайн консультации, на которые может попасть каждый и задать волнующие вопросы. Чтобы связаться со мной и записаться на прием, можно написать на почту в одной из социальных сетей или мессенджере: Viber, Telegram, Instagram, WhatsApp, Skype, ВКонтакте.
Наиболее популярные вопросы пациентов с ответами Романова Георгия Никитича
Галина: У меня уже 7 лет определяются узлы на щитовидке. Одни говорят оперироваться, другие – подождать. Что делать, не знаю.
Галина: А правда, что пункция провоцирует рост узлов в щитовидной железе и нельзя часто ее делать?
Романов Г.Н: Таких данных в мире не существует. Нигде и никогда не было доказано, что пункция узлов стимулирует их рост, и тем более перерождение. Повторные пункции врач Вам предложит только в двух случаях: когда появился новый узел или старый узел при повторном УЗИ исследовании изменился (быстро вырос, изменил контуры или свои характеристики).
Романов Г.Н: Это бывает крайне редко. Если и будет, то фолликулярная опухоль, которая очень редко ведет себя агрессивно. Я, думаю, все будет хорошо!
Романов Г.Н: Принимать ничего не надо! Контроль узи ЩЖ через 6 мес и все!
Оксана(Одесса): Здравствуйте! У меня обнаружен узел в щитовидной железе, 3 см. Есть анализы УЗИ, анализ на гормоны щитовидки, анализ биопсии.
1.Результаты УЗИ : щитовидная железа расположена типично, доли асимметричны, с четкими контурами. Размеры по Brunn(возрастная норма 12 куб.см): правая доля-22х26х50мм (объем-13.7 куб.см); левая доля-15х17х44мм (объем-5.4куб.см.), суммарный объем 19.1 куб.см. Перешеек толщиной 4мм. Структура железистой ткани однородная, ткань изоэхогенная. Занимая нижний и средний сегменты правой доли, определяется узел овальной формы умеренно повышенной эхогенности с четкими контурами размерами 31х21мм, сожержит анэхогенный очаг овальной формы размерами 6.5х4мм. Увеличение лимфоузлов не определяется.
2.Исследование содержания гормонов щитовидной железы и антител тиреоидной пероксидазе в сыворотке крови человека методом РИА:
3.ТАПБ щитовидной железы под контролем УЗИ
Диагноз: узловой зоб 2 стадии
Материал: Пунктат узла щитовидной железы.
Цитограмма фолликулярной опухоли (гиперклеточный коллоидный зоб?аденома?)
Скажите, пожалуйста, Ваше мнение, может быть какие-то признаки Вам непонятны?
Романов Г.Н: Удалить правую долю с узлом и забыть. К сожалению, других вариантов здесь нет.
Юлия: Здравствуйте.После лазерной деструкции узла на 4 день стало болеть горло внутри на уровне самого узла. Это нормально? Я очень переживаю.
Романов Г.Н: Это ожог и он должен болеть. Пока не заживет рана внутри.
Оксана: Добрый вечер, результаты УЗИ: в нижней трети справа изоэхогенный узел с четкими контурами,неоднородной структуры,размер 5×6 мм, с признаками кровотока. Это при нормальных гормонах и ткани в норме. Есть ли показания для пункции?
Романов Г.Н: Надо еще другие факторы риска онкозаболевания рассматривать для решения (Чернобыль, облучение головы и шеи, родственники и др.).
Романов Г.Н: Это значит, что все хорошо.
Марина: Здравствуйте, доктор. У меня в 2013 году был обнаружен узел щитовидной железы. Сама железа увеличена. Правая доля была 23х22х50, левая доля 18х16х42, общий объем 19.5. И узел был 16.1 на 16.8 на 22 мм. Я будучи трусихой (возраст 42 года на данный момент), не сделала биопсию. И вот в этом году сделала повтор УЗИ. Размер правой доли длина 56, ширина 29,толщина 31. Левая доля длина 50, ширина 18, толщина 16. Общий объем 31.6. Узел в правой доле 36 на 23.5 на 29, с интра и перинодулярным кровотоком. И в левой доле маленький появился 4.7 мм. ТТГ сейчас 0.5. Ходила к хирургу,и он меня отругал,сказал,что надо оперировать было еще три года назад.Что у меня низкий ТТГ(хотя я думала,что это в пределах нормы).Вот пойду теперь только на биопсию,и хирург сказал,что независимо от ее результатов у меня нет других вариантов,кроме операции. Скажите пожалуйста свое мнение. Действительно ли все так плохо,как сказал хирург? Какие нормальные рекомендации Вы можете дать?
Романов Г.Н: Рост действительно значимый. Имеет значение и Ваша история (Чернобыль, наследственность?). Биопсия расставит все точки над i. Выполнить ее следует обязательно в Вашем случае.
Романов Г.Н: Через 6 мес контроль УЗИ и затем решение о ТАБ.
Романов Г.Н: Вы 1980 года рождения, а значит в группе риска по Чернобылю. Придется все узлы более 1 см пунктировать.
Романов Г.Н: Тироксином восстанавливайте ТТГ и наблюдайтесь.
Романов Г.Н: Они разные по структуре, поэтому надо делать пункцию двух узлов.
Узи 7.09.12:ЩЗ- правая доля 6.0, левая доля 4.2. Эхоструктура неоднородная. Дилатация сосудов нет. Гиперэхогенная тяжистость- нет. Эхогенность- изоэхогенная,неравномерная. Аномалии-нет. Узловое образование в правой доле 12.7*8.1мм.Форма-округлая.Контуры нечеткие. Эхогенность- гипоэхогенная. Структура однородная. Какие могут быть прогнозы? (пункцию делать не предлагали, повторное УЗИ через 3 мес.)
Романов Г.Н: Очень похоже на простой кистозно-узловой зоб. Можно еще понаблюдать.
Выводы
Из данной статьи ясно, что ответ на вопрос «как избавиться от узлов на щитовидке?» не имеет единого ответа для всех пациентов.
Вопросы, ответы на которые были приведены, были взяты из моего форума, где я, Романов Георгий Никитич, постарался максимально четко ответить на поставленные вопросы, но стоит помнить, что у каждого человека есть индивидуальные факторы, которые также влияют на работу нашего организма.
ГЕТЕРОГЕННОСТЬ ОПУХОЛИ — ДИНАМИЧНОЕ СОСТОЯНИЕ
Обобщены и проанализированы литературные данные по проблеме гетерогенности опухоли. Рассмотрены фенотипические проявления, генетические и эпигенетические механизмы развития, причинные факторы гетерогенности, а также ее значение для биологии популяций опухолевых клеток и чувствительности опухолей к терапевтическим воздействиям.
Гетерогенными называют предмет или систему, состоящие из множества варьирующих единиц/ компонентов, которые часто не легко сортируются или разделяются. Термин «гетерогенность опухоли» подразумевает существование ряда отличий клеток в опухоли, клеток первичной опухоли и метастазов, клеток отдельных метастазов одной опухоли [1]. В 1977 г. авторитетный журнал «Cancer Research» не принял к печати статью, авторы которой, получив и охарактеризовав 4 разные субпопуляции опухолевых клеток (ОК) из одной спонтанной опухоли молочной железы мыши, утверждали, что эти данные служат доказательством гетерогенности опухоли, и что такая гетерогенность является общим феноменом. Редакция отвергла статью, указав, что моноклональность опухолей — общеизвестный факт [2]. В настоящее время показано, что большинство опухолей обладает вариабельностью по широкому спектру морфологических и функциональных показателей. Установлено также, что гетерогенность (плейоморфизм) ОК затрагивает фенотипические, генетические и эпигенетические признаки. В процессе прогрессии опухоли составляющие ее клетки претерпевают ряд разнообразных изменений [2, 3]. В то же время остается открытым ряд фундаментальных вопросов относительно причин гетерогенности опухолей, механизмов ее формирования, значимости этого феномена для эволюции популяции ОК и развития опухолевого процесса. Гетерогенность ОК требует дальнейшего изучения и анализа и с позиций клинической онкологии — для совершенствования методов диагностики и лечения. Накопленный объем информации в этой области сегодня подобен котлу, в котором переплавляются несопоставимые понятия и созревают новые концепции.
Целью данной работы является обобщение и ана-
лиз данных о формах проявления, причинах и механизмах формирования гетерогенности ОК, а также точек зрения на проблему, идей и концепций с позиций оптимизации диагностики и лечения больных с опухолью.
ФЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ ОК: ФЕНОМЕНОЛОГИЯ, ВОЗМОЖНЫЕ ПРИЧИНЫ, БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Различают следующие формы гетерогенности опухолей: межопухолевая — разные (первично множественные) опухоли в одном органе могут иметь различный фенотип; внутриопухолевая — каждая отдельная опухоль состоит из фенотипически и функционально гетерогенных ОК с неодинаковым поведением [3]. Поскольку развитие первично множественных опухолей является достаточно редким феноменом, основной массив исследований по проблеме посвящен внутриопухолевой гетерогенности; в нашем обзоре мы также ограничимся рассмотрением только названного феномена.
Если каталогизировать выявленные в различных исследованиях параметры гетерогенности опухолей, становится очевидным, что выраженность последней зависит от этиологии опухоли, ее гистогенеза, локализации в органе. Неоднородность характерна как собственно ОК, так и компонентам (клеточным и неклеточным) опухолевого микроокружения; иными словами, гетерогенными могут быть и паренхима, и строма опухоли.
Согласно публикациям последних лет ОК одного новообразования могут отличаться как по морфологическим (степень дифференцировки, размеры, форма, количество ядер, цитохимические особенности, кариотип и т.д.), так и функциональным характеристикам (морфогенетические реакции, уровень пролиферации, взаимодействия клетка-клетка, подвижность, инвазивность, склонность к метастазированию, чувствительность к индукторам апоптоза, химиотерапевтическим агентам и иммунотерапии). Описана гетерогенность ОК по составу клеточных мембран; их антигенности; спектру маркеров клеточной поверхности, включая рецепторы ростовых факторов; по активности сигнальных путей, регулирующих пролиферацию, клеточный цикл, репарацию ДНК, апоптоз, функциональный ответ клеток на изменения условий внешней (внеклеточной) среды [2–4, 25].
Существенно варьируют не только параметры роста ОК in vitro, но и туморогенность in vivо (включая число введенных клеток, необходимое для генерирования опухолей; латентный период и скорость роста последних), чувствительность к неспецифическим реакциям противоопухолевого иммунитета и способность индуцировать специфический иммунный ответ хозяина. В свою очередь, изменение возраста и гормонального статуса организма хозяина оказывают влияние на отличия ОК [2, 3, 5, 6].
Гетерогенными являются и клональные популяции ОК. Показано, что при введении каждого клона ОК бестимусным мышам могут расти гистологически различные опухоли. Считают, что такая гетерогенность в значительной мере возникает вследствие фенотипической пластичности и различной дифференциации стволовых клеток опухоли под влиянием сигналов микроокружения и, вероятно, некоторых стохастических клеточно-автономных механизмов. Относительный вклад в гетерогенность наследственных и ненаследственных механизмов все еще не ясен [7].
Новообразования или их различные участки могут также отличаться по составу экстрацеллюлярного матрикса, клеточным и неклеточным компонентам соединительной ткани (стромы опухоли); по количеству и типам клеток иммунной системы, инфильтрирующих опухолевую паренхиму; по степени васкуляризации (как кровеносными, так и лимфатическими сосудами), по метаболическим особенностям микроокружения [67]. Иными словами, даже в одной опухоли ОК получают различные сигналы микроокружения, которые могут изменять фенотип когда-то идентичных клеток [9, 21].
В то же время показано, что наряду с фенотипическими отличиями, которые возникают в ответ на изменения условий внешней среды (микроокружения ОК), возможна гетерогенность ОК даже при наличии очевидно гомогенного окружения. Например, генетически гомогенные линии ОК могут проявлять морфологическую гетерогенность (сочетание округлых, не способных двигаться эпителиоидных клеток и подвижных фибробластоподобных клеток, которое можно обнаружить как in vitro, так и in vivo), которая является результатом различной взаимоисключающей и взаимообратимой активации G-белков Rac и Rho [8].
Вариабельность ОК разных первичных опухолей одного и того же органа, а также ОК в каждой отдельной опухоли не исчерпывают все аспекты опухолевой гетерогенности. Накапливается информация о фенотипических и генотипических отличиях между клетками первичных опухолей и метастазов, а также о гетерогенности метастатических опухолевых очагов. Однако данные достаточно разноречивы. Часть исследований, в которых сравнивали характеристики первичных опухолей и метастазов, обнаружили довольно тесную клональную связь. В частности, такая связь была выявлена для пер-
вичных и метастатических опухолей простаты (независимо от анатомической локализации метастазов), что подчеркивает природную моноклональность этих новообразований [10, 11]. В то же время другими исследователями при раке простаты обнаружена гетерогенность и в первичных опухолях, и в метастатических очагах [12, 13]. Выявлены радикальные отличия первичных и метастатических опухолей простаты, а также молочной железы, проявляющиеся в потере аллелей, что указывает на высокую степень генетической дивергенции [14, 15]. Сравнение последовательностей первичных лобулярных и метастатических опухолей молочной железы выявило множественные мутации, присущие только метастазам [16]. Считают, что первичная и метастатические опухоли могут развиваться как генетически отличающиеся в тех случаях, когда метастатическое распространение происходит на раннем этапе опухолевой прогрессии. Ясно, что необходимо дальнейшее изучение клональной связи между первичной и метастатическими популяциями ОК при злокачественных нововобразованиях различного гистогенеза.
Вопрос клональной гетерогенности внутри самого(их) метастаза(ов) еще менее изучен. Сложная сеть метастического микроокружения, комплексные взаимодействия ОК, клеток стромы, иммунных клеток, неклеточного матрикса и растворимых факторов являются ключевыми игроками прогрессии и метастазирования, а также гетерогенности метастатических опухолей. Повторим, что стромальные клетки как опухолей, так и метастазов коэволюционируют вместе с ОК, изменяя свой генои фенотип с целью аккомодации к нуждам своих постоянно меняющихся неопластических соседей [17]. Принимая во внимание приведенную информацию, актуальными представляются следующие вопросы: а) какова клональная связь между первичной и метастатической опухолями: являются ли клетки метастазов прямыми потомками клонов развитых первичных опухолей или они отклоняются на ранних стадиях эволюции опухоли?; б) какова степень гетерогенности метастатических опухолей по сравнению с первичными, являются ли они более или
менее клонально гетерогенными?
Существуют 2 основные концепции происхождения гетерогенности ОК: различные субтипы ОК возникают из различных стволовых клеток (концепция стволовой клетки); различные субтипы ОК возникают вследствие несовпадающих генетических и/ или эпигенетических изменений стволовой (мишеневой) клетки (концепция клональной эволюции) [9, 10]. Каждая из этих концепций исследуется немало времени. А. Marusyka, К. Polak [9] считают, что, хотя концепции стволовой клетки и клональной эволюции (фенотипической пластичности) имеют немало сходного, их следует взаимно исключить как фундаментально разные. Однако по мнению ряда исследователей, выявленные клеточные и молекулярные ме-
ханизмы не являются взаимоисключающими и могут действовать совместно. При формировании гетерогенности конкретных опухолей обе концепции (или каждая из них) могут быть в определенной степени справедливы. Даже если большинство ОК в некоторых (или многих?) опухолях не способны поддерживать пролиферацию и, таким образом, могут быть идентифицированы как нестволовые, компартмент стволовой клетки должен быть фенотипически различным и пластичным [21].
К сложным молекулярным и клеточным программам, определяющим характеристики гетерогенности и дифференциации (межклеточная адгезия, апикально-базальная полярность или ее отсутствие, отсутствие подвижности) эпителиальных клеток, а также приобретение ими мезенхимальных функций (подвижность, инвазивность, повышение резистентности к апоптозу), относится эпителиально-мезенхимальный переход. Последний детально проанализирован в обзорах [22—24], к которым мы отсылаем заинтересованного читателя.
Следует также упомянуть, что постепенно накапливается информация о синхронном изменении in vivo некоторых гетерогенных характеристик ОК, имеющих совершенно разную молекулярную основу, и о совпадении спектра таких характеристик при противоопухолевых воздействиях разной природы. Так, злокачественному (особенно метастатическому) фенотипу клеток многих опухолей присущи одновременно несколько признаков, определяющих резистентность ОК к цитотоксическому действию эффекторов естественного иммунитета. Это секре-
ция простагландина Е 2 (приводит к подавлению активности естественных киллеров, Т-лимфоцитов, нейтрофилов) и активация механизмов катаболизма Н 2 О 2 /супероксидных радикалов, в частности, каталаз и окислительно-восстановительного цикла глютатиона (обеспечивает защиту против продуктов
«кислородного взрыва» макрофагов, нейтрофилов) [71]. В то же время высокая активность системы глютатиона относится к числу признаков, гетерогенно экспрессируемых в популяции ОК в процессе формирования лекарственной резистентности, в частности, к алкилирующим соединениям или цисплатину [72]. Рассмотренные примеры иллюстрируют положение о том, что гетерогенность ОК является отражением их естественного отбора по множеству связанных с выживаемостью in vivo свойств. Приобретаемая в условиях организма устойчивость ОК к его защитным реакциям, относительная устойчивость к гипоксии, резистентность к лучевой и лекарственной (включая таргетную) терапии связаны с разными механизмами, но как явления, обусловленные отбором, имеют общую биологическую природу. Гетерогенность опухоли — необходимое условие возможности такого отбора.
Таким образом, в настоящее время не вызывает сомнений, что опухоли не являются статичными образованиями. Они начинаются из генетически нор-
мальной клетки и завершают формированием популяции, состоящей из триллионов ОК, которые сформировали множество клеточных фенотипов. Наличие многих интерактивных субпопуляций (как ОК, так и клеток микроокружения) составляют основу феномена «прогрессия, диссеминация и колонизация опухоли», когда в течение времени опухоль претерпевает гетерогенные изменения своих свойств. Очевидно, что знание характеристик отдельных клонов ОК недостаточно для прогнозирования поведения опухоли в целом [18]. Удивительно, что несмотря на выраженную гетерогенность опухолей, они часто остаются относительно стабильными в течение развития от локализованной формы до метастазов и даже до последней стадии болезни [19, 20].
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ГЕТЕРОГЕННОСТИ ОПУХОЛИ
Механизмы диверсификации ОК могут быть аналогичными (или идентичными) нормальной диверсификации в эмбриональном и постэмбриональном периодах развития организма. Как уже отмечалось выше, ряд исследователей полагает, что одной из базисных причин гетерогенности популяции ОК является высокая изменчивость. Последняя связана, по крайней мере, с 3 механизмами: с повышением частоты истинных генетических изменений, которые закрепляются в ряду клеточных поколений (генетическая/геномная нестабильность); со значительным увеличением вероятности возникновения ОК эпигенетических изменений, вследствие которых может происходить подавление экспрессии одних генов и/или усиление экспрессии других; с наличием стохастической вариабельности экспрессии гомологичных белков в отдельных генетически идентичных клетках при одинаковых условиях внешней среды (генетический шум Эловица [68]).
Генетическая нестабильность (ГН) состоит в основном из 2 типов нарушений: генных мутаций (мутационная нестабильность, связанная с изменениями в последовательности нуклеотидов ДНК) и перестроек хромосом (хромосомная нестабильность, возникающая из их ошибочных реаранжировок). Структура и число мутаций и изменений хромосом со временем меняется в ОК по сравнению с нормальными клетками [26]. В некоторых ОК человека были описаны и другие формы ГН, в частности микросателлитная нестабильность, которая характеризуется увеличением или уменьшением числа олигонуклеотидных повторов, имеющихся в микросателлитных последовательностях генома [27, 28], а также разновидность ГН, для которой характерно повышение частот пар оснований [29]. В ОК и нормальной ткани наблюдаются различия между микросателлитами одного и того же локуса. Дестабилизация микросателлитных локусов, по-видимому, не служит непосредственной причиной малигнизации, однако может быть чувствительным маркером мутатор-
ного фенотипа, проявлением ГН и одной из характеристик гетерогенности ОК.
ГН является характерной чертой практически всех ОК человека, но на какой стадии развития опухоли она возникает и какова ее молекулярная основа в каждом конкретном новообразовании — это вопросы, на которые мы только начинаем получать ответы. В основе возникновения ГН лежат 4 основных типа нарушений: уменьшение точности воспроизведения генетический информации — понижение точности репликации ДНК и сегрегации хромосом во время митоза; нарушение в системах репарации повреждений ДНК или ошибок ее репликации; ослабление контроля клеточного цикла — активации чекпойнтов, в результате чего клетка с поврежденной ДНК или хромосомными изменениями продолжает делиться и умножать аномальную популяцию; ослабление индукции апоптоза, вследствие чего клетки с генетическими нарушениями не элиминируются из популяции. Все описанные нарушения так или иначе связаны с мутациями и инактивацией функции антионкогенов — опухолевых супрессоров. В 1997 г.
K.W. Kinzler и B. Vogelstein сгруппировали эти гены в 2 класса: «смотрители —caretakers« и «стражи/сторожа — gatekeepers« [31]. Продукты генов-стражей функционируют в системе контроля, обеспечивающего запрет на пролиферацию клеток с различными (в том числе генетическими) нарушениями. Генысмотрители кодируют продукты, которые принимают участие в репарации ДНК, стабилизируя, таким образом, геном. Некоторые опухолевые супрессоры (р53, BRCA1, ATM, CHK2 и др.) выполняют обе функции [32]. При наличии мутации в гене-смотрителе имеется высокая вероятность мутации и в генестраже [33]. В 3–31% спорадических опухолей человека в генах-смотрителях встречаются одна или более мутаций. Достаточно большой разброс данных может быть связан с отличиями в методиках, использованных для идентификации мутаций [30].
В спорадических опухолях человека основной формой ГН является хромосомная неустойчивость; для многих наследственных опухолей характерны мутации, в частности в генах различных систем репарации ДНК (разрывов ДНК — BRCA1/2, неспаренных оснований — MSH2,3,6, MLH1, PMS1,2, эксцизионной — XP A-G). На сегодня приняты 2 гипотетические модели ГН. Первая из них — мутационная, которая утверждает, что ГН имеется уже при предопухолевых состояниях и побуждает развитие опухоли путем повышения уровня спонтанных мутаций. Упомянутая выше идентификация мутаций в генах репарации ДНК при наследственных формах рака обеспечивает сильную поддержку этой гипотезе. Согласно второй модели основную роль в развитии опухоли играет индуцированная онкогенами (RAS, BCR/ABL) стрессовая репликации ДНК [30]. Нарушение правильной сегрегации хромосом может происходить вследствие изменения числа и структуры центросом или центров организации ми-
кротрубочек. К таким изменениям приводит активация RAS и инактивация опухолевых супрессоров р53, АРС, BRCA1.
Процесс репликации ДНК по существу ставит клетку в ситуацию риска приобретения мутаций. Многие гены системы репарации ДНК и гены, кодирующие ферменты матричного синтеза нуклеиновых кислот, называют мутаторными генами (генами-мутаторами). Нарушения функционирования и координации экспрессии генов метаболизма нуклеотидов приводит к возникновению мутаторного фенотипа так же, как и нарушения функционирования систем рекомбинации, транскрипции, контроля структуры хроматина; ферментных систем, контролирующих сегрегацию хромосом и число копий индивидуальных генов; систем, участвующих в синтезе эндогенных мутагенов [34].
Таким образом, ГН связана в конечном счете с изменениями онкогенов и опухолевых супрессоров. Однако, как следует из работ, выполненных на широком спектре опухолей человека, не многие из них мутированы, делетированы и/или амплифицированы в спорадических новообразованиях с большой частотой [35–38]. К наиболее «универсальным» относятся супрессоры р53, INK4a, PTEN, Rb, гены CKI (ингибиторов циклин-зависимых киназ), онкогены RAS и EGFR (две формы рецептора эпидермального фактора роста) [39]. Эти данные поддерживают точку зрения, что незначительная популяция ОК может потенциально обеспечить рост всей опухолевой массы, активно поддерживая гетерогенность ОК внутри опухоли [4]. Определение взаимодействий между генетически разнородными ОК может послужить основой новых методов терапевтического вмешательства.
Геном человека динамичен: согласно расчетам в течение суток в каждой клетке может реализоваться более 20 000 повреждений ДНК и более 10 000 ошибок репликации. Число белков, которые участвует в репликативных процессах ДНК клетки человека, неизвестно. Исследования на дрожжах показали, что поддержание генетической стабильности обеспечивают более 100 генов [36]. Даже если в окружающей среде отсутствуют мутагены, мутации происходят спонтанно со скоростью примерно 10–6 мутаций на ген в течение клеточного цикла. На протяжении жизни человека каждый отдельный ген может претерпеть около 1010 различных мутаций. В результате мутации встречаются по всему геному, включая гены, которые поддерживают генетическую стабильность. С этой точки зрения, проблема злокачественных опухолей состоит не в том, почему они вообще возникают, а почему они, с одной стороны, возникают так редко, с другой — сохраняются как относительно стабильные популяции [34, 44].
Эпигенетическими (Эг) называют наследуемые изменения в экспрессии гена, которые не связаны с качественными изменениями в последовательностях ДНК [45, 46]. Геном эукариотов собран в хро-
матин-структурный комплекс. Изменения структуры этого комплекса, а также модификация хроматина нехроматиновыми белками может влиять на экспрессию отдельных генов, приводить к активации и/или ингибированию различных сигнальных и метаболических путей. Генетические и Эг механизмы сочетаются и взаимодействуют на всех стадиях развития опухоли. Эг аберрации, в противоположность генетическим мутациям, потенциально обратимы; возможно восстановить их нормальное состояние. Эг гетерогенность считают ключевым элементом в прогрессии опухоли, особенно в условиях, неблагоприятных для последней воздействий, так как она обеспечивают популяцию ОК необходимым для успешной селекции многообразием и устойчивостью. В частности, приобретенная лекарственная устойчивость ОК связана преимущественно с Эг механизмами. Поэтому регуляторы последних являются потенциальными мишенями для новых терапевтических соединений [47, 48].
Эг гетерогенность реализуется посредством 3 отдельных взаимоусиливающих механизмов: изменений метилирования ДНК; посттрансляционной модификации коровых гистонов; экспрессии РНК, не кодирующих белок (микро-РНК и малые интерферирующие РНК (миРНК)). Кроме прямого эффекта на ядерные процессы (такие как транскрипционная активность), метилирование ДНК и модификации гистонов играют также ключевую роль в регуляции структуры хроматина и экспрессии генетической информации [49, 50], в нормальном развитии и поддержании клеточного гомеостаза, устраняют активность повторных элементов ДНК, инактивируют Х-хромосому у женщин [51].
клетке может приводить к фенотипической гетерогенности по ряду признаков. В последние годы отмечают значительный прогресс в выяснении природы и роли механизмов, вовлеченных в гипометилирование ДНК при онкогенезе. В ОК содержание геномного метилцитозина снижается от 4% в нормальных тканях до 2–3%, однако это обнаружено не во всех опухолях. Точные геномные локализации гипометилирования остаются предметом исследований [52]. Хотя большинство публикаций сообщает, что гипометилирование встречается в повторных элементах, это не дает окончательного ответа на вопрос, на каком этапе оно возникает и какую роль играет в канцерогенезе, ведь имеются отличия между различными классами повторных элементов. Ряд исследователей полагают, что гипометилирование происходит на раннем этапе трансформации [53], другие связывают его с более поздними этапами развития опухоли. Гипометилирование повторных элементов может способствовать ГН, обеспечивая пластичность и преимущества роста ОК, и является потенциальной терапевтической мишенью [52].
Важный Эг механизм, который регулирует структуру хроматина и экспрессию генов — модификации гистонов. Основными классами энзимов, участвующими в этих реаранжировках, являются ферменты ремоделирования хроматина и гистоновые модификаторы. Наиболее охарактеризованы такие посттрансляционные ковалентные модификации гистонов, как ацетилирование, метилирование, фосфорилирование, убиквитинирование, сумоилирование, биотинилирование и ADP-рибозилирование. Хотя взаимодействие между различными модификациями гистонов еще не определено, многие из них способствуют развитию различных форм рака человека («гистоновые онкомодификации») [54]. Например, ацетилтрансфераза гистонов Tip60 не воздействует прямо (подобно опухолевым супрессорам или онкогенам), а облегчает действия других белков в силу того, что является транскрипционным коактиватором [55, 56]. Было описано ее вовлечение в экспрессию ряда генов, регулируемых фактором транскрипции NF-ƙB [57]. Последний активируется многими агонистами (провоспалительные цитокины, T- и B-клеточные митогены, продукты жизнедеятельности и структурные компоненты бактерий, вирусные белки, двуспиральные РНК, белки теплового шока и др.), а также при физических и химических стрессах, включая действие ионизирующей радиации и химиотерапевтических препаратов [59, 60]. Активированные факторы семейства NF-ƙB регулируют транскрипцию более 400 генов, вовлеченных в иммунорегуляцию, воспаление, регуляцию пролиферации и апоптоза, рост и распространение опухолей (в частности и супресссорный ген метастазирования KAI1). Этот же фактор регулирует химиои радиорезистентность в различных ОК. Из приведенного перечня ясно, что вариабельность эффектов активации NF-ƙB, опосредуемая ацетилтрансферазой Tip60, может приводить
к фенотипической гетерогенности ОК по широкому спектру характеристик [61]. Ацетилирование/деацетилирование модулируют экспрессию генов, вовлеченных в прогрессию опухоли в процессе селективного отбора ОК. Например, гипоксия (один из факторов, вызывающих гетерогенность ОК) индуцирует экспрессию и активность гистоновой деацетилазы, которая в свою очередь регулирует экспрессию Е-кадгерина — супрессорного белка, контролирующего сигнальный путь β-катенин/Cdk/pRb. Потеря экспрессии Е-кадгерина нарушает процессы адгезии, вызывает эпителиальную инвазию, необходимую для первого этапа метастазирования [58]. Еще одним важным регулятором гетерогенности опухоли являются миРНК, которые играют важную роль в поддержании целостности генома, в делении клеток, поддержании и дифференциации стволовых клеток (в эмбриональный и постнатальный период), в канцерогенезе, миграции ОК и метастазировании. Этот список продолжает расти. На ряде объектов исследования показано, что опухоль часто уклоняется от регуляции, опосредованной миРНК; репрессия миРНК ассоциируется с нарастанием туморогенности ОК. Каждая миРНК может регулировать экспрессию большого числа таргетных генов. И наоборот, один ген может быть регулирован многими миРНК, что может привести к гетерогенности клеток. Поняв уровень регуляции при помощи миРНК, можно существенно углубить понимание биологии опухолей, в частности проблемы гетерогенности ОК. МиРНК могут быть перспективными ми-
шенями противоопухолевой терапии [66].
Учитывая, что эпигенетические механизмы находятся в центре многих проявлений фенотипической вариабельности, представляется вероятным, что понимание и манипулирование эпигеномом обещает многое в профилактике и лечении злокачественных опухолей [3].
Гетерогенность клеток возникает естественно и неизбежно также из «шумовых» процессов — стохастичности в экспрессии генов, следствием которой является продукция в генетически идентичных клетках различных уровней конкретных белков в каждый момент. Стохастичность в экспрессии генов обусловливает существенные вариации фенотипов в популяции. Большинство исследований этого феномена проводили в популяциях микроорганизмов, однако в 2006 г. при измерении уровня различных белков в генетически идентичных клетках человека отмечены отклонения значений в отдельных клетках на 15–30% от среднего. «Генетические шумы» запускают ряд полезных физиологических механизмов регуляции, клеточную дифференцировку, участвуют в передаче или блокировании биологических сигналов, координируя экспрессию большого набора генов благодаря неравномерности уровней синтеза соответствующих белков, вариабельности продолжительности их жизни и распространения в клетке [41, 42]. Идеальной методологией исследования
стохастической экспрессии генов является мониторирование продукции, деградации и функционального состояния отдельных биомолекул в реальном времени в живых клетках [43]. Методами математического (компьютерного) моделирования и экспериментальных наблюдений показано значение генетических «шумов» для гетерогенности/вариабельности фенотипов. Последняя определяет высокие эволюционные потенции популяции, высокий уровень приспособления к переменам условий среды (3-й тип популяций по В. Гранту) [70], что так характерно для популяции ОК.
Для возможно полного анализа молекулярных
событий, характеризующих явление гетерогенности ОК, упомянем также следующие. Описаны многочисленные пути генерирования ошибочных белков, которые не вовлечены в процессы пролиферации и апоптоза клеток, однако являются важными для нарушения «социального поведения» ОК и их селективного преимущества перед нормальными клетками. На уровне трансляции ошибки могут возникать из-за неправильного включения аминокислоты, пробуксовки (slippage) машины трансляции или отсутствия модификации тРНК, приводящего к ошибке чтения мРНК. Такие ошибки встречаются 1 раз на каждые 1000–10 000 транслированных кодонов и относятся к гетерогенным характеристикам ОК [40]. При опухолевой прогрессии возможно усиление гетерогенности ОК вследствие посттрансляционных нарушений (процессинга предшественников, презентации и локализации) белков, значимых для сохранения и умножения опухолевой популяции. Примером может служить давно описанное, наблюдаемое с разной частотой в разных ОК, снижение экспрессии на клеточной мембране антигенов главного комплекса гистосовместимости I класса, следствием чего является «невидимость» таких ОК для распознавания эффекторами специфического клеточного иммунитета [69]. Приспособление опухолей к особенностям обмена веществ в макроорганизме может достигаться репрограммированием метаболических путей ОК. Экспрессия некоторых генов, которые контролируют ключевые метаболические пути (гликолиз, липогенез и синтез нуклеотидов) радикально изменяется на различных стадиях прогрессии опухоли. Сегодня особое значение придают 3 группам генов: GLUT1, G6PD, TKTL1 и PGI/AMF (гликолиз); ACLY, ACC1 и FAS (липогенез); RRM2, p53R2 и TYMS (нуклеотидный синтез), — изменение которых также может вносить важный вклад в рост гетерогенности популяции ОК [62].
Таким образом, фенотип клеток (в том числе и ОК) в конечном счете определяется сочетанием генетической программы, воздействия внешней среды и случайными изменениями [3]. Популяции ОК обладают генетической, эпигенетической и фенотипической гетерогенностью, качественные и ко-
личественные параметры которой могут динамично изменяться в течение неопластического процесса, обеспечивая более агрессивное, метастатическое поведение опухоли. Гетерогенность является принципиально важным элементом в прогрессии опухоли, ее резистентности к «враждебному окружению» и разнообразным противоопухолевым воздействиям (химиотерапии, лучевой терапии, иммунотерапии) [63–65], ибо она придает популяции ОК многообразие, устойчивость, возможность селекции.
Гетерогенность опухоли — это активное динамичное состояние, поддерживаемое как клеточными, так и неклеточными факторами. Новые варианты клеток, взаимодействуя между собой, помогают опухоли противостоять деструктивным влияниям. Как любое сообщество, опухоль не просто сумма слагающих ее субпопуляций, это взаимодействующая экосистема, каждая характеристика которой может влиять на другую. Биологические характеристики «ранней» преинвазивной опухоли не аналогичны таковым той же опухоли, когда она достигла стадии диссеминации. Гетерогенность опухоли имеет много уровней и молекулярных механизмов (еще не до конца раскрытых). Все они вместе обеспечивают выживание и распространение (диссеминацию, колонизацию, метастазирование) популяции ОК. Каждая ОК в организме больного уникальна по потенциальной возможности претерпеть различные изменения, и одна ОК, избежавшая действия терапии, может потенциально вызвать прогрессирование болезни.
Проблема клональной гетерогенности остается еще плохо изученной. Нужны новые подходы (включая математическое моделирование) для характеристики клональной гетерогенности различных типов и субтипов опухолей на разных стадиях их развития, а также в условиях различных лечебных воздействий. Тем не менее наши знания о гетерогенности ОК уже сегодня находят реализацию в диагностике и лечении онкологических больных. Например, на основе установления высокой гетерогенности по экспрессии HER2/neu клеток рака желудка и гастроэзофагеального рака разработаны принципы HER2-тестирования этих опухолей, отличающиеся от таких при раке молочной железы. Реализация этих принципов позволяет существенно повысить качество диагностики и выбирать оптимальную индивидуализированную тактику лечения пациентов с использованием таргетных (антиHER2/neu) препаратов [73]. Другим примером могут явиться разрабатываемые с учетом гетерогенности ОК и асинхронности их гибели при лечебных воздействиях рекомендации по оптимизации режимов исследования апоптоза ОК для оценки эффективности противоопухолевой терапии [74], в частности, больных раком молочной железы [75] или метастатическим раком почки [76].
Большинство данных о гетерогенности получены в результате исследований опухолей, клетки ко-
торых прошли отбор в условиях организма. Однако последние исследованя на уровне отдельной клетки показали, что в культуре клеток млекопитающих уже после нескольких делений появляется широкий спектр вариабельности в локальной плотности монослоя, в межклеточных контактах, относительной локализации и количестве свободного пространства на клетку, в форме и/или поляризации клеток, а также их подвижности. В сочетании эти параметры составляют популяционный контекст отдельной клетки, к которому каждая из них адаптирует свою физиологию. Такая адаптация может осуществляться на уровне транскрипции генов, трансляции отдельных белков, регуляции клеточного цикла, активности пролиферации, чувствительности к апоптозу, метаболических особенностей. Перечисленные характеристики определяют как поведение индивидуальной клетки в популяции, так и ее влияние на формообразование популяционного контекста. Эти комплексные и нелинейные механизмы обратной связи на многих уровнях клеточной организации определяют фенотипические свойства отдельной клетки в популяции, даже когда клетки не дифференцируются [25]. Все сказанное ставит проблему клеточной изменчивости и фенотипической гетерогенности не только в центр сегодняшней фундаментальной онкологии, но и современной биологии клетки.