Герпевир или ацикловир что лучше мазь
Какое средство лучше Герпевир или Ацикловир?
Герпес является распространенным заболеванием. Возбудитель инфекции однажды, попав в организм, остается в нем до конца жизни. Для лечения герпеса применяются противогерпетические средства. К этой группы препаратов относится Герпевир и Ацикловир. Попробуем разобраться какой медикамент лучше.
Герпевир
Герпевир в качестве действующего вещества содержит ацикловир. Он представляет собой искусственный аналог пуринового нуклеозида, который подавляет активность герпесвирусов, в том числе вируса герпеса I и II типа, ветряной оспы, опоясывающего лишая, вируса Эпстайна — Барр, цитомегаловируса. Медикамент проявляет высокоселективную активность в отношении выше перечисленных вирусов.
Энзим тимидинкиназа, который закодирован в возбудителях простого герпеса, опоясывающего лишая, ветрянки, вирусах Эпстайна — Барр, способствует образованию из ацикловира монофосфата, который является аналогом нуклеозида, и далее дифосфата и трифосфата при участии клеточных энзимов. Встроенный в вирусную ДНК ацикловир трифосфат вступает во взаимодействие с вирусной ДНК-полимеразой, в результате нарушается биосинтез ДНК герпесвирусов.
Таблетки и уколы Герпевир рекомендованы с целью лечения при следующих заболеваниях:
Таблетки можно принимать с целью профилактики болезней, вызванных вирусом простого герпеса у людей с иммунодефицитом и нормальным иммунитетом.
Уколы применяются для лечения герпетического энцефалита. Мазь применяется при инфекциях губ и лица, которые спровоцированы вирусом простого герпеса.
Ацикловир
Ацикловир является искусственным аналогом пуринового нуклеозида, который блокирует герпесвирусы. Он рекомендован для лечения герпетических инфекций кожи и слизистых оболочек, в том числе лабиального и полового герпеса, ветряной оспы, опоясывающего лишая. Ацикловир можно применять с целью профилактики герпетических инфекций у больных с нормальным иммунитетом и иммунодефицитом.
Общие характеристики
Герпевир и Ацикловир имеют следующие сходства:
Отличия
Между Герпевиром и Ацикловиром имеются следующие различия:
| Герпевир | Ацикловир | |
| Форма выпуска | В продаже лекарство бывает в мази, таблетках, порошке для приготовления инъекционного раствора. | Препарат в продаже бывает в таблетках, креме, обычной и глазной мази, лиофилизате, из которого готовится инъекционный раствор, |
| Страна производитель | Герпевир — украинский препарат. | Лекарство выпускается несколькими отечественными и иностранными компаниями. |
| Применение в детской практике | Уколы Герпевира можно делать с рождения, таблетки разрешены с 2 лет, а мазь только с 12 лет. | Возраст, с которого разрешено принимать противогерпетическое средство нужно уточнять в аннотации, так как в зависимости от компании-изготовителя рекомендации на этот счет будут отличаться. |
| Применение в период лактации | Лекарственное средство можно прописывать женщинам, поддерживающим грудное вскармливание с осторожностью. | При названии во время грудного вскармливания глазной мази, инъекционных и оральных форм нужно перевести младенца на смесь. |
| Правила продажи | Лекарство в таблетках, порошке, мази по 15 г отпускаются по рецепту. Препарат в виде мази по 5 г продается без рецепта. | Лиофилизат и таблетки отпускаются по рецепту, остальные формы выпуска можно купить без рецепта. |
Что выбрать?
Отличия между Герпевиром и Ацикловиром несущественные. Но при глазном герпесе нужно использовать Ацикловир в виде глазной мази. Герпевир в виде мази нельзя применять при половом герпесе, для этой цели можно использовать его в других лекарственных формах или же лечиться Ацикловиром.
При приеме внутрь и инъекционном введении они могут стать причиной следующих нежелательных явлений:
Из-за инъекционного введения препараты могут стать причиной флебита. Если при внутривенном введении медикамент попал во внеклеточное пространство, то он может спровоцировать деструктивные изменения кожных покровов.
Из-за лечения мазью или кремом могут быть гиперемия, сухость, жжение и шелушение кожных покровов. При нанесении их на слизистые оболочки может начаться воспалительный процесс. Глазная мазь может стать причиной легкого жжения, блефарита, конъюнктивита.
Герпевир или Ацикловир?
Герпес — это вирусное заболевание, характеризующееся поражением поверхности кожных покровов и слизистых оболочек на различных частях тела вследствие ослабления иммунитета. Терапия герпеса обуславливает использование противогерпетических средств. Выбирая что лучше, Герпевир или Ацикловир, следует обратить внимание на особенности каждого препарата по отдельности.
Отличия между Герпевиром и Ацикловиром незначительны. По сути, оба этих препарата идентичны, так как в их состав входит одно и то же лекарственное вещество — ацикловир. Данное вещество подавляет рост и активность разного рода вирусов герпеса и других вирусных заболеваний.
Препарат Герпевир имеет форму выпуска в виде мазей, таблеток и порошка для приготовления инъекций. Ацикловир же имеет более разнообразный выбор лекарственных форм, помимо вышеперечисленного данный препарат представлен в форме крема, глазных мазей и лиофилизата для приготовления инъекций.
Преимуществом Герпевира считается то, что он не противопоказан при кормлении грудью, в отличие от Ацикловира, при использовании которого следует переходить на смеси.
Использовать Ацикловир у детей следует, учитывая показания, форму выпуска и фирму производителя лекарственного средства. Таблетированная форма Герпевира показана детям после 2 лет, в виде мази с 12 лет.
В итоге, делая выбор между Герпевиром и Ацикловиром, следует учесть их преимущества и недостатки, применяя тот или иной препарат, исходя из показаний, лекарственной формы, согласно рекомендациям специалиста.
Источники
Опишите симптомы или нужный препарат — мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой домой или просто проконсультируем. Мы — это 28 провизоров и 0 ботов.
Напишите нам «Морковка» и мы начислим вам 50 грн бонусов. Так мы всегда будем с вами на связи и сможем пообщаться в любой момент.
Опишите симптомы или нужный препарат — мы поможем подобрать его дозировку или аналог, оформим заказ с доставкой домой или просто проконсультируем. Мы — это 28 провизоров и 0 ботов.
Напишите нам «Морковка» и мы начислим вам 50 грн бонусов. Так мы всегда будем с вами на связи и сможем пообщаться в любой момент.
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
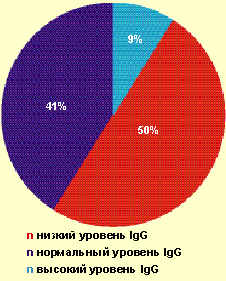 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
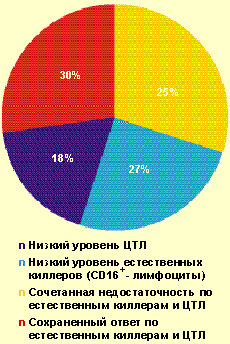 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва
Терапевтические возможности 1% крема пенцикловира при купировании обострений простого герпеса различных локализаций
Проблема целесообразности применения препаратов местного действия при лечении простого герпеса до сих пор дискутируется. Однако все же не вызывает сомнения тот факт, что симптоматическое лечение герпеса имеет свою терапевтическую нишу, несмотря на появлен
Проблема целесообразности применения препаратов местного действия при лечении простого герпеса до сих пор дискутируется. Однако все же не вызывает сомнения тот факт, что симптоматическое лечение герпеса имеет свою терапевтическую нишу, несмотря на появление современных системных противовирусных средств (ацикловир, валцикловир, пенцикловир) и иммунных препаратов профилактического действия (интерфероногены, герпетическая вакцина). Использование топических средств при купировании обострений простого герпеса патогенетически обосновано.
Доказательством этому служат проведенные исследования по состоянию местного иммунитета в местах традиционных высыпаний, а также изучение биологии вируса при формировании везикул. Так, в ряде работ было показано, что наряду с системным иммунодефицитом, лежащим в основе реактивации вируса простого герпеса (ВПГ), наблюдается снижение местной резистентности кожи и слизистых, материальным субстратом которого, главным образом, являются В и Т-лимфоциты: макрофаги, нейтрофильные лейкоциты и кератиноциты. Результатом же депрессии локального иммунитета является незавершенный фагоцитоз вирусов и уменьшение продукции, в первую очередь, альфа-интерферона (ИФ) — естественного «противовирусного антибиотика», активно участвующего в цитолизе инфекционного начала [1, 2].
Существуют достоверные данные, свидетельствующие, что выраженность нарушений местного иммунитета прямо коррелирует с системным иммунодефицитом и требует соответствующей коррекции [2].
Также в ряде работ при электронной микроскопии гистологических биоптатов кожи были получены данные о наличии возбудителя в виде провируса в местах традиционных клинических проявлений в период ремиссии заболевания. Изучение механизмов персистенции и репликации герпес-вирусной инфекции показало, что, возможно, полный цикл репродукции ВПГ и выход полноценных вирионов происходит именно в эпителиальных клетках, т. е. в процессе формирования везикул, когда возбудитель проявляет свое цитопатическое действие [1].
Все эти факты полностью обосновывают необходимость включения местных противовирусных средств в комплексную терапию обострений герпетического процесса.
По современным представлениям, местное лечение простого герпеса оправдано в том случае, когда период продромы (явлений предвестников рецидива) уже упущен и имеет место пик обострения, т. е. 2–3 день рецидива. Это связано с тем, что к этому моменту репликация ВПГ в паравертебральных ганглиях уже произошла и назначение системных ациклических синтетических нуклеозидов не имеет смысла. Именно в данной ситуации местные противовирусные средства способны произвести эффект, заключающийся в сокращении сроков регресса герпетических высыпаний либо за счет активации местного иммунитета, либо нивелирования цитопатического действия самого вируса на эпителиальные клетки.
Помимо применения в качестве монотерапии в вышеизложенных случаях, препараты для местного лечения простого герпеса можно и нужно использовать как вспомогательные средства в комплексе с системными противовирусными препаратами. Имеются многочисленные работы, свидетельствующие о том, что комбинированная терапия рецидивов ПГ дает более высокие клинические результаты и позволяет полностью купировать клиническую симптоматику обострения на стадии предвестников или эритемы у подавляющего числа пациентов [3, 4].
Настоящим прорывом в области лечения простого герпеса стало создание в 1974 г. в Великобритании ацикловира, первого синтетического ациклического аналога нуклеозида гуанозина.
После многочисленных исследований, подтвердивших высокую клиническую эффективность пероральной формы препарата при купировании рецидивов инфекции, была разработана мазь, а затем крем на основе ацикловира. Первые опыты их применения как у нас в стране, так и за рубежом дали, в целом, неплохие результаты. Вместе с тем со временем стали появляться работы, свидетельствующие о нарастании резистентности к местному лечению ацикловиром, что значительно реже наблюдается при своевременном назначении таблетированных форм препарата [3].
Не так давно на отечественном рынке наряду с хорошо известной таблетированной формой синтетического ациклического нуклеозида нового поколения, пенцикловира — Фамвиром®, появилось новое местное противогерпетическое средство — 1% крем Фенистил® Пенцивир. В 1 г крема содержится 10 мг активного вещества — пенцикловира.
Проведенные в Великобритании исследования показали, что спектр противовирусного действия местного препарата пенцикловира аналогичен спектру противовирусного действия ацикловира и токсичность для незараженных клеток является такой же низкой. Скорость и степень фосфорилирования, а следовательно, и последующее блокирование синтеза вирусной ДНК, у пенцикловира были намного выше, чем у ацикловира (ацикловира трифосфат впервые обнаруживался через 40 мин инкубации с зараженными ВПГ-1 клетками человека, тогда как пенцикловира трифосфат обнаруживали спустя уже одну минуту после начала инкубации). Пенцикловир также фосфорилировался в большей степени, чем ацикловир. Дополнительно было выявлено, что противовирусный эффект у пенцикловира более стойкий, чем у ацикловира (период полувыведения составлял соответственно 10 и 0,7 ч). Таким образом, было обозначено, что применение данного соединения возможно с меньшей частотой дозирования [9].
При сравнении проницаемости кожи для пенцикловира и ацикловира посредством послойного удаления рогового слоя и измерения содержания активных ингредиентов, проникших через кожу, было доказано, что, хотя оба препарата могут достигать своих клеток-мишеней в базальном слое эпидермиса, пенцикловир 1%, крем в эффективной терапевтической концентрации обнаруживает тенденцию к более легкой диффузии лекарственного вещества сквозь роговой слой в более глубокие слои эпидермиса. Молекулярное моделирование выявило у ацикловира два фрагмента с более высокой степенью гидрофобности, при взаимодействии которых с гидрофобной структурой в роговом слое возникают препятствия к дальнейшему проникновению препарата. Сравнение результатов, полученных при нанесении препаратов в эквивалентной дозе, показало, что количество пенцикловира, проникшего из 1% крема через кожу, было в 16,7 раза больше, чем количество ацикловира, проникновение которого, в основном, ограничивалось поверхностным слоем кожи [6].
Обобщенные данные зарубежной литературы, основанные на анализе применения препарата Фенистил® Пенцивир более чем у 6 000 пациентов, страдающих рецидивирующим лабиальным герпесом, в целом свидетельствуют о его высокой эффективности. Все исследователи отмечали более быструю динамику регресса основных симптомов обострения на 20–30% по сравнению с кремом на основе ацикловира [5, 7, 8].
Нами также было проведено изучение эффективности и безопасности 1% крема Фенистил® Пенцивир двойным рандомизированным методом, результаты которого нами были опубликованы ранее [4].
В исследовании принимали участие 60 пациентов с диагнозом «лабиальный простой герпес». Диагноз выставлялся на основании жалоб пациентов и характерной клинической картины. Среди пациентов было 22 мужчины и 38 женщин в возрасте от 17 до 52 лет. Анамнез заболевания составлял от 5 до 37 лет, а длительность одного обострения колебалась от 7 до 14 дней (в среднем 10 дней), при частоте рецидивов от 2–4 до 6–8 раз в год. Пациенты были разбиты на две репрезентативные группы по 30 больных, путем случайной выборки. Первая группа получали монотерапию 1% кремом Фенистил® Пенцивир, вторая 5% кремом ацикловира.
Фенистил® Пенцивир крем применялся согласно протоколу каждые 2 часа периода бодрствования на протяжении 10 дней. Крем с ацикловиром применялся согласно инструкции 5 раз в день, также в течение 10 дней.
В первой группе пациентов 12 человек страдали часто рецидивирующим лабиальным герпесом (6 и более раз в год), 18 — редко рецидивирующим (2–4 раза в год), среди больных второй группы эти показатели соответственно составляли 14 и 16.
14 пациентам первой группы и 15 больным второй начато лечение на 1–2 день рецидива, в остальных случаях терапия начиналась с 3–4 дня обострения.
Однако их анализ показал, что имеется существенная разница эффективности препарата в зависимости от частоты рецидивов вирусного процесса. У пациентов с частыми рецидивами заболевания длительность всех проявлений оказалась в среднем лишь на один день меньше по сравнению с таковой при применении крема с ацикловиром и составила 5–7 дней. В группе больных с редкими рецидивами кожная и субъективная симптоматика полностью купировалась на 3–4 сутки, т. е. на 3–4 дня быстрее по сравнению с группой сравнения и в среднем на 2 дня быстрее, чем при часто рецидивирующем простом герпесе на том же 1% креме Фенистил® Пенцивир.
Данные проведенного исследования представлены на рис. 1 и 2, где выраженность клинических симптомов оценена по 3 балльной шкале в зависимости от степени их выраженности.
Переносимость местного применения 1% крема Фенистил® Пенцивир всеми больными оценивалась положительно. Ни в одном случае развития каких-либо нежелательных кожных реакций и других побочных эффектов отмечено не было.
Обобщая имеющиеся данные зарубежной литературы, а также результаты собственного исследования, можно сделать вывод о высокой эффективности 1% крема Фенистил® Пенцивир в купировании обострений простого герпеса и его значительном преимуществе по сравнению с ацикловиром в динамике стихания клинической симптоматики. Вместе с тем проведенное клиническое испытание позволило сделать дополнительные выводы и определить следующие показания для назначения препарата. Прежде всего, Фенистил® Пенцивир можно рекомендовать в качестве монотерапии обострения простого герпеса в случае, если лечение начато на пике обострения, когда применение системных средств нецелесообразно. Наиболее эффективен 1% крем Фенистил® Пенцивир при купировании острых проявлений простого герпеса легкой (1–2 рецидива в год) и средней степени (3–4 обострения в год) тяжести, при назначении его не позднее второго дня начала манифестации герпес-вирусного процесса.
Однако уже на этапе данного исследования возникало закономерное непонимание значительного сужения спектра показаний к назначению 1% крема Фенистил® Пенцивир, ограничивающегося только лабиальной формой простого герпеса. Такой подход представляется абсолютно нелогичным. Дело в том, что независимо от того, где возникают клинические проявления вирусного процесса, механизм действия препаратов остается идентичным и не зависит от приуроченности высыпаний. В частности, ни у одного из местных противогерпетических средств, за исключением глазной формы ацикловира, нет подобных ограничений. Однако надо учесть, что крем с ацикловиром для лечения офтальмогерпеса имеет отличную от дерматологических форм основу и степень очистки.
В связи с этим мы провели несравнительное открытое исследование терапевтических возможностей 1% крема Фенистил® Пенцивир при других локализациях простого герпеса.
В результате добровольного согласия пациентов на применение 1% крема Фенистил® Пенцивир для купирования острых проявлений герпетической инфекции, в исследовании приняли участие 60 больных с диагнозами «простой герпес генитальной и глютеальной локализации» (49 и 11 человек соответственно). Диагноз выставлялся на основании жалоб пациентов и характерной клинической картины. Среди пациентов были 31 мужчина и 29 женщин. Возраст пациентов колебался от 21 до 54 лет, длительность течения заболевания — от 2 до 12 лет. Продолжительность эпизода обострения простого герпеса составляла от 10 до 16 дней (в среднем 13 дней), а частота рецидивов варьировала от 2–4 (28 больных) до 6–12 (32 пациента) раз в год. В исследования не включались беременные и женщины в период лактации. Также исключались пациентки с локализацией высыпаний на слизистой влагалища.
1% Фенистил® Пенцивир крем применялся согласно инструкции каждые 2 часа периода бодрствования на протяжении 10 дней.
42 пациента начинали лечение на 1–2 день манифестации герпес-вирусного процесса, 18 больных на 3–4 день обострения, что соответствовало срокам обращения за консультацией.
Результаты лечения показали, что данные наблюдения во многом аналогичны таковым при оценке эффективности и безопасности препарата в случаях купирования рецидивов простого лабиального герпеса.
Было отмечено, что существуют различия в эффективности крема Фенистил® Пенцивир у больных с часто и умеренно рецидивирующими формами заболевания. У пациентов с частыми рецидивами (6 и более раз в год) сроки регресса высыпаний при лечении сокращались в среднем лишь на 2–3 дня. Вместе с тем пациенты с умеренной частотой рецидивов (не более четырех раз в год) отмечали более существенную положительную динамику купирования вирусного процесса, в среднем на 5–6 дней. Также было отмечено, что в обоих случаях эффект от лечения выше в случае начала применения крема на 1–2 день рецидива.
То же самое касается динамики отдельных показателей, таких как исчезновение субъективной симптоматики, везикул, формирование корочки и процесс полной эпителизации.
Динамика показателей выраженности клинических симптомов простого герпеса генитальной и глютеальной локализации в баллах (по трехбалльной шкале, от 0 до 3) в среднем по группе представлена на рис. 3,
а сравнительная динамика эффективности в зависимости от частоты обострений на рис. 4.
Переносимость местного применения 1% крема Фенистил® Пенцивир, как и при лабиальном простом герпесе, всеми больными оценивалась положительно. Ни в одном случае развития каких-либо нежелательных кожных реакций и других побочных эффектов отмечено не было.
Таким образом, проведенное исследование 1% крема Фенистил® Пенцивир показало, что его применение при генитальной и глютеальной формах простого герпеса является безопасным и эффективным и может быть рекомендовано больным для местного лечения, наряду с основным показанием — лабиальным простым герпесом. Наибольшая эффективность достигается при его применении на ранних сроках обострения (1–2 день) у пациентов с частотой манифестаций заболевания, не превышающих 3–4 раз в год.
Таким образом, в заключение следует еще раз подчеркнуть, что:
Литература
Первый МГМУ им. И. М. Сеченова, Москва


.jpg)
.jpg)
.jpg)
.jpg)