Герпесный дерматит чем лечить
Дерматит герпетиформный
Общая информация
Краткое описание
РОССИЙСКОЕ ОБЩЕСТВО ДЕРМАТОВЕНЕРОЛОГОВ И КОСМЕТОЛОГОВ
ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ВЕДЕНИЮ БОЛЬНЫХ ДЕРМАТИТОМ ГЕРПЕТИФОРМНЫМ
Шифр по Международной классификации болезней МКБ-10
L13.0
Герпетиформный дерматит (dermatitis herpetiformis Duhring; болезнь Дюринга) – воспалительное заболевание кожи, ассоциированное с глютеновой энтеропатией и характеризующееся полиморфными зудящими высыпаниями, хроническим рецидивирующим течением, гранулярным отложением IgA в сосочках дермы.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Общепринятой классификации не существует.
Этиология и патогенез
Герпетиформный дерматит (ГД) – редкий дерматоз, чаще встречающийся у жителей Северной Европы.
По данным эпидемиологических исследований, проведенных в Северной Европе, в различных странах заболеваемость ГД колеблется от 0,4 до 3,5 случаев на 100 000 населения в год, распространенность – от 1,2 до 75,3 случаев на 100 000 населения [1–8].
Обычно заболевание начинается в возрасте 30–40 лет, однако может развиться в детском и пожилом возрасте [9]. Мужчины болеют чаще женщин; соотношение заболеваемости мужчин и женщин варьирует от 1,1:1 до 1,9:1 [10].
По данным официальных государственных статистических наблюдений, в 2014 году распространенность ГД в Российской Федерации составила 2,0 случаев на 100 тысяч населения в возрасте 18 лет и старше, заболеваемость – 0,8 случаев на 100 тысяч населения в возрасте 18 лет и старше. [11]
Герпетиформный дерматит, как и глютен-чувствительная энтеропатия (целиакия), ассоциирован с гаплотипами HLA-DQ2 и HLA-DQ8 [12]. Примерно у 5% пациентов с глютеновой энтеропатией развивается ГД [13].
К потенциальным механизмам развития ГД при глютеновой энтеропатии относятся следующие:
— после употребления и переваривания пищи, содержащей глютен, образуется глиадин, который всасывается через слизистую оболочку тонкой кишки;
— глиадин дезаминируется тканевой трансглютаминазой в слизистой оболочке тонкой кишки, формируются ковалентные перекрестные связи между глиадином и трансглютаминазой;
— дезаминированные пептиды глиадина связываются с молекулами HLA DQ2 или HLA DQ8 на антиген-презентирующих клетках, где они распознаются Тh-лимфоцитами;
— активированные Тh-лимфоциты вырабатывают провоспалительные цитокины и матриксные металлопротеиназы, которые стимулируют повреждение слизистой оболочки кишки и продукцию В-клетками антител против тканевой трансглютаминазы;
— развивается формирование иммунного ответа против эндогенного антигена или множественных эндогенных антигенов вследствие его/их экспозиции во время повреждения тканей и начинается продукция IgA антител, способных связываться с эпидермальной трансглютаминазой;
— IgA антитела к эпидермальной трансглютаминазе распространяются с кровотоком, достигают кожи, и связываются с эпидермальной трансглютаминазой в сосочках дермы;
— отложение иммунных комплексов в сосочках дермы стимулирует хемотаксис нейтрофилов, которые вызывают протеолитическое расщепление базальной мембраны на уровне светлой пластинки, приводящее к формированию субэпидермальных пузырей [14].
Клиническая картина
Cимптомы, течение
Наблюдаемая иногда мономорфность высыпаний позволила выделить ряд клинических форм ГД [9]:
— буллезная;
— герпесоподобная;
— трихофитоидная;
— строфулезная.
Заболевание характеризуется хроническим рецидивирующим течением со сменой рецидивов периодами медикаментозных или спонтанных полных ремиссий продолжительностью от нескольких недель до нескольких лет. Спонтанные ремиссии возможны у 10–25% больных.
Для ГД характерны полиморфизм, группировка и симметричность высыпаний. Высыпания локализуются преимущественно на разгибательных поверхностях конечностей, волосистой части головы, плечах, коленях, локтях, крестце, ягодицах, сопровождаются зудом. Сыпь представлена пятнами, волдырями, папулами и пузырями различной величины. Пузыри напряженные, с плотной покрышкой, наполненные прозрачным или мутным, иногда геморрагическим содержимым, образуются на гиперемированном отечном основании. Пузыри вскрываются, образуя эрозии, которые быстро эпителизируются, оставляя гиперпигментацию. Иногда поражение кожи носит локализованный характер. Поражение слизистой оболочки полости рта наблюдается редко. Общее состояние больных удовлетворительное.
Диагностика
Диагноз основывается на анализе анамнестических, клинических и лабораторных данных.
Для постановки диагноза необходимо проведение следующих лабораторных исследований [9, 14]:
— исследование содержимого пузырей на эозинофилию;
— гистологическое исследование биоптата кожи, полученного из свежего очага поражения, содержащего полость (пузырь) позволяет выявить субэпидермальное расположение полости, содержащей фибрин, нейтрофильные и эозинофильные лейкоциты;
— исследование биоптата кожи методом прямой иммунофлюоресценции позволяет выявить зернистые отложения иммуноглобулина класса А в сосочковом слое дермы;
— исследование сыворотки крови методом ИФА:
o определение содержания IgA-антител к тканевой трансглютаминазе в крови;
o определение содержания IgA-антител к эндомизию в крови.
Для оценки общего состояния больного и выявления ассоциированных с ГД заболеваний возможно проведение дополнительных исследований:
— биопсии тонкой кишки (в редких случаях по рекомендации гастроэнтеролога);
— определения маркеров мальабсорбции (уровня железа, витамина В12, фолиевой кислоты в сыворотке крови);
— скрининга на другие аутоиммуные заболевания:
o определение содержания неспецифических антител в крови: антител к тиреопероксидазе (обнаруживаются приблизительно у 20% больных ГД) и к париетальным клеткам желудка (у 10–25% больных ГД), антинуклеарных антител;
o тестирование для выявления заболеваний щитовидной железы (исследование уровня тиреотропного гормона (ТТГ), общего трийодтиронина (Т3) в крови, общего тироксина (Т4) в сыворотке крови);
o типирование на антигены гистосовместимости второго типа (HLA II): DQ2, DQ8.
Дифференциальный диагноз
Дифференциальную диагностику проводят с буллезным пемфигоидом, вульгарной пузырчаткой, линеарным IgA-дерматозом, многоформной эритемой, а также с атопическим дерматитом, чесоткой, папулезной крапивницей у детей.
Буллезный пемфигоид Левера отличается от герпетиформного дерматита отсутствием интенсивного зуда, группировки пузырей, локализацией высыпаний в складках тела. При исследовании биоптатов кожи больных буллезным пемфигоидом методом прямой иммунофлюоресценции вдоль базальной мембраны выявляются иммуноглобулины класса G.
Вульгарная пузырчатка. Первые высыпания чаще всего появляются на слизистых оболочках полости рта, носа, глотки и/или красной кайме губ. Больных беспокоят боли при приеме пищи, разговоре, при проглатывании слюны. Характерные признаки – гиперсаливация и специфический запах изо рта. Через 3–12 месяцев процесс приобретает более распространенный характер с поражением кожного покрова. Пузыри сохраняются непродолжительное время (от нескольких часов до суток). На слизистых оболочках их появление иногда остается незамеченным, поскольку покрышки пузырей – тонкие, быстро вскрываются, образуя длительно незаживающие болезненные эрозии. Некоторые пузыри на коже могут ссыхаться в корки. Эрозии при вульгарной пузырчатке обычно ярко-розового цвета с блестящей влажной поверхностью, имеют тенденцию к периферическому росту, возможна генерализация кожного процесса с формированием обширных очагов поражения, ухудшением общего состояния, присоединением вторичной инфекции, развитием интоксикации и смертельным исходом. Одним из наиболее характерных признаков акантолитической пузырчатки является симптом Никольского – клиническое проявление акантолиза, который при вульгарной пузырчатке может быть положительным как в очаге поражения, так и вблизи от него, а также на видимо здоровой коже вдали от очага поражения.
При многоформной экссудативной эритеме наряду с пятнами и папулами могут возникать пузырьки, пузыри, волдыри. На слизистых оболочках образуются пузыри, которые вскрываются с образованием болезненных эрозий. По периферии пятен и/или отечных папул образуется отечный валик, а центр элемента, постепенно западая, приобретает цианотичный оттенок (симптом «мишени», или «радужной оболочки», или «бычьего глаза»). Субъективно высыпания сопровождаются зудом. Высыпания склонны к слиянию, образуя гирлянды, дуги. Высыпания появляются в течение 10–15 дней и могут сопровождаться ухудшением общего состояния: недомоганием, головной болью, повышением температуры. Затем в течение 2–3 недель они постепенно регрессируют, не оставляя рубцов; на их месте может наблюдаться пигментация.
Лечение
Цели лечения:
— прекращение появления новых высыпаний;
— эпителизация эрозий;
— достижение и поддержание ремиссии;
— повышение качества жизни больных.
Общие замечания по терапии
Основу терапии составляет безглютеновая диета, приводящая к разрешению кожного процесса, устранению энтеропатии, исчезновению IgA- антител к глиадину, эндомизию и тканевой трансглютаминазе (С).
Препаратом выбора для лечения больных ГД является дапсон. Терапия дапсоном требует тщательного лабораторного контроля, особенно функции печени и почек. Возможно развитие серьезных побочных эффектов, особенно гемолиза. Может также развиться тяжелый синдром гиперчувствительности [15].
В случае возникновения нежелательных явлений во время терапии дапсоном или его неэффективности может назначаться сульфасалазин. На фоне терапии сульфасалазином могут отмечаться реакции гиперчувствительности, гемолитическая анемия, протеинурия и кристаллурия. Для контроля нежелательных явлений терапии препаратом назначаются клинический анализ крови и общий анализ мочи, которые проводят перед началом терапии и ежемесячно первые 3 месяца, далее – 1 раз в 6 месяцев. Наиболее частые нежелательные явления терапии сульфасалазином – тошнота, рвота и отсутствие аппетита предотвращаются назначением кишечно-растворимых форм препарата.
Системные глюкокортикостероидные препараты малоэффективны.
Диета (B)
Из рациона должны быть полностью устранены пшеница, ячмень, рожь, овес и другие злаки. Также необходимо исключить продукты, содержащие йод (продукты моря, фейхоа, хурма и др.).
Безглютеновая диета приводит к регрессу высыпаний через 1–2 года, однако герпетиформный дерматит неизменно рецидивирует в течение 12 недель после повторного поступления глютена с пищей, в связи с чем пациенты должны пожизненно придерживаться диеты. Только у 10–20% больных развивается иммунная толерантность, и появляется возможность придерживаться обычной диеты после нескольких лет строгой безглютеновой диеты; это наиболее часто наблюдается в случаях начала заболевания в детском возрасте и у пациентов, получавших дапсон.
Строгое соблюдение безглютеновой диеты в течение длительного времени приводит к уменьшению потребности в лекарствах, снижению риска развития лимфом кишечника, разрешению кожных высыпаний и симптомов энтеропатии/мальабсорбции [15].
Схемы терапии
Системная терапия
— дапсон (С) 1 мг на кг массы тела перорально в сутки в течение 1–2 лет (до наступления стойкого эффекта безглютеновой диеты) [15]
или
— сульфасалазин (С) перорально в дозе 1–2 г в сутки [15].
| Примечание. В инструкции по медицинскому применению сульфасалазина дерматит герпетиформный не включен в показания к применению препарата. |
Антигистаминные препараты (D)
Антигистаминные препараты могут применяться для контроля зуда, чередуясь при необходимости каждые 10 дней [16, 17]:
— клемастин 1 мг перорально 2 раза в сутки в течение 7–10 дней.
или
— хлоропирамин 25 мг перорально 1–2 раза в сутки в течение 7–10 дней
или
— лоратадин 10 мг 1 раз в сутки перорально в течение 7–10 дней
или
— мебгидролин 50–200 мг перорально 1–2 раза в сутки в течение 7–10 дней.
При выраженном зуде показано парентеральное введение антигистаминных препаратов:
— клемастин 2 мг внутримышечно на ночь в течение 7 дней
или
— хлоропирамин 20–40 мг внутримышечно на ночь в течение 7 дней.
Наружная терапия
Глюкокортикостероидные препараты (D)
Топические глюкокортикостероидные препараты могут применяться при выраженном зуде для его уменьшения [15]:
— клобетазола пропионат 0,05% мазь, крем на очаги поражения 1 раз в сутки
или
— триамцинолон 0,1% мазь на очаги поражения 2 раза в сутки
или
— бетаметазон 0,01% мазь на очаги поражения 2 раза в сутки
Обработка пузырей и эрозий (D) [9]:
Область пузырей, эрозий обрабатывают раствором анилиновых красителей, при наличии вторичной инфекции – аэрозолями, содержащими глюкокортикостероиды и антибактериальные препараты. На эрозии в области слизистой оболочки полости рта наносят антисептические растворы для полосканий.
Особые ситуации
Лечение детей
Рекомендуемая дозировка дапсона у детей – 2 мг на кг массы тела в сутки [16].
Требования к результатам лечения
— регресс высыпаний;
— эпителизация эрозий;
— исчезновение зуда.
Тактика при отсутствии эффекта от лечения
В случае отсутствия эффекта от терапии дапсоном в дозировке 1 мг на кг массы тела в сутки дозировка препарата может быть повышена до 150–200 мг в сутки кратким курсом или может быть назначена терапия сульфасалазином перорально.
ПРОФИЛАКТИКА
Первичная профилактика дерматита герпетиформного не разработана. Мерой вторичной профилактики является соблюдение безглютеновой диеты больными дерматитом герпетиформным и глютеновой энтеропатией (целиакией).
Госпитализация
— отсутствие эффекта от лечения, проводимого в амбулаторных условиях;
— появление новых высыпаний;
— наличие вторичного инфицирования в очагах поражения.
Информация
Источники и литература
Информация
Персональный состав рабочей группы по подготовке федеральных клинических рекомендаций по профилю «Дерматовенерология», раздел «Дерматит герпетиформный»:
1. Карамова Арфеня Эдуардовна – заведующий отделом дерматологии ФГБУ «Государственный научный центр дерматовенерологии и косметологии» Минздрава России, кандидат медицинских наук, г. Москва
2. Знаменская Людмила Федоровна – ведущий научный сотрудник отдела дерматологии ФГБУ «Государственный научный центр дерматовенерологии и косметологии» Минздрава России, доктор медицинских наук, г. Москва
3. Чикин Вадим Викторович – старший научный сотрудник отдела дерматологии ФГБУ «Государственный научный центр дерматовенерологии и косметологии» Минздрава России, кандидат медицинских наук, г. Москва
МЕТОДОЛОГИЯ
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE и MEDLINE.
Методы, использованные для оценки качества и силы доказательств:
· Консенсус экспертов;
· Оценка значимости в соответствии с рейтинговой схемой (схема прилагается).
Рейтинговая схема для оценки силы рекомендаций:
| Уровни доказательств | Описание |
| 1++ | Мета-анализы высокого качества, систематические обзоры рандомизированных контролируемых исследований (РКИ) или РКИ с очень низким риском систематических ошибок |
| 1+ | Качественно проведенные мета-анализы, систематические, или РКИ с низким риском систематических ошибок |
| 1- | Мета-анализы, систематические, или РКИ с высоким риском систематических ошибок |
| 2++ | Высококачественные систематические обзоры исследований случай-контроль или когортных исследований. Высококачественные обзоры исследований случай-контроль или когортных исследований с очень низким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 2+ | Хорошо проведенные исследования случай-контроль или когортные исследования со средним риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 2- | Исследования случай-контроль или когортные исследования с высоким риском эффектов смешивания или систематических ошибок и средней вероятностью причинной взаимосвязи |
| 3 | Неаналитические исследования (например: описания случаев, серий случаев) |
| 4 | Мнение экспертов |
Методы, использованные для анализа доказательств:
· Обзоры опубликованных мета-анализов;
· Систематические обзоры с таблицами доказательств.
Методы, использованные для формулирования рекомендаций:
Консенсус экспертов.
Рейтинговая схема для оценки силы рекомендаций:
Индикаторы доброкачественной практики (Good Practice Points – GPPs):
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
· Внешняя экспертная оценка;
· Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии рецензированы независимыми экспертами.
Комментарии, полученные от экспертов, систематизированы и обсуждены членами рабочей группы. Вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не были внесены, то зарегистрированы причины отказа от внесения изменений.
Консультация и экспертная оценка:
Предварительная версия была выставлена для обсуждения на сайте ФГБУ «Государственный научный центр дерматовенерологии и косметологии» Минздрава России для того, чтобы лица, не участвующие в разработке рекомендаций, имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Рабочая группа:
Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы.
Основные рекомендации:
Сила рекомендаций (A–D) приводится при изложении текста рекомендаций.
Актуальные вопросы тяжелой герпетической инфекции у взрослых
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная
В настоящее время неуклонно увеличивается число больных рецидивирующей герпетической инфекцией, вызванной вирусами простого герпеса (ВПГ) 1 и 2 типа различной локализации. Наиболее распространенная локализация у взрослых лиц — аногенитальная и лабиальная. Многие вопросы патогенеза и терапии тяжелого и крайне-тяжелого течения герпесвирусной инфекции по-прежнему не решены.
Вид ВПГ относится к семейству Herpesviridae, подсемейству L-Herpesviridae, виду ВПГ. Различают два основных типа вируса — ВПГ 1 и ВПГ 2. Инфицирование возможно как одним, так и двумя типами возбудителя. ВПГ способен внедряться в различные клетки организма человека: в клетки кожи, слизистых оболочек урогенитального и желудочно-кишечного трактов (ЖКТ), дыхательных путей, центральной и периферической нервной системы, печени, эндотелия сосудов, а также в клетки крови — лимфоциты и др. [1]. Место постоянного обитания (пожизненного персистирования) ВПГ — паравертебральные сенсорные ганглии. ВПГ передается прямым контактным путем, возможна передача возбудителя контактно-бытовым и вертикальным путем (от матери к плоду), а также трансфузионным и парентеральным путями через инструменты при оперативных вмешательствах, стоматологических процедурах и т. д.
Как известно, большинство людей инфицированы ВПГ. Первичный иммунный ответ на инфекцию протекает латентно или с герпетическими высыпаниями с местной и общей воспалительной реакцией. У лиц с нормальным иммунным ответом размножение (репликация) ВПГ находится под иммунологическим контролем, и рецидивы бывают крайне редко или не возникают в течение всей жизни. В противовирусной защите организма участвуют факторы неспецифической защиты, уничтожающие или блокирующие вирусы: макрофаги и другие клетки-продуценты интерферонов (ИФН) α, β и γ, ряд интерлейкинов (ИЛ) (фактор некроза опухоли (ФНО), ИЛ-6 и др.), естественные киллеры и факторы, формирующие специфический иммунный ответ против конкретного вируса: цитотоксические Т-лимфоциты (ЦТЛ) (CD 8+ Т-лимфоциты) и В-лимфоциты, ответственные за продукцию специфических антител, блокирующих репликацию вируса и расположенные вне клетки вирусы. Для адекватного функционирования этих клеток и поддержания иммунного ответа необходима соответствующая продукция ИФН и ИЛ.
Под влиянием различных экзогенных и эндогенных факторов, повреждающих иммунную систему, возможно ослабление контроля над репликацией вируса и соответственно развитие рецидива. Рецидив ВПГ-инфекции могут спровоцировать другие инфекционные заболевания, переохлаждение, чрезмерная инсоляция, психические или физические стрессы, интоксикации различного генеза, в том числе употребление алкоголя, циклические изменения гормонального статуса (менструации), особенно при дисбалансе уровня гормонов у женщин, резкая смена климатических поясов и др.
При длительной хронической инфекции вирусы оказывают многостороннее неблагоприятное действие на иммунную систему человека. ВПГ прямо повреждают клетки иммунной системы (лимфоциты, макрофаги и естественные киллеры). Синтезируя белки-супрессоры и химерные белки, вирусы угнетают многие реакции иммунитета: ВПГ могут блокировать действие ИФН, нарушать распознавания инфицированных клеток и другие защитные реакции. Кроме того, высокая мутационная активность вирусного генома также способствует ускользанию вируса от иммунологического контроля.
Хроническая, часто рецидивирующая ВПГ-инфекция может провоцировать развитие аутоиммунных состояний (антифосфолипидный синдром, аутоиммунный тиреоидит, аутоиммунные васкулиты и др.). Кроме того, при интеграции ВПГ в генетический аппарат клеток возможна неопластическая трансформация клеток. Так, ВПГ является одним из факторов повышенного риска развития рака тела и шейки матки и других онкологических заболеваний. Также ВПГ-инфекция является одной из ведущих причин самопроизвольных абортов, преждевременных родов, рождения детей с патологией центральной нервной системы и внутренних органов. ВПГИ ассоциирована со многими «болезнями цивилизации» — атеросклерозом, ишемической болезнью сердца у лиц моложе 50 лет и др. Тяжелое течение ВПГИ может быть маркером онкологических заболеваний и СПИДа [7].
В зависимости от числа и выраженности рецидивов, выделяют легкое, среднетяжелое и тяжелое течение болезни (табл. 1).
При тяжелом течении ВПГ-инфекции возможно одновременное появление нескольких очагов поражения (например, в области половых органов, губ, крыльев носа), а также последовательное возникновение высыпаний разной локализации (один рецидив на фоне другого), продолжительность обострения при этом может достигать 16–20 дней. В месте высыпания больные ощущают жар, жжение, боль, напряжение и/или зуд кожи. На инфильтрированной коже появляется группа пузырьков, заполненных прозрачным содержимым. Пузырьки могут сливаться в сплошной многокамерный элемент. Прозрачное их содержимое затем мутнеет. Пузырьки в дальнейшем вскрываются, образуя мелкие эрозии, или подсыхают и превращаются в корочки. Возможно наслоение вторичной бактериальной инфекции. При рецидивах ВПГ часто поражает одни и те же участки кожи. Как правило, при тяжелом течении инфекции значительно ухудшается физическое и психическое состояние больных. У части пациентов в период рецидива увеличиваются или появляются слабость, лихорадка, озноб, миалгии, цефалгии, артралгии, раздражительность, нарушение сна, эмоциональная лабильность, также могут развиваться тяжелые депрессивные состояния, требующие медикаментозной коррекции. По данным органов здравоохранения США, ВПГ-инфекция аногенитальной локализации является примерно в 10% случаев причиной депрессий и суицидов. Тяжелое течение генитальной формы ВПГ-инфекции с частыми рецидивами приводит к нарушению нормальной половой функции пациента, болезнь нередко создает конфликтные ситуации в семье, на работе. Лечение больных с тяжелым течением ВПГ-инфекции представляет собой сложную задачу и должно включать как медикаментозную терапию, так и психологическую адаптацию пациента.
У больных с тяжелой ВПГ-инфекцией в большинстве случаев не наблюдается стойкого и значимого клинического эффекта в ответ на эпизодические курсы комбинированной терапии (противовирусные и иммунотропные средства, общеукрепляющие препараты). Как правило, такие больные меняют много лечебных учреждений в поисках адекватной помощи.
С течением заболевания появляется много побочных реакций на медикаменты или их непереносимость, в ряде случаев развивается устойчивость ВПГ к ацикловиру, ИФН a, другим средствам. Иммуностимуляторы, используемые эмпирически, могут приносить облегчение в период их приема, но во многих случаях они оказываются неэффективными и даже ухудшают клиническое течение болезни. Усугубляются проявления вторичного иммунодефицита, присоединяются другие инфекции, субдепрессивные состояния переходят в стойкие нарушения психики, теряется вера больных в выздоровление, в возможность современной медицины им помочь.
Для разработки современных подходов к лечению и контролю над ВПГ-инфекцией и более углубленного понимания патогенеза заболевания нами было изучено состояние различных звеньев противовирусной защиты и системы цитокинов у больных с тяжелым и крайне тяжелым течением ВПГ-инфекции аногенитальной и лабиальной локализации, а также степень инфицированности (системности заболевания) и частота сочетания с другими герпесвирусными инфекциями.
Обследовано 102 больных, страдающих тяжелой ВПГ-инфекцией более 2 лет (28 мужчин и 74 женщины, средний возраст — 34 ± 1,5 года) и имеющих частоту рецидивов более шести в год.
При этом у 60 больных наблюдалось от 6 до 11 рецидивов ВПГ-инфекции в год, а у 42 больных — от 12 до 20 рецидивов. У большинства пациентов преобладала аногенительная или смешанная локализация герпеса. Средняя длительность тяжелого течения заболевания составила 9,3 ± 1,2 года. Группу контроля составили 32 практически здоровых добровольца (14 мужчин и 18 женщин, средний возраст — 32 ± 1,6 года). Анализ ряда изучаемых параметров включал результаты обследования пациентов с легким течением заболевания (36 человек — 10 мужчин, 26 женщин, средний возраст — 33,4 ± 2,1 года, с частотой рецидивов 2,9 ± 0,8 в год). При рецидивах жалобы больных были характерными. Часто встречались депрессия, раздражительность, снижение памяти и другие нарушения физического и психического состояния и познавательных функций.
У многих больных в анамнезе были указания на повторные курсы противовирусной и/или иммунотропной терапии, оказывавшей неоднозначное влияние: или кратковременное положительное влияние на течение ВПГ-инфекции, или ухудшение и развитие рецидива на фоне или после отмены иммунокоррекции. Такие анамнестические данные отражают тяжесть иммунной недостаточности и неадекватность проводимой эмпирической терапии без оценки иммунного статуса и индивидуального подбора иммунокорректоров, а также восстановительной терапии — иммунореабилитации [5].
При обследовании больных с тяжелым течением ВПГ-инфекции выявлялись многие маркеры вторичного иммунодефицита в виде хронических инфекционно-воспалительных заболеваний различной локализации, со смешанным характером микрофлоры и в большинстве случаев ее устойчивостью к повторным курсам антибиотикотерапии. Из 102 больных хронической ВПГ-инфекцией тяжелого течения выявлены:
Эти данные свидетельствуют о необходимости комплексного подхода к лечению ВПГ-инфекции тяжелого течения с учетом осложнений вторичного иммунодефицита.
Кроме того, проводили ПЦР-исследование биологических материалов на наличие ДНК ВПГ 1 и 2 типа и других вирусов герпес-группы: цитомегаловируса, вируса герпеса человека (ВГЧ) 6 типа, вируса Эпштейна–Барр. Используемые нами программы амплификации позволяли выявлять ДНК вирусов на уровне, соответствующем активной их репликации. Наличие активной репликации вирусов подтверждали полуколичественным ПЦР-исследованием и серологическими тестами.
В результате исследования у больных с тяжелым течением ВПГ-инфекции обнаружены лабораторные признаки вторичного иммунодефицита.
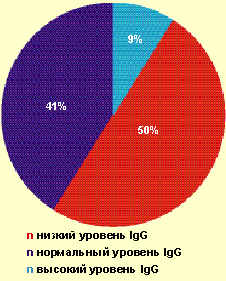 |
| Рисунок 1. Частота выявления различных значений IgG у больных с тяжелым течением ВПГ-инфекции |
Так, у большинства пациентов (91%) отсутствовало адекватное повышение продукции IgG в ответ на рецидив ВПГ-инфекции (рис. 1). При частоте рецидивов ВПГ-инфекции 6–11 рецидивов в год низкий уровень IgG выявлялся у 25% больных, при частоте — 12–20 рецидивов в месяц — уже у 64,3% больных. Более чем у 70% больных был повышен уровень ЦИК в 1,5–2,0 раза от показателей нормы. Известно, что длительная циркуляция ЦИК может приводить к отложению их на эндотелии сосудов и служить одним из факторов формирования аутоиммунной патологии.
У большинства больных с ВПГ-инфекцией тяжелого течения (70%) были обнаружены нарушения в системе естественной и/или специфической цитотоксичности (рис. 2) — снижение содержания зрелых активированных естественных киллеров CD16 + (менее 11%), Т-киллеров и/или ЦТЛ CD8 + (менее 27%). Важно отметить, что выраженное снижение уровня CD8 + (в состав которых входят также и супрессорные клетки) в большинстве случаев сочеталось с повышением уровня CD4 + и иммунорегуляторного индекса, что является фактором риска в отношении формирования аутоиммунных процессов. Как известно, системы естественной и специфической цитотоксичности играют ведущую роль в противовирусной защите.
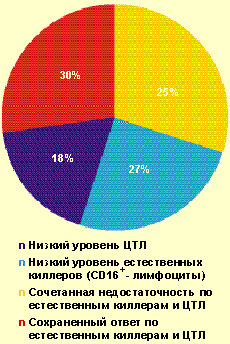 |
| Рисунок 2. Частота выявления нарушений в системе естественной и специфической цитотоксичности у больных с тяжелым течением ВПГ-инфекции (n = 102) |
Обнаруженные нарушения в системах цитотоксичности и их активационных маркерах при ВПГ-инфекции косвенно свидетельствуют о недостаточном уровне продукции Т-хелперами 1 типа ИЛ-2 — одного из важнейших звеньев цитокиновой сети, необходимого для полноценного противовирусного иммунного ответа.
При исследовании функционального состояния нейтрофилов у больных с тяжелым течением ВПГ-инфекции повышение спонтанного НСТ-теста было выявлено почти в половине случаев. Однако показатели стимулированного НСТ-теста и индекса стимуляции, напротив, были существенно снижены у большинства больных, что свидетельствует об истощении у них резервных способностей нейтрофилов.
Н. А. Дидковский, доктор медицинских наук, профессор
И. К. Малашенкова, кандидат медицинских наук
Ж. Ш. Сарсания, кандидат биологических наук
А. Н. Танасова, И. Н. Зуйкова, И. А. Зуйков, Н. М. Хитрик
НИИ физико-химической медицины, ММА им. И. М. Сеченова, Москва

